研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
“外泌体”还能这样研究?广西医科大宁峙彭NUS陈小元AS新作!国自然热点+转录组+实验,14+出文拿捏!
478 人阅读发布时间:2025-04-29 11:13
基于无重原子的近红外(NIR)激活的光敏剂在光免疫治疗中具有很大的优势,但肿瘤微环境往往制约其疗效。而一种名为Cy-BF的近红外激活的无重原子光敏剂可解决该问题。

湾湾今天分享的是一篇发表在【Advanced Science】(IF:14.3)上题为“Simultaneous Reversal of T Lymphocytes and Cancer Cells Metabolism Via a Biomimetic Heavy-Atom-Free Photosensitizers-Based Combination Therapies to Boost Cancer Photoimmunotherapy”的研究,该研究一种近红外激活的无重原子光敏剂(命名为 Cy-BF)。随后,采用磷脂和血小板外泌体囊泡对 Cy-BF 进行封装,构建了血小板外泌体囊泡仿生化和 Cy-BF 负载的杂合脂质体(命名为 CHL),并引入一种使用碳酸锂的联合疗法,为未来光免疫治疗的临床应用铺筑道路。
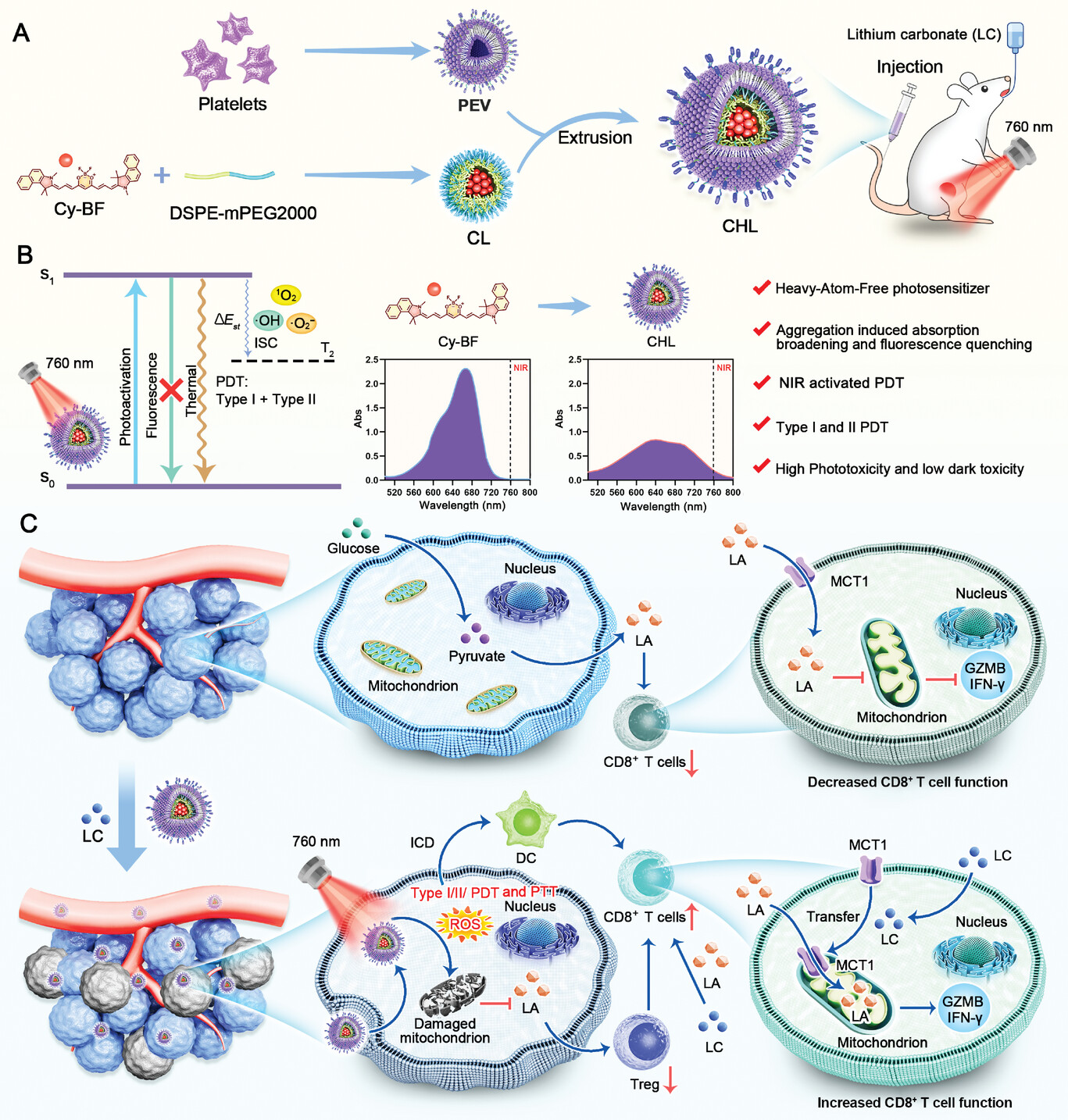
研究成果
1. Cy-BF和CHL的制备与表征
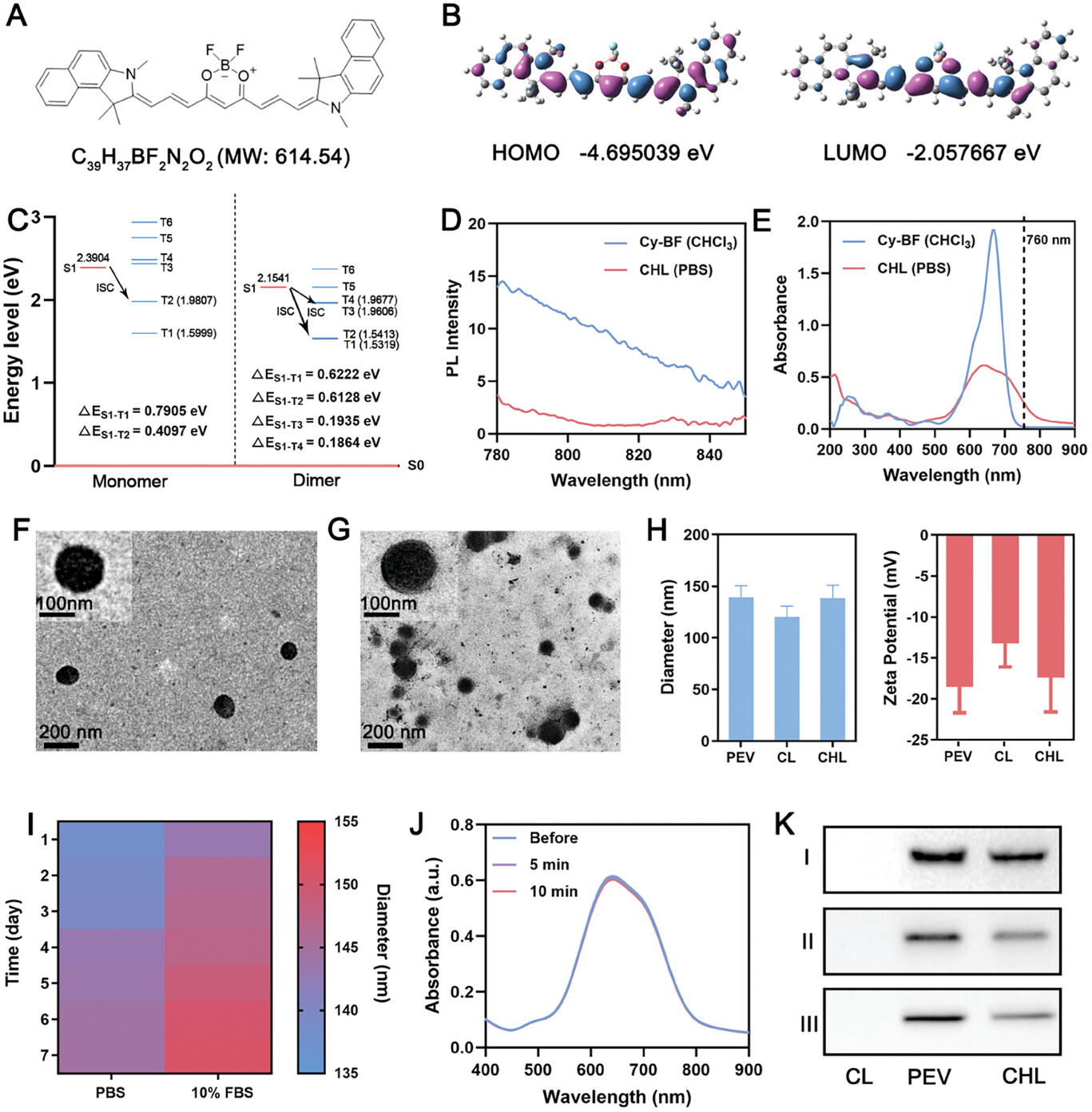
图1 Cy-BF和CHL的制备与表征。
图1A:Cy-BF的化学结构公式。
图1B:由Cy-BF的DFT计算确定的均卢米族分布。
图1C:在优化的分子几何形状下简化的单体和二聚体Cy-BF的能级。
图1D-E:CY-BF在CHCl3中的光致发光(PL)光谱和吸收光谱与PBS溶液中CHL相比,溶液使用760 nm的激发波长。
图1F-G:CL和CHL的TEM图像,包括粒子的放大视图。
图1H:PEV,CL和CHL的颗粒直径和ZETA电位测量值。
图1I:CHL在各种解决方案中的稳定性。
图1J:在暴露于760 nm激光照射下以0.5W/cm2接触的CHL吸收光谱在不同的持续时间内。
图1K:以10 µg ml的Cy-BF浓度在不同制剂(I:肌动蛋白,II:P-链蛋白,III:CD41)中对关键蛋白的蛋白质印迹(WB)分析。
这些结果显示,研究成功合成了CHL,其具有良好的近红外吸收、肿瘤靶向性和光稳定性,为后续的生物学实验奠定了基础。
2. CHL的光热能力,活性氧生成和体外抗癌能力
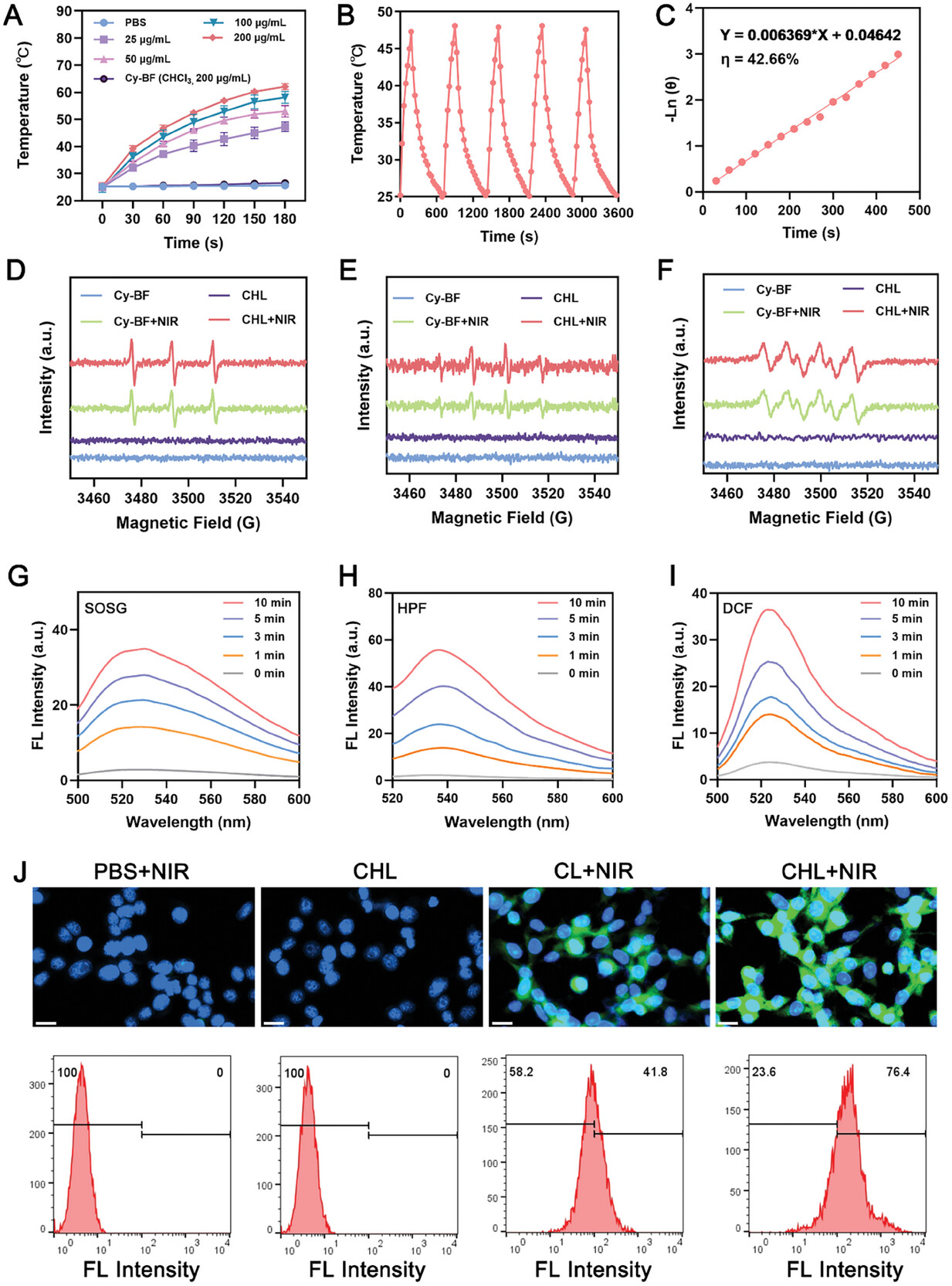
图2 CHL的光热能力。
图2A:含有不同浓度的CY-BF,PBS和滤仿溶液的Chl的加热曲线CY-BF以下760 nm激光照射持续3分钟。
图2B:不同配方的光热循环曲线。
图2C:使用CHL冷却曲线的线性回归计算传热的时间常数。
图2D-F:生产1O2,•OH和•O2- 由CHL或CHL+NIR由ESR确定。
图2G-I:SOSG,HPF和DCF后CHL加上760 nm激光照射在不同的时间的荧光光谱。
图2J:用不同组分处理的细胞内ROS的荧光图像和流式细胞仪分析。
这些结果显示,随着浓度的增加,CHL在近红外光下升温更快,CHL具有稳定的光热循环能力和较高的光热转换效率;CHL在760 nm激光照射下可以同时进行I型和II型光动力疗法(PDT;CHL+NIR处理导致ROS增加并改变了4T1细胞的线粒体膜电位。
3. CHL的活性氧生成和体外抗癌能力
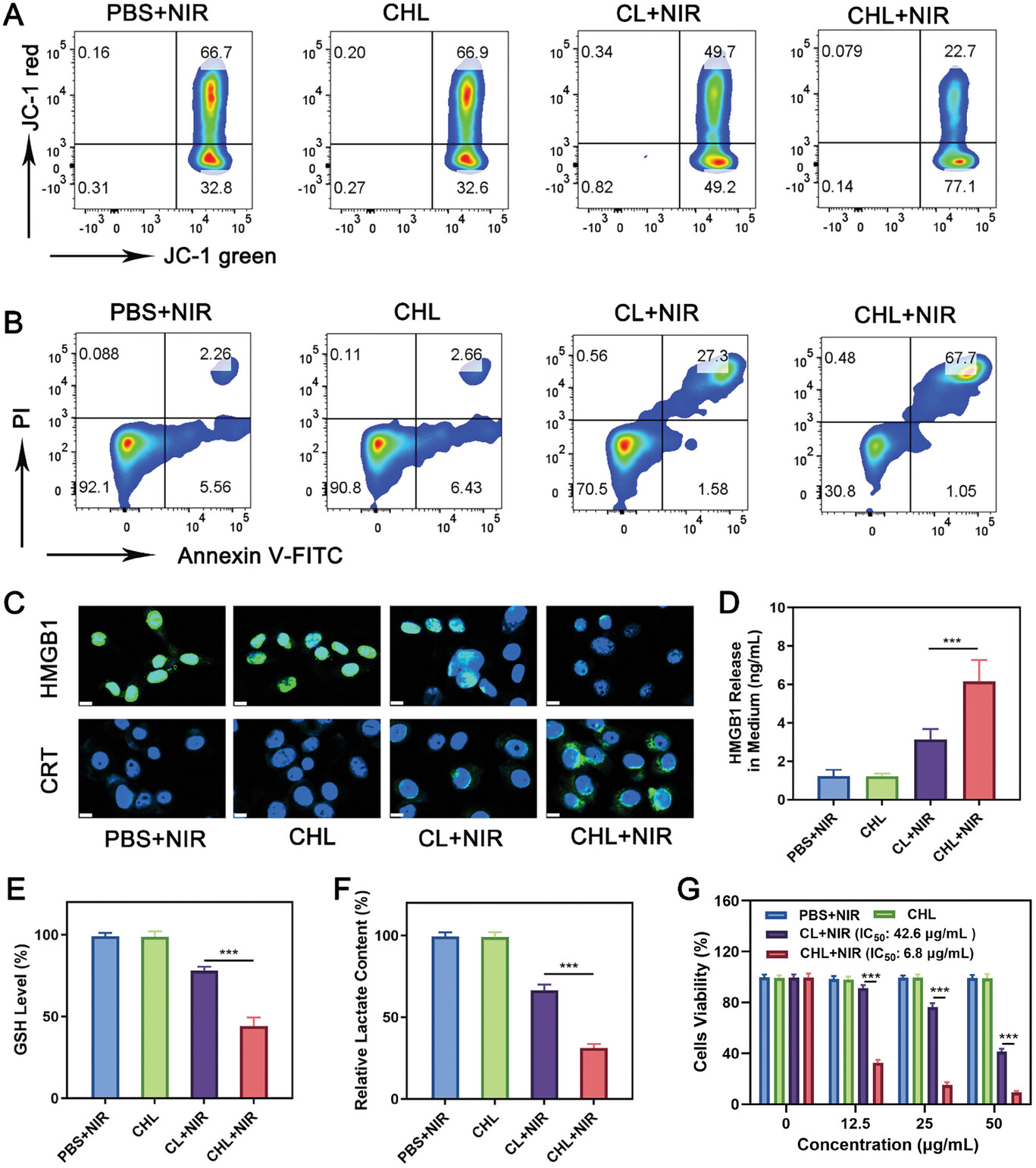
图3 CHL诱导的线粒体损伤、免疫原性细胞死亡(ICD)及乳酸代谢变化。
图3A:JC-1流式细胞术分析。
图3B:不同成分处理4T1细胞的凋亡检测。
图3C-D:不同剂型处理4T1细胞后HMGB1和CRT的表达和HMGB1的释放。
图3E-F:不同处理后细胞内GSH和乳酸水平。
图3G:不同浓度Cy-BF处理4T1细胞后的相对细胞活力。
这些结果显示CHL+NIR触发的氧化应激可导致4T1细胞ICD。此外,CHL+NIR处理也导致4T1细胞的谷胱甘肽(GSH)和乳酸(LA)水平降低;CCK-8检测证实了CHL+NIR对4T1细胞的细胞毒性作用。
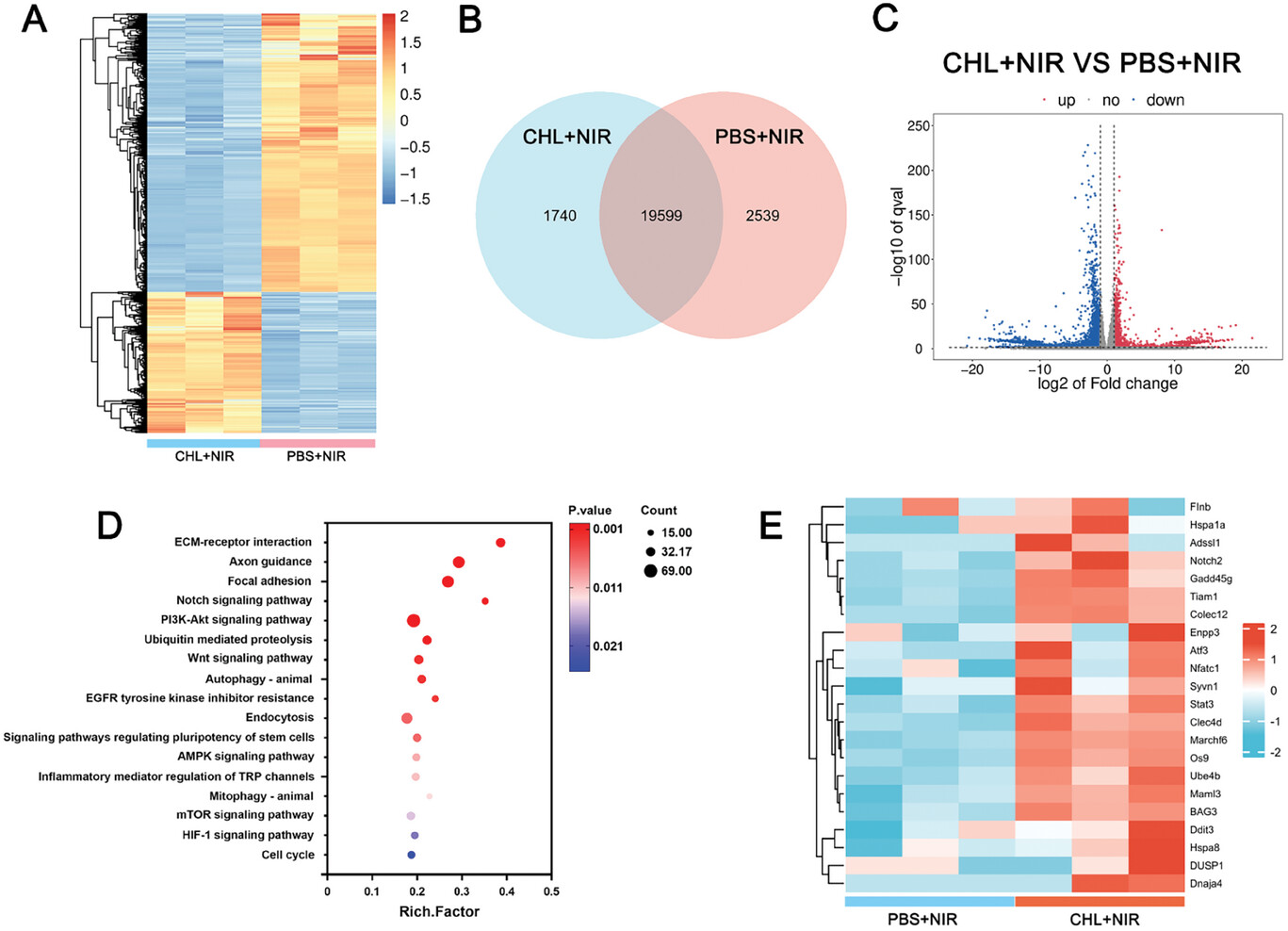
图4转录组测序分析CHL介导的基因表达调控。
图4A:治疗后差异表达基因的热图。
图4B:维恩图显示了特定治疗组的基因转录数量。
图4C:火山图说明了差异表达的基因。
图4D:KEGG通路富集分析结果。
图4E:PBS + NIR和CHL + NIR处理4T1细胞凋亡、免疫和氧化应激相关基因表达的热图。
这些结果显示差异基因显著富集于与ICD、ROS和免疫调节相关的信号通路,进一步证明了CHL在免疫增敏治疗中的潜力。
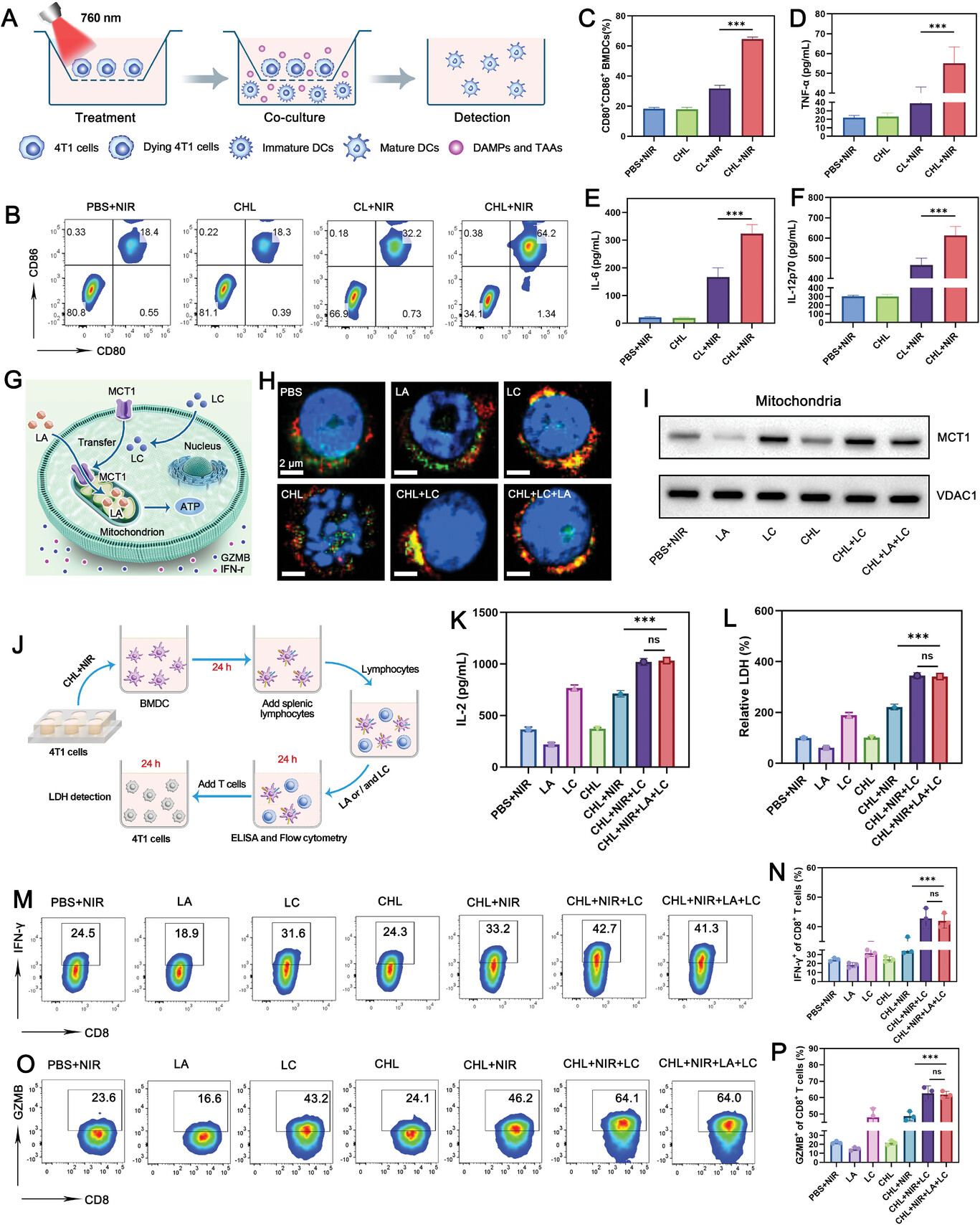
图5 CHL介导的树突状细胞(DCs)成熟及T细胞免疫激活。
图5A:体外诱导BMDCs成熟的Transwell系统示意图。
图5B-C:流式细胞术分析和不同处理后成熟BMDCs的定量分析。
图5D-F:成熟BMDCs分泌的TNF-α水平,IL-6水平和IL-12p70水平。
图5G:LC如何促进MCT1从T细胞膜转位到线粒体的示意图。
图5H:用所述制剂处理的CD8+T细胞中的MCT1和COX IV的免疫荧光染色。
图5I:CD8+ T细胞线粒体中MCT1的蛋白质印迹。
图5J:代表体外特异性免疫激活实验装置的示意图。
图5K:ELISA检测LA或LC处理24h后CD8+T细胞上清液中IL-2的水平。
图5L:检测脾脏T淋巴细胞与4T1肿瘤细胞共孵育24h后上清液中LDH水平。
图5M-N:通过流式细胞术分析不同处理后CD8+T细胞中IFN-γ的代表性图和定量。
图5O-P:流式细胞术分析不同处理后CD8+T细胞颗粒酶B(GZMB)的代表性图和定量。
这些结果表明,LC处理后,CD8+T细胞中的MCT1蛋白主要定位于线粒体,不受CHL或LA处理的影响,且联合治疗成功克服了乳酸诱导的T细胞抑制。
4. CHL的体内抗肿瘤能力
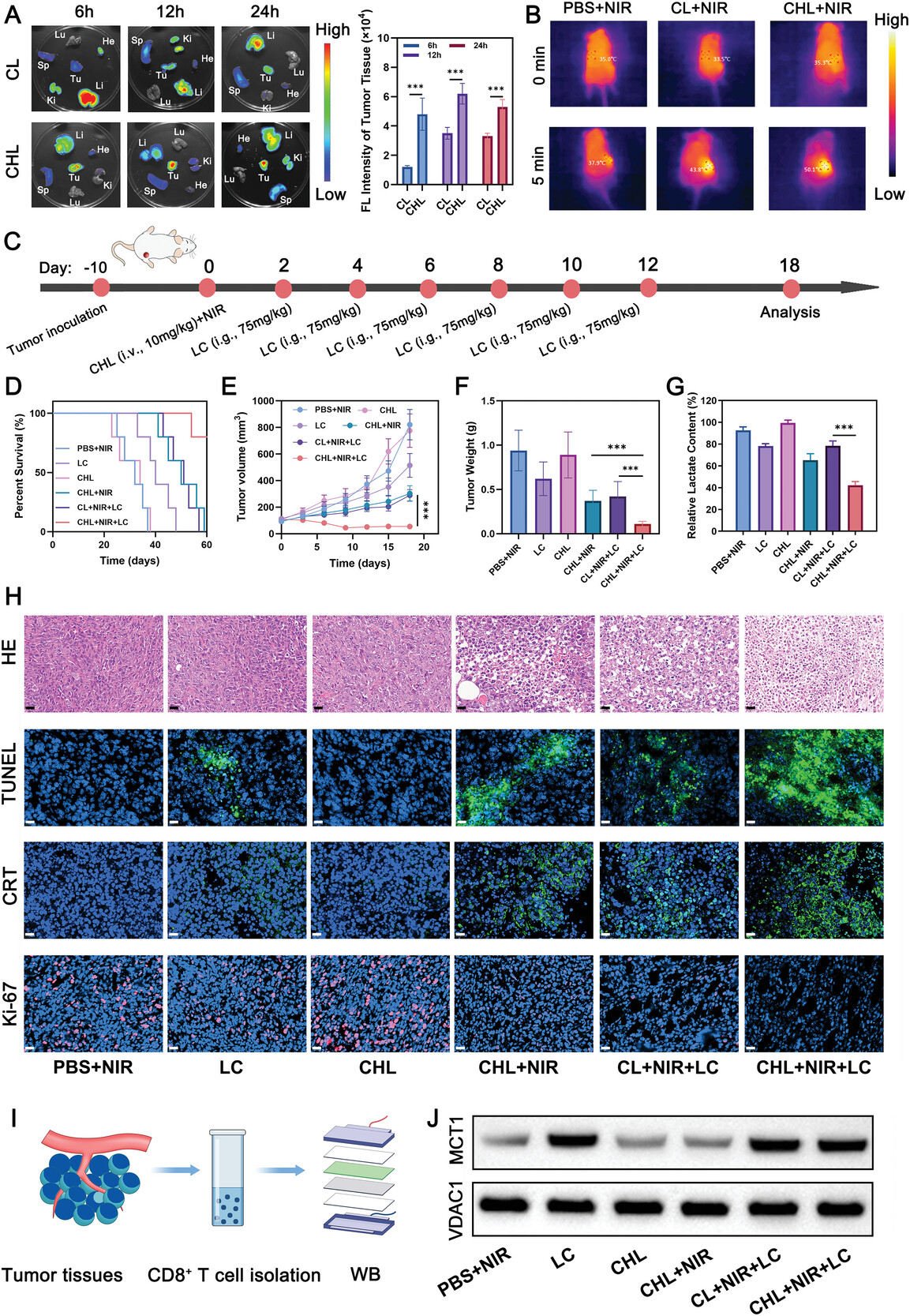
图6联合治疗可增强肿瘤靶向性。
图6A:4T1荷瘤小鼠注射CL或CHL后不同时间点肿瘤和器官的离体荧光成像和相应强度数据。
图6B:不同治疗后肿瘤组织的红外热成像。
图6C:概述肿瘤接种、纳米药物给药、激光治疗和肿瘤生长监测时间线的示意图。
图6D:治疗后生存曲线。
图6E:每3天测量各组的肿瘤体积。
图6F:在研究结束时记录每种治疗的肿瘤重量。
图6G:不同处理后4T1肿瘤组织中乳酸相对含量。
图6H:治疗后对肿瘤切片进行HE、TUNEL、CRT和Ki-67染色。
图6I:CD8+T细胞中蛋白表达的蛋白质印迹分析示意图。
图6J:Western blot分析CD8+T细胞线粒体中VDAC1和MCT1的表达。
这些结果显示,该治疗可增强肿瘤靶向性,提高光热效应,抑制肿瘤生长,延长生存期,并降低肿瘤乳酸水平及调控CD8+T细胞线粒体相关蛋白表达。
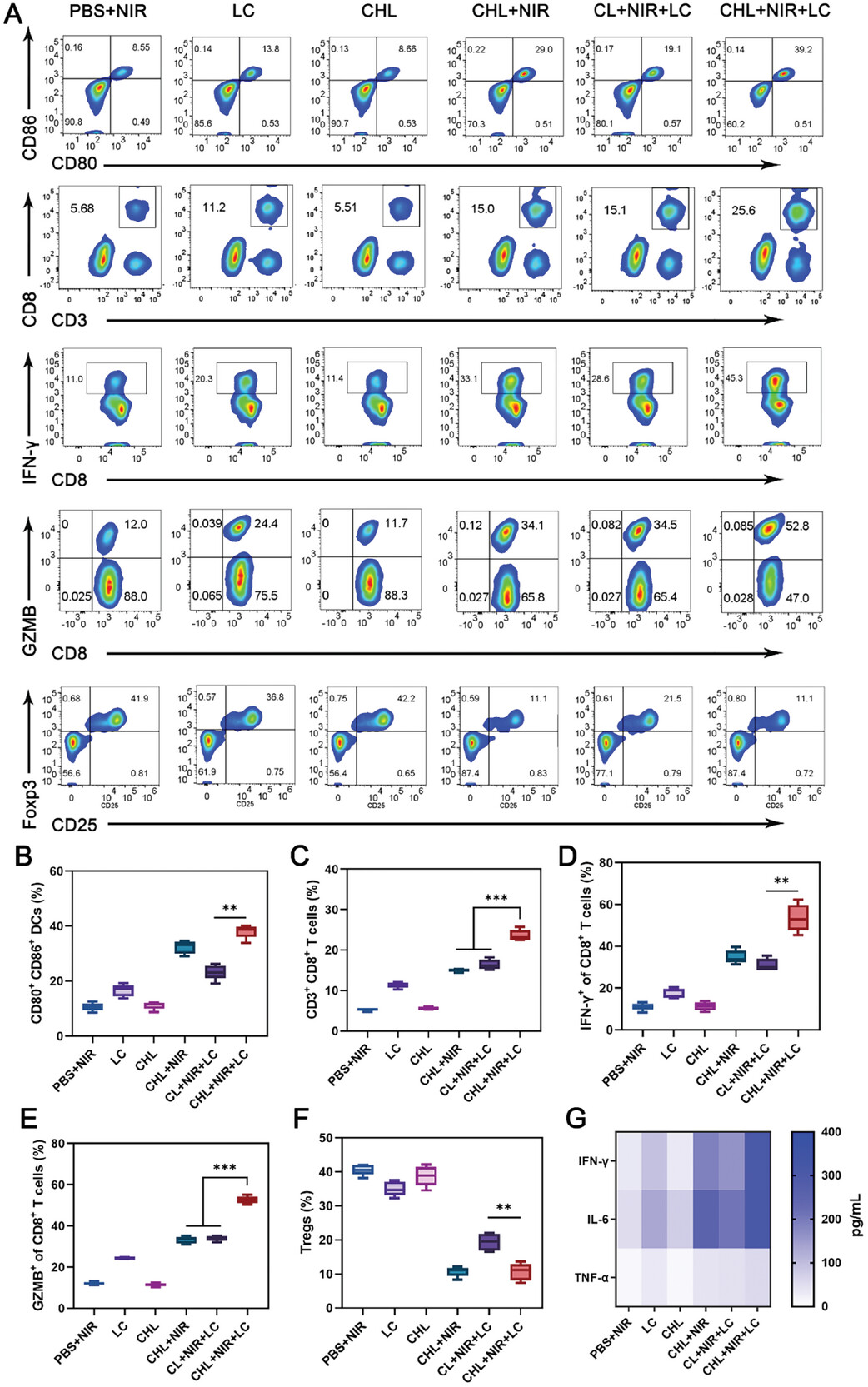
图7该治疗可促进淋巴结中DCs成熟。
图7A:流式细胞术数据显示治疗对淋巴结中DCs成熟,4T1肿瘤组织中CD3+ CD8+ T淋巴细胞浸润,CD8+ T细胞中IFN-γ+和GZMB+细胞水平,以及肿瘤组织中CD25+ Foxp3+ Tregs的影响。
图7B:治疗诱导的淋巴结中DC成熟的定量分析。
图7C:4T1肿瘤组织中CD3+ CD8+ T淋巴细胞浸润。
图7D-E:CD8+ T淋巴细胞中IFN-γ+和GZMB+细胞。
图7G:不同处理后血清中促炎细胞因子(TNF-α, IFN-γ和IL-6)的分泌。
图7F:CD4+Foxp3+肿瘤组织中的Tregs。
这些结果显示该治疗可促进淋巴结中DCs成熟,增强肿瘤组织 CD8+T 细胞浸润及IFN-γ和GZMB 介导的免疫响应,并减少Tregs及提高促炎细胞因子水平。
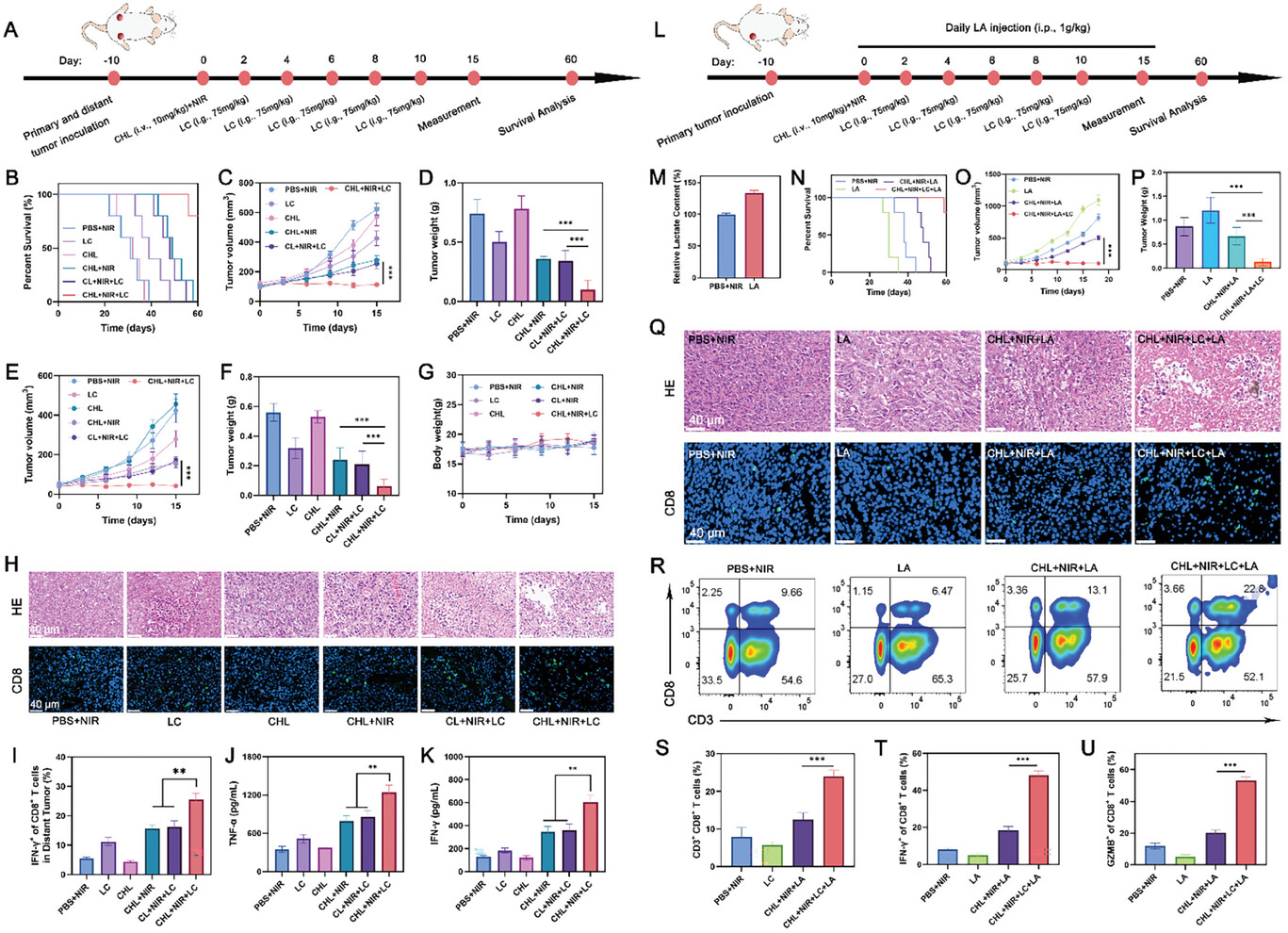
图8 CHL的体内抗肿瘤能力。
图8A:4T1双侧肿瘤治疗研究的示意图。
图8B:不同处理后的生存曲线。
图8C-D:原发肿瘤体积的演变和各种治疗后的肿瘤重量。
图8E-F:远处肿瘤体积的发展和不同治疗后的肿瘤重量。
图8G:治疗期间体重的变化。
图8H:不同治疗后远处肿瘤组织的he和CD8染色分析。
图8I:CD8+ T细胞中治疗诱导的IFN-γ+细胞的定量。
图8J-K:不同治疗后血清中促炎细胞因子TNF-α和IFN-γ的水平。
图8L:4T1肿瘤治疗研究的示意图。
图8M:不同治疗后肿瘤组织的乳酸含量。
图8N:不同处理后的生存曲线。
图8O-P:肿瘤体积的变化和不同治疗后的肿瘤重量。
图8Q:不同治疗方式下肿瘤组织的HE和CD8染色分析。
图8R-S:流式细胞术分析和4T1肿瘤组织中CD3+ CD8+ T淋巴细胞浸润的定量。
图8T-U:CD8+ T细胞中治疗诱导的IFN-γ+和GZMB+细胞的数量。
这些结果证实了CHL介导的NIR 摄影疗法(PIT)联合LC能有效延缓原发肿瘤的生长并诱导远隔效应,从而抑制远处肿瘤的生长。
结论
综上所述,CHL表现出良好的肿瘤靶向性,在无光环境下毒性最小。CHL联合近红外激光治疗可导致肿瘤细胞线粒体损伤、乳酸降低和免疫原性细胞死亡。此外,CHL减少了肿瘤微环境中的调节性T细胞(Tregs),增加了CD8+T细胞。此外,LC的整合能够转化乳酸,使CD8+T细胞能够利用LA作为能量来源,从而显著提高CHL介导的光免疫治疗的效果。这种联合疗法通过治疗原发肿瘤显著抑制远处肿瘤的生长。






