研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
“国自然热点”——外泌体载药再创新!联合巨噬细胞发文,突破8+!创新才是发文动力!
438 人阅读发布时间:2025-05-30 16:47
脂肪干细胞(ADSCs)及其分泌的外泌体(Exos)可促进伤口愈合,胸腺素β4(Tβ4)在促进血管生成和减轻炎症方面有重要作用。外泌体(Exos)具有免疫原性低、安全性高、便于储存运输等优势,还能作为药物递送载体。

今天分享的是一篇发表在【Mater Today Bio】(IF:8.7)上题为“Tβ4-exosome-loaded hemostatic and antibacterial hydrogel to improve vascular regeneration and modulate macrophage polarization for diabetic wound treatment”的研究,该研究利用外泌体(Exos)的特性,将Tβ4基因导入ADSCs,制备高表达Tβ4的Exos,并开发由透明质酸甲基丙烯酰(HAMA)和聚赖氨酸甲基丙烯酰(PLMA)组成的双光聚合水凝胶,用于Tβ4-Exos的持续释放,以加速糖尿病伤口愈合。
研究成果
1.ADSCs,Exos和Tβ4-Exos的特征
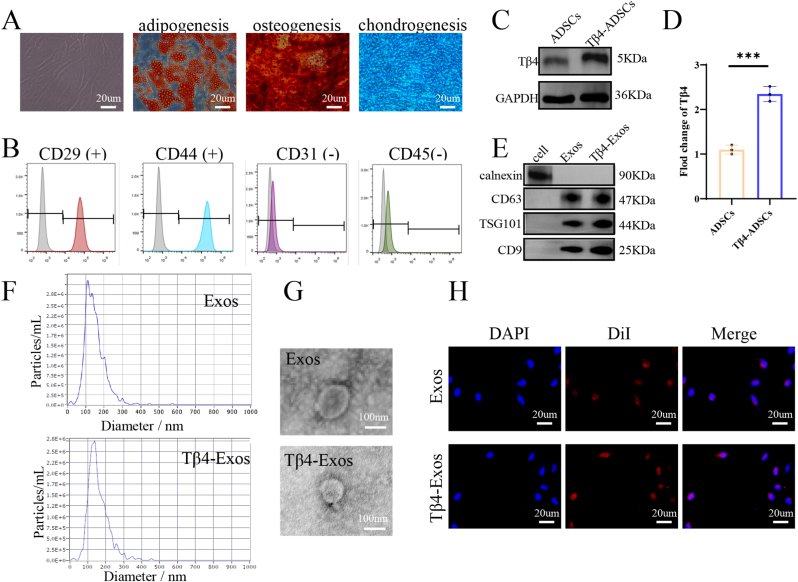
图1 ADSCs,Exos和Tβ4-Exos的特征
图1A:倒置相差显微镜下的显微图像。结果显示ADSCs呈特征性纺锤形,具有分化为脂肪细胞、成骨细胞和软骨细胞的能力。
图1B:流式细胞术检测。结果显示ADSCs表达表面标记CD29和CD44,不表达CD31和CD45。
图1C-D:Western blot检测胸腺素β4 (Tβ4)在ADSCs和Tβ4转导的ADSCs中的表达水平。结果证实Tβ4基因转染效率。
图1E:Western blot分析鉴定外泌体标志物。结果表明Exos和Tβ4-Exos符合外泌体特征,存在阳性标记(CD63、TSG101、CD9),不存在阴性标记钙连蛋白。
图1F:纳米颗粒跟踪分析(NTA)定量外泌体(Exos)和Tβ4-Exos。结果显示Exos和Tβ4-Exos粒径分布峰值约为150nm。
图1G:透射电子显微镜(TEM)提供Exos和Tβ4-Exos的高分辨率图像。结果显示Exos和Tβ4-Exos呈典型球形杯状膜泡形态。
图1H:细胞荧光显微镜图像。结果显示DiI标记的Exos可被人脐静脉内皮细胞(HUVECs)摄取。
这些结果表明,过表达Tβ4不影响Exos的形态、外观和细胞摄取功能。
2.HAMA-PLMA(HP)水凝胶的表征和止血性能。
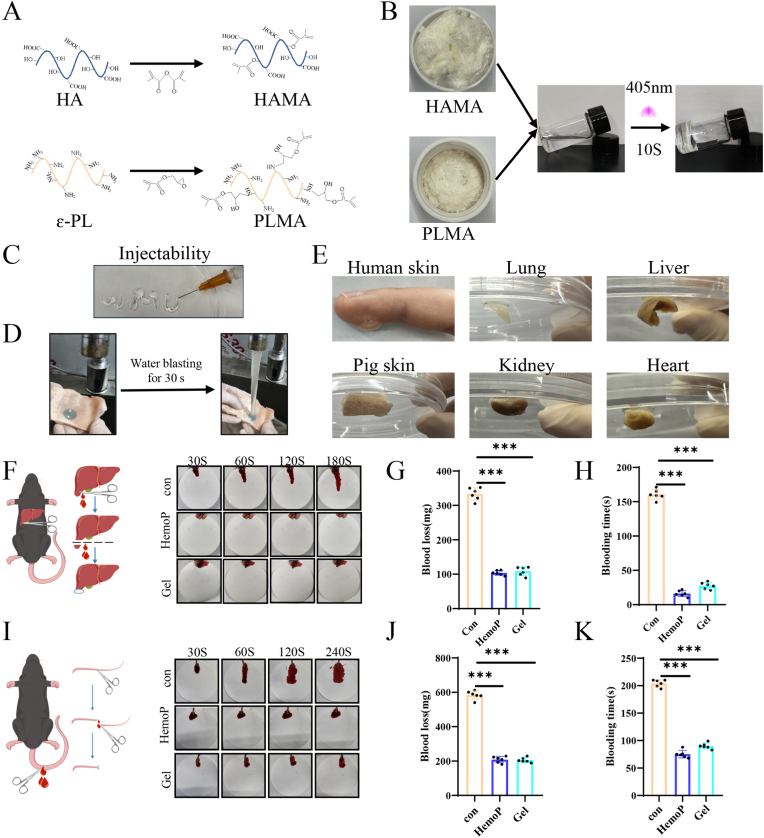
图2 HAMA-PLMA(HP)水凝胶的表征和止血性能。
图2A:透明质酸甲基丙烯酰(HAMA)和多聚赖氨酸甲基丙烯酰(PLMA)的分子结构示意图。
图2B:HAMA-PLMA (HP)水凝胶在HAMA和PLMA混合后形成过程示意图。结果显示HAMA和PLMA混合后在405nm紫外光下10s内可光聚合。
图2C:HP水凝胶可注射性的评估。结果表明HP水凝胶具有良好的可注射性。
图2D:评价HP水凝胶对水流冲击的抵抗力。结果显示HP水凝胶能在强水流冲击30s下仍附着在猪皮上,展现出强抗水流冲击能力。
图2E:检查HP水凝胶的粘附特性。结果显示HP水凝胶对人皮肤、猪皮肤以及小鼠心脏、肺、肾和肝脏的湿润表面具有高粘附性,且无过敏反应和残留。
图2F-H:肝切除止血模型中出血量和止血时间的定量分析。结果显示HP水凝胶和商业止血粉的平均失血量和止血时间均显著低于对照组。
图2I-K:小鼠断尾止血模型中出血量和止血时间定量分析。结果显示HP水凝胶和商业止血粉的平均失血量和止血时间同样显著低于对照组。
这些结果表明,HP水凝胶具有快速光聚合、可注射、强粘附、高止血性能等特点,可作为伤口敷料和Tβ4-Exos的载体。
3.HP水凝胶具有优异的Exos缓释能力
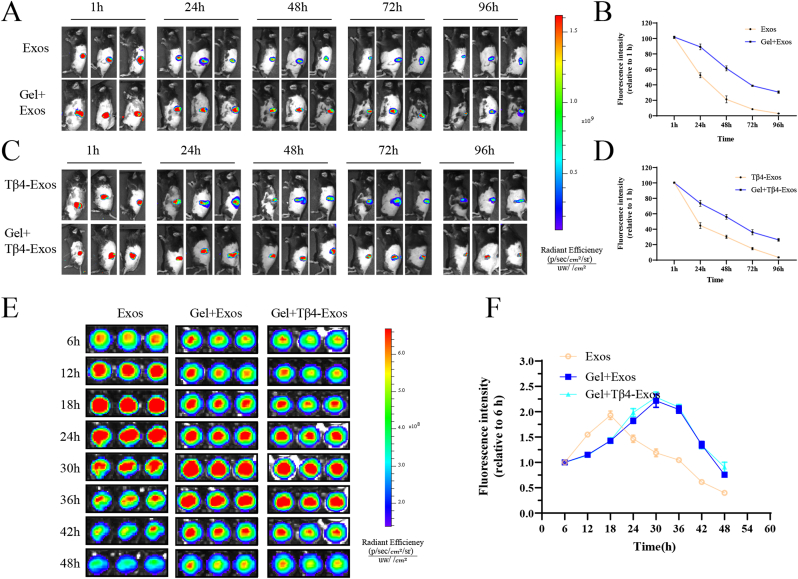
图3 HP水凝胶表现出良好的外泌体缓释能力。
图3A-D:体内光学成像实验。结果显示48h后,Gel+Exos组和Gel+Tβ4-Exos组伤口处Exos剩余百分比均高于Exos-only组和Tβ4-Exos组。
图3E-F:体外释放实验。结果显示Gel+Exos组和Gel+Tβ4-Exos组的荧光强度峰值出现时间(约30h)明显晚于Exos-only组(约18h)。
这些结果表明,HP水凝胶能有效实现Exos和Tβ4-Exos的持续释放。
4.HP水凝胶的生物相容性
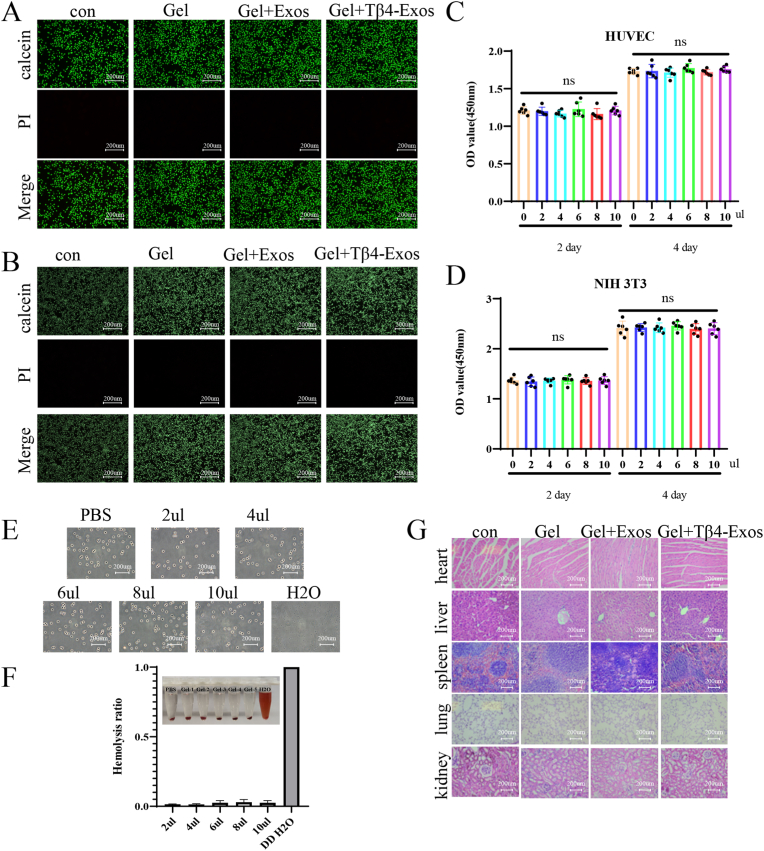
图4 HP水凝胶的生物相容性。
图4A-B:活/死细胞染色实验。结果显示Gel+Exos、Gel+Tβ4-Exos与HUVECs或NIH3T3细胞共培养48h,死细胞的红色荧光极少。
图4C-D:CCK8实验。结果表明不同浓度HP水凝胶对HUVECs和NIH3T3细胞增殖无显著影响。
图4E:血液相容性实验。结果显示无溶血迹象。
图4F:HP水凝胶的溶血率观察。结果显示各浓度下溶血率均低于5%。
图4G:HE染色观察Gel、Gel + Exos、Gel + Tβ4-Exos应用于创面后小鼠心、肝、脾、肺、肾的病理变化。结果显示Gel+Exos和Gel+Tβ4-Exos组小鼠的心、肝、脾、肺、肾组织无明显病理改变。
这些结果表明,HP水凝胶具有良好的细胞相容性、血液相容性和低毒性。
5.Tβ4-Exos水凝胶在体内可加速伤口愈合
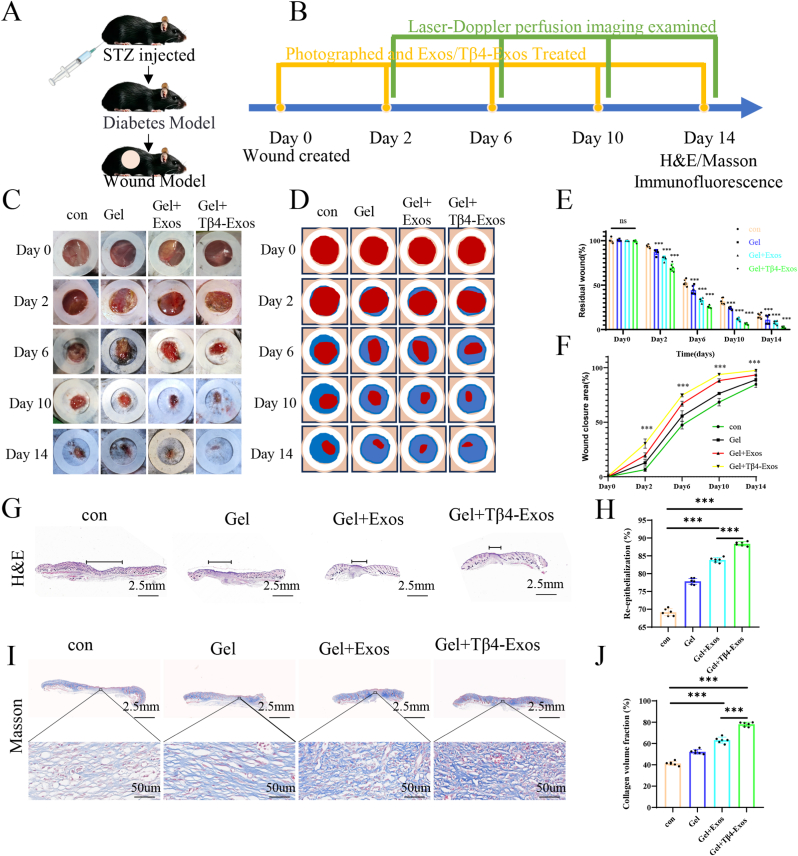
图5 Tβ4-Exos水凝胶在体内加速创面愈合。
图5A-B:糖尿病伤口建模和治疗方案。
图5C-F:宏观伤口图像显示。结果表明Gel+Tβ4-Exos组伤口愈合效果最明显。
图5G-H:HE染色的组织学图像。结果显示Gel+Tβ4-Exos组剩余伤口长度最短,愈合效果最佳。
图5I-J:Masson三色染色以及伤口区域内胶原蛋白含量的定量分析。结果显示,Gel+Tβ4-Exos组胶原纤维更厚,胶原面积比更大。
这些结果表明,Tβ4-Exos水凝胶能加速糖尿病伤口的愈合。
6.Tβ4-Exos水凝胶促进创面血管生成和胶原沉积,减轻创面炎症
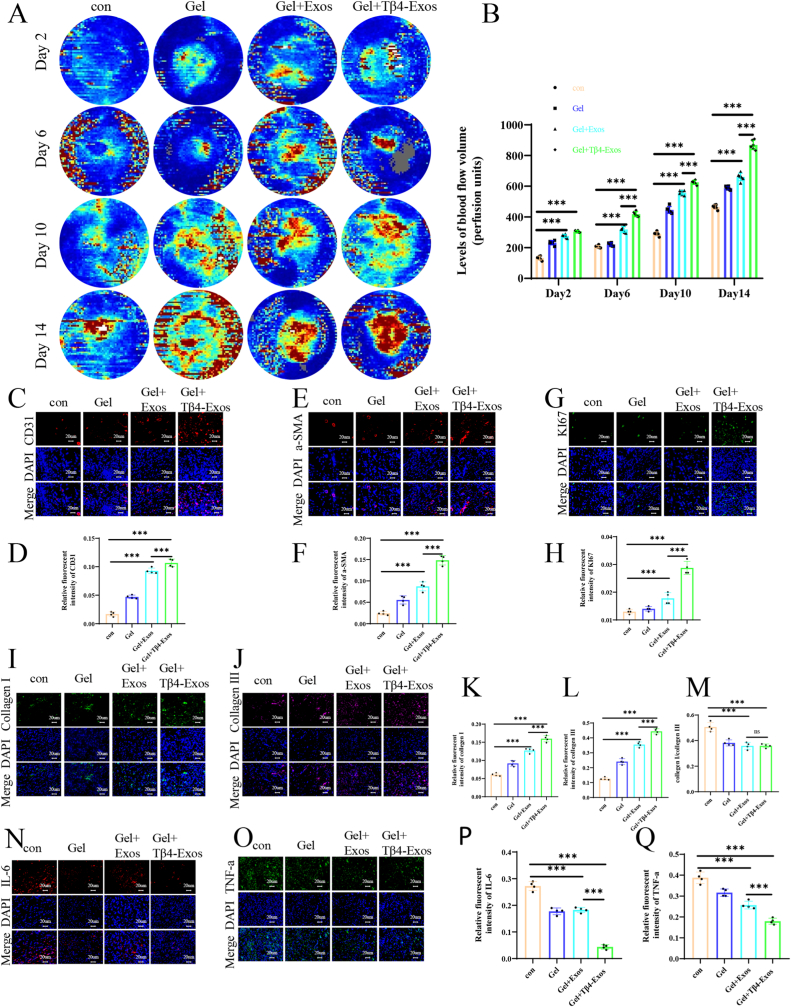
图6 Tβ4-Exos水凝胶促进创面血管生成和胶原沉积,减轻创面炎症。
图6A-B:采用激光多普勒成像技术捕捉创面血流并提供相应的定量分析。结果显示,Gel+Tβ4-Exos组伤口区域平均血流强度最高。
图6C-H:组织荧光染色评估新生血管情况,对标记物CD31 (C、D)和α-SMA (E、F)进行成像和定量分析。结果表明,Gel+Tβ4-Exos组血管新生标记物CD31、α-SMA以及增殖标记物KI67的表达均最高。
图6I-M:通过组织荧光染色和定量分析(G和H)评估增殖标志物KI67。通过分别对胶原蛋白I (I和K)和胶原蛋白(I和K)进行荧光染色,评估胶原蛋白I和胶原蛋白III在创面组织中的存在,并进一步进行定量分析。通过组织荧光染色和定量分析IL-6 (N和P)、TNF-α (O和Q)来评估炎症因子。结果显示,Gel+Tβ4-Exos组伤口组织中胶原蛋白I和胶原蛋白III的荧光强度较高,且I/III型胶原蛋白比值较低。
这些结果表明,Tβ4-Exos水凝胶可增强糖尿病伤口的血管生成,促进伤口愈合和胶原蛋白沉积。
7.Tβ4-Exos水凝胶通过调控巨噬细胞极化减轻体内外创面炎症
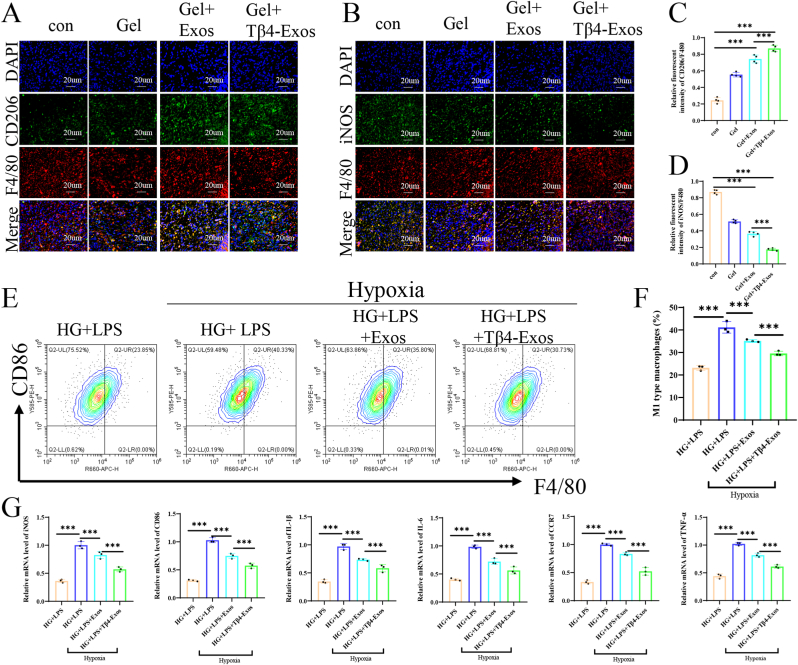
图7体内和体外研究均证实,负载Tβ4-Exos的水凝胶可调节巨噬细胞极化,从而减轻伤口环境中的炎症。
图7A-D:对F4/80和iNOS (M1型巨噬细胞极化的标志物)进行双重免疫荧光染色,并进行后续定量分析。结果显示,Gel+Tβ4-Exos组中M2标记(CD206)与泛巨噬细胞标记(F4/80)的比值最高,M1标记(iNOS)与F4/80的比值最低。
图7E-F:流式细胞术检测M1型巨噬细胞标志物CD86的表达。结果表明,Tβ4-Exos组中M1细胞比例显著低于对照组和Exos组。
图7G:定量聚合酶链反应(q-PCR)检测不同处理组间M1相关标志物。结果显示,Tβ4-Exos处理降低了巨噬细胞向M1表型的极化相关标记物(iNOS、CD86、IL-1β、IL-6、CCR7、TNF-α)的mRNA水平。
这些结果表明,Tβ4-Exos通过调节巨噬细胞极化,上调CD206,下调iNOS、CD86、IL-6、TNF-α等炎症指标,减轻炎症,促进糖尿病伤口愈合。
8.Tβ4-Exos在高糖环境下可促进细胞增殖、迁移和血管生成
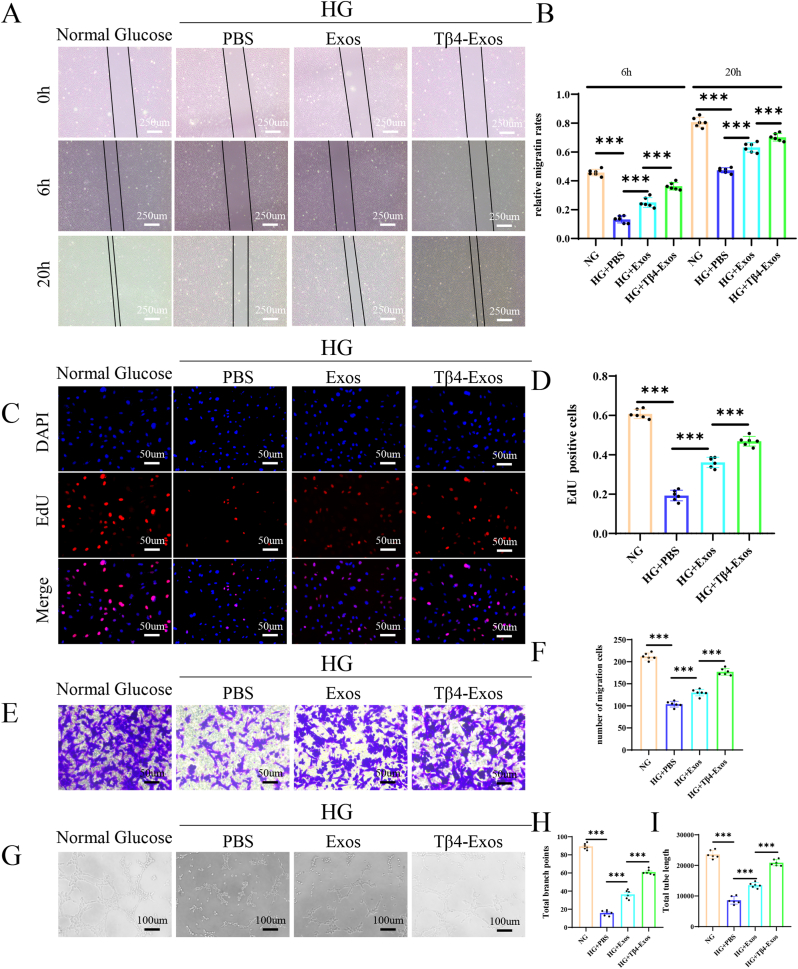
图8 Tβ4-Exos在高糖条件下促进细胞增殖、迁移和血管生成。
图8A-B:划痕实验评估不同组的迁移能力,并进行定量分析。结果表明Tβ4-Exos显著改善高糖诱导的细胞迁移受损。
图8C-D:EdU检测各组细胞增殖情况并进行定量分析。结果表明高糖条件下Tβ4-Exos处理使EdU阳性细胞比例显著增加。
图8E-F:Transwell迁移实验检测不同组细胞的迁移行为并进行定量分析。结果表明Tβ4-Exos显著增强高糖条件下细胞的迁移能力。
图8G-I:小管形成实验评估血管生成潜能,定量分析各组总分支点和总小管长度。结果表明Tβ4-Exos增加了高糖刺激下的分支点数量和总管长。
这些结果表明,Tβ4-Exos在高糖环境下仍能刺激细胞增殖、迁移和血管生成。
9.Tβ4-Exos通过激活PI3K/AKT/mTOR/HIF-1a通路促进血管生成
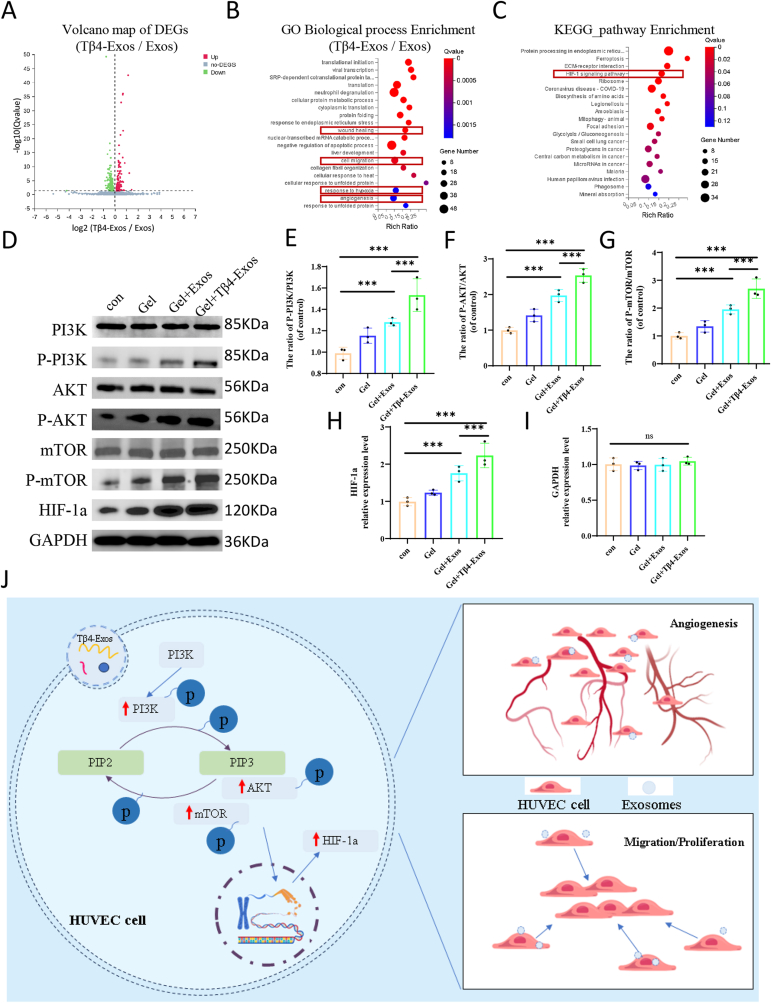
图9 Tβ4-Exos促进PI3K/AKT/mTOR/HIF-1a通路导致血管生成。
图9A:从转录组测序数据中生成火山图。结果说明了Tβ4-Exos组相对于Exos组的基因差异表达情况。
图9B:进行基因本体论(GO)生物过程富集分析。结果表明,差异表达基因在伤口愈合、细胞迁移、缺氧反应和血管生成等途径显著富集。
图9C:进行京都基因与基因组百科全书(KEGG)通路富集分析。结果表明,差异表达基因在HIF-1a信号通路高度富集。
图9D-I:进行蛋白质免疫印迹分析。结果表明,Tβ4-Exos显著提高了PI3K/AKT/mTOR磷酸化蛋白水平和HIF-1a表达。
图9J:示意图展示Tβ4-Exos激活PI3K/AKT/mTOR/HIF-1a信号通路促进内皮细胞增殖、迁移和管形成的机制。
这些结果表明,Tβ4-Exos可能通过PI3K/AKT/mTOR/HIF-1a信号通路促进糖尿病伤口的迁移、增殖和血管生成。
结论
本研究开发了一种可注射、止血、抗菌且长效的HAMA-PLMA(HP)水凝胶,用于Tβ4-Exos的持续释放。在模拟糖尿病伤口的微环境中,负载Tβ4-Exos的HP水凝胶能持续作用于伤口表面,通过PI3K/AKT/mTOR/HIF-1a通路促进糖尿病伤口的迁移、增殖、血管生成、胶原蛋白沉积和血管增生,并调节巨噬细胞的M1-M2转化以减轻炎症,最终加速伤口愈合。该治疗模式为糖尿病伤口的管理提供了一种有前景的策略。






