研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF10+研究,外泌体“硬核带货”小RNA!时间剂量双验证,48h全内化,这技术太顶了!
443 人阅读发布时间:2025-05-30 16:34
足细胞损伤是慢性肾病(CKD)的核心病理特征,其结构改变导致80%以上的CKD进展。外泌体作为细胞间通讯载体,在小RNA递送中具有潜力,但传统间接加载方法存在特异性差、效率低等问题。
湾湾今天分享的是发表在【J Nanobiotechnology】(IF:10.6)上题为“Efficient delivery of small RNAs to podocytes in vitro by direct exosome transfection”的研究。 该研究开发外泌体直接转染技术,通过荧光标记和功能验证,解析其向足细胞递送小RNA的机制及效果,为CKD治疗提供新方向。
研究结果
1、外泌体转染前后的形态与标志物稳定性
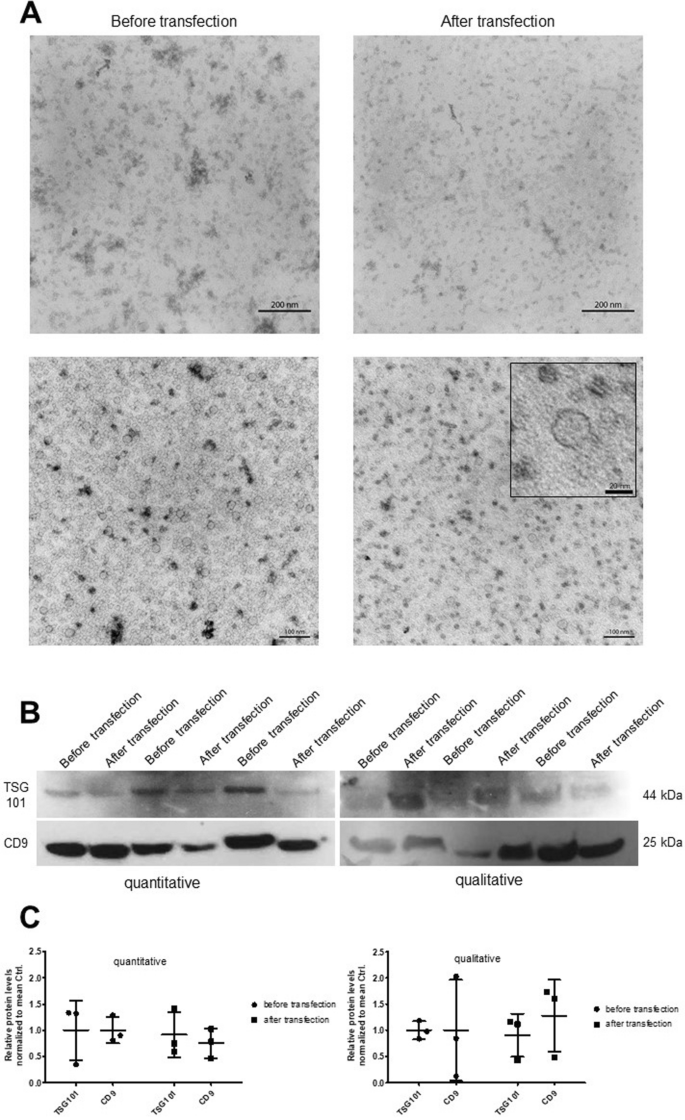
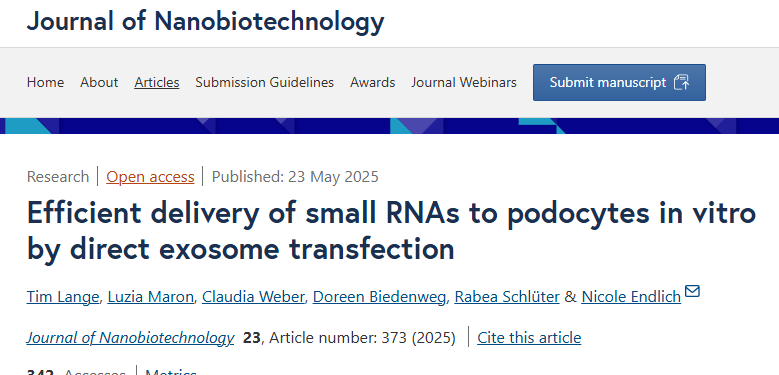
图1A:透射电镜观察显示转染前后外泌体均呈典型杯状结构,直径20-30nm,转染后分布更均匀,聚集现象减少。
图1B-C:Western blot分析表明转染前后外泌体均稳定表达CD9和TSG101,定量分析显示蛋白水平无显著差异,定性实验提示转染后CD9信号略增强,可能与纯度提升相关。
这些结果表明,直接转染未破坏外泌体形态及标志物表达,证实该技术对载体结构的兼容性。
2、足细胞对外泌体携带小RNA的摄取可视化
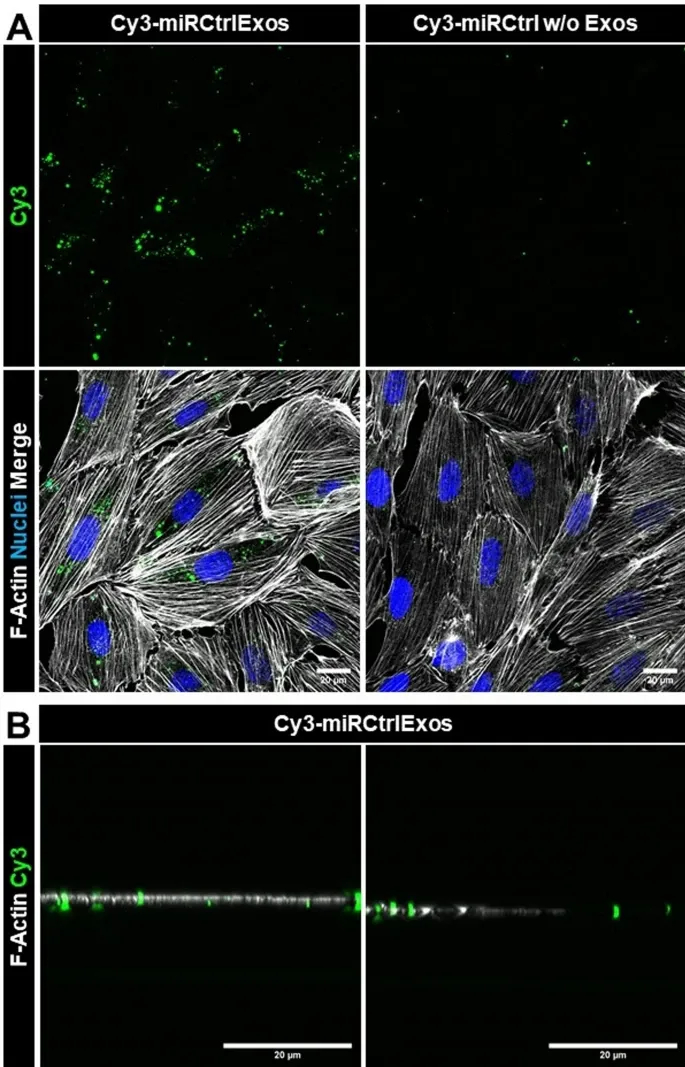
图2A:共聚焦显微镜成像分析显示Cy3标记的对照miRNA转染外泌体(Cy3-miRCtrlExos)处理48小时后,足细胞内可见强荧光信号,呈点状或弥散分布;无外泌体对照组(Cy3-miRCtrlw/oExos)仅见极少量非特异性荧光。
图2B:三维投影分析显示xyz和xzy平面显示荧光信号位于细胞质内,与F-肌动蛋白(Phalloidin染色)共定位,提示通过细胞骨架相关通路摄取。
这些结果表明,足细胞可高效摄取外泌体携带的小RNA,且摄取具有特异性。
3、流式细胞术量化外泌体摄取效率
图3A:流式细胞分析显示,96.5%的足细胞对Cy3-miRCtrlExos呈阳性反应,而无小RNA转染的外泌体对照组(Exosw/oCy3-miRCtrl)阳性率仅0.15%,未处理组无荧光信号。
图3B:成像流式细胞术分析显示,Cy3-miRCtrlExos处理组可见细胞内明确荧光颗粒,其他组无信号,且各组细胞形态无差异。
这些结果表明,外泌体小RNA递送效率高达96.5%,且对足细胞无形态毒性。
4、外泌体摄取机制的分子验证
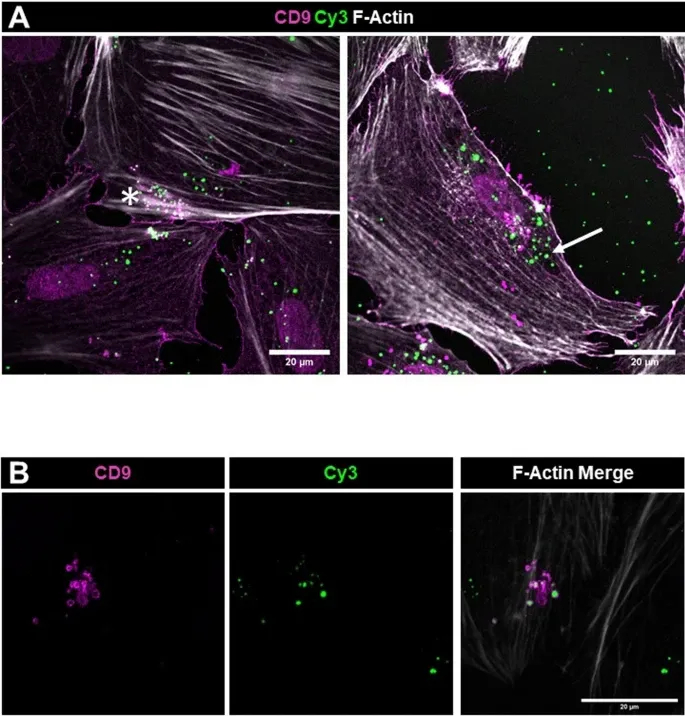
图4A:CD9共染色分析显示,足细胞内Cy3信号分为两类:CD9阴性和CD9阳性,后者直径200-700nm,符合内吞囊泡特征。
图4B:内吞标志物共定位表明早期内体标志物Rab5与Cy3信号广泛共定位,而晚期内体/溶酶体标志物Rab7共定位较少,表明摄取主要通过早期内吞途径,而非溶酶体降解。
这些结果表明,足细胞通过内吞作用摄取外泌体,且小RNA主要定位于早期内体,提示保留功能活性。
5、时间与剂量依赖的摄取动力学
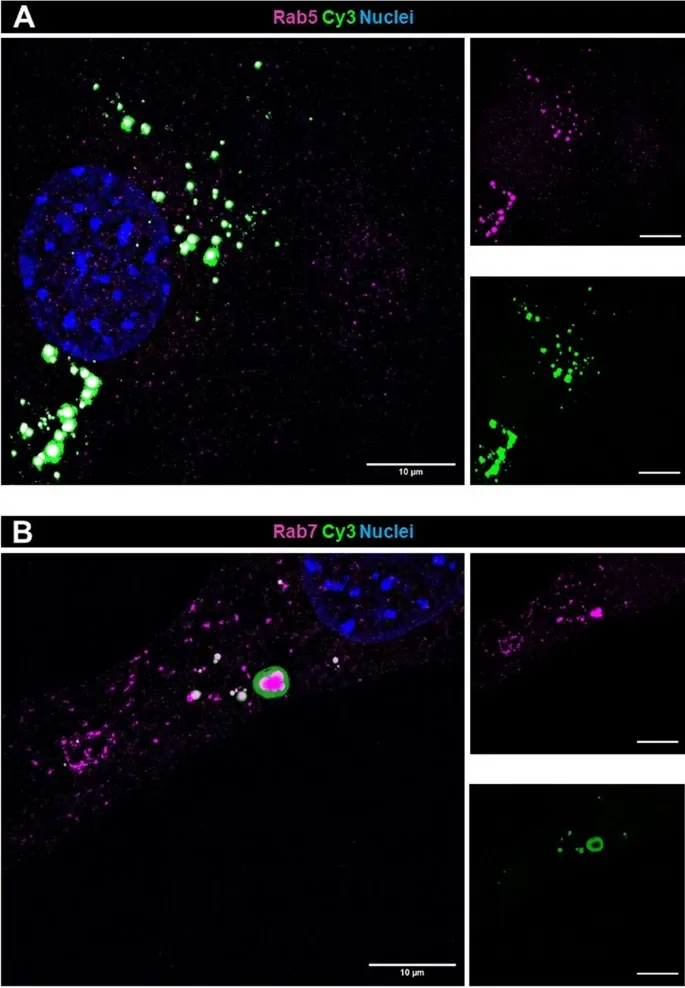
图5A时间依赖性分析表明,处理4小时即可检测到胞内荧光,24小时时细胞内外信号量相近,48小时后细胞外信号显著减少,1周时完全内化,伴随CD9阳性囊泡积累。
图5B:剂量依赖性分析表明,外泌体浓度从18.75µg/孔增至150µg/孔,细胞内荧光强度呈线性增加,证实摄取效率与剂量正相关。
这些结果表明,足细胞对外泌体的摄取具有时间和剂量依赖性,长期培养下可完全内化。
6、外泌体递送pre-miR-21的功能活性验证
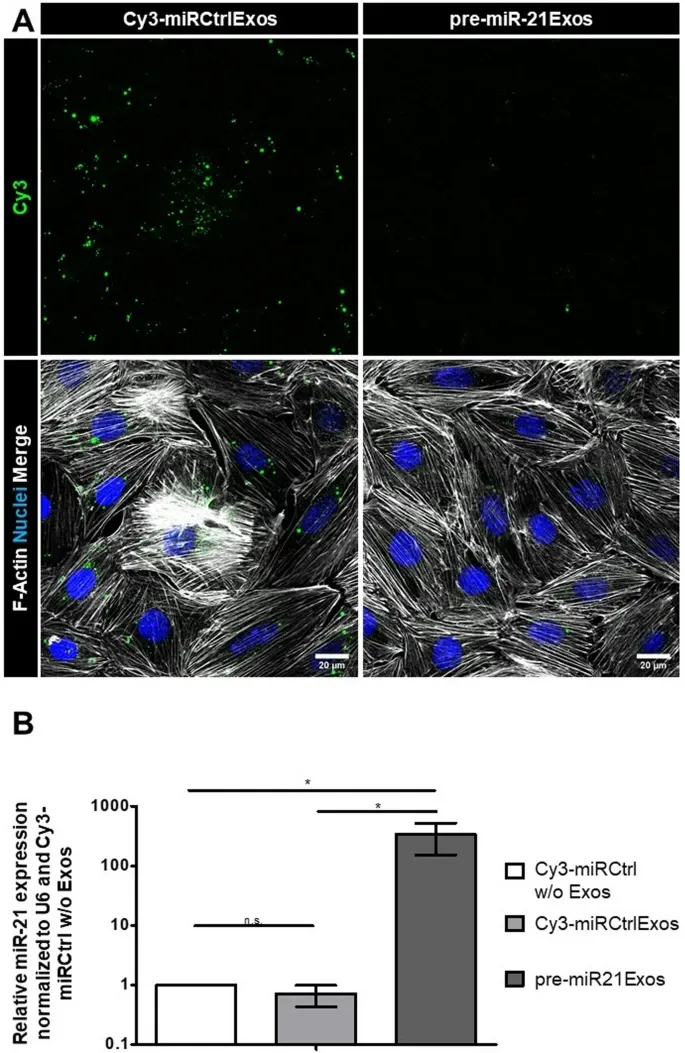
图6A:cLSM显示,pre-miR-21Exos(无荧光标记)处理组足细胞无Cy3信号,排除非特异性结合;Cy3-miRCtrlExos对照组显示高效内化。
图6B:RT-qPCR检测显示,pre-miR-21Exos处理组成熟miR-21水平较对照组显著升高338倍,证实外泌体递送的pre-miR-21可被加工为功能性成熟miRNA。
这些结果表明,外泌体可有效递送pre-miRNA并诱导靶基因表达上调,验证其在基因调控中的功能活性。
7、外泌体递送siRNA的基因沉默效应
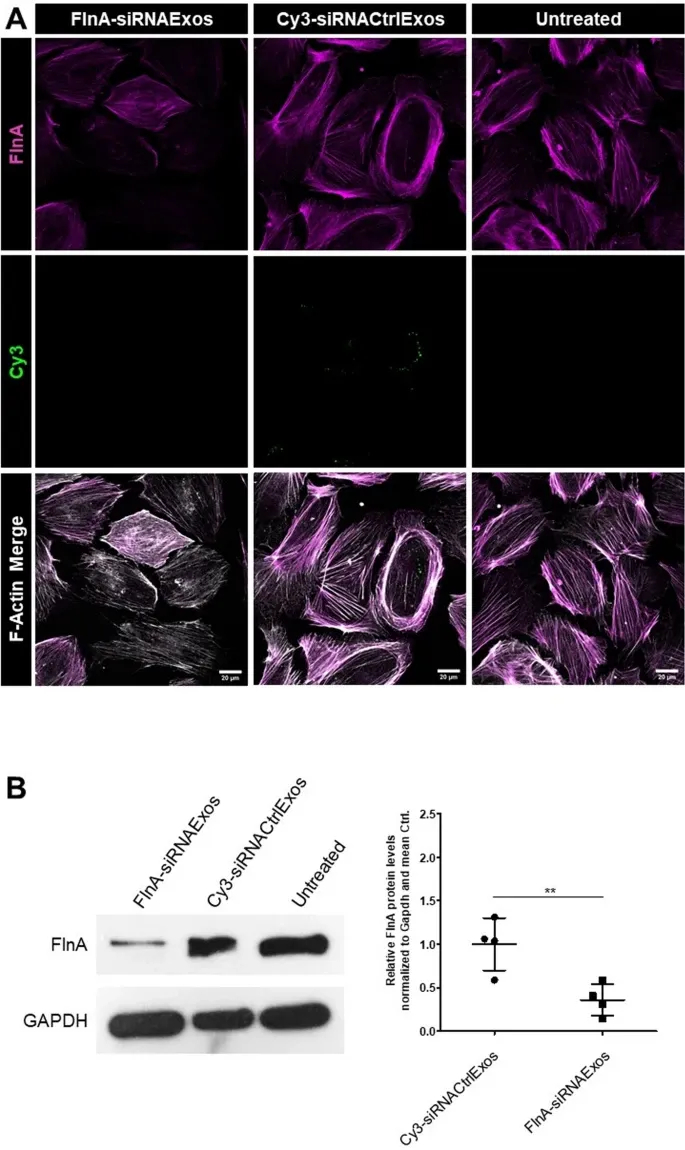
图7A:免疫荧光染色显示,FilaminA(FlnA)siRNA转染外泌体(FlnA-siRNAExos)处理后,足细胞FlnA蛋白荧光强度显著降低,而对照siRNA组(Cy3-siRNACtrlExos)无变化。
图7B:Western blot定量显示,FlnA-siRNAExos组FlnA蛋白表达量降至对照组的0.36倍,证实特异性基因沉默效应。
这些结果表明,外泌体递送siRNA可高效抑制靶蛋白表达,验证了其在基因编辑中的有效性。
结论
本研究首次证实,外泌体直接转染技术可通过内吞途径高效、特异地向足细胞递送小RNA(miRNA/siRNA),且避免溶酶体降解以保留功能活性。体外实验显示,该技术可显著上调成熟miR-21表达,并特异性沉默FlnA等靶基因,为CKD中足细胞损伤的机制研究和靶向治疗提供了新工具。与传统间接加载方法相比,直接转染具有高纯度、低毒性、强特异性及可规模化等优势,有望推动外泌体在肾脏疾病基因治疗中的临床转化。未来需进一步探索其在体内的递送效率及长期安全性,以拓展其应用场景。






