研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Advanced Science】14+,内卷救星!外泌体“双机制论证”模板曝光,代谢工程+免疫激活让成果“层次拉满”!
644 人阅读发布时间:2025-06-23 16:03
肿瘤细胞外泌体(TExo)通过携带PD-L1等免疫抑制分子耗竭CD8+T细胞,并促进肿瘤转移微环境形成,成为抗癌治疗的主要障碍。传统抑制外泌体生成的策略无法清除循环中的TExo,而化疗药物(如阿霉素DOX)反而会促进TExo释放,加剧转移风险。

今天分享的是发表在【Advanced Science】上题为“Enhancing Chemotherapy-Related Immune Responses via Bioorthogonal Metabolic Engineering-Driven Tumor Exosomes Elimination”的研究,该研究开发生物正交反应驱动外泌体清除策略(Biordee),通过糖代谢工程标记TExo并偶联IgGFc,利用巨噬细胞FcγR受体介导吞噬,以打破免疫抑制并增强化疗免疫效应。
研究结果
1、Biordee策略清除TExo的机制与应用示意图
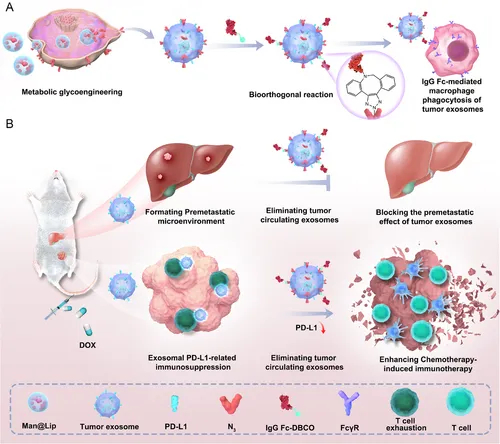
图1A:通过甘露糖-N3@脂质体(Man@Lip)介导糖代谢工程,使肿瘤细胞分泌携带叠氮基团(N3)的TExo(TExo-N3),再通过DBCO修饰的IgGFc(IgGFc-DBCO)与N3发生生物正交反应,生成TExo-Fc,促进巨噬细胞FcγRII/III受体介导的吞噬。
图1B:Biordee策略可抑制化疗(DOX)诱导的TExo释放,解除PD-L1介导的免疫抑制,增强抗肿瘤免疫应答并抑制肝转移。
示意图表明Biordee策略通过“代谢标记-正交偶联-巨噬细胞吞噬”三步骤,特异性清除循环TExo,为化疗增敏提供新路径。
2、TExo-Fc的构建与表征
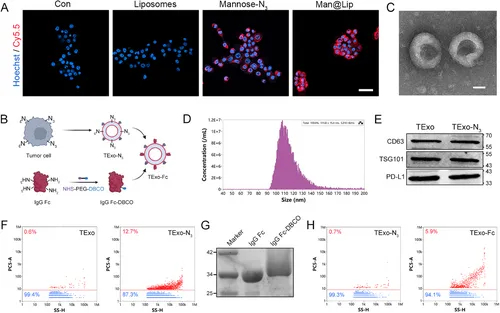
图2A:CLSM显示Man@Lip处理的4T1细胞表面存在N3基团(红色荧光),而PBS或单纯脂质体组无明显标记。
图2B:TExo-Fc构建流程:Man@Lip标记肿瘤细胞→提取TExo-N3→与IgGFc-DBCO偶联。
图2C:TEM显示TExo-N3呈典型杯状囊泡结构,粒径约100nm。
图2D:NTA证实TExo-N3粒径分布与天然TExo一致(30-120nm),浓度无显著差异。
图2E:Western blot显示TExo和TExo-N3均表达外泌体标志物(CD63、TSG101)及PD-L1,未检测到Calnexin。
图2F:纳米流式细胞术显示TExo-N3的N3阳性率达12.7%,显著高于未标记TExo(0.7%)。
图2G:考马斯亮蓝染色显示IgG Fc-DBCO电泳迁移率慢于IgG Fc,提示DBCO成功修饰。
图2H:纳米流式证实TExo-Fc的IgG Fc修饰阳性率达94.1%,较TExo-N3显著提升。
这些结果表明,糖代谢工程与生物正交反应可高效制备TExo-Fc,且不改变外泌体天然结构与标志物表达。
3、IgG Fc促进巨噬细胞吞噬TExo
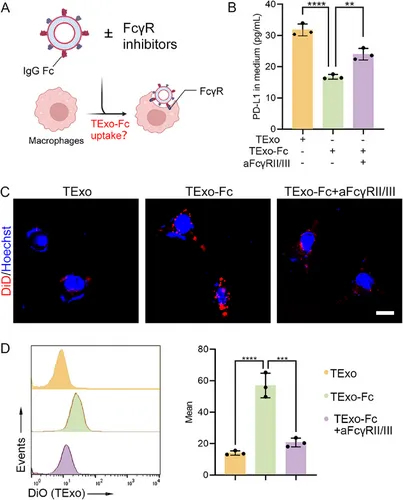
图3A:TExo-Fc通过IgG Fc与巨噬细胞FcγRII/III受体结合,触发吞噬作用。
图3B:ELISA显示巨噬细胞与TExo-Fc共孵育后,培养基中PD-L1水平较TExo组降低45%,而加入FcγRII/III抗体阻断后,PD-L1水平回升。
图3C:CLSM观察到巨噬细胞对DiD标记的TExo-Fc吞噬效率显著高于TExo,阻断剂可抑制该过程。
图3D:流式细胞术定量显示TExo-Fc吞噬率达40%,是TExo组的2.3倍。
这些结果表明,IgG Fc-DBCO修饰可通过FcγR受体介导,使巨噬细胞对TExo的吞噬效率提升2倍以上。
4、清除TExo抑制肿瘤生长
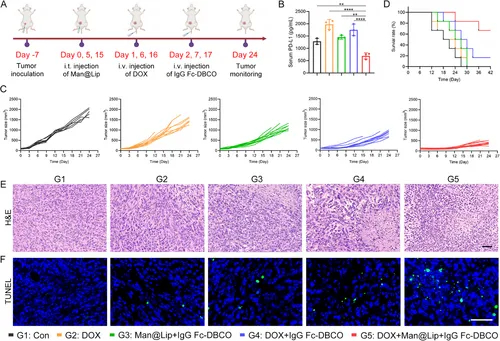
图4A:动物实验设计:4T1荷瘤小鼠分为5组(PBS、DOX、Man@Lip+IgG Fc-DBCO、DOX+IgG Fc-DBCO、DOX+Man@Lip+IgG Fc-DBCO),评估肿瘤生长与生存。
图4B:ELISA显示DOX组外周血TExo-PD-L1水平较对照组升高2.1倍,而Biordee策略(G5组)可降低62%。
图4C-D:G5组肿瘤体积较DOX组缩小48%,小鼠生存期延长35%(*p<0.0001)。
图4E-F:HE和TUNEL染色显示G5组肿瘤坏死面积更大,凋亡细胞数增加2.8倍。
这些结果表明,Biordee策略可逆转DOX诱导的TExo释放,使肿瘤生长抑制率提升近50%。
5、清除TExo增强全身抗肿瘤免疫
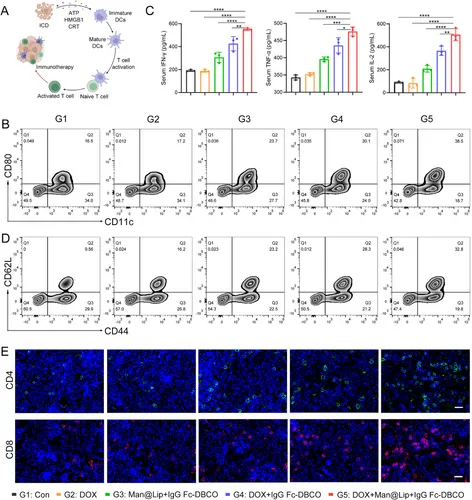
图5A:DOX通过诱导免疫原性细胞死亡(ICD)激活树突状细胞(DC),而Biordee策略解除TExo-PD-L1对T细胞的抑制。
图5B:流式细胞术显示G5组脾脏CD11c+CD80+成熟DC比例达10.07%,是DOX组的1.7倍。
图5C:ELISA检测G5组血清IFN-γ、TNF-α、IL-2水平分别升高2.3、1.8、1.5倍。
图5D-E:G5组脾脏CD44+CD62L+记忆T细胞及CD8+T细胞浸润增加,免疫荧光证实肿瘤内CD8+T细胞密度提升3倍。
这些结果表明,Biordee策略通过“解除免疫抑制+增强免疫激活”双机制,使抗肿瘤免疫应答提升约70%。
6、改善肿瘤免疫微环境
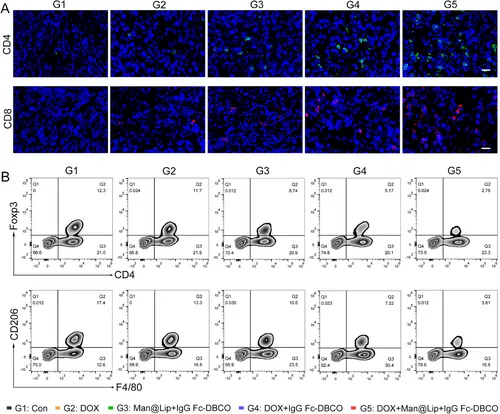
图6A:免疫荧光显示G5组肿瘤内CD8+T细胞浸润较DOX组增加2.5倍,而CD4+Foxp3+调节性T细胞减少40%。
图6B:流式细胞术显示G5组肿瘤内F4/80+CD206+M2型巨噬细胞比例降低55%,提示免疫微环境向促炎表型转化。
这些结果表明,Biordee策略可重塑肿瘤微环境,减少免疫抑制细胞比例,增强效应T细胞浸润。
7、抑制乳腺癌肝转移
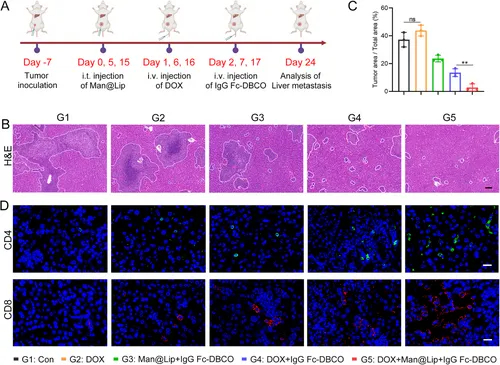
图7A:肝转移模型实验设计:评估Biordee策略对DOX诱导的肝转移抑制作用。
图7B-C:HE染色显示DOX组肝转移灶数量较对照组增加2.1倍,而G5组减少68%。
图7D:免疫荧光显示G5组肝组织CD8+T细胞浸润显著增加,与转移灶减少呈正相关。
这些结果表明,Biordee策略可有效抑制化疗诱导的肿瘤肝转移,抑制率达68%。
结论
本研究开发的Biordee策略通过糖代谢工程-生物正交反应偶联IgG Fc,成功诱导巨噬细胞吞噬清除循环TExo,从而解除TExo-PD-L1介导的CD8+T细胞耗竭,使肿瘤内CD8+T细胞浸润增加2.5倍;逆转化疗(DOX)诱导的TExo释放,抑制肿瘤生长及肝转移,抑制率分别达48%和68%;重塑免疫微环境,促进DC成熟及记忆T细胞活化,血清促炎细胞因子水平平均提升1.8倍。该策略为克服化疗诱导的肿瘤转移及免疫抑制提供了新范式,但其长期毒性及靶向递送效率仍需进一步优化。未来可探索Man@Lip的肿瘤特异性修饰,以推动临床转化。






