研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF10 +发文秘钥!外泌体 ADAM10 成 VM 形成“关键内援”,DDX5 增强子调控机制全解析
374 人阅读发布时间:2025-06-25 13:07
抗血管生成疗法(AATs)在鼻咽癌(NPC)治疗中常因肿瘤产生耐药而疗效有限,其关键机制之一是血管生成拟态(VM)的代偿性形成。VM是由恶性肿瘤细胞独立于内皮细胞形成的功能性微循环系统,与NPC转移和不良预后密切相关。

湾湾今天分享的是发表在【Cell Rep Med】(IF:10.6)上题为“DDX5 super-enhancer promotes vasculogenic mimicry formation and metastasis in nasopharyngeal carcinoma by enhancing ADAM10 transcription”的研究。该研究通过整合蛋白质组学、染色质互作分析等技术,揭示VM形成的分子机制,并筛选出靶向VM的潜在治疗化合物,为克服AATs耐药提供新策略。
研究结果
1.MV抑制诱导代偿性VM形成及VM在NPC中的临床意义
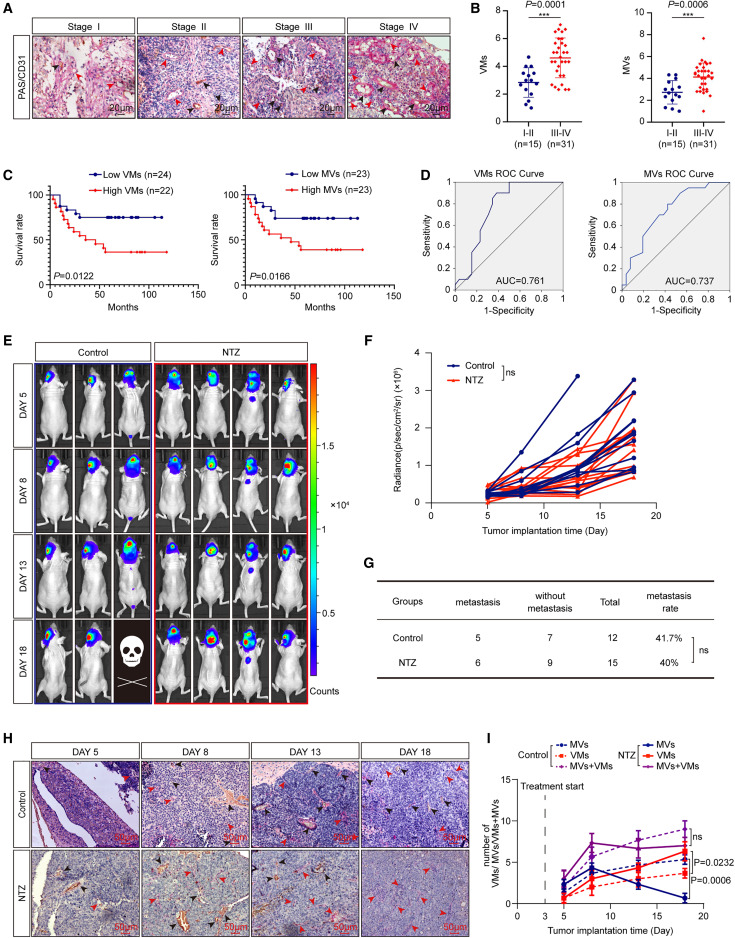
图1A:CD31(内皮细胞标记)和PAS(基底膜标记)双重染色显示,NPC组织中存在PAS+/CD31-的VM结构(红色箭头)和PAS+/CD31+的微血管(MV,黑色箭头)。
图1B:临床分期III-IV期患者的VM和MV数量显著高于I-II期。
图1C:Kaplan-Meier分析表明,高VM或高MV密度患者的总生存期更短。
图1D:ROC曲线显示VM和MV数量对NPC预后具有较高预测价值(AUC分别为0.761和0.737)。
图1E-G:在NPC原位小鼠模型中,尼莫司汀(NTZ)治疗未显著抑制肿瘤生长或转移率。
图1H-I:NTZ治疗导致VM数量代偿性增加,维持总微循环密度不变。
这些结果表明,VM在NPC进展中起关键作用,AATs治疗可诱导VM代偿性形成,是导致治疗耐药的重要原因。
2.富含ADAM10的外泌体促进VM形成、迁移和侵袭
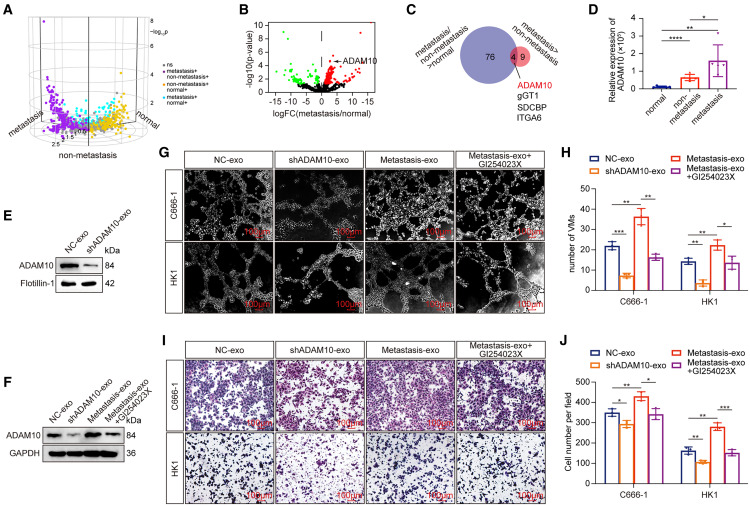
图2A-C:DIA蛋白质组学分析显示,转移患者血清外泌体(metastasis-exos)中ADAM10表达显著上调,且与非转移外泌体(non-metastasis-exos)和正常外泌体(normal-exos)存在差异蛋白表达。
图2D:Western blot验证ADAM10在metastasis-exos中高表达。
图2E-F:敲低ADAM10(shADAM10-exo)显著降低外泌体中ADAM10水平,并抑制NPC细胞中ADAM10表达。
图2G-J:功能实验表明,metastasis-exos促进NPC细胞体外管腔形成、迁移和侵袭,而ADAM10抑制剂(GI254023X)可逆转该效应。
这些结果表明,ADAM10在外泌体中富集,是驱动VM形成和NPC细胞恶性表型的关键因子。
3.ADAM10敲低联合NTZ治疗通过抑制VM和MV形成预防转移并改善预后
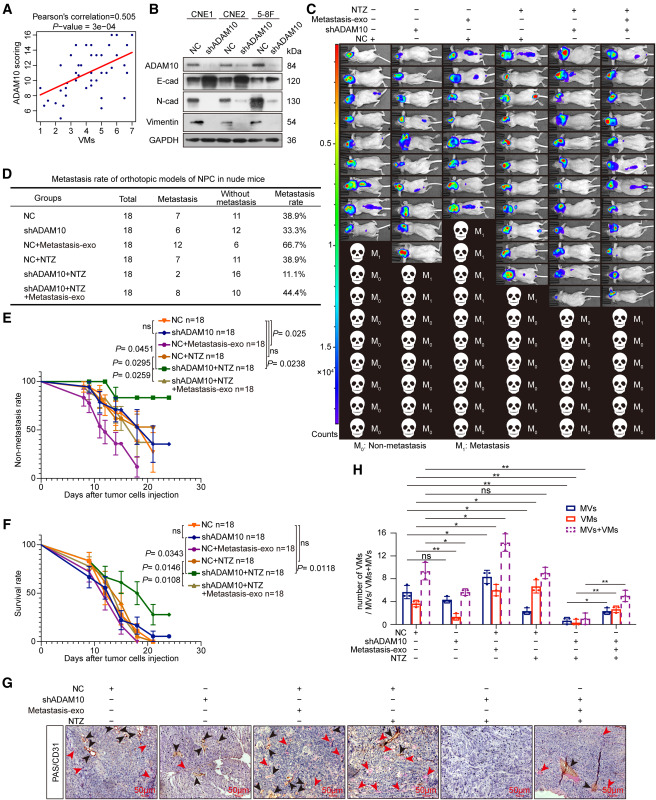
图3A:NPC组织中ADAM10表达与VM密度呈正相关(Pearson相关分析)。
图3B:敲低ADAM10抑制NPC细胞中EMT相关蛋白(如N-cadherin、Vimentin)表达。
图3C-G:在小鼠模型中,shADAM10联合NTZ治疗显著抑制肿瘤生长,降低转移率并延长生存期。
图3H:联合治疗显著减少VM和MV数量,抑制EMT和ADAM10表达。
这些结果表明,ADAM10促进NPC进展和VM形成,联合抑制ADAM10和VEGF可增强抗肿瘤效果。
4.ADAM10上游转录因子DDX5和E2F1通过与超级增强子(SE)的长程环化互作被激活
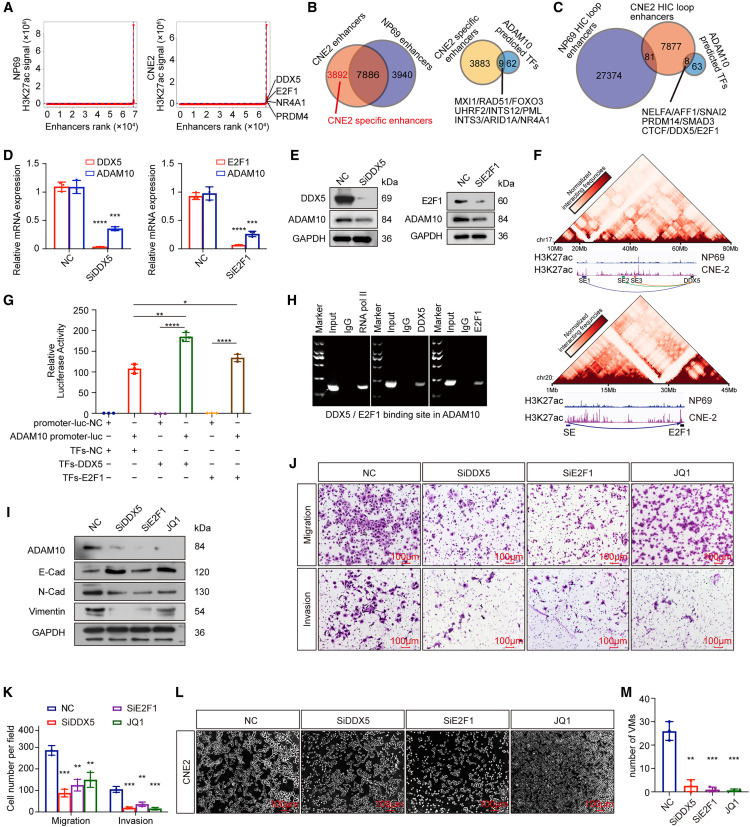
图4A-B:CUT&Tag测序鉴定CNE2细胞中H3K27ac标记的增强子,发现DDX5和E2F1与SE相关。
图4C:Hi-C分析显示CNE2细胞中SE区域与DDX5/E2F1启动子存在长程染色质环化。
图4D-E:敲低DDX5或E2F1显著降低ADAM10mRNA和蛋白表达(p<0.0001)。
图4F:Hi-C验证SE与DDX5/E2F1启动子的特异性互作。
图4G-H:荧光素酶报告基因和ChIP实验证实DDX5/E2F1结合ADAM10启动子并激活其转录。
图4I-M:敲低DDX5/E2F1或使用SE抑制剂(JQ1)抑制ADAM10表达、EMT和VM形成。
这些结果表明,DDX5和E2F1通过SE介导的长程染色质互作激活ADAM10转录,促进NPC恶性表型。
5.DDX5-SE的关键成分通过转录激活ADAM10在促进迁移、侵袭和VM形成中起关键作用
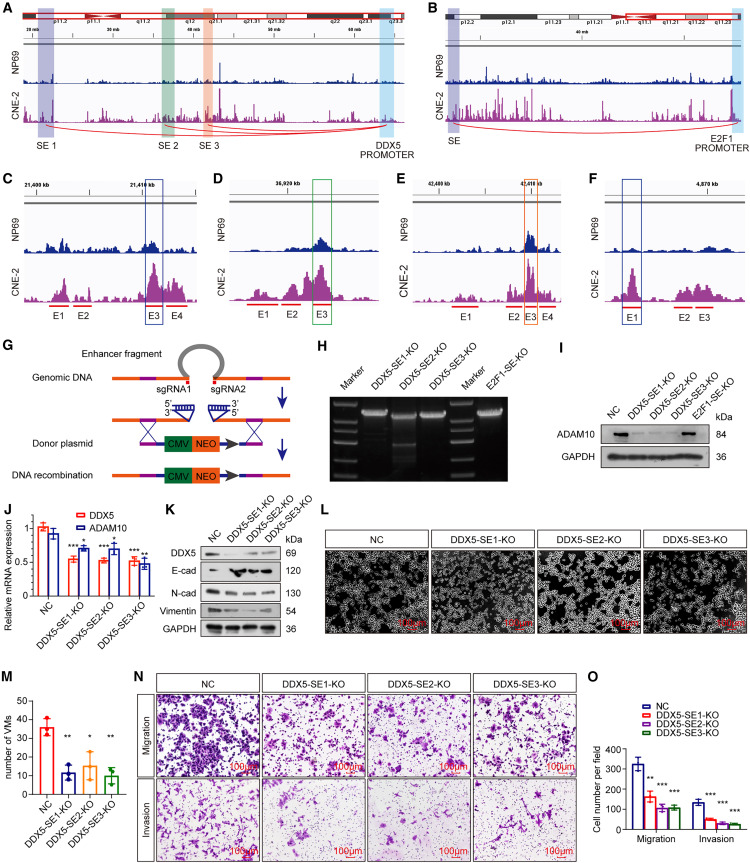
图5A-B:Hi-C显示DDX5-SE与启动子区域存在特异性环化互作。
图5C-F:CRISPR-Cas9设计靶向DDX5-SE的三个关键成分(SE1-SE3)及E2F1-SE。
图5G-H:PCR验证SE成分缺失的CNE2细胞系构建成功。
图5I-K:敲除DDX5-SE1-SE3显著降低DDX5和ADAM10表达(p<0.05),抑制EMT。
图5L-O:SE成分缺失抑制NPC细胞体外管腔形成、迁移和侵袭。
这些结果表明,DDX5-SE的关键成分是激活ADAM10转录和驱动VM形成的必要条件。
6.AML、SRY和NKX2.5与DDX5-SE的关键成分互作,负责DDX5和ADAM10的表达和功能
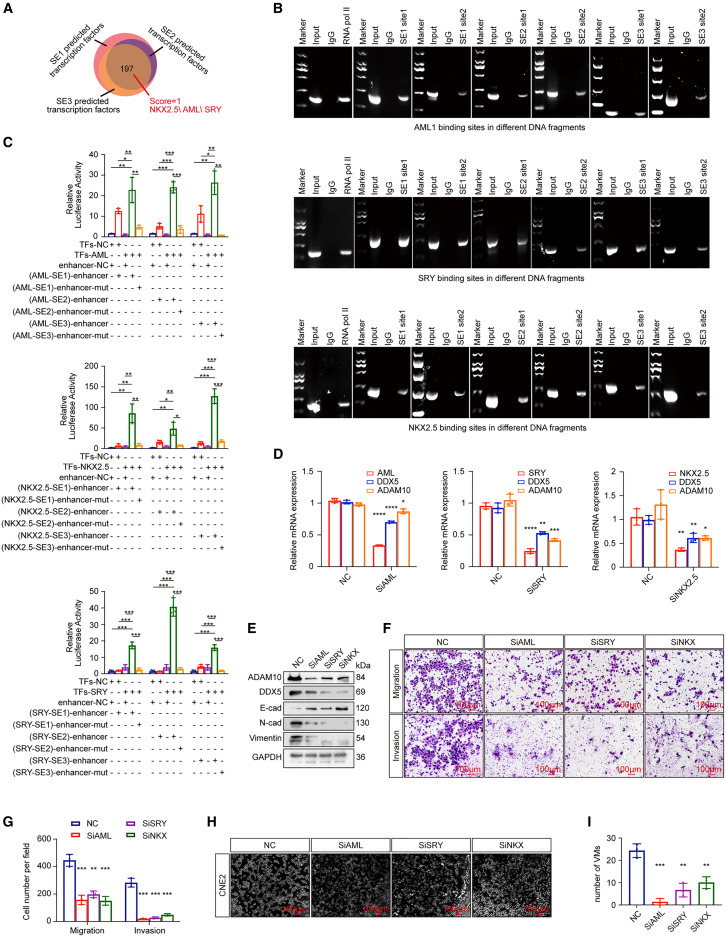
图6A:生物信息学预测NKX2.5、AML和SRY为DDX5-SE的潜在结合转录因子。
图6B-C:ChIP和荧光素酶实验证实这三种转录因子结合DDX5-SE并激活其活性。
图6D-E:敲低NKX2.5/AML/SRY降低DDX5和ADAM10表达,抑制EMT。
图6F-I:功能实验显示,敲低这三种转录因子抑制NPC细胞迁移、侵袭和VM形成。
这些结果表明,NKX2.5、AML和SRY通过结合DDX5-SE激活DDX5/ADAM10轴,促进NPC进展。
7.IM预防AAT耐药,IM与NTZ联合治疗预防转移并改善预后
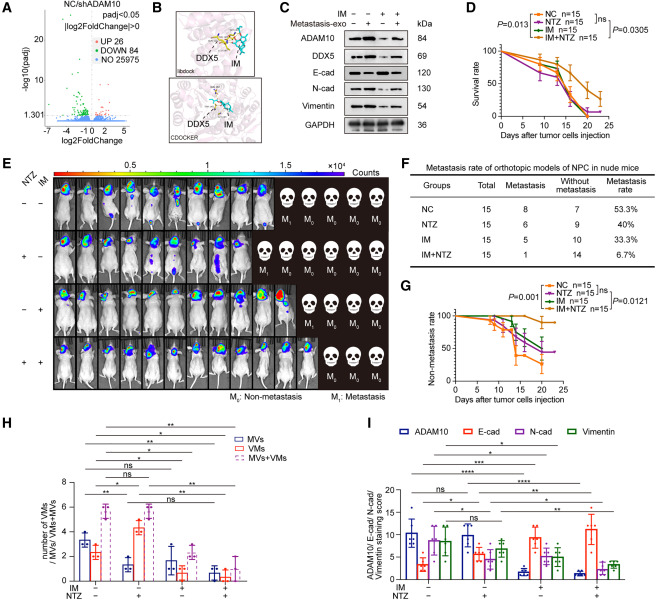
图7A:转录组分析显示,敲低ADAM10导致26个基因上调和84个基因下调。
图7B:分子对接显示IM与DDX5具有高亲和力。
图7C:IM治疗降低DDX5、ADAM10和EMT蛋白表达,逆转metastasis-exos的促恶性作用。
图7D-G:在小鼠模型中,IM联合NTZ治疗显著延长生存期,降低转移率。
图7H-I:联合治疗减少VM和MV数量,抑制ADAM10表达和EMT。
这些结果表明,IM通过靶向DDX5抑制ADAM10/VM轴,与NTZ联合使用可增强抗肿瘤和抗转移效果。
结论
本研究揭示了NPC中VM形成的分子机制:DDX5超级增强子通过招募转录因子NKX2.5、AML和SRY,驱动ADAM10转录,促进VM形成和肿瘤转移。靶向DDX5的化合物IM可有效抑制VM和转移,与NTZ联合使用能克服AATs耐药,为NPC治疗提供了新的靶向策略。未来需进一步验证IM的临床安全性和疗效,探索其与其他疗法的联合应用潜力。






