研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
10+热点破局!热门人参中药成分遇上“国自然热点外泌体”:TMTP1修饰克服肿瘤免疫治疗耐药!
1398 人阅读发布时间:2025-06-27 17:07
近年来,外泌体作为国自然研究热点,在肿瘤免疫治疗领域持续引发关注。当传统中药人参中的关键成分人参皂苷Rb1,与具备精准靶向能力的TMTP1肽修饰外泌体相遇,一场克服肿瘤免疫治疗耐药的科研探索就此展开。研究表明,通过TMTP1修饰的外泌体递送系统(Rb1@T-exo),可高效装载人参皂苷Rb1,靶向抑制PI3K/AKT/mTOR信号通路,重塑肿瘤微环境,逆转免疫治疗耐药。这一融合中药活性成分与纳米递送技术的创新策略,不仅为突破肿瘤免疫治疗瓶颈提供了新思路,更彰显了中药成分与前沿生物医学技术结合的巨大潜力。

今天分享的是一篇发表在【J Nanobiotechnology】(IF:10.6)上题为“Overcoming acquired immunotherapy resistance in non-small cell lung cancer using ginsenoside Rb1-loaded, peptide-enhanced exosome delivery systems”的研究,该研究提出一种创新策略:利用肿瘤来源外泌体(T-exo)修饰肿瘤靶向肽TMTP1,并通过电穿孔加载人参皂苷Rb1(Rb1@T-exo)。研究旨在利用Rb1@T-exo有效靶向肿瘤细胞,抑制PI3K/AKT/mTOR信号通路的活性,从而逆转对免疫治疗的获得性耐药。此外,通过系统的体外和体内实验,该研究详细阐述了Rb1@T-exo在重塑肿瘤免疫微环境、促进T细胞增殖以及极化M1巨噬细胞方面的作用。从科学角度而言,该研究阐明了PI3K突变型NSCLC耐药的分子机制,为未来抗肿瘤治疗提供了新的理论基础和分子靶点。从临床角度而言,该研究的发现为NSCLC的诊断和治疗提供了新的方向,特别是在克服免疫治疗耐药方面,Rb1@T-exo展现出显著的应用潜力,有望为患者提供更有效且持久的治疗选择。
研究成果
1.肽修饰的Rb1@T-Exo的制备及表征
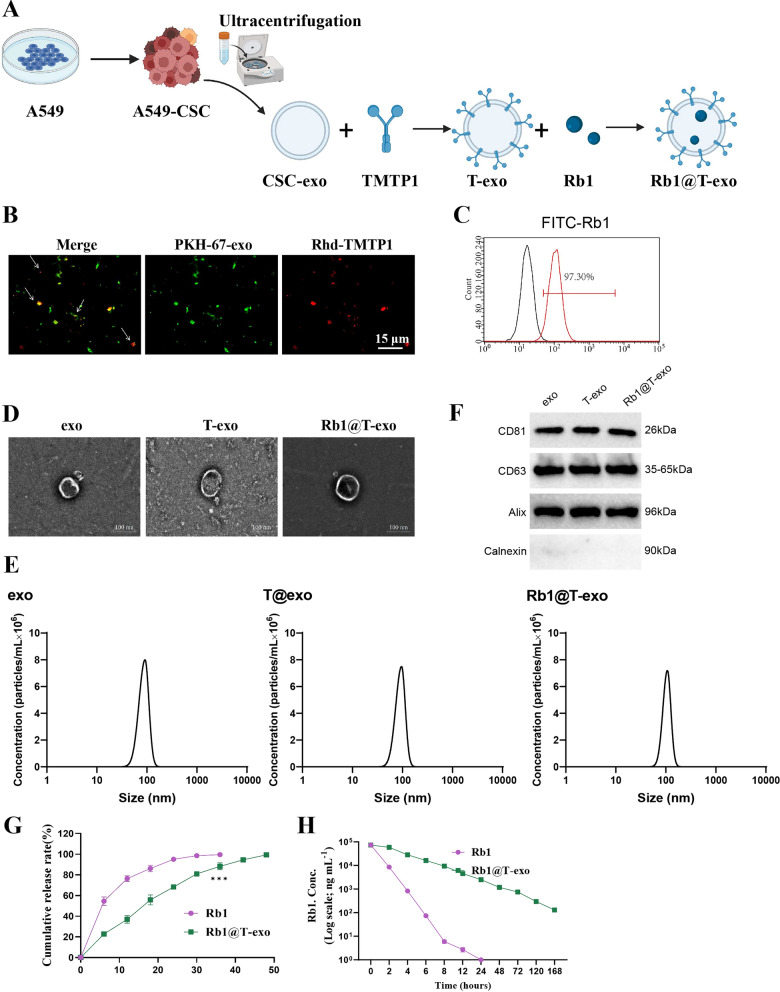
图1 Rb1@T-exo的制备与表征。
图1A:Rb1@T-exo的制备流程示意图。
图1B:在共聚焦激光扫描显微镜下观察到的PKH-67-exo与Rhd-TMTP1的共定位。结果显示,PKH67标记的CSC-exo与Rhd标记的TMTP1成功共定位,证实TMTP1与外泌体的有效结合。
图1C:用FITC-Rb1进行流式细胞术分析。结果显示Rb1成功加载至T-exo内。
图1D:通过透射电子显微镜观察到的Rb1@T-exo的形态特征。结果显示Rb1@T-exo呈典型杯状或球形,直径约107.4nm。
图1E:外体、T@exo和Rb1@T-exo的尺寸分布的纳米颗粒追踪分析。结果显示Rb1@T-exo的粒径分布与T-exo相似,但平均直径略大。
图1F:Rb1@T-exo中CD63、CD81、Calnexin和Alix表达的WB分析。结果显示Rb1@T-exo保留外泌体标记蛋白(CD63、CD81、Alix),且未引入新杂质。
图1G:未结合Rb1和Rb1@T-exo的药物释放曲线。结果显示Rb1@T-exo的药物释放速率慢于游离Rb1,具有缓释特性。
图1H:各给药时间点Rb1和Rb1@T-exo的血浆浓度-时间曲线。结果显示Rb1@T-exo在血浆中的浓度-时间曲线下面积(AUC)是游离Rb1的3倍,半衰期延长33倍,清除率降低。
这些结果表明,Rb1@T-exo成功制备,具备良好的理化性质、缓释能力及体内稳定性。
2.Rb1@T-exo能抑制PI3K突变型非小细胞肺癌的生长和转移,且安全性良好
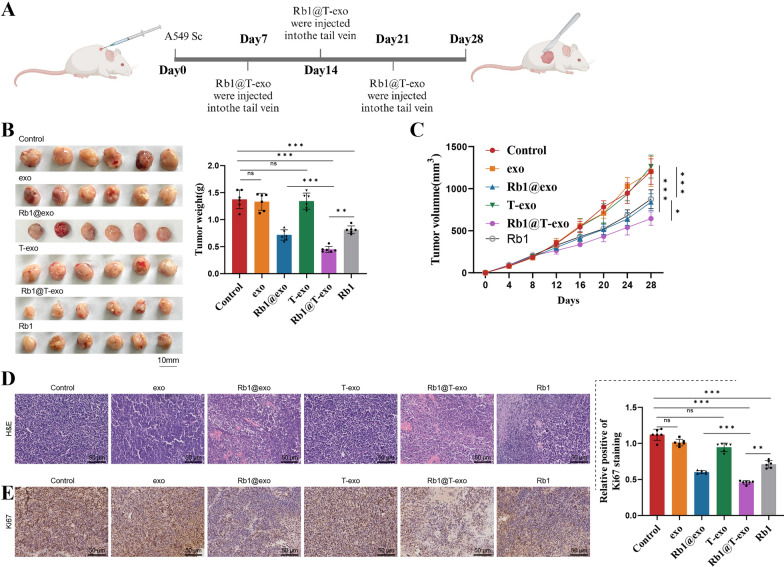
图2 Rb1@T-exo对PI3K突变型非小细胞肺癌皮下异种移植小鼠模型的影响。
图2A:动物实验的示意图。
图2B:各组皮下异种移植模型小鼠分离肿瘤的图像及重量。结果显示,Rb1@T-exo组肿瘤重量显著低于对照组,且优于游离Rb1组。
图2C:各组小鼠的肿瘤生长曲线。结果显示Rb1@T-exo组肿瘤生长速率最慢。
图2D:各组肿瘤的H&E染色图像。结果显示,Rb1@T-exo组肿瘤细胞排列更规整,炎症细胞浸润减少,细胞形态更接近正常。
图2E:各组肿瘤中Ki67表达的免疫组织化学分析。结果显示,Rb1@T-exo组Ki67表达显著降低,提示肿瘤细胞增殖受抑。
这些结果表明Rb1@T-exo可有效抑制PI3K突变NSCLC的皮下肿瘤生长,且安全性良好。
3.Rb1@T-exo可逆转非小细胞肺癌患者对免疫疗法产生的耐药性
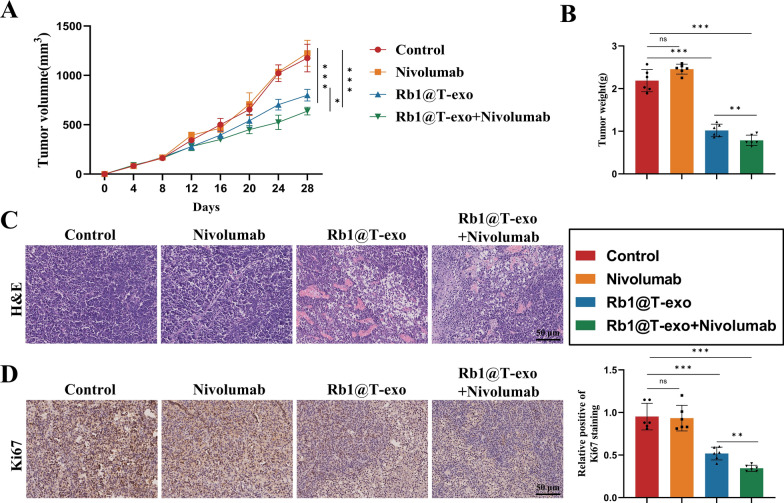
图3 Rb1@T-exo对具有免疫治疗耐药性的PI3K突变型非小细胞肺癌小鼠模型的影响。
图3A:各组小鼠的肿瘤生长曲线。结果显示,Nivolumab单药对耐药模型(344SQ_R细胞)无效,而Rb1@T-exo联合Nivolumab组肿瘤生长抑制最显著。
图3B:各组小鼠的肿瘤重量。结果显示Rb1@T-exo联合Nivolumab组肿瘤重量最低。
图3C:各组肿瘤的HE染色图像。结果显示,联合治疗组肿瘤细胞结构破坏更明显,细胞异型性降低。
图3D:各组肿瘤中Ki67表达的免疫组织化学分析。结果显示联合治疗组Ki67表达量最低,证实肿瘤增殖受抑。
这些结果表明Rb1@T-exo单药或联合Nivolumab可逆转NSCLC的免疫治疗耐药,联合治疗效果更优。
4.对Rb1@T-Exo的转录组分析揭示了PI3K突变型非小细胞肺癌小鼠对免疫治疗获得性耐药的逆转机制,并确定了关键通路

图4转录组分析及关键通路鉴定。
图4A:差异表达基因的火山图。结果显示,Rb1@T-exo组与对照组相比,有223个差异表达基因(DEGs),其中98个上调、125个下调。
图4B:热图展示前50个显著差异基因的表达模式。
图4C-D:差异表达基因的GO和KEGG分析。结果显示,DEGs富集于PI3K/AKT/mTOR信号通路、PD-L1表达及免疫相关通路。
图4E:对照组和Rb1@T-exo组基因表达谱的GSEA富集分析。结果证实,Rb1@T-exo显著抑制PI3K/AKT/mTOR通路。
图4F-H:蛋白互作(PPI)网络分析及枢纽基因鉴定。结果显示,PI3K/AKT/mTOR通路相关基因(如PIK3CA、AKT1)在网络中处于核心地位。
以上这些结果表明Rb1@T-exo通过调控PI3K/AKT/mTOR通路及免疫相关基因,逆转NSCLC的免疫治疗耐药。
5.Rb1@T-exo能增强纳武利尤单抗对PI3K/AKT/mTOR通路的抑制作用,该作用在PI3K突变的耐药性非小细胞肺癌中尤为显著。
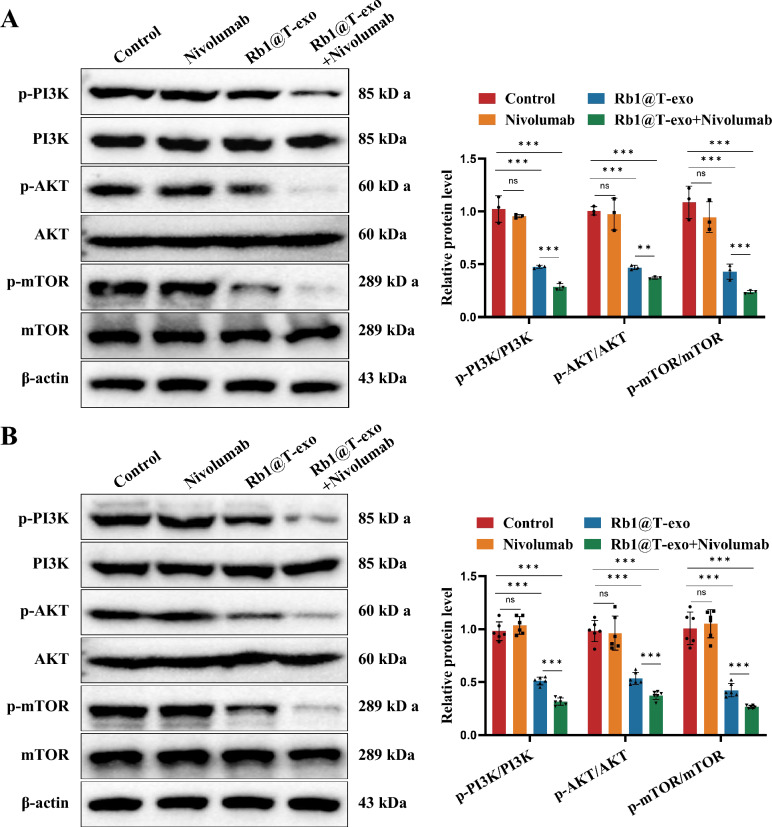
图5 Rb1@T-exo对PI3K/AKT/mTOR通路的抑制作用。
图5A:各细胞组中p-PI3K/PI3K、p-AKT/t-AKT和p-mTOR/mTOR表达的WB分析。结果显示,Rb1@T-exo组及联合治疗组的p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR磷酸化水平显著降低。
图5B:各小鼠组中p-PI3K/PI3K、p-AKT/t-AKT和p-mTOR/mTOR表达的WB分析。结果显示联合治疗组抑制最明显。
以上结果表明Rb1@T-exo通过抑制PI3K/AKT/mTOR通路的激活,逆转肿瘤细胞的耐药表型。
6.Rb1@T-exo能够促使具有PI3K突变且对免疫疗法产生耐药性的非小细胞肺癌患者的免疫微环境发生重塑
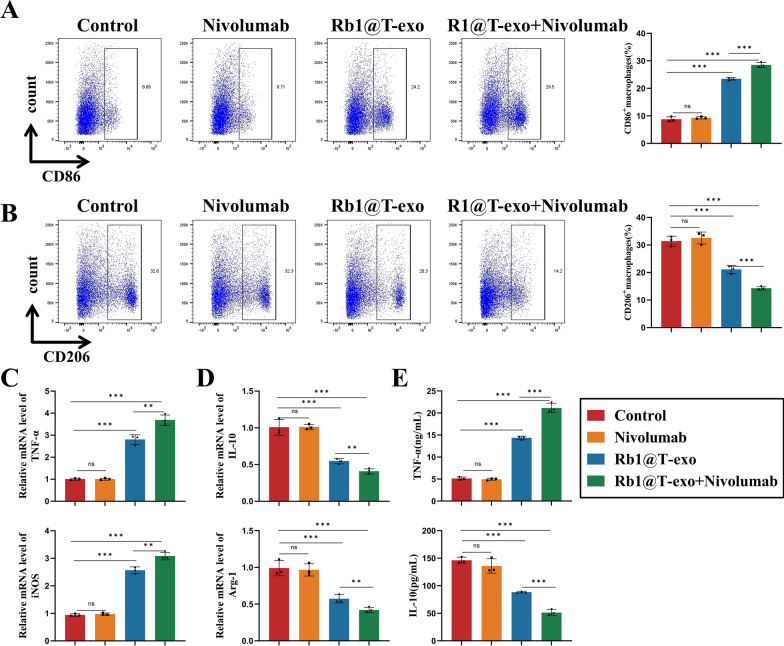
图6 Rb1@T-exo对巨噬细胞的影响。
图6A:对各组中M1型巨噬细胞比例的流式细胞术分析。结果显示,Rb1@T-exo组M1型巨噬细胞(CD86+)比例增加。
图6B:对各组中M2型巨噬细胞比例的流式细胞术分析。结果显示M2型(CD206+)比例减少,联合治疗组效果更显著。
图6C:对各组中M1型巨噬细胞标志物iNOS和TNF-α表达的RT-PCR分析。结果显示M1标志物(iNOS、TNF-α)表达上调。
图6D:对各组中M2型巨噬细胞标志物IL-10和Arg-1表达的RT-PCR分析。结果显示M2标志物(IL-10、Arg-1)表达下调。
图6E:对各组中M1/M2型巨噬细胞标志物TNF-α和IL-10水平的ELISA分析。结果显示Rb1@T-exo组TNF-α水平升高,IL-10水平降低,提示促炎环境增强。
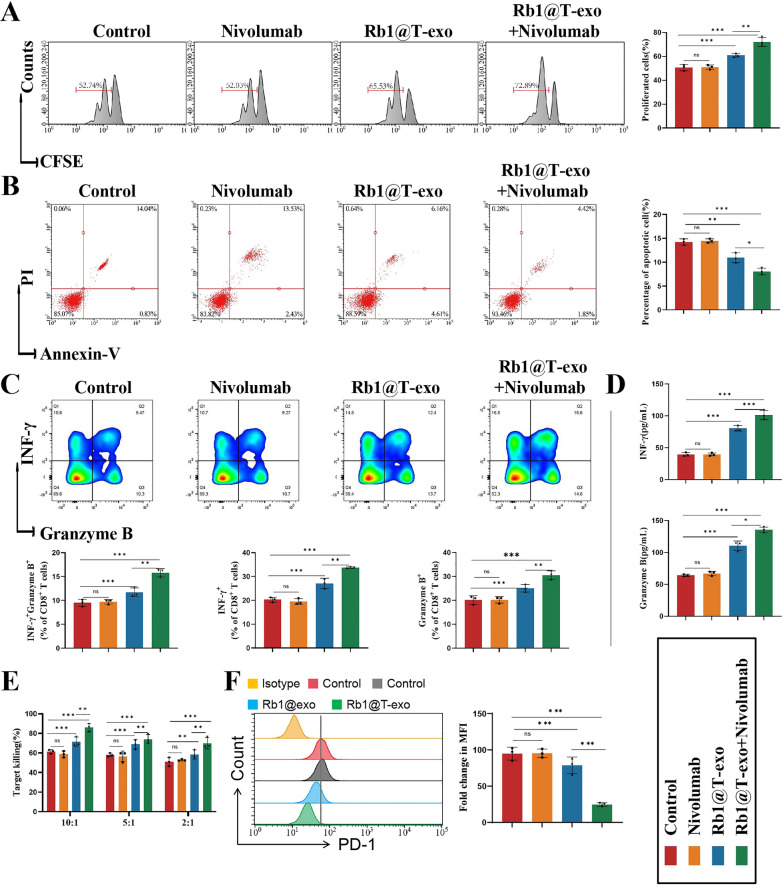
图7 Rb1@T-exo对CD8+T细胞的影响。
图7A:流式细胞术检测各组中CD8+T细胞的增殖情况。结果显示Rb1@T-exo组CD8+T细胞增殖增加。
图7B:流式细胞术检测各组中CD8+T细胞的凋亡情况。结果显示凋亡减少。
图7C:流式细胞术测量各组中TNF-α+干扰素γ释放酶B+CD8+T细胞、TNF-α+CD8+T细胞和干扰素γ释放酶B+CD8+T细胞的比例。结果显示CD8+T细胞分泌的IFN-γ、GranzymeB(细胞毒性因子)水平显著升高。
图7D:酶联免疫吸附测定评估各组细胞中TNF-α和干扰素γ释放酶B的水平。
图7E:乳酸脱氢酶释放测定评估在不同条件下CD8+T细胞对肿瘤细胞的细胞毒性。结果显示Rb1@T-exo增强CD8+T细胞对肿瘤细胞的杀伤能力。
图7F:流式细胞术分析各组中CD8⁺T细胞上PD-1的表达情况,结果显示Rb1@T-exo和Rb1@T-exo+帕博利珠单抗治疗降低了PD-1水平,从而减少了免疫逃逸。
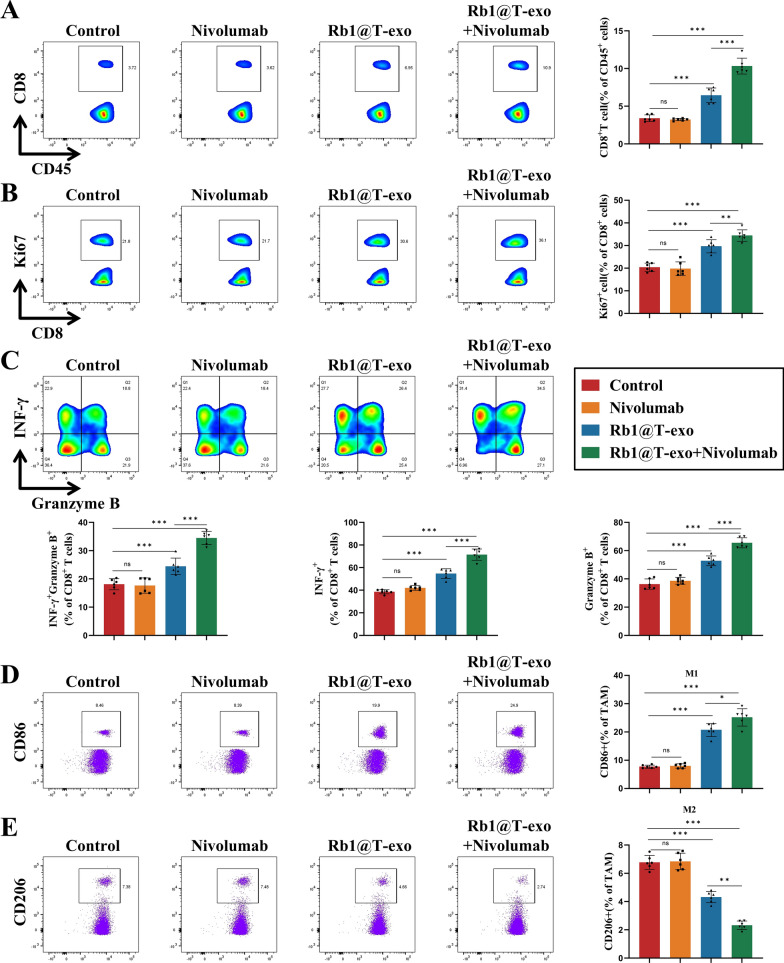
图8 Rb1@T-exo对免疫微环境的影响。
图8A:对各组小鼠中CD8+T细胞比例的流式细胞术分析。结果显示Rb1@T-exo组肿瘤内CD8+T细胞比例显著增加。
图8B:对各组小鼠中Ki67+CD8+T细胞比例的流式细胞术评估。结果显示Rb1@T-exo组肿瘤内增殖型CD8+T细胞(Ki67+)比例显著增加。
图8C:对各组小鼠中TNF-α+CD8+T细胞和GranzymeB+CD8+T细胞比例的流式细胞术检查。结果显示,Rb1@T-exo组肿瘤内细胞毒性CD8+T细胞(IFN-γ+、GranzymeB+)比例显著增加。
图8D:对各组小鼠中M1型巨噬细胞比例的流式细胞术测量。结果显示Rb1@T-exo组肿瘤内M1型巨噬细胞(CD86+)比例增加。
图8E:对各组小鼠中M2型巨噬细胞比例的流式细胞术评估。结果显示Rb1@T-exo组肿瘤内M2型(CD206+)比例减少。
综上,这些结果表明Rb1@T-exo促进巨噬细胞向抗肿瘤的M1型极化,重塑免疫微环境,还可通过增强CD8+T细胞的增殖、细胞毒性及降低免疫检查点表达,恢复抗肿瘤免疫应答,并在体内通过增加效应T细胞浸润及促进巨噬细胞向M1型极化,逆转免疫抑制微环境。
结论
该研究开发的肽修饰外泌体递送系统Rb1@T-exo,通过靶向抑制PI3K/AKT/mTOR信号通路,重塑肿瘤免疫微环境(促进M1巨噬细胞极化、增强CD8+T细胞功能),有效逆转PI3K突变NSCLC的免疫治疗获得性耐药。该系统兼具良好的靶向性、稳定性及生物相容性,为NSCLC耐药的临床治疗提供了新思路。






