研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
外泌体的科研"变形记":从天然囊泡到CAP修饰的miR-148a缓释舱,改写骨关节炎治疗递送规则!
864 人阅读发布时间:2025-07-04 11:29
骨关节炎(OA)因复杂病理机制和有限治疗手段,临床诊疗受到限制。脐带间充质干细胞来源的外泌体(MSC-EXOs)具低免疫原性、高生物相容性和优异跨生物膜特性,在OA治疗中展现研究价值;而软骨细胞中miR-148a异常减少会损害细胞外基质合成,加速OA进展,故增加软骨细胞中miR-148a是潜在治疗策略。

今天分享一篇发表在【Mater Today Bio】(IF:10.2)上题为“A microsphere loaded with chondrocyte-targeting exosomes continuously deliver miR-148a for osteoarthritis therapy”的研究,该研究构建了miR-148a全基因敲除小鼠,并说明miR-148a的缺失加速了关节软骨的退化。研究结果表明,miR-148a通过靶向Robo2并负向调节MAPK信号通路来促进细胞外基质的合成代谢。研究首先将生物素-CAP贴附在间充质干细胞衍生的外泌体(MSC-EXOs)的表面,然后通过微流控系统合成了含有甲基丙烯酸明胶和链霉亲和素的微球(GAM),将miR-148a加载到用软骨靶向肽CAP修饰的外泌体(CAP-EXOs)中,并将其封装到GAM中,获得CAP-EXOs/miR148a@GAM。微流控技术开发了一种水凝胶微球中的持续释放平台,最后评估了CAP-EXOs/miR-148a@GAM在前交叉韧带断裂(ACLT)诱导的小鼠骨关节炎模型中对软骨退化的治疗效果。总的来说,该研究提出了一种用于治疗骨关节炎(OA)的多功能核酸药物输送体系。
研究成果
1. miR-148a缺失加剧了ACLT引发的骨关节炎中的软骨破坏
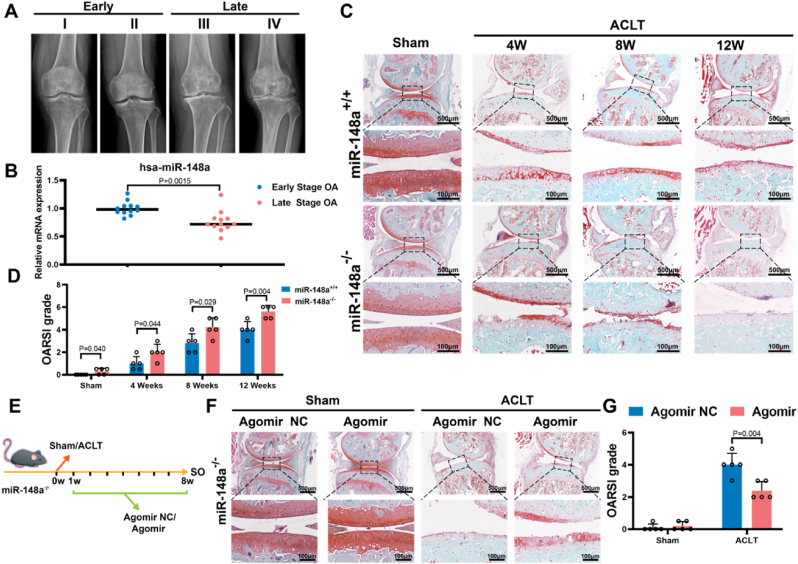
图1 miR-148a缺失加速OA进展。
图1A:不同骨关节炎阶段患者的膝关节代表性X光片。结果显示晚期OA患者滑膜液中hsa-miR-148a水平显著低于早期患者。
图1B:不同骨关节炎阶段患者滑膜液中的miR-148a水平。结果显示miR-148a敲除小鼠(miR-148a−/−)的软骨损伤较野生型小鼠更严重,其蛋白聚糖丢失更早且更显著。
图1C-D:术后12周,miR-148a−/−小鼠的OARSI评分与HE染色图像。结果显示miR-148a缺失加速软骨退化。
图1E-G:miR-148a−/−小鼠体内拯救实验。结果显示关节腔内注射miR-148a mimic(agomir)可显著改善miR-148a−/−小鼠的软骨结构。
这些结果表明,miR-148a缺失会加速OA进展,而外源性补充miR-148a可减轻软骨损伤,提示miR-148a是OA治疗的潜在靶点。
2.miR-148a通过维持软骨细胞合成代谢的平衡来延缓软骨的破坏
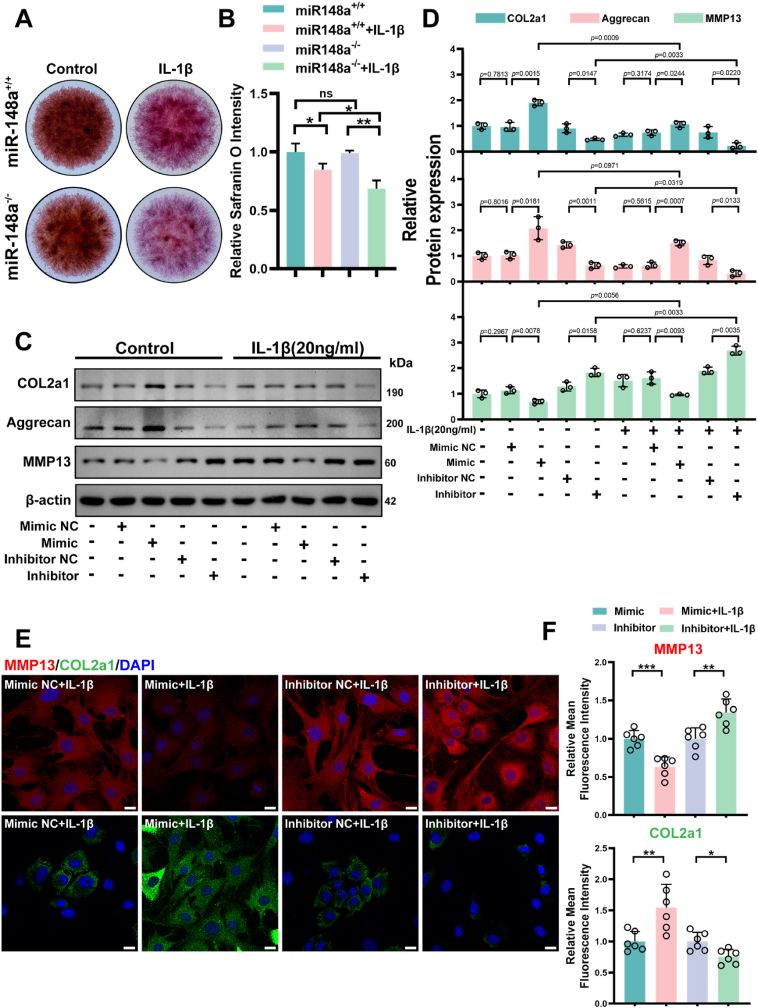
图2 miR-148a通过维持软骨合成代谢抑制OA。
图2A-B:IL-1β刺激下,miR-148a−/−软骨细胞的Safranin O染色图像。结果显示细胞外基质降解更明显。
图2C-D:对转染后miR-148a+/+的原代软骨细胞进行western blot检测及定量分析。结果显示,过表达miR-148a可增加COL2A1和Aggrecan表达,减少MMP13生成;抑制miR-148a则相反,且IL-1β会进一步加剧这种分解代谢效应。
图2E-F:转染后miR-148a+/+原代软骨细胞的免疫荧光染色图像及定量分析。结果显示,miR-148a模拟物可减少IL-1β诱导的MMP13表达,增加COL2A1阳性区域,而抑制剂作用相反。
这些结果表明,miR-148a通过促进软骨细胞合成代谢、抑制分解代谢,从而维持软骨稳态,延缓OA进展。
3. miR-148a的作用靶点为Robo2蛋白
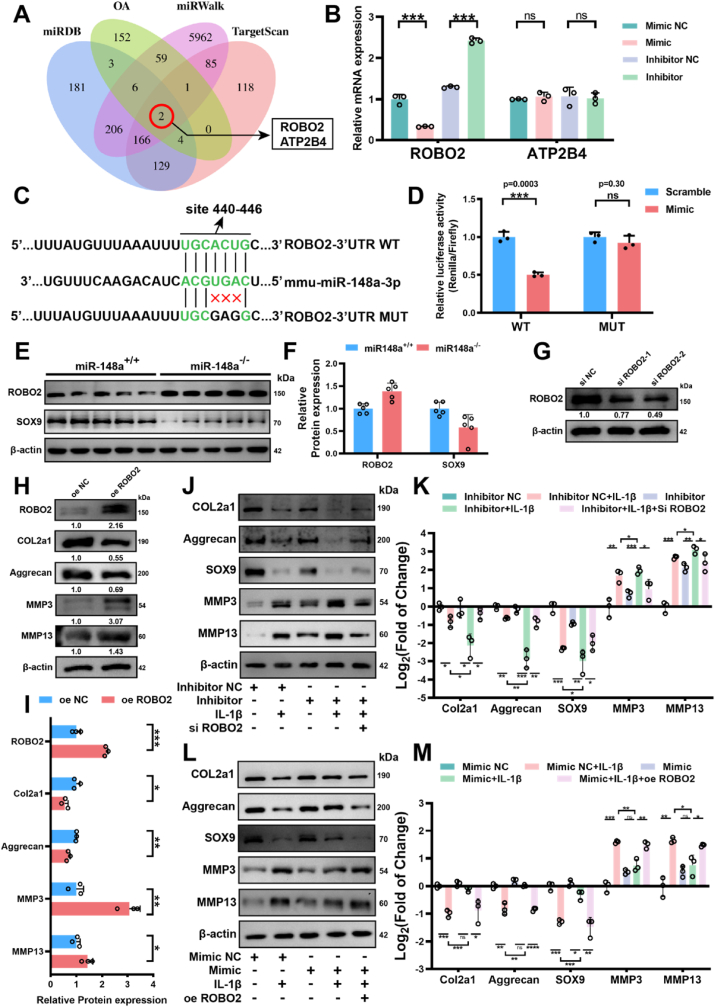
图3 Robo2是miR-148a的直接作用靶点。
图3A:通过生物信息学预测与差异基因分析,绘制venn图。结果筛选出Robo2为miR-148a的潜在靶点。
图3B:通过qPCR评估转染了miR-148a-3p模拟物/抑制物的软骨细胞中两个候选基因的mRNA表达水平。结果显示miR-148a模拟物下调Robo2 mRNA表达,抑制剂则上调,而ATP2B4无显著变化。
图3C-D:双荧光素酶报告基因实验。结果证实,miR-148a与ROBO2的3′UTR直接结合,突变结合位点后荧光素酶活性恢复。
图3E-F:检测miR-148a+/+和miR-148a−/−小鼠软骨细胞中Robo2和Sox9的免疫印迹。结果显示miR-148a−/−软骨细胞中Robo2蛋白表达升高,SOX9表达降低。
图3G:将两种siRNA(siRobo2-1和siRobo2-2)转染到原代软骨细胞中,并通过蛋白质印迹法检测。结果证明了Robo2的沉默效率。
图3H-I:Robo2过表达后细胞外基质(ECM)相关蛋白的蛋白质印迹实验。结果显示
Robo2的过表达下调了COL2A1和Aggrecan的表达,并上调了MMPs的表达。
图3J-K:在抑制miR-148a或联合应用miR-148a抑制剂和siRobo2 48小时后,软骨细胞中COL2a1、Aggrecan、SOX9、MMP3、MMP13蛋白水平的蛋白质印迹分析。结果显示Robo2 的沉默逆转了该抑制剂对合成因子的抑制作用以及对病理代谢因子的诱导作用。
图3L-M:miR-148a过表达或miR-148a与ROBO2过表达联合后软骨细胞中COL2A1、Aggrecan、SOX9、MMP3、MMP13蛋白水平的蛋白质印迹分析。结果显示Robo2 的过表达部分削弱了模拟物的保护作用。
这些结果表明,miR-148a通过靶向抑制ROBO2,解除其对软骨合成代谢的抑制作用,从而发挥保护效应。
4. miR-148a抑制了IL-1β引发的MAPK信号通路的激活作用
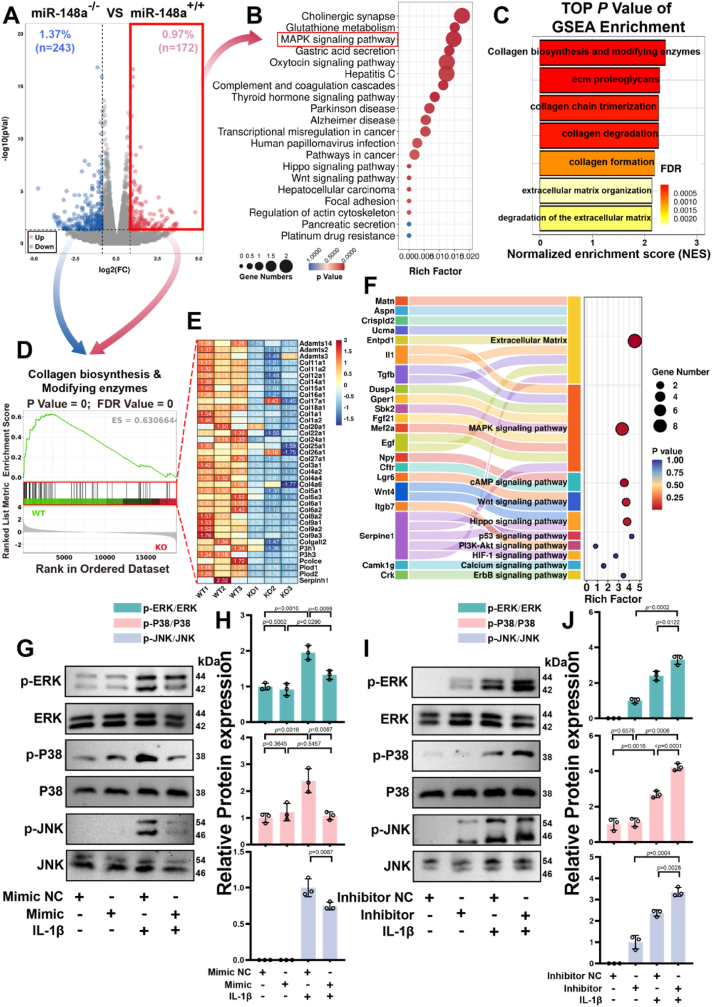
图4 miR-148a抑制MAPK信号通路激活。
图4A:转录组分析的火山图。结果显示,miR-148a缺失导致MAPK信号通路相关基因显著富集。
图4B-C:对上调的差异表达基因(up-DEGs)进行KEGG与GSEA分析。结果表明,miR-148a缺失主要影响细胞外基质组织、胶原生物合成等通路。
图4D-F:miR-148a−/−和miR-148a+/+组的热图与桑基图。结果显示,miR-148a−/−软骨细胞中胶原合成相关基因表达下调,且MAPK通路与细胞外基质基因互作最强。
图4G-H:相对于ERK、P38和JNK的p-ERK、p-P38和p-JNK的定量分析及蛋白印记检测。结果显示miR-148a模拟物抑制IL-1β诱导的ERK、JNK和p38磷酸化。
图4I-J:对在抑制miR-148a/IL-1β刺激后软骨细胞中p-ERK、p-P38和p-JNK相对于ERK、P38和JNK的定量检测及蛋白印记分析。结果显示抑制剂则增强ERK、JNK和p38磷酸化的激活。
这些结果表明,miR-148a通过抑制MAPK信号通路过度激活,减少炎症诱导的软骨基质降解,维持软骨细胞稳态。
5.靶向软骨细胞的MSC-EXOs的制备与表征
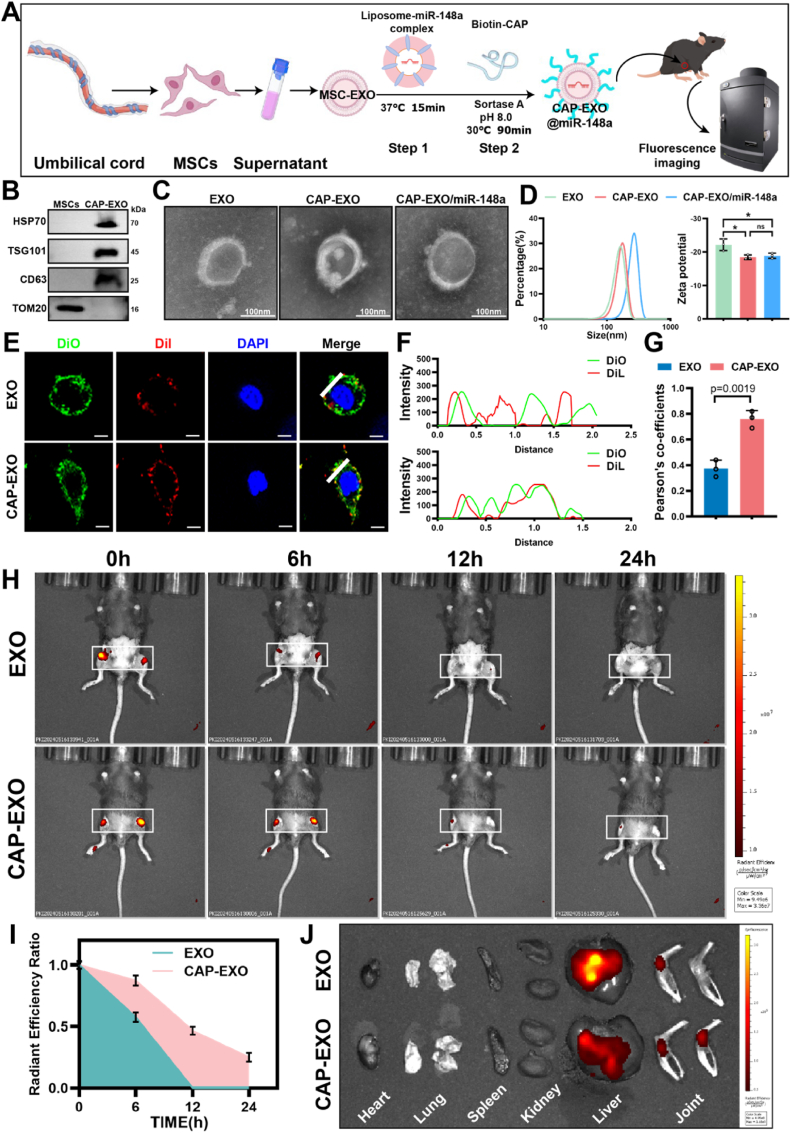
图5软骨细胞靶向性外泌体(CAP-EXOs)的制备与表征。
图5A: CAP-EXOs的两步修饰流程示意图。
图5B:Western blot验证外泌体标志物。结果显示CD63、TSG101和HSP70阳性,线粒体蛋白TOM20阴性,表明外泌体制备成功。
图5C:透射电镜显示CAP-EXOs/miR-148a的形态。结果显示其保持完整双层膜结构,粒径从163.2nm增至268.6nm。
图5D-E:流式与共聚焦显微镜观察EXOs、CAP-EXOs和CAP-EXOs/miR-148a。结果显示,CAP-EXOs与软骨细胞的结合效率显著高于未修饰外泌体。
图5F:沿选定线(白色)在细胞上横截的强度图。
图5G:外泌体与软骨细胞的皮尔逊相关系数的定量分析。
图5H:通过体内成像技术,在指定时间点测量了EXOs/CAP-EXOs在小鼠膝关节中的保留时间。结果显示CAP-EXOs在关节腔的滞留时间延长。
图5I:通过测量辐射效对体内外泌体的保留情况进行定量分析。结果显示12h后荧光强度仍为未修饰外泌体的2倍。
图5J:在关节内注射后12小时内,EXOs和CAP-EXOs在不同器官中的分布情况。结果显示肝、脾等器官分布减少。
这些结果表明,CAP修饰可显著提升外泌体的软骨细胞靶向性与体内滞留时间,为miR-148a的精准递送奠定基础。
6.基于生物素-亲和素系统的凝胶甲基丙烯酸甲酯水凝胶微球可延长CAP-EXOs在体内的滞留时间
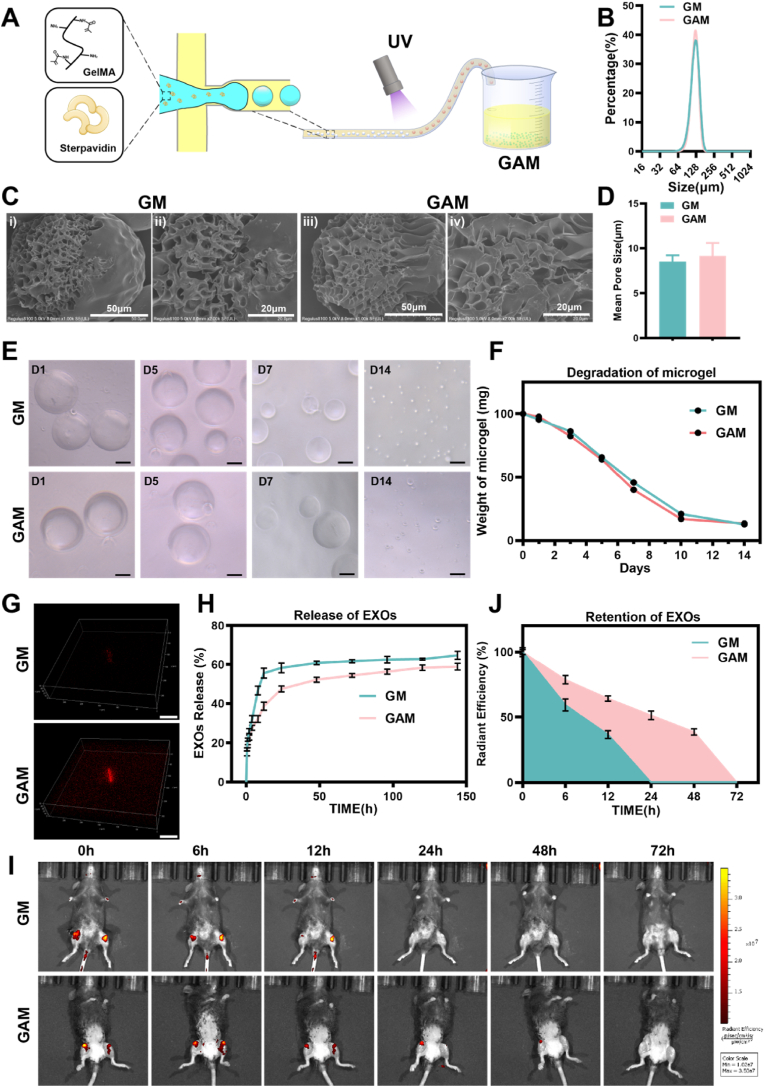
图6 GelMA微球的制备与缓释性能
图6A:示意图显示基于生物素-链霉亲和素系统的GelMA微球(GAM)制备流程,粒径约125μm,具有多孔结构。
图6B-C:GM与GAM的扫描电子显微镜(SEM)图像。结果显示GAM与无链霉亲和素的GM微球均具有均匀孔隙,平均孔径8μm,可延缓药物释放。
图6D-E:体外降解实验。结果表明,GAM与GM在胶原酶II作用下均缓慢降解,7天失重约50%。
图6F-G:GM和GAM在含有胶原酶II的PBS中的定量降解曲线与释放曲线。结果显示,GAM中CAP-EXOs的释放周期为GM的5倍,体内实验证实GAM可延长外泌体滞留至24h。
这些结果表明,GAM微球可通过生物素-链霉亲和素相互作用实现CAP-EXOs的可控缓释,提升治疗持续性。
7. CAP-EXOs/miR148a对关节软骨培养物的体外作用以及CAP-EXOs/miR148a@GAM在骨关节炎小鼠体内的体内作用
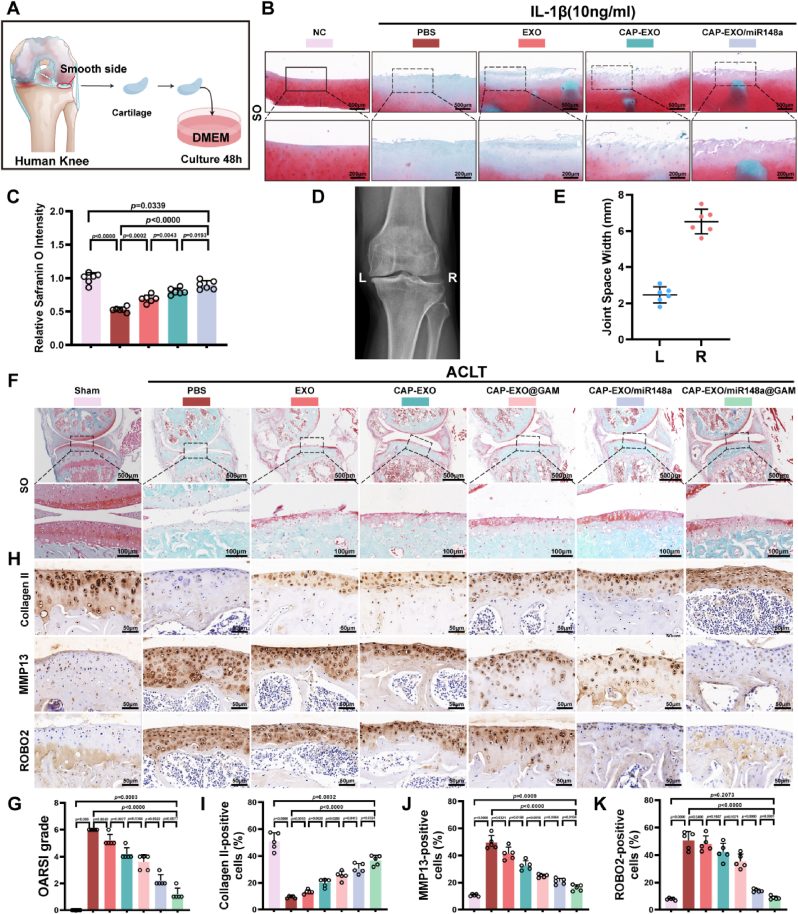
图7 CAP-EXOs/miR-148a@GAM的体内外治疗效果
图7A-B:关节软骨体外培养实验的示意图及软骨外植体的代表性苏丹红O/快速绿染色图像。图像显示,CAP-EXOs/miR-148a可显著减轻IL-1β诱导的Safranin O染色强度下降,维持软骨表面完整性。
图7C-D:ACLT小鼠模型苏丹红O染色相对强度的定量分析及IV期骨关节炎患者的代表性膝关节X光片。结果显示CAP-EXOs/miR-148a@GAM组的OARSI评分显著低于PBS组,且软骨结构接近对照组。
图7E:患者内侧和外侧膝关节间隙的宽度。
图7F:miR-148a+/+小鼠接受ACLT手术,然后接受关节内注射PBS、CAP-EXOs、CAP-EXOs@GAM、CAP-EXOs/miR-148a、CAP-EXOs/miR-148a@GAM后苏丹红O/快速绿染色的代表性治疗图像。结果显示CAP-EXOs/miR-148a@GAM 组与对照组最相似。
图7G:基于OARSI评分系统的内侧胫骨平台关节评分。
图7H:8周时关节切片的免疫组织化学染色(COL2a1、MMP13和ROBO2)。
图7I-K:对关节切片中COL2a1+、MMP13+和ROBO2+细胞数量的定量分析。结果显示COL2A1表达最高,MMP13与ROBO2表达最低,表明其有效促进合成代谢、抑制分解代谢。
这些结果表明,CAP-EXOs/miR-148a@GAM通过靶向递送与持续释放miR-148a,有效延缓OA进展,是一种极具潜力的治疗策略。
结论
本研究构建了一种基于“靶向性外泌体-微球缓释系统”的OA治疗新范式。通过miR-148a靶向抑制ROBO2并调控MAPK信号通路,结合CAP修饰与GelMA微球的协同作用,实现了miR-148a的精准递送与持续释放,在体内外实验中均证实可有效延缓软骨退化。该研究为OA的基因治疗提供了新的作用靶点与递送策略,具有重要的临床转化价值。






