研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
外泌体介导的miR-224-5p信号轴,细胞互作研究发分密码曝光!IF:14+高分思路,还不快快学起来?
383 人阅读发布时间:2025-07-09 11:29
心房颤动(AF)是全球高发的心律失常,现有治疗(如射频消融、抗心律失常药物)复发率高(50%-63%),且放疗会导致神经认知缺陷。心房成纤维细胞(ACFs)与心房肌细胞(ACMs)的旁分泌通讯在AF发生中起关键作用,而细胞外囊泡(EVs)作为细胞间通讯的重要载体,其cargo(如miRNA)可能参与AF的病理过程。

今天分享的是发表在【Advancedscience】(IF:14.1)上题为“Atrial Fibroblasts-Derived Extracellular Vesicles Exacerbate Atrial Arrhythmogenesis”的研究,本研究旨在探索ACFs来源的EVs如何通过调控miRNA影响AF发生,重点关注miR-224-5p对靶基因CACNA1C(编码L型钙通道Cav1.2)的作用及机制。
研究结果
1.AngII处理的心房成纤维细胞(ACFs)分泌的EVs促进心房颤动(AF)发生
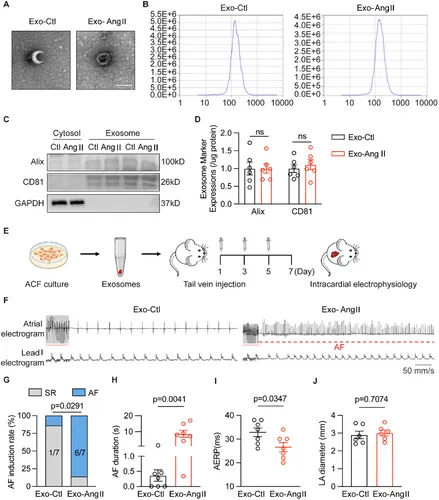
图1A:透射电镜(TEM)显示,人ACFs分泌的EVs呈典型囊泡结构,对照组(Exo-Ctl)与AngII处理组(Exo-AngII)形态无显著差异。
图1B:纳米颗粒跟踪分析(NTA)显示,EVs粒径主要分布在30-150nm,两组粒径范围一致。
图1C-D:Western blot检测显示,EVs中高表达标志物Alix和CD81,而胞质裂解物中不表达,证实EVs纯度。
图1E:实验设计:培养人ACFs,AngII处理后提取EVs,尾静脉注射到大鼠体内,检测心脏电生理指标。
图1F-G:心内电生理检测显示,Exo-AngII组大鼠起搏诱导AF的发生率(85.7%)显著高于Exo-Ctl组。
图1H:Exo-AngII组AF持续时间显著长于Exo-Ctl组。
图1I:Exo-AngII组心房有效不应期(AERP)显著缩短。
图1J:两组左心房面积无显著差异,提示AF易感性增加不依赖结构重构。
这些结果表明,AngII诱导的ACFs分泌的EVs可增加AF易感性,表现为AF发生率升高、持续时间延长及AERP缩短,且不依赖心房结构改变。
2.ACFs来源的EVs中miR-224-5p是促进AF的关键分子
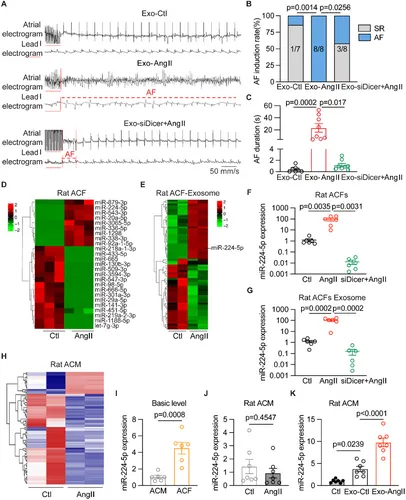
图2A-C:敲低ACFs中Dicer(抑制miRNA生成)后,其分泌的EVs(Exo-siDicer+AngII)可降低AF发生率,缩短AF持续时间。
图2D-E:miRNA测序显示,AngII处理的大鼠ACFs及其EVs中miR-224-5p显著上调(热图)。
图2F-G:qRT-PCR验证,AngII处理的大鼠ACFs及其EVs中miR-224-5p表达显著升高,而敲低Dicer可逆转。
图2H-J:ACMs中miR-224-5p基础水平显著低于ACFs,且AngII处理不影响ACMs中该miRNA水平。
图2K:与ACFs-EVs共培养后,ACMs中miR-224-5p水平显著升高,且AngII处理的EVs诱导更显著。
这些结果表明,miR-224-5p在AngII诱导的ACFs及其EVs中高表达,且可通过EVs传递至ACMs,是介导EVs促AF作用的关键miRNA。
3.大鼠ACFs来源的EVs中miR-224-5p加剧AF易感性
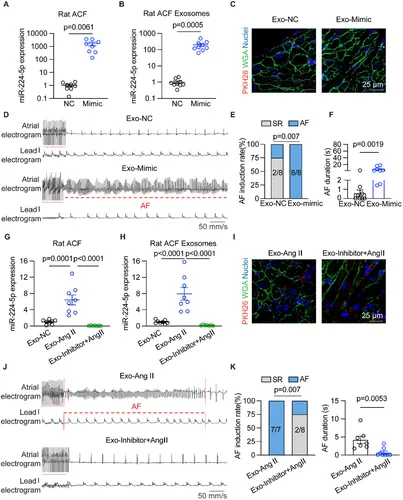
图3A-B:miR-224-5p mimic转染ACFs后,细胞及EVs中该miRNA水平显著升高。
图3C:PKH-26标记的EVs可被大鼠心房组织摄取(WGA染色显示心肌细胞)。
图3D-F:注射miR-224-5p模拟物处理的ACFs-EVs(Exo-Mimic)的大鼠,AF发生率(100%)显著高于对照组(Exo-NC,25%,p=0.007),AF持续时间延长。
图3G-H:miR-224-5p抑制剂转染ACFs后,细胞及EVs中该miRNA水平显著降低。
图3I-K:注射AngII+抑制剂处理的ACFs-EVs(Exo-Inhibitor+AngII)的大鼠,AF发生率(25%)显著低于Exo-AngII组,AF持续时间缩短。
这些结果表明,ACFs-EVs中的miR-224-5p可剂量依赖性地调节AF易感性,过表达促进AF,抑制则缓解。
4.miR-224-5p通过缩短动作电位时程(APD)促进AF
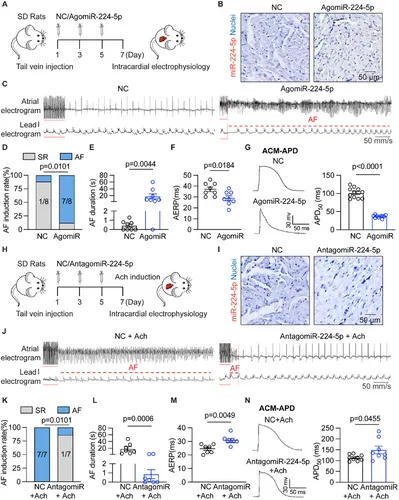
图4A:实验设计示意图。SD大鼠分别尾静脉注射阴性对照(NC)或miR-224-5p激动剂(agomiR-224-5p),每隔1天注射1次,共3次,随后进行心内电生理检测。
图4B:原位杂交显示,agomiR-224-5p处理组大鼠心房组织中miR-224-5p(红色荧光)表达显著高于NC组。
图4C:代表性心电图(导联I)和心内电图显示,agomiR-224-5p组大鼠在程序性刺激后出现房颤(AF),而NC组维持窦性心律(SR)。
图4D:agomiR-224-5p组房颤发生率(87.5%,7/8)显著高于NC组。
图4E:agomiR-224-5p组房颤持续时间显著长于NC组。
图4F:agomiR-224-5p组大鼠心房有效不应期(AERP)显著短于NC组。
图4G:膜片钳记录显示,agomiR-224-5p组分离的心房肌细胞(ACMs)动作电位时程(APD)缩短,其中APD50(50%复极化时程)显著降低。
图4H:另一实验设计示意图:SD大鼠分别尾静脉注射NC或miR-224-5p拮抗剂(antagomiR-224-5p),共3次,1周后在乙酰胆碱(Ach)诱导下进行心内电生理检测。
图4I:原位杂交显示,antagomiR-224-5p处理组大鼠心房组织中miR-224-5p(红色荧光)表达显著低于NC组。
图4J:代表性心电图显示,NC+Ach组大鼠出现房颤,而antagomiR-224-5p+Ach组维持窦性心律。
图4K:antagomiR-224-5p+Ach组房颤发生率(14.3%,1/7)显著低于NC+Ach组。
图4L:antagomiR-224-5p+Ach组房颤持续时间显著短于NC+Ach组。
图4M:antagomiR-224-5p+Ach组大鼠AERP显著长于NC+Ach组。
图4N:膜片钳记录显示,antagomiR-224-5p组ACMs的APD50较NC组轻度延长。
这些结果表明,miR-224-5p可通过缩短心房肌细胞动作电位时程(APD)和心房有效不应期(AERP),增加房颤易感性;而抑制miR-224-5p可逆转上述电生理异常,降低房颤发生率并缩短持续时间,证实其在心房电重构中的关键作用。
5.miR-224-5p直接靶向CACNA1C抑制L型钙电流(I_Ca,L)
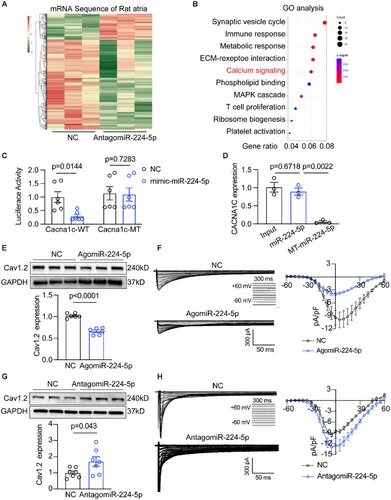
图5A-B:mRNA测序及GO分析显示,antagomiR处理的大鼠心房中差异基因富集于钙信号通路。
图5C:双荧光素酶报告基因实验显示,miR-224-5p模拟物显著降低野生型CACNA1C的luciferase活性,对突变型无影响,证实直接结合。
图5D:RNA pull down实验显示,生物素标记的miR-224-5p可富集CACNA1CmRNA。
图5E-F:agomiR处理的大鼠心房中Cav1.2(CACNA1C编码蛋白)水平降低,ACMs的I_Ca,L电流减小。
图5G-H:antagomiR处理的大鼠心房中Cav1.2水平升高,ACMs的I_Ca,L电流增大。
这些结果表明,miR-224-5p直接靶向CACNA1C,抑制其表达及I_Ca,L电流,是导致APD缩短的分子机制。
6.成纤维细胞特异性miR-224-5p敲入(FMKI)小鼠AF易感性增加
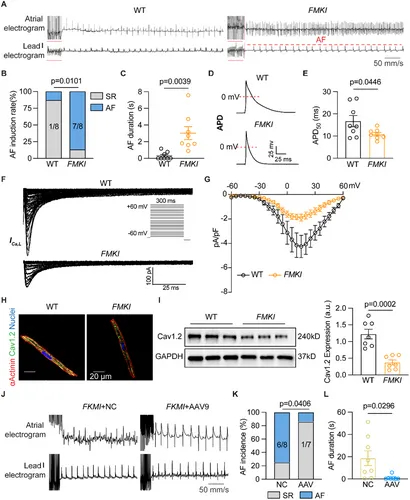
图6A-C:FMKI小鼠AF发生率(87.5%)显著高于野生型,AF持续时间延长。
图6D-E:FMKI小鼠ACMs的APD50显著缩短。
图6F-G:FMKI小鼠ACMs的I_Ca,L电流显著减小。
图6H-I:FMKI小鼠ACMs中Cav1.2表达显著降低。
图6J-L:FMKI小鼠注射AAV9-miR-224-5p海绵后,AF发生率(14.3%)显著低于对照组(75%,p=0.0406),AF持续时间缩短。
这些结果表明,成纤维细胞特异性过表达miR-224-5p可通过降低Cav1.2和I_Ca,L,增加AF易感性,而抑制该miRNA可缓解。
7.敲低成纤维细胞miR-224-5p减轻Crem小鼠自发性AF
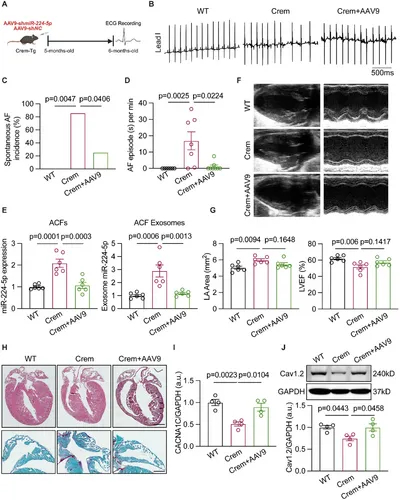
图7A:实验设计:Crem转基因小鼠(自发性AF模型)注射AAV9-shmiR-224-5p,检测AF表型。
图7B-D:Crem小鼠自发性AF发生率(85.7%)显著高于WT,注射AAV9后发生率降至37.5%,AF持续时间缩短。
图7E:Crem小鼠ACFs及其EVs中miR-224-5p水平升高,注射AAV9后降低。
图7F-J:Crem小鼠左心房面积增大、LVEF降低,Cav1.2表达降低,注射AAV9后部分逆转。
这些结果表明,敲低成纤维细胞miR-224-5p可减轻自发性AF模型的AF表型,改善心房电重构。
8.AF患者血浆EVs中miR-224-5p升高且促进大鼠AF
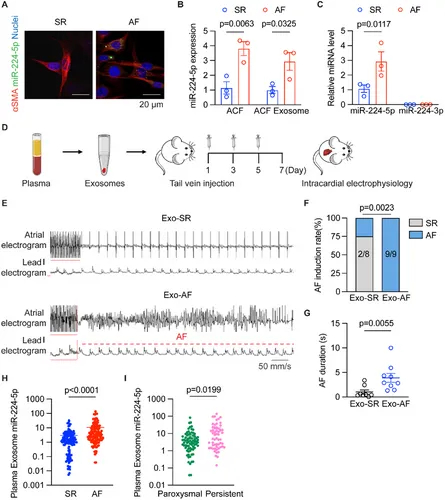
图8A:免疫荧光显示,AF患者心房成纤维细胞中miR-224-5p水平高于窦性心律(SR)患者。
图8B-C:qRT-PCR显示,AF患者ACFs、ACFs-EVs及血浆EVs中miR-224-5p水平显著升高,miR-224-3p无差异。
图8D:实验设计。将SR/AF患者血浆EVs注射到大鼠体内,检测AF易感性。
图8E-G:AF患者EVs(Exo-AF)处理的大鼠AF发生率(100%)显著高于SR组,AF持续时间延长。
图8H-I:AF患者血浆EVs中miR-224-5p水平显著高于SR患者,且持续性AF患者高于阵发性AF。
这些结果表明,AF患者血浆EVs中miR-224-5p水平升高,且可加剧大鼠AF易感性,提示其作为AF生物标志物的潜力。
结论
本研究证实,心房成纤维细胞(ACFs)在AngII刺激下分泌的EVs富含miR-224-5p,该miRNA通过直接靶向CACNA1C抑制L型钙电流(I_Ca,L),缩短心房肌细胞动作电位时程(APD)和心房有效不应期(AERP),导致心房电重构,增加AF易感性。成纤维细胞特异性过表达miR-224-5p可加剧AF,而抑制该miRNA可缓解多种AF模型的病理表型。此外,AF患者血浆EVs中miR-224-5p水平升高,且与疾病进展及射频消融后复发相关。这些发现揭示了ACFs-EVs-miR-224-5p-CACNA1C轴在AF发生中的关键作用,为AF的诊断和治疗提供了新靶点。






