研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
还在为MPN靶向难发愁?看双修饰外泌体如何带着抑制剂在骨髓 “开绿灯”,这思路能直接套实验!
1420 人阅读发布时间:2025-07-16 15:30
骨髓增殖性肿瘤(MPNs)是一组以成熟髓系细胞过度生成为特征的克隆性造血干细胞疾病,主要由JAK2、CALR等基因突变驱动JAK/STAT通路过度激活所致。现有治疗(如羟基脲、芦可替尼)仅能缓解症状,无法清除恶性克隆,且存在耐药、全身毒性等问题。骨髓微环境的复杂性及药物靶向递送障碍进一步加剧治疗难度。

湾湾今天分享的是发表在【Journal of Nanobiotechnology】上题为“USP5 inhibition via bone marrow-targeted engineered exosomes for myeloproliferative neoplasms therapy”的研究。研究发现,去泛素化酶USP5在JAK2V617F突变的间充质干细胞(Mut-MSCs)中高表达,通过抑制Caspase3介导的凋亡促进细胞异常增殖,是MPNs进展的关键调控因子。为靶向递送USP5抑制剂(USP5-IN-1),本研究构建了共表达CXCR4和P-选择素靶向肽(PSN)的工程化外泌体(USP5@Exosome-CP),实现骨髓特异性递送,旨在提升MPNs治疗效果并减少脱靶效应。
研究结果
1.MPN小鼠模型中调控MSC增殖的去泛素化酶筛选
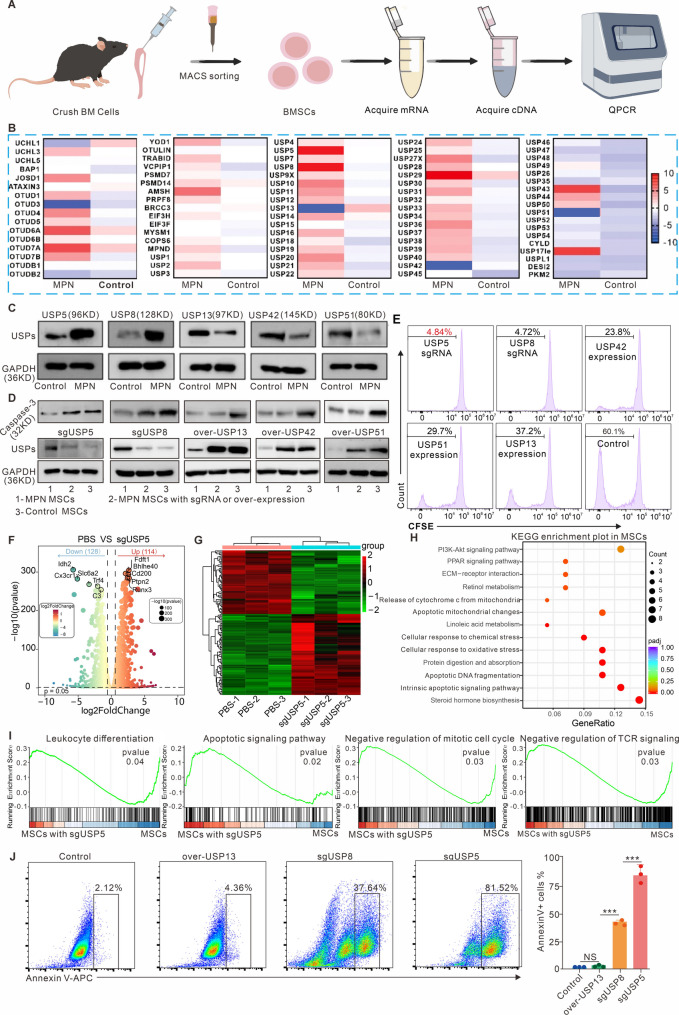
图1A:实验流程示意图。通过CD117磁珠分选正常小鼠和JAK2V617F突变小鼠骨髓中的MSCs,提取mRNA并逆转录为cDNA,利用含86种去泛素化酶的引物库进行QPCR筛选。
图1B:QPCR结果显示,与正常MSCs相比,Mut-MSCs中USP5和USP8的mRNA表达显著上调,而USP13、USP42、USP51显著下调。
图1C:Western blot验证显示,USP5、USP8蛋白在Mut-MSCs中高表达,USP13、USP42、USP51低表达,与mRNA水平一致。
图1D:Western blot显示,Mut-MSCs中Caspase3表达低于正常MSCs;敲低USP5或USP8可显著上调Caspase3,而过表达USP13、USP42、USP51对其无影响。
图1E:流式细胞术显示,敲低USP5或USP8可显著抑制Mut-MSCs增殖,而过表达USP13、USP42、USP51仅轻微抑制。
图1F-G:USP5敲除(sgUSP5)后,Mut-MSCs中癌基因(如Idh2、Slc6a2)下调,抑癌基因(如Ptpn2、Runx3)上调(火山图及热图)。
图1H-I:KEGG和GSEA分析显示,sgUSP5组凋亡通路、细胞分化、细胞周期负调控等通路富集。
图1J:流式细胞术显示,sgUSP5组Annexin V阳性细胞比例显著高于对照组,提示凋亡增加。
这些结果表明,USP5是调控Mut-MSCs异常增殖的关键去泛素化酶,其通过抑制Caspase3介导的凋亡促进细胞存活,是MPNs的潜在治疗靶点。
2.USP5表达与急性髓系白血病(AML)患者疾病进展的关联分析
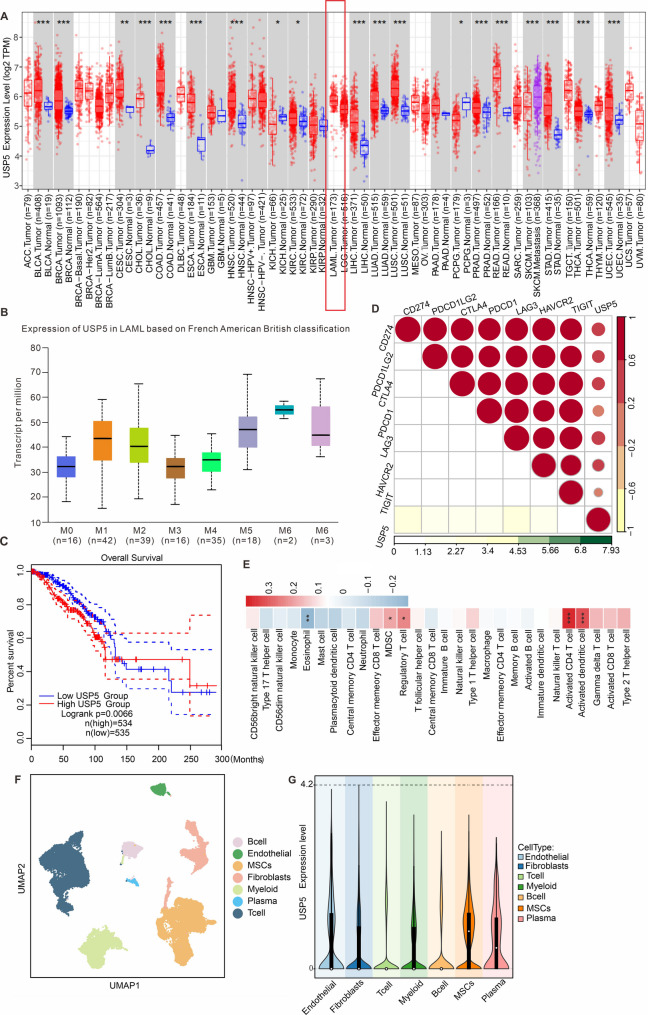
图2A:TCGA数据库分析显示,USP5 mRNA在AML患者中高表达。
图2B:不同FAB分型(M1-M6)的AML患者中均存在USP5高表达。
图2C:生存分析显示,USP5高表达的AML患者总生存期显著短于低表达患者。
图2D-E:USP5高表达与肿瘤微环境中PD-L1、PD-1等免疫抑制分子高表达及髓系抑制细胞、调节性T细胞浸润增加显著相关。
图2F-G:单细胞数据分析显示,USP5主要在高表达CD34、CD117的MSCs中表达。
这些结果表明,USP5高表达与myeloid恶性肿瘤(包括AML)的进展、免疫抑制微环境及不良预后相关,提示其在myeloid肿瘤中的广泛调控作用。
3.USP5@Exosome-CP的制备与表征
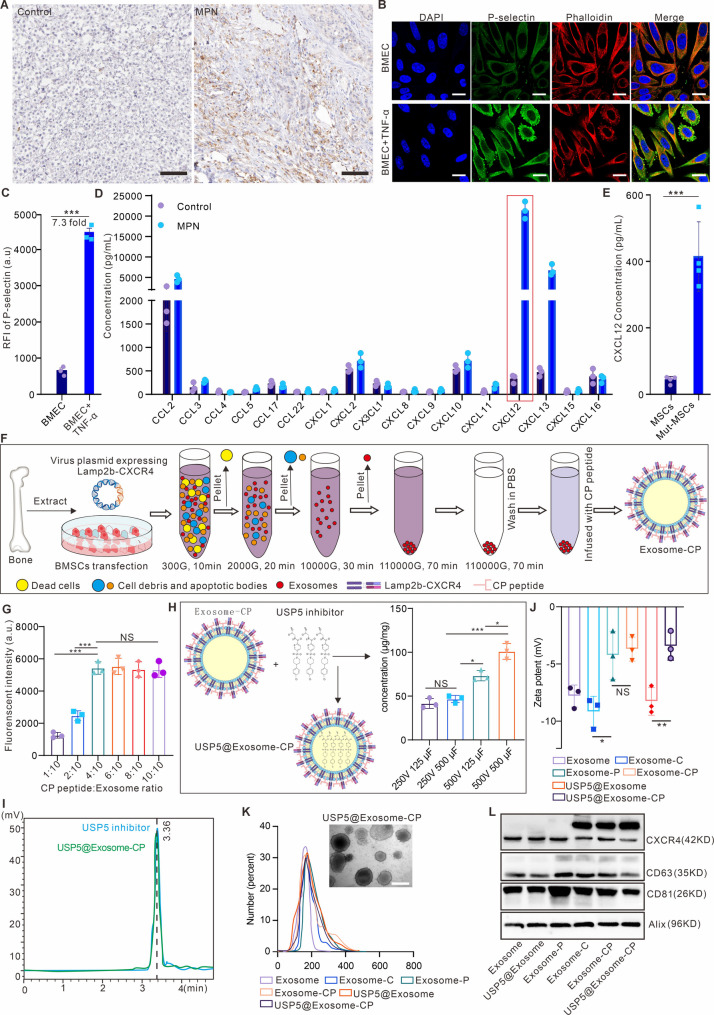
图3A-C:免疫组化、共聚焦及流式细胞术显示,MPN模型小鼠骨髓血管内皮细胞(BMEC)中P-选择素表达显著高于正常小鼠,TNF-α刺激可进一步上调。
图3D-E:多细胞因子检测及ELISA显示,MPN小鼠骨髓中CXCL12表达最高,且Mut-MSCs分泌的CXCL12显著高于正常MSCs。
图3F:外泌体制备流程。通过基因工程使MSCs表达Lamp2b-CXCR4融合蛋白,再通过CP05-PSN肽(靶向CD63和P-选择素)修饰,电穿孔装载USP5-IN-1。
图3G:流式细胞术显示,当CP肽与外泌体蛋白质量比为2:5时,外泌体表面荧光饱和,装载效率最高。
图3H-I:电穿孔参数优化显示,500V、500μF时USP5-IN-1装载量最高;HPLC证实USP5@Exosome-CP中药物保留化学特性。
图3J-K:Zeta电位显示修饰后外泌体电荷无显著变化;DLS和TEM显示其粒径约100-200nm,符合外泌体特征。
图3L:Western blot验证外泌体表达CD63、CD81等标志物及CXCR4。
这些结果表明,USP5@Exosome-CP可通过CXCR4和P-选择素靶向肽实现骨髓靶向,高效装载USP5-IN-1且保留外泌体固有特性。
4.USP5@Exosome-CP对炎症BMEC和Mut-MSCs的靶向性
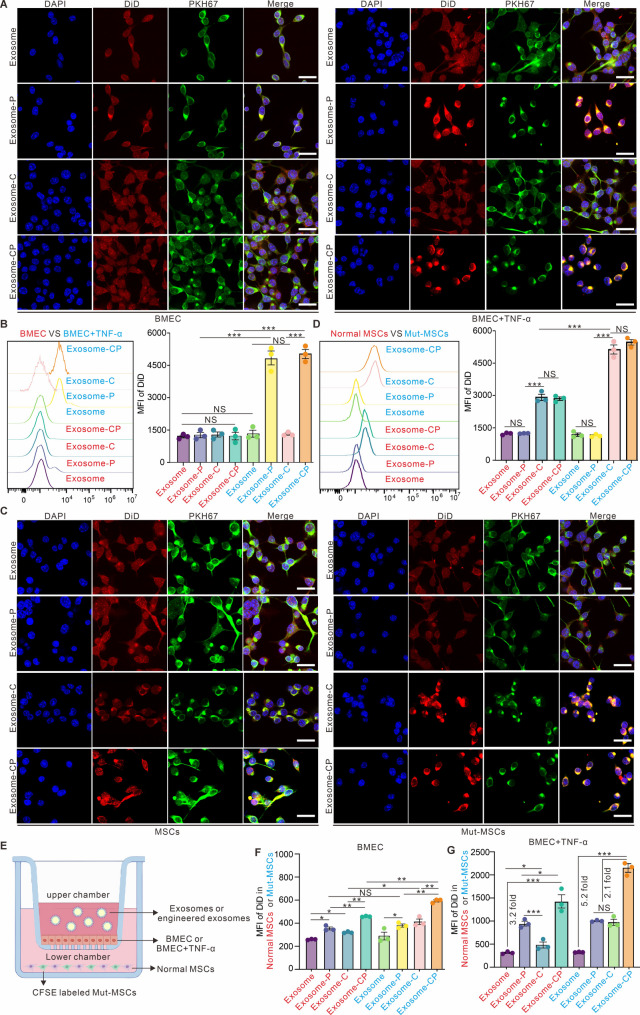
图4A-B:共聚焦及流式细胞术显示,Exosome-P(P-选择素靶向)对炎症BMEC(TNF-α刺激)的摄取效率显著高于正常BMEC;Exosome-CP(双靶向)摄取效率最高。
图4C-D:共聚焦及流式细胞术显示,Exosome-C(CXCR4修饰)对Mut-MSCs的靶向效率显著高于正常MSCs;Exosome-CP靶向性更强。
图4E-G:Transwell模型显示,Exosome-CP穿过炎症BMEC后对Mut-MSCs的靶向效率(MFI)是Exosome-C和Exosome-P的5倍。
这些结果表明,双靶向修饰的Exosome-CP可高效穿透炎症BMEC屏障并特异性靶向Mut-MSCs,为骨髓靶向递送奠定基础。
5.USP5@Exosome-CP在MPN模型小鼠中的生物分布
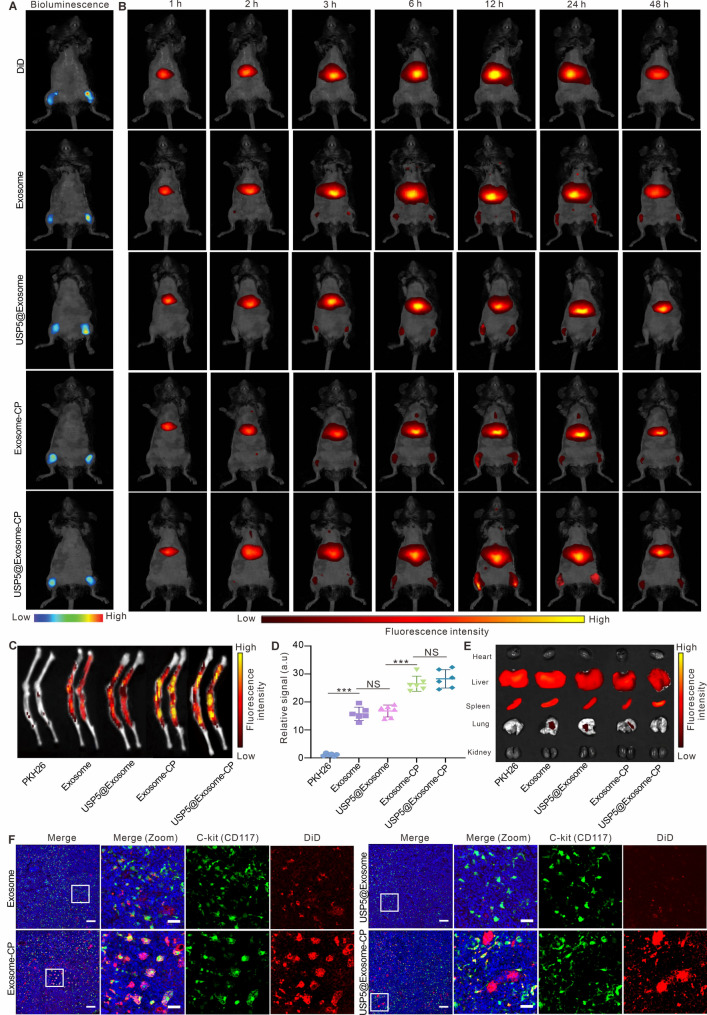
图5A:生物发光成像证实成功构建luciferase标记的MPN模型。
图5B-D:荧光成像显示,USP5@Exosome-CP在骨髓的积累量显著高于未修饰外泌体,12h达峰,荧光强度是未修饰组的2.2倍。
图5E:器官分布显示,外泌体主要积累于肝、脾,USP5@Exosome-CP在骨髓中特异性富集。
图5F:免疫荧光显示,USP5@Exosome-CP与骨髓中c-kit+Mut-MSCs共定位显著。
这些结果表明,USP5@Exosome-CP可高效靶向MPN小鼠骨髓并与Mut-MSCs特异性结合,实现药物的精准递送。
6.USP5@Exosome-CP在MPN模型中的治疗效果
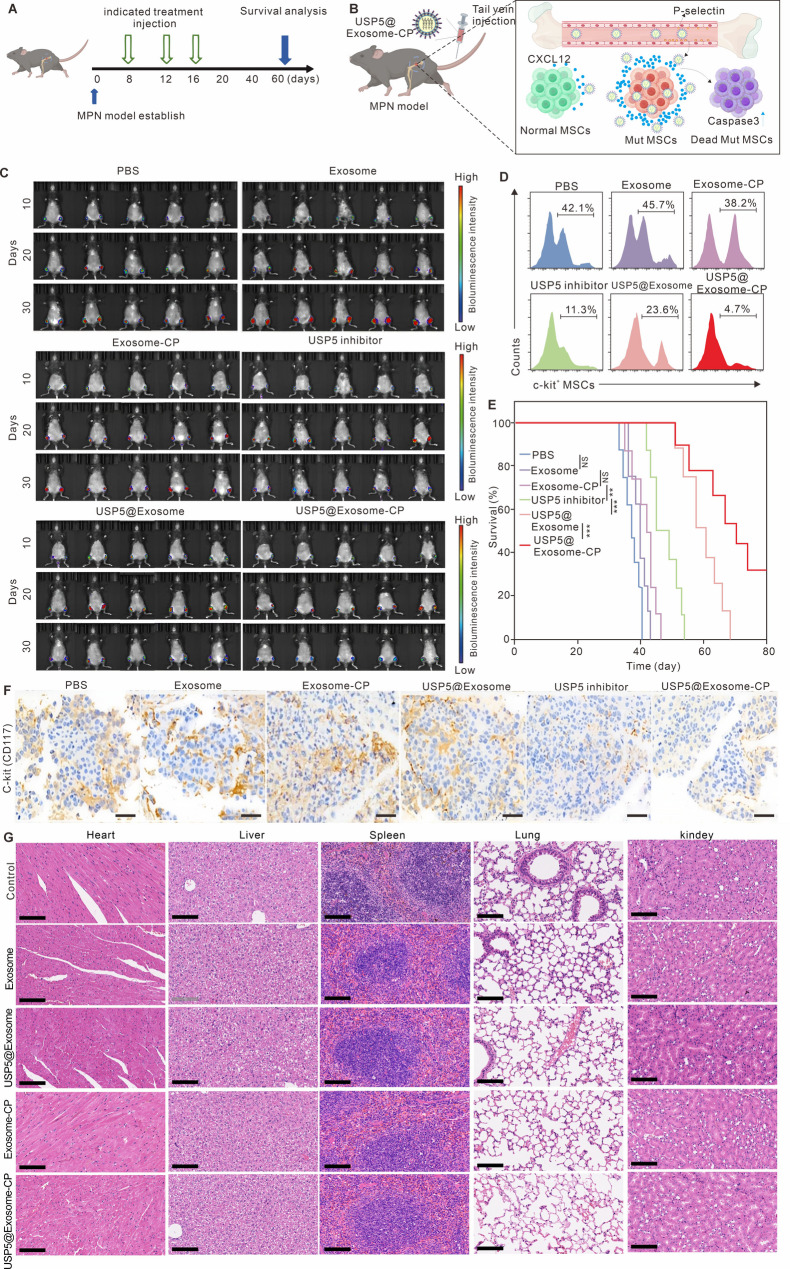
图6A-B:实验设计。MPN模型小鼠尾静脉注射USP5@Exosome-CP(5mg/kg USP5-IN-1),每3天1次,共5次。
图6C-D:生物发光及流式细胞术显示,USP5@Exosome-CP组肿瘤负荷显著降低,Mut-MSCs数量减少4.7%(对照组42.1%)。
图6E:生存分析显示,USP5@Exosome-CP组80天生存率为30%,显著高于其他组。
图6F-G:免疫组化显示骨髓中c-kit+细胞减少;H&E染色证实各器官无明显病理损伤。
这些结果表明,USP5@Exosome-CP可显著抑制MPN进展,延长生存期且无明显毒性,具有良好治疗效果。
结论
本研究证实USP5是MPNs中调控Mut-MSCs异常增殖的关键靶点,其通过抑制Caspase3凋亡促进疾病进展。构建的双靶向工程化外泌体(USP5@Exosome-CP)可通过CXCR4/CXCL12和P-选择素/P-选择素轴高效靶向骨髓,实现USP5-IN-1的精准递送。
该系统在MPN模型中显著抑制Mut-MSCs增殖,减少肿瘤负荷,延长生存期,且全身毒性低。这一策略不仅验证了USP5作为MPNs治疗靶点的价值,还为骨髓微环境靶向治疗提供了新范式。






