研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
眼疾研究卷不动了?外泌体来救场!IF12+综述拆解 “纳米囊泡” 的创新密码,科研人速来Get!
293 人阅读发布时间:2025-07-23 10:13
今天分享的是发表于《Journal of Nanobiotechnology》(IF:12.6)题为“Recent advances in engineered exosome-based therapies for ocular vascular disease”的综述,本综述聚焦眼新生血管疾病(ONDs)的外泌体疗法。ONDs包括角膜新生血管(CoNV)、年龄相关性黄斑变性(AMD)、糖尿病视网膜病变(DR)等,以异常血管生成为核心特征,是全球视力损伤的主要原因之一。其病理机制涉及缺氧、炎症和氧化应激的恶性循环:缺氧激活HIF-1α/VEGF轴促进血管新生,炎症因子加剧血管渗漏,氧化应激破坏血管屏障,三者相互强化。

当前抗VEGF疗法存在耐药性、频繁注射风险及无法改善组织修复等局限,而外泌体因生物相容性高、免疫原性低、靶向性强及可负载多种生物活性分子,成为ONDs治疗的新型递送平台。本综述系统梳理外泌体特性、工程化策略及在ONDs中的应用,为临床转化提供参考。
研究结果
1.眼新生血管疾病(ONDs)的病理机制
ONDs的核心驱动因素为缺氧、炎症和氧化应激的协同作用。缺氧通过HIF-1α上调VEGF,促进内皮细胞增殖和血管渗漏;炎症细胞释放的TNF-α、IL-6等破坏血-视网膜屏障(BRB),同时刺激VEGF分泌;氧化应激通过ROS损伤线粒体,激活MAPK等通路,进一步加剧病理过程。三者形成“缺氧-炎症-氧化应激”的恶性循环,推动疾病进展。
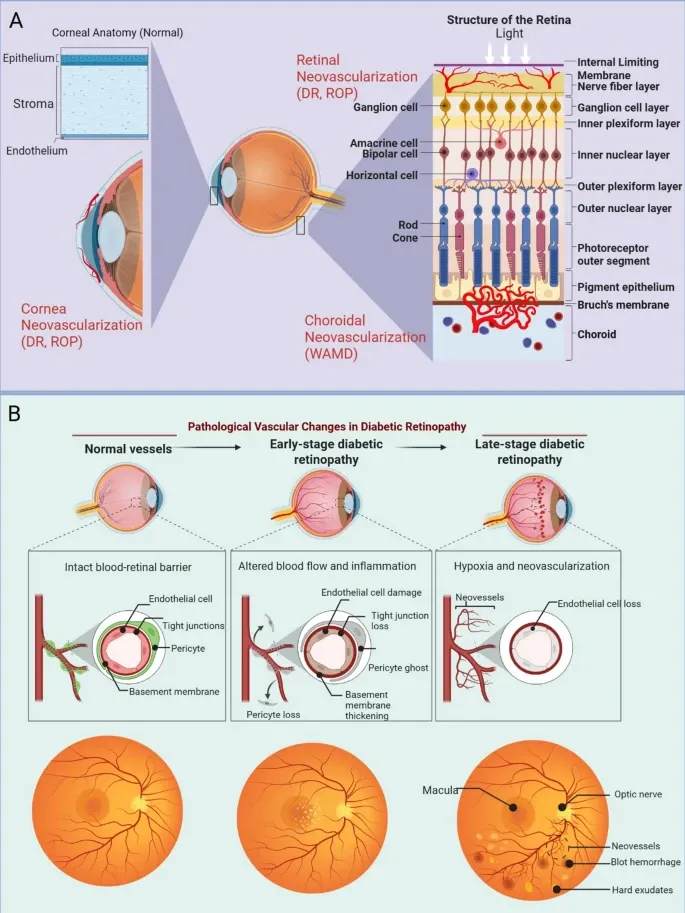
Figure1 展示了ONDs的血管结构异常:图1A对比正常与病理状态下角膜、视网膜、脉络膜的血管差异(如CoNV中血管从角膜缘侵入、DR中视网膜血管渗漏);图1B呈现DR进展,从BRB完整到缺氧诱发新生血管
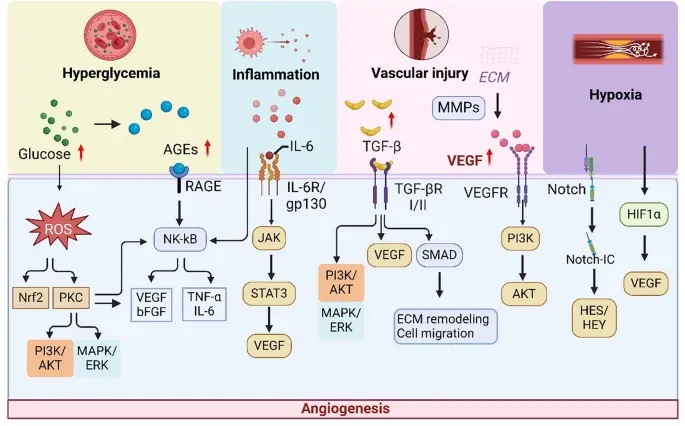
Figure2 揭示分子调控网络,显示高血糖、缺氧等通过VEGF、IL-6等信号分子联动PI3K/AKT、NF-κB等通路,形成病理信号放大环
2.外泌体的特性与递送优势
外泌体是30-150nm的胞外囊泡,由内体成熟为多泡体(MVBs)后与细胞膜融合释放,通过内吞或膜融合被靶细胞摄取。其核心优势包括:膜表面富含CD9、CD63等四跨膜蛋白,天然靶向眼部细胞;脂质bilayer保护cargo不被降解,延长作用时间;免疫原性低,减少眼部炎症风险,是理想的眼部药物递送载体。
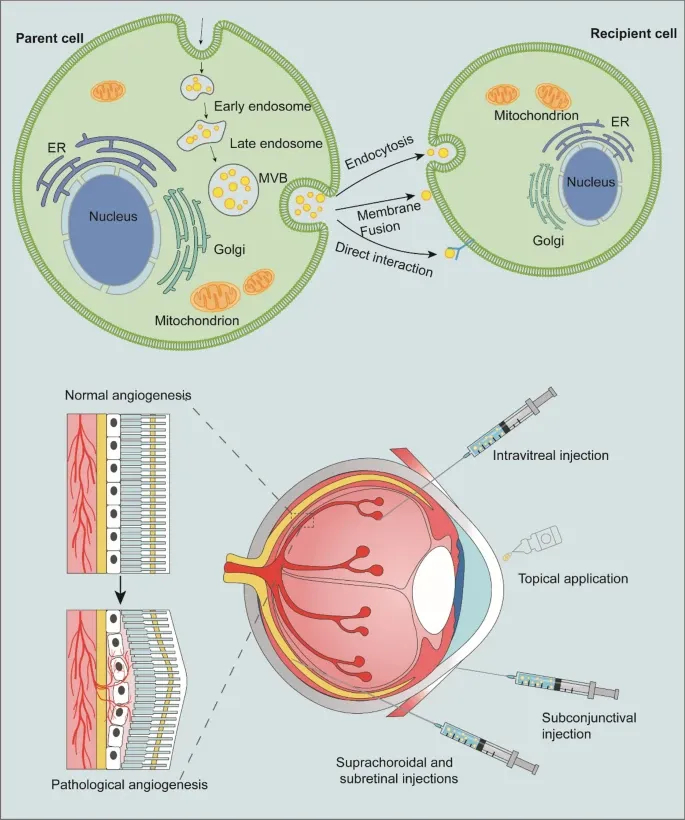
Figure3 展示外泌体的生物发生与眼部递送机制:上半部分描述外泌体从内体成熟到释放的过程;下半部分呈现其眼部递送路径(如玻璃体内注射、局部滴注),凭借纳米尺寸穿透BRB、角膜上皮等屏障,靶向视网膜内皮细胞、RPE细胞等
3.外泌体的工程化策略
为提升外泌体的靶向性和cargo负载效率,需通过工程化改造优化。分离方法包括超速离心、尺寸排阻色谱(高纯度)、免疫亲和分离(靶向特定亚群);cargo加载策略有电穿孔(高效加载RNA,效率>70%)、超声(低损伤加载疏水药物,效率50-70%)、化学偶联(稳定加载蛋白);混合系统(如外泌体-脂质体杂交载体)结合两者优势,提升稳定性和负载量。表面修饰RGD肽可靶向新生血管内皮细胞,阳离子修饰增强角膜穿透性。
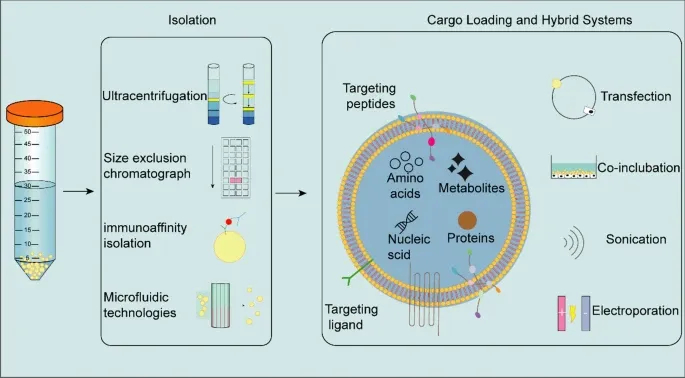
Figure4 展示外泌体的分离、cargo加载及混合系统,直观呈现超速离心、免疫亲和分离等方法,以及电穿孔、超声等加载策略,强调混合系统对稳定性和靶向性的提升
4.外泌体在ONDs中的应用
外泌体通过抑制异常血管生成、调节炎症、促进修复,在多种ONDs中显示治疗潜力。在CoNV中,肿瘤细胞来源外泌体(B16-Exo)通过递送JAK2蛋白抑制T细胞增殖,减少新生血管,延长角膜移植片存活时间;在DR中,工程化外泌体(EXOKV11)加载抗血管生成肽KV11,减少无血管区和新生血管丛;在AMD中,黑磷量子点修饰外泌体(BREs)通过调节葡萄糖代谢抑制CNV;可切割VEGF抗体偶联外泌体(rEXS–cL–aV)通过协同抑制VEGF和巨噬细胞浸润,缩小CNV病灶。
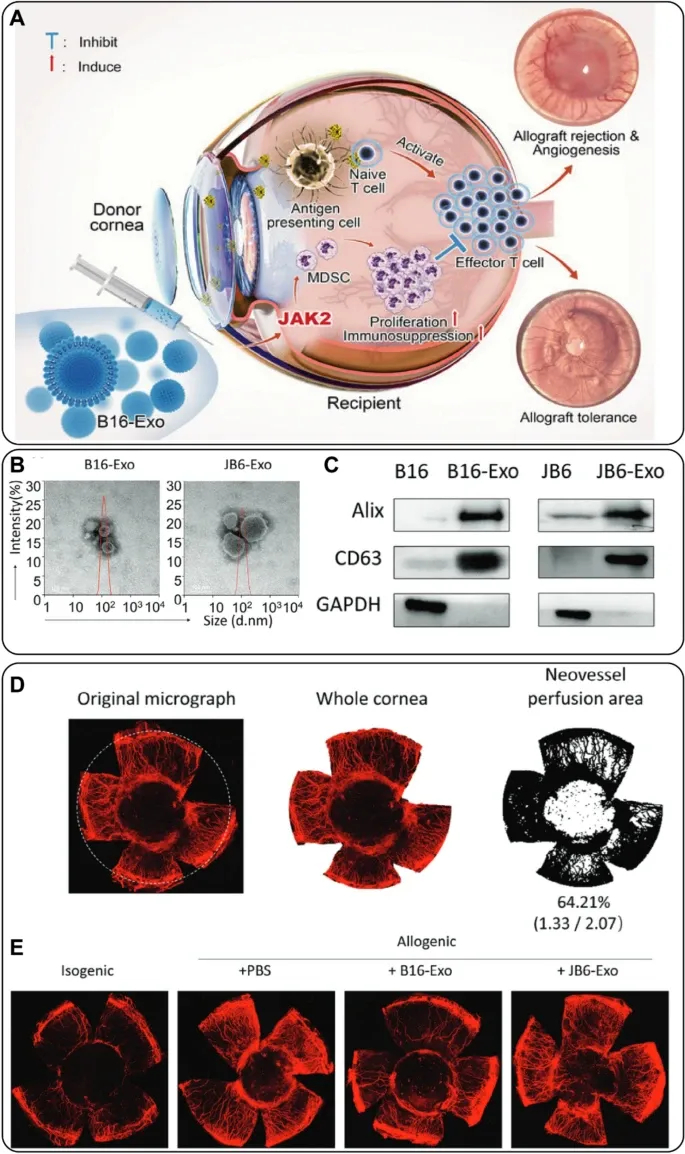
Figure5显示B16-Exo减少角膜移植新生血管
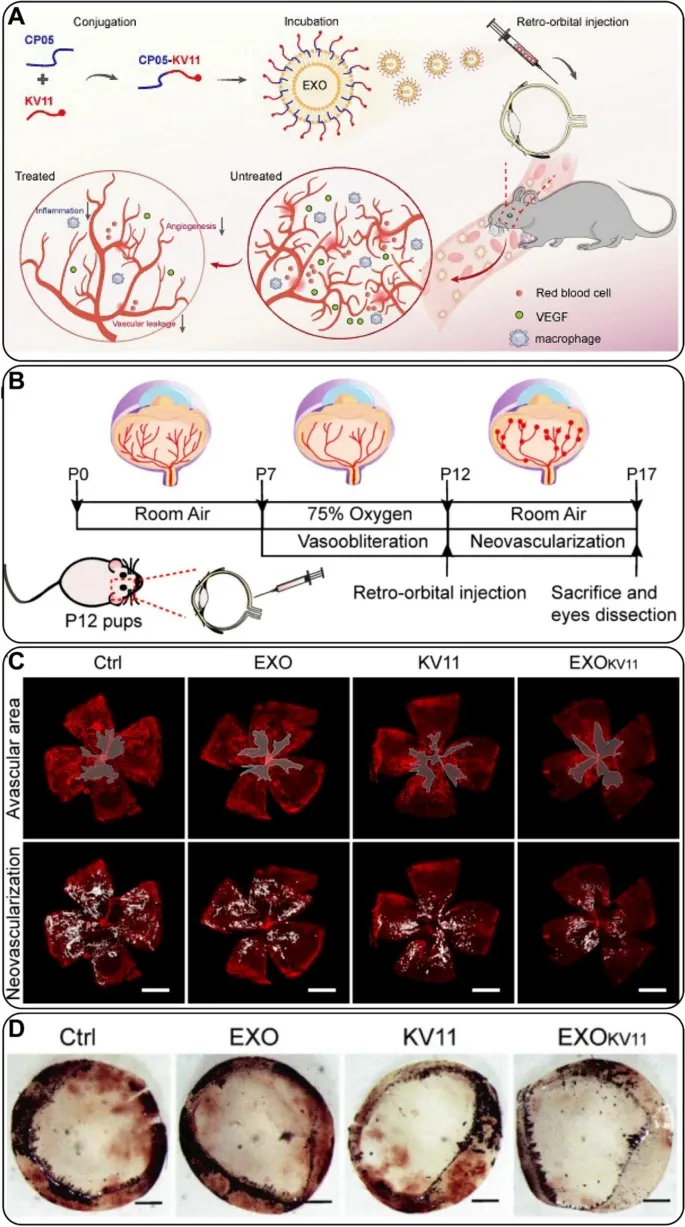
Figure6 显示EXOKV11降低DR视网膜出血
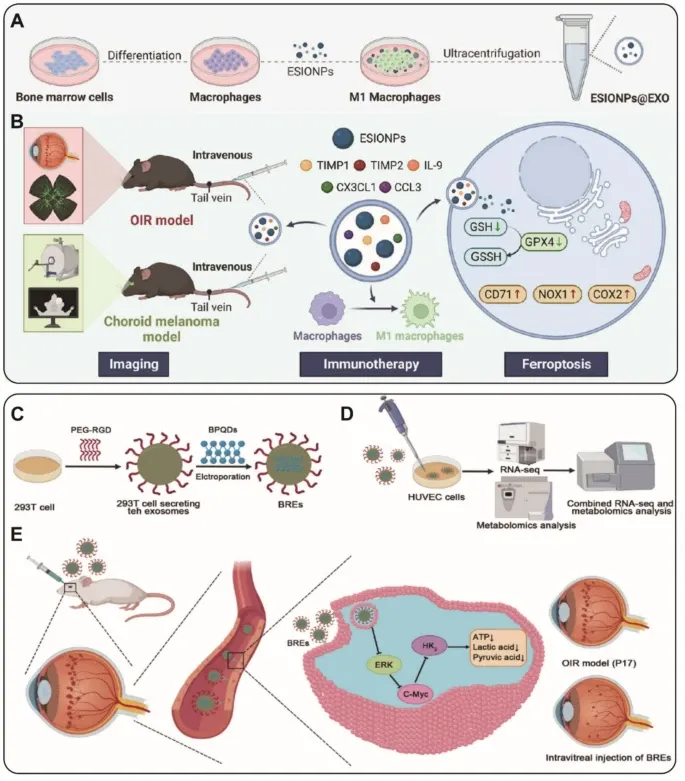
Figure7 显示BREs抑制AMD的CNV
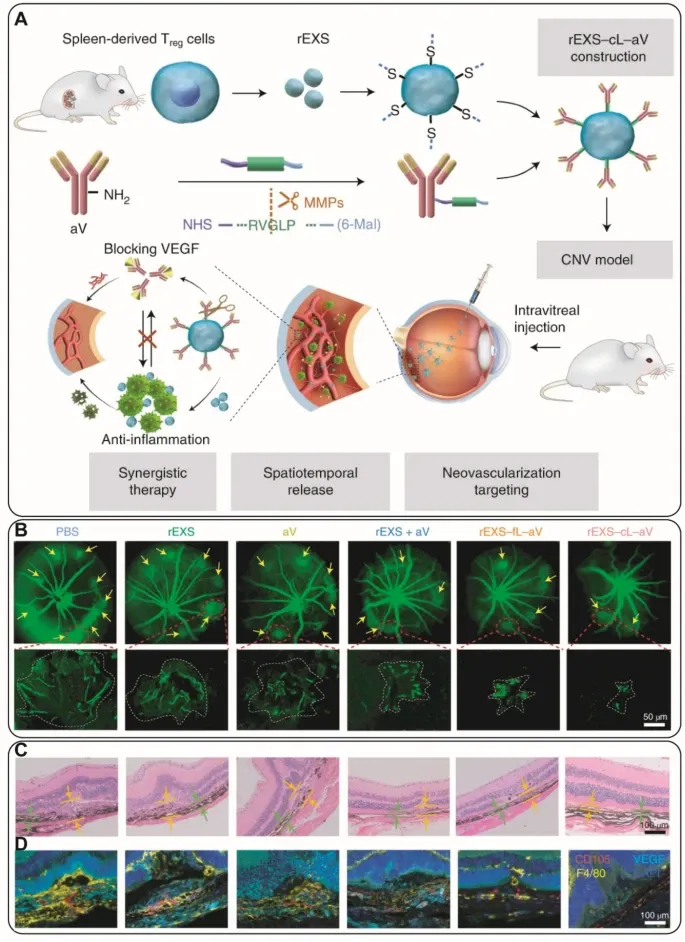
Figure8 显示rEXS–cL–aV缩小CNV病灶
5.外泌体应用的挑战
外泌体在ONDs中的应用面临多重挑战:规模化生产中,外泌体异质性高,现有分离方法难以标准化,影响批次一致性;稳定性方面,其对温度、pH敏感,需开发冻干或膜修饰技术延长保质期;眼部递送中,角膜上皮、BRB限制穿透效率,需优化表面修饰(如TAT肽增强角膜穿透)。
结论
外泌体作为新型递送平台,在ONDs治疗中展现显著优势:天然靶向性减少脱靶效应,多cargo负载能力可同时调控血管生成、炎症等多通路,工程化改造进一步提升疗效。当前研究已证实其在CoNV、DR、AMD等模型中的潜力,但临床转化需突破规模化生产、稳定性优化、监管标准建立等瓶颈。未来应聚焦个性化外泌体开发、“外泌体-抗VEGF”联合疗法及标准化协议制定,推动其从基础研究走向临床应用,为ONDs患者提供更安全、高效的治疗选择。






