研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
聚焦外泌体前沿:揭秘神奇“外泌体”靶向巨噬细胞极化机制,探索1型糖尿病外泌体疗法新路径!
727 人阅读发布时间:2025-07-25 11:44
1型糖尿病(T1DM)是一种自身免疫性疾病,目前主流的胰岛素替代疗法虽能满足基本代谢需求,但存在引发致命性低血糖事件的风险,且无法预防相关并发症。此外,T1DM患者持续的免疫失调会加速疾病进展。
间充质干细胞(MSCs)具有多向分化潜能和免疫调节特性,其分泌的细胞外囊泡(如外泌体)在免疫调节中发挥重要作用。人脐带间充质干细胞来源的外泌体(hucMSC-EXOs)相比其他来源的间充质干细胞外泌体,具有易获取、免疫原性低等优势,在多种炎症疾病中显示出治疗潜力。因此本研究旨在系统探究hucMSC-EXOs在T1DM中的治疗潜力,并明确其免疫调节机制中的关键生物活性蛋白成分。

湾湾今天分享的是一篇发表在【Stem Cell Res Ther】(IF:7.3)上题为“hucMSC-derived exosomes targeting macrophage polarization attenuate systemic inflammation in T1DM via INS/SOD1 delivery”的研究,该研究使用链脲佐菌素诱导C57BL/6雄性小鼠患上1型糖尿病(T1DM),随后给其腹腔注射人脐带间充质干细胞外泌体(hucMSC-EXOs),随后对全身葡萄糖代谢、多器官病理变化以及巨噬细胞浸润情况进行评估,并在体外将THP-1细胞衍生的巨噬细胞诱导为M1型,用hucMSC-EXOs进行处理,最后通过蛋白质组学分析、药理抑制和功能测试来确定关键的外泌体成分。结果发现hucMSC-EXOs显著降低了1型糖尿病小鼠的高血糖症,恢复了其葡萄糖耐量,并减轻了胰腺、脾脏、肝脏、肾脏和心脏的结构损伤。蛋白质组分析显示,INS和超氧化物歧化酶1(SOD1)是hucMSC-EXOs中富集的抗炎蛋白。热失活消除了它们的生物活性,而对INS(S961)或SOD1(ATN-224)的药理抑制则逆转了hucMSC-EXOs对巨噬细胞活化的抑制作用。该研究揭示,hucMSC-EXOs通过协同传递胰岛素和超氧化物歧化酶1发挥其抗炎作用,为T1DM中由外泌体介导的免疫调节建立了一个以蛋白质为中心的机制。
研究成果
1、1型糖尿病小鼠多个器官的病理变化
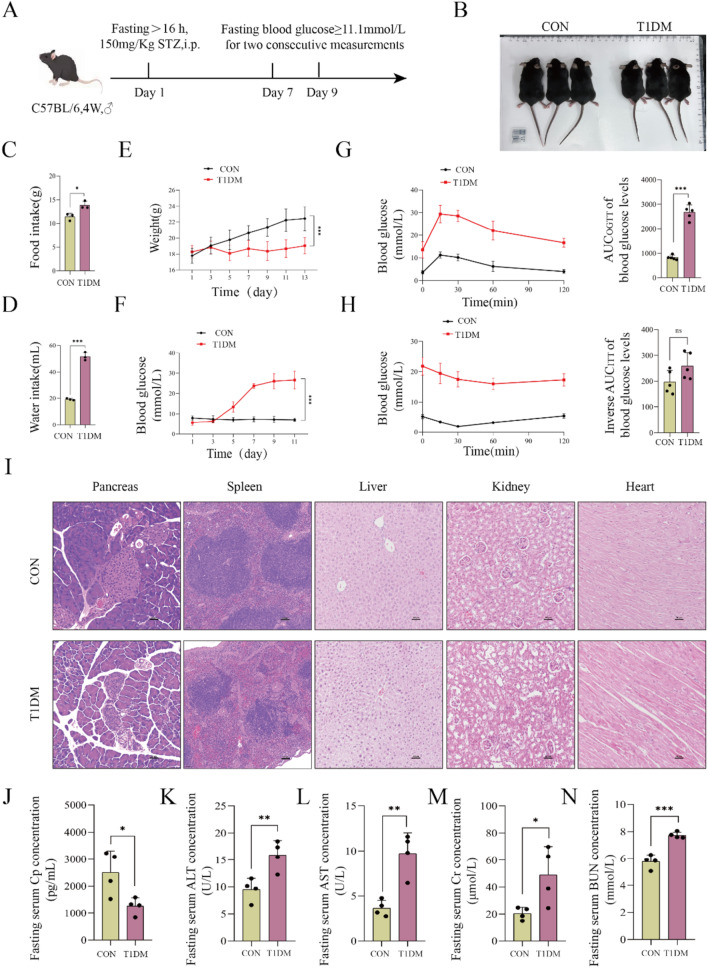
图1 T1DM小鼠多器官的病理变化。
图1A:1型糖尿病小鼠模型建立的示意图。
图1B:对照组(CON)和T1DM小鼠的外观图像。结果显示T1DM小鼠体型较小。
图1C-F:两组小鼠的生理和代谢指标,包括食物摄入量、饮水量、体重和血糖水平。结果显示T1DM小鼠表现出多食、多饮、体重下降和持续高血糖。
图1G-H:通过口服葡萄糖耐量试验(OGTT)和胰岛素耐量试验(ITT)评估的葡萄糖代谢情况。结果显示T1DM小鼠存在高血糖、葡萄糖耐量受损和葡萄糖稳态紊乱。
图1I:对两组小鼠胰腺、脾脏、肝脏、肾脏和心脏进行HE染色。结果显示,T1DM小鼠多器官出现明显结构损伤,如胰岛萎缩、脾红白髓界限模糊、肝细胞水肿等。
图1J-N:两组小鼠血清中多器官功能损伤标志物的浓度。结果显示T1DM小鼠胰腺β细胞功能标志物C肽(Cp)水平显著降低,肝损伤标志物(ALT、AST)和肾功能标志物(Cr、BUN)水平升高。
这些结果表明,T1DM小鼠出现了明显的代谢紊乱和多器官结构及功能异常,成功构建了T1DM小鼠模型。
2、巨噬细胞炎症激活会引发1型糖尿病小鼠的多器官损伤
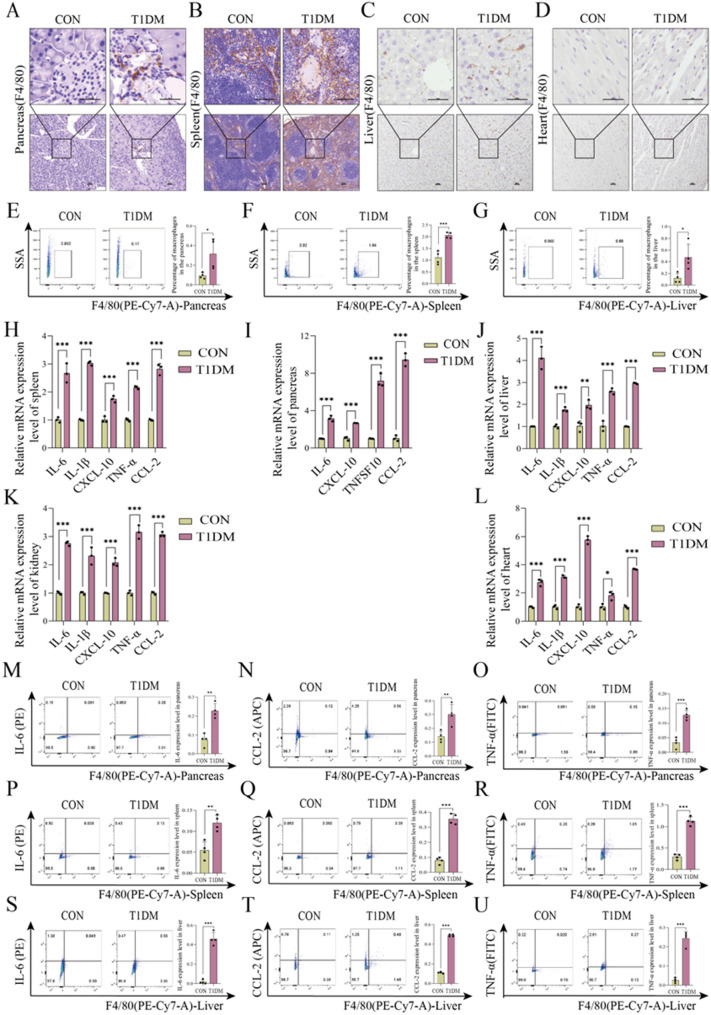
图2 巨噬细胞炎性激活促进T1DM小鼠多器官损伤。
图2A-D:对照组和T1DM小鼠胰腺、脾脏、肝脏和心脏中F4/80阳性巨噬细胞的免疫组化(IHC)染色结果。结果显示T1DM小鼠这些器官中巨噬细胞浸润显著增加。
图2E-G:流式细胞术检测到的胰腺、脾脏和肝脏中F4/80阳性巨噬细胞比例。结果显示T1DM小鼠阳性巨噬细胞比例显著高于对照组。
图2H-L:qPCR检测到的脾、胰腺、肝、肾和心脏中炎症细胞因子(IL-6、CCL-2、TNF-α等)的mRNA表达水平。结果显示T1DM小鼠这些细胞因子表达显著上调。
图2M-U:流式细胞术检测到的胰腺、脾脏和肝脏中浸润巨噬细胞分泌的IL-6、CCL-2、TNF-α蛋白水平。结果显示T1DM小鼠显著升高。
这些结果表明,巨噬细胞的炎性激活是T1DM小鼠多器官功能障碍的重要促进因素。
3.、hucMSC-EXOs可逆转1型糖尿病小鼠的病理表型
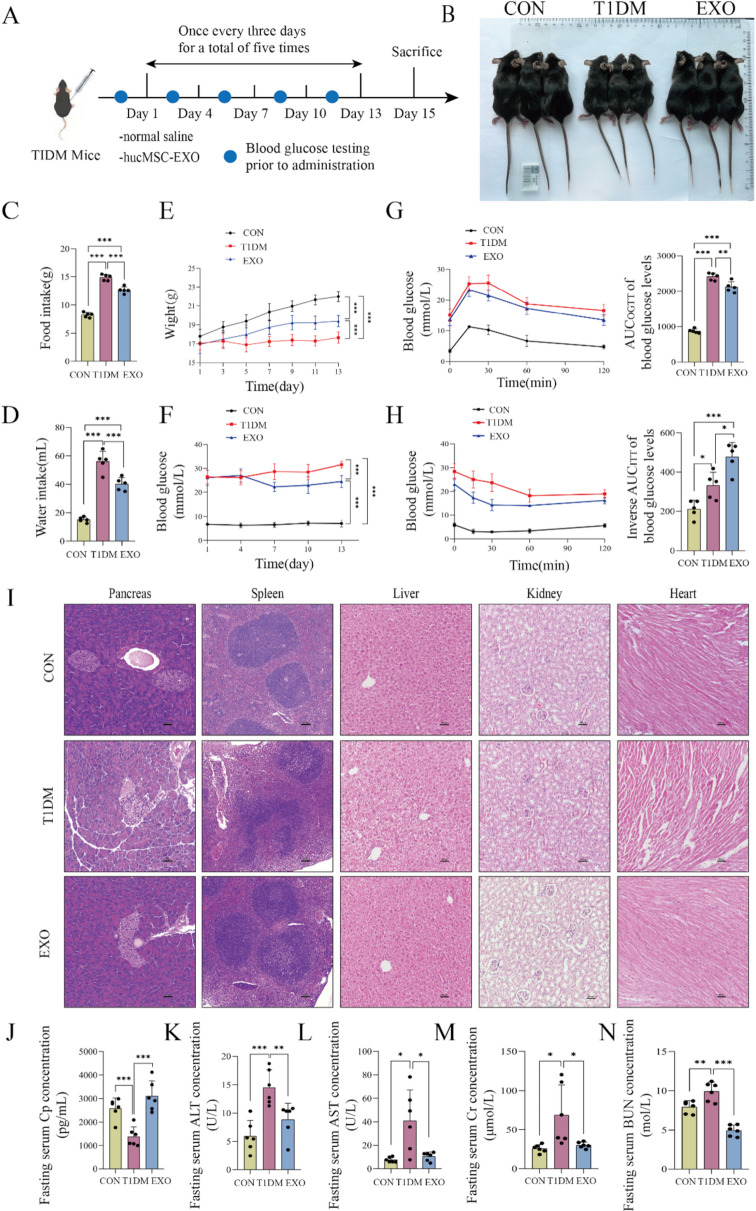
图3 hucMSC-EXOs逆转T1DM小鼠的病理表型。
图3A:T1DM小鼠腹腔注射hucMSC-EXOs的给药实验示意图。
图3B:CON、T1DM和hucMSC-EXOs处理组(EXOs)小鼠的外观图像。结果显示EXOs组小鼠体型较T1DM组有所恢复。
图3C-F:三组小鼠的食物摄入量、饮水量、体重和血糖水平。结果显示EXOs组小鼠的多食、多饮、体重下降症状得到缓解,血糖水平显著降低。
图3G-H:三组小鼠的OGTT和ITT结果。结果显示EXOs组小鼠的胰腺β细胞功能和胰岛素敏感性得到改善。
图3I:三组小鼠多器官的HE染色结果。结果显示EXOs组小鼠的胰腺、脾脏、肝脏、肾脏和心脏的结构损伤显著减轻。
图3J-N:三组小鼠血清中多器官功能损伤标志物的浓度。结果显示EXOs组小鼠的Cp水平显著升高,肝、肾相关功能标志物水平降至接近正常。
这些结果表明,hucMSC-EXOs可改善T1DM小鼠的多种病理表型,恢复多器官的结构和功能。
4、 hucMSC-EXOs可抑制1型糖尿病小鼠体内巨噬细胞的浸润
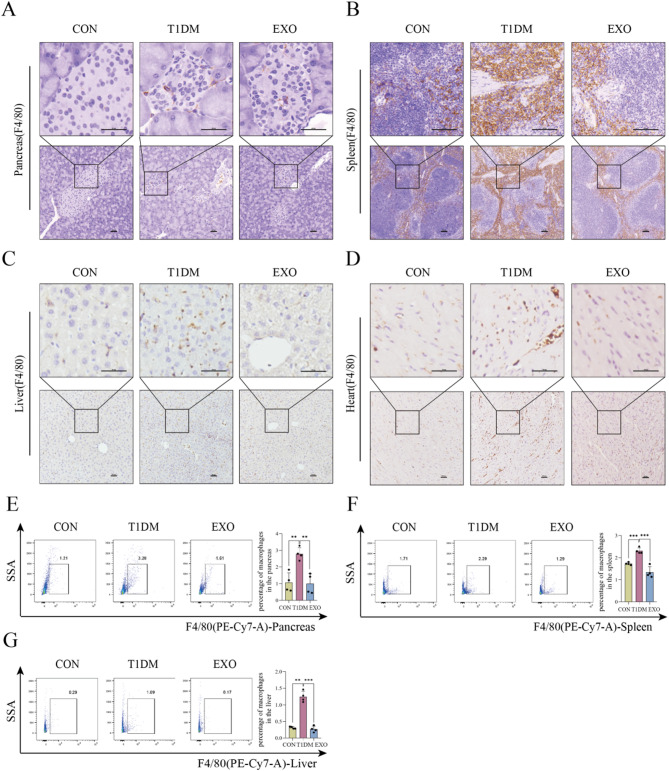
图4 hucMSC-EXOs抑制T1DM小鼠的巨噬细胞浸润。
图4A-D:对CON、T1DM和EXOs组小鼠胰腺、脾脏、肝脏和心脏中F4/80阳性巨噬细胞进行IHC染色。结果显示,EXOs组小鼠这些器官中巨噬细胞数量显著低于T1DM组。
图4E-G:流式细胞术检测到的三组小鼠胰腺、脾脏和肝脏中F4/80阳性巨噬细胞的比例。结果显示EXOs组阳性巨噬细胞的比例显著降低。
这些结果表明,hucMSC-EXOs通过减少T1DM小鼠病变组织中的巨噬细胞浸润,修复多组织的炎性损伤。
5、hucMSC-EXOs可抑制1型糖尿病小鼠巨噬细胞的炎症激活过程
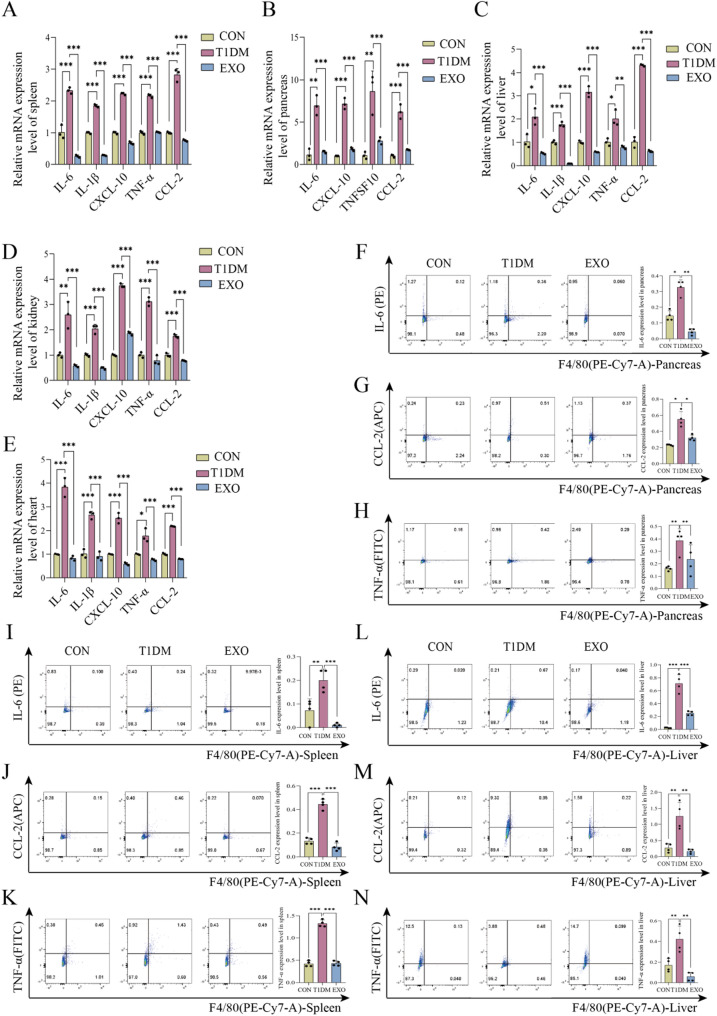
图5 hucMSC-EXOs抑制T1DM小鼠巨噬细胞的炎症激活现象。
图5A-E:qPCR检测到的CON、T1DM和EXOs组小鼠脾、胰腺、肝、肾和心脏中炎症细胞因子的mRNA表达水平、结果显示EXOs组mRNA表达水平显著低于T1DM组。
图5F-N:流式细胞术检测到的三组小鼠胰腺、脾脏和肝脏中浸润巨噬细胞分泌的IL-6、CCL-2、TNF-α蛋白水平。结果显示EXO组IL-6、CCL-2、TNF-α蛋白水平显著降低。
这些结果表明,hucMSC-EXOs通过抑制巨噬细胞的促炎激活,逆转T1DM小鼠的多器官炎性表型。
6、人脐带间充质干细胞外泌体中的抗炎蛋白成分
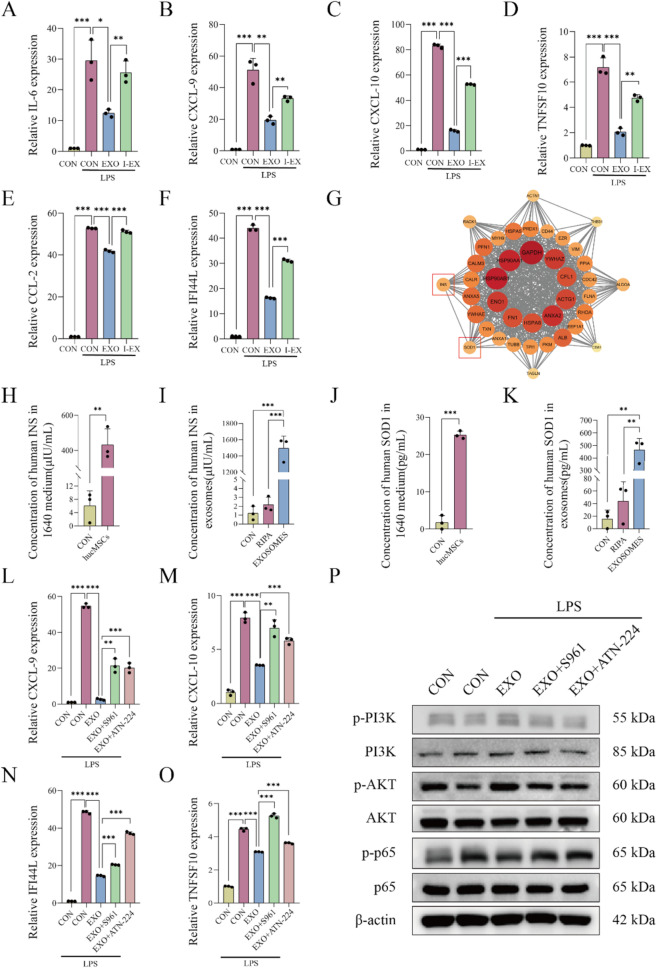
图6 hucMSC-EXOs中的抗炎蛋白成分。
图6A-F:通过qPCR比较热灭活的hucMSC-EXOs和未处理的hucMSC-EXOs对巨噬细胞中炎症细胞因子表达水平的影响。结果显示热灭活的hucMSC-EXOs抗炎活性显著降低。
图6G:通过STRING数据库对hucMSC-EXOs蛋白进行拓扑分析。结果识别出INS和SOD1等关键枢纽蛋白。
图6H-K:通过ELISA检测hucMSCs培养上清液和hucMSC-EXOs中INS和SOD1的含量。结果显示hucMSC-EXOs中这两种蛋白含量显著富集。
图6L-O:通过qPCR分析EXOs单独处理、EXOs联合S961(INS受体拮抗剂)及EXOs联合ATN-224(SOD1抑制剂)对巨噬细胞中炎症因子表达的影响。结果显示联合处理组炎症因子表达水平较EXOs单独处理组升高。
图6P:Western blot分析不同处理对巨噬细胞中PI3K/AKT和P65磷酸化的影响。结果显示联合处理组的相关磷酸化水平发生改变。
这些结果表明,INS和SOD1是hucMSC-EXOs中发挥抗炎作用的关键蛋白成分。
7、抑制剂INS和SOD1可逆转hucMSC-EXOs在1型糖尿病小鼠体内的抗炎作用
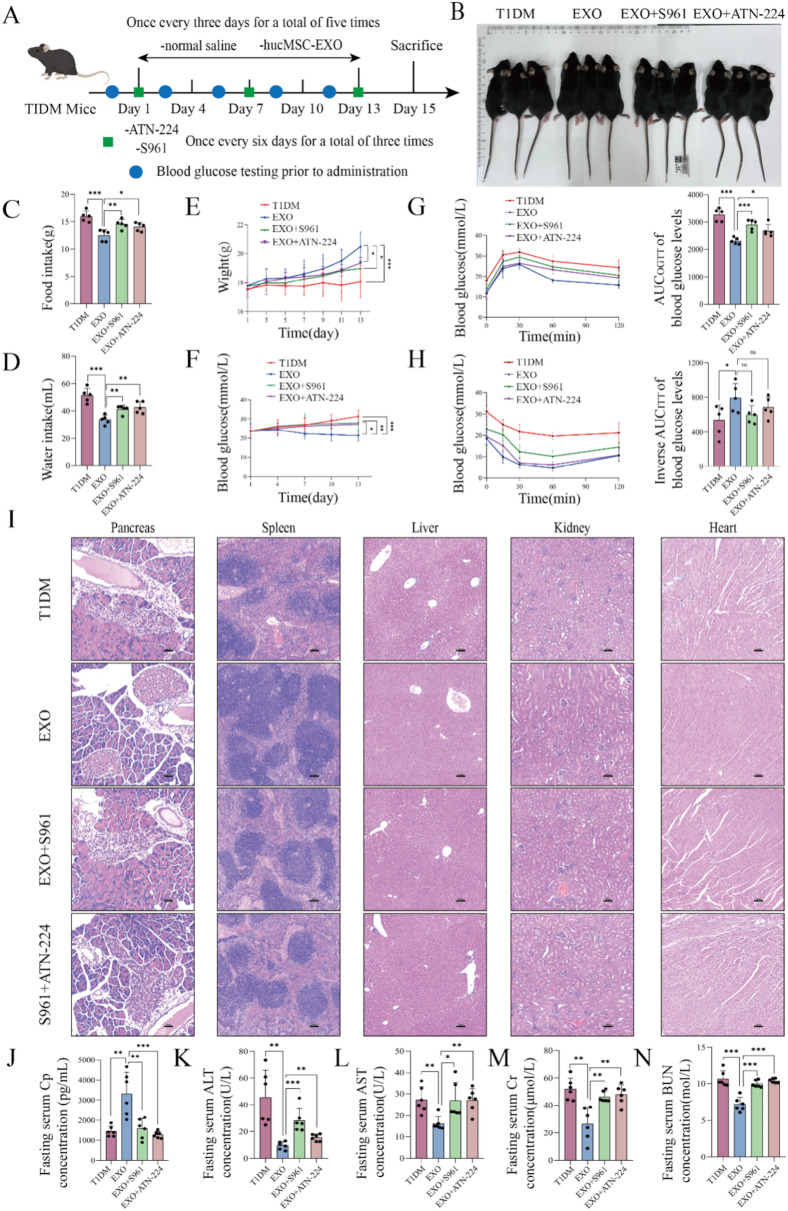
图7 S961和ATN-224部分逆转hucMSC-EXOs对T1DM小鼠的治疗效果。
图7A:T1DM小鼠接受S961、ATN-224和hucMSC-EXOs联合治疗的方案示意图。
图7B:T1DM、EXOs、EXOs+S961和EXOs+ATN-224组小鼠的外观图像。结果显示联合治疗组小鼠的外观改善程度不及EXOs组。
图7C-F:四组小鼠的食物摄入量、饮水量、体重和血糖水平。结果显示联合治疗组的症状缓解和血糖降低效果不及EXOs组。
图7G-H:四组小鼠的OGTT和ITT结果。结果显示联合治疗组小鼠的胰腺β细胞功能和胰岛素敏感性改善程度不及EXOs组。
图7I:四组小鼠多器官的HE染色结果。结果显示联合治疗组小鼠的器官结构损伤改善程度不及EXOs组。
图7J-N:四组小鼠血清中多器官功能损伤标志物的浓度。结果显示联合治疗组的标志物水平改善程度不及EXOs组。
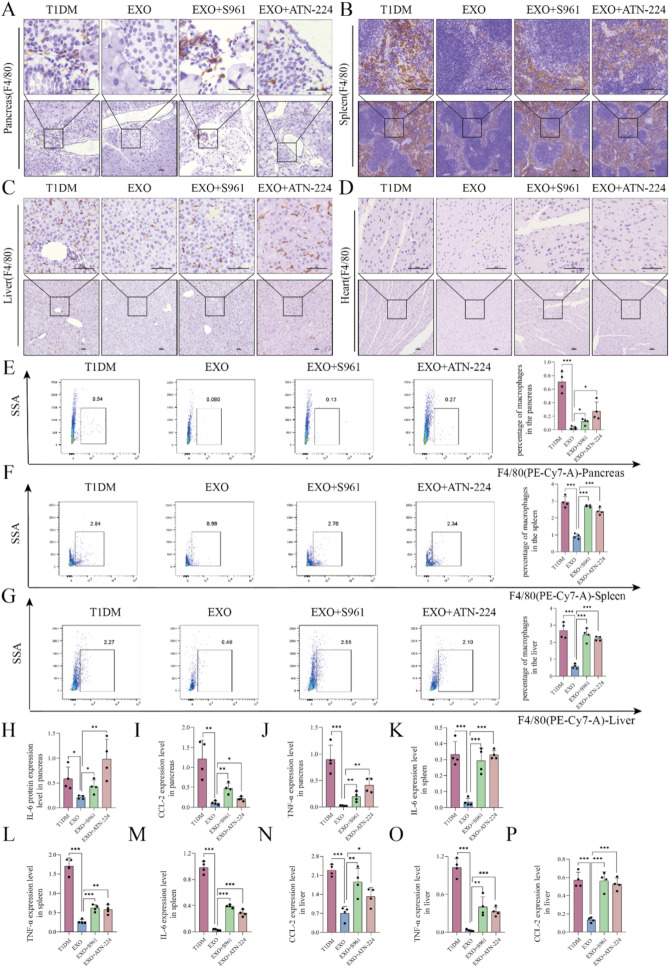
图8 S961和ATN-224逆转hucMSC-EXOs介导的多器官抗炎作用。
图8A-D:多组小鼠胰腺、脾脏、肝脏和心脏中F4/80阳性巨噬细胞的IHC染色结果。结果显示联合治疗组巨噬细胞数量多于EXOs组。
图8E-G:流式细胞术检测到的多组小鼠胰腺、脾脏和肝脏中F4/80阳性巨噬细胞的比例。结果显示联合治疗组阳性巨噬细胞的比例显著高于EXOs组。
图8H-P:流式细胞术分析多组小鼠胰腺、脾脏和肝脏中浸润巨噬细胞分泌的IL-6、CCL-2、TNF-α蛋白水平。结果显示联合治疗组蛋白水平显著高于EXOs组。
这些结果表明,S961和ATN-224可部分逆转hucMSC-EXOs对T1DM小鼠的治疗效果(图7),还可逆转hucMSC-EXOs在T1DM小鼠多器官中的抗炎作用(图8)。
结论
本研究表明,hucMSC-EXOs通过递送INS和SOD1靶向巨噬细胞极化,减轻T1DM小鼠的全身性炎症,改善高血糖和多器官炎症损伤。这一发现建立了外泌体介导的T1DM免疫调节中以蛋白质为中心的机制,为T1DM新型免疫疗法的开发提供了重要理论依据。外泌体在炎症性疾病治疗中的潜力正不断被挖掘,本研究中hucMSC-EXOs通过递送INS和SOD1调控巨噬细胞极化,为1型糖尿病治疗提供了新方向!






