研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
RBMX去SUMO化给外泌体miRNA“装导航”,靶向调控DKD纤维化,这波研究思路超硬核!
587 人阅读发布时间:2025-08-06 16:51
糖尿病肾病(DKD)是我国慢性肾衰竭的主要病因,肾小管间质纤维化是其进展为终末期肾病的核心机制。外泌体作为肾脏病理变化的“信使”,其携带的miRNA组成受RNA结合蛋白(RBPs)调控。RBMX作为异质核核糖核蛋白家族成员,可通过结合RNA调控外泌体内容物分选,但在DKD中的作用尚不明确。

今天分享的是发表在【J Adv Res】(IF:13)上题为“DeSUMOylation of RBMX regulates exosomal sorting of cargo to promote renal tubulointerstitial fibrosis in diabetic kidney disease”的研究。该研究旨在探索RBMX对DKD中肾小管上皮细胞外泌体miRNA分选的调控机制,明确其在肾小管间质纤维化和线粒体损伤中的作用,为DKD的治疗提供新靶点。
研究结果
1.DKD中肾小管上皮细胞RBMX高表达
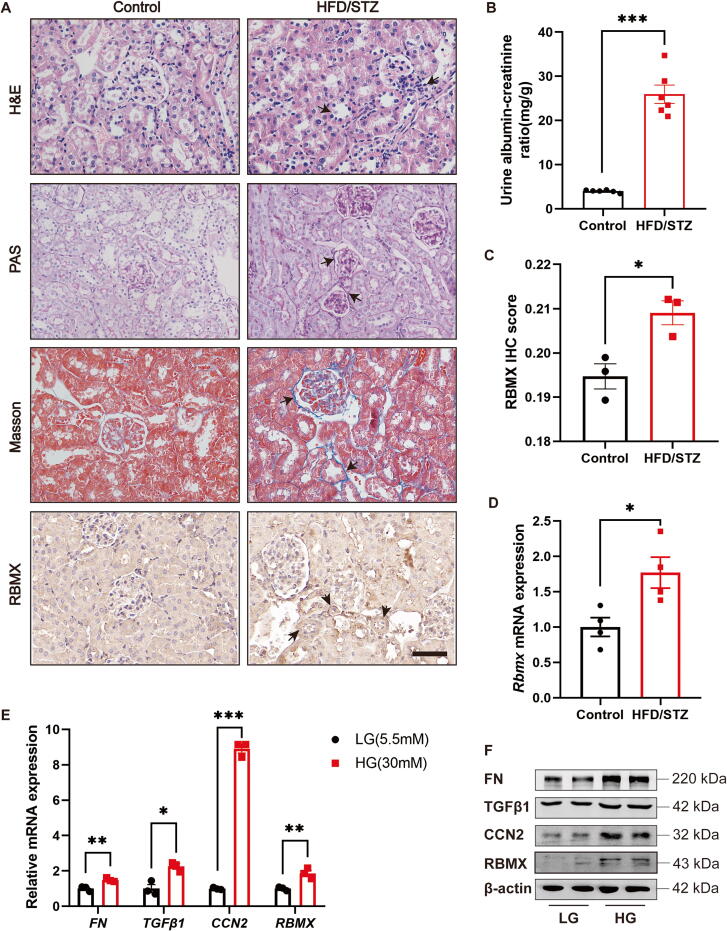
图1A:HE、PAS和Masson染色显示,HFD/STZ诱导的DKD小鼠肾皮质出现肾小球系膜基质扩张、肾小管萎缩和胶原沉积;免疫组化显示RBMX主要定位于肾小管,且表达量较对照组显著增加。
图1B:DKD小鼠尿白蛋白/肌酐比值(UACR)显著升高,提示肾损伤加重。
图1C:对HFD/STZ诱导的DKD小鼠肾皮质中RBMX表达进行半定量分析(ImageJ检测平均光密度),结果显示DKD组RBMX表达水平显著高于对照组。
图1D:qRT-PCR显示,HFD/STZ诱导的DKD小鼠肾皮质中Rbmx mRNA表达水平显著高于对照组。
图1E:高糖(HG)处理的HK-2细胞中,纤维化指标(FN、TGFβ1、CCN2)及RBMX的mRNA表达均较正常糖(LG)组显著上调。
图1F:Western blot显示,HG处理的HK-2细胞中,FN、TGFβ1、CCN2及RBMX蛋白表达水平较LG组显著增加。
这些结果表明,RBMX在DKD模型(体内和体外)的肾小管上皮细胞中高表达,且与肾损伤及纤维化指标升高相关。
2.RBMX促进DKD肾小管间质纤维化
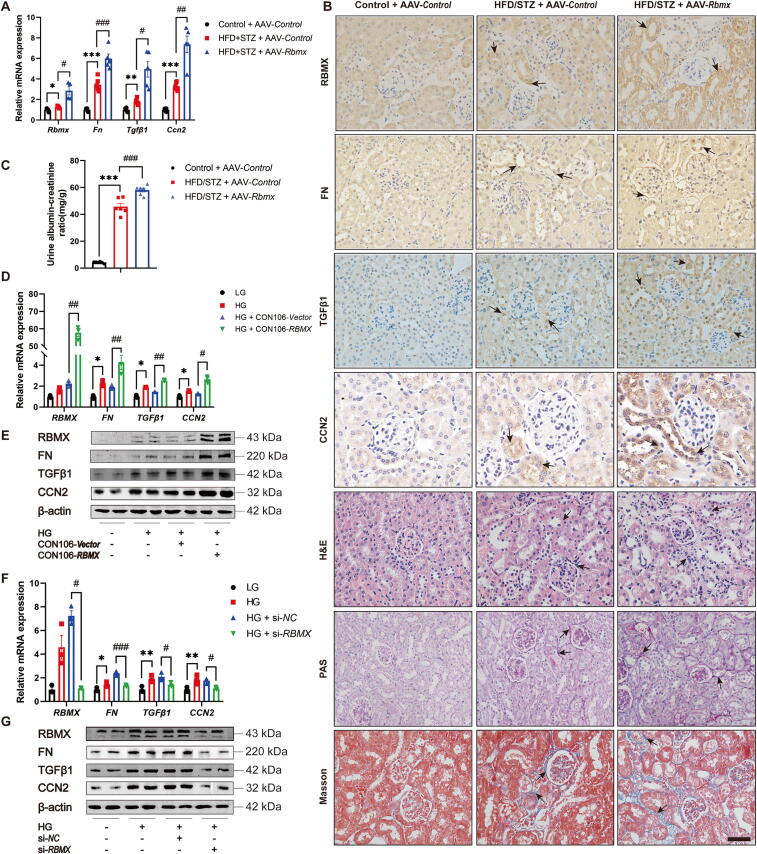
图2A:qRT-PCR显示,肾过表达Rbmx的HFD/STZ小鼠肾皮质中,Rbmx、Fn、Tgfb1、Ccn2的mRNA表达水平显著高于对照组。
图2B:免疫组化及HE、PAS、Masson染色显示,过表达Rbmx加剧DKD小鼠肾小球基底膜增生、肾小管萎缩和间质纤维化,且RBMX及纤维化标志物(FN、TGFβ1、CCN2)表达显著增加。
图2C:过表达Rbmx的DKD小鼠尿白蛋白/肌酐比值(UACR)进一步升高,提示肾损伤加重。
图2D:HG处理的HK-2细胞转染RBMX过表达质粒后,RBMX、FN、TGFβ1、CCN2的mRNA表达显著上调。
图2E:Western blot验证上述蛋白表达相应增加。
图2F:HG处理的HK-2细胞转染si-RBMX后,RBMX及纤维化因子的mRNA表达显著降低。
图2G:Western blot显示上述蛋白表达水平相应降低。
这些结果表明,RBMX可促进DKD肾小管间质纤维化,过表达RBMX加剧损伤,敲低则缓解。
3.RBMX加剧DKD线粒体损伤
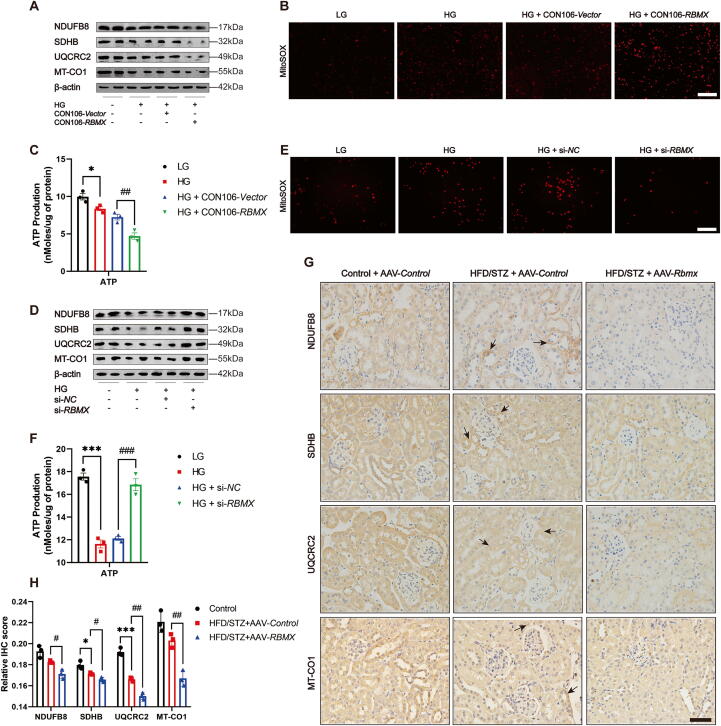
图3A:Western blot显示,HG处理的HK-2细胞过表达RBMX后,线粒体呼吸链复合体蛋白(NDUFB8、SDHB、UQCRC2、MT-CO1)表达显著降低。
图3B:MitoSOX检测显示,线粒体ROS水平显著升高。
图3C:ATP检测显示,细胞内ATP含量显著减少。
图3D:HG处理的HK-2细胞转染si-RBMX后,上述线粒体呼吸链蛋白表达显著回升。
图3E:线粒体ROS水平显著降低。
图3F:ATP含量显著增加。
图3G-H:免疫组化及定量分析显示,过表达Rbmx的DKD小鼠肾皮质中,NDUFB8、SDHB等线粒体蛋白表达显著降低。
这些结果表明,RBMX通过降低线粒体呼吸链复合体蛋白表达、减少ATP生成及增加ROS,加剧DKD线粒体损伤。
4.RBMX通过外泌体释放miRNA调控线粒体损伤
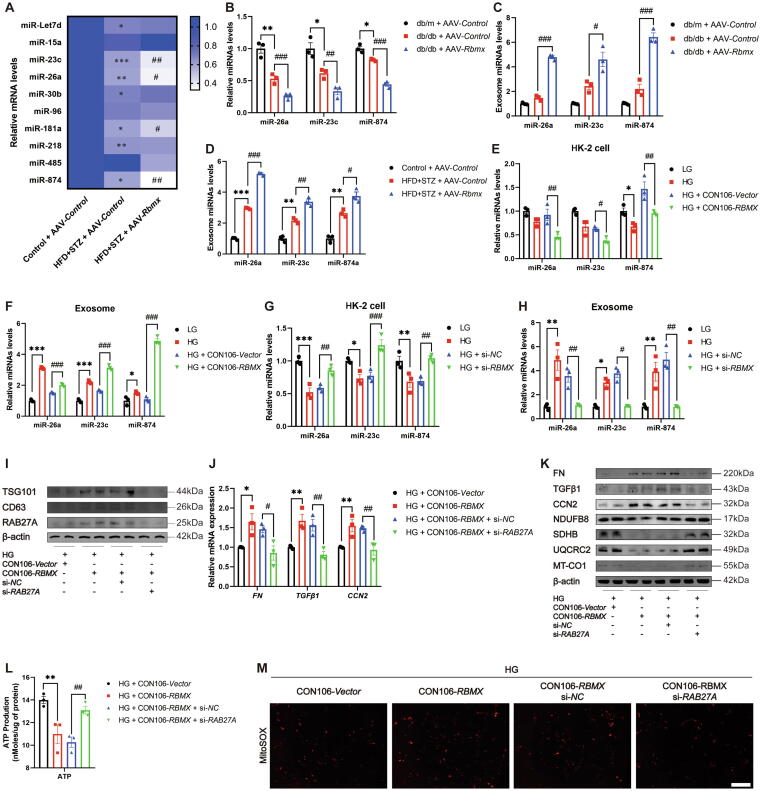
图4A:qRT-PCR显示,过表达Rbmx的HFD/STZ小鼠肾皮质中,miR-26a、miR-23c、miR-874等miRNA表达显著降低。
图4B:db/db小鼠肾皮质中,上述miRNA表达同样降低。
图4C-D:HFD/STZ和db/db小鼠肾外泌体中,miR-26a、miR-23c、miR-874表达显著升高。
图4E:HG处理的HK-2细胞过表达RBMX后,细胞内上述miRNA表达降低。
图4F:其分泌的外泌体中上述miRNA表达升高。
图4G-H:敲低RBMX后,细胞内miRNA表达升高,外泌体中降低。
图4I:Western blot显示,敲低RAB27A(抑制外泌体分泌)后,外泌体标志物TSG101、CD63表达降低。
图4J-K:敲低RAB27A可逆转RBMX过表达诱导的纤维化标志物(FN、TGFβ1)升高及线粒体蛋白(NDUFB8等)降低。
图4L-M:ATP含量回升,线粒体ROS减少。
这些结果表明,RBMX通过调控外泌体分选miR-26a、miR-23c、miR-874,促进线粒体损伤和纤维化,抑制外泌体分泌可逆转该效应。
5.去SUMO化的RBMX促进外泌体miRNA分选及肾小管间质纤维化
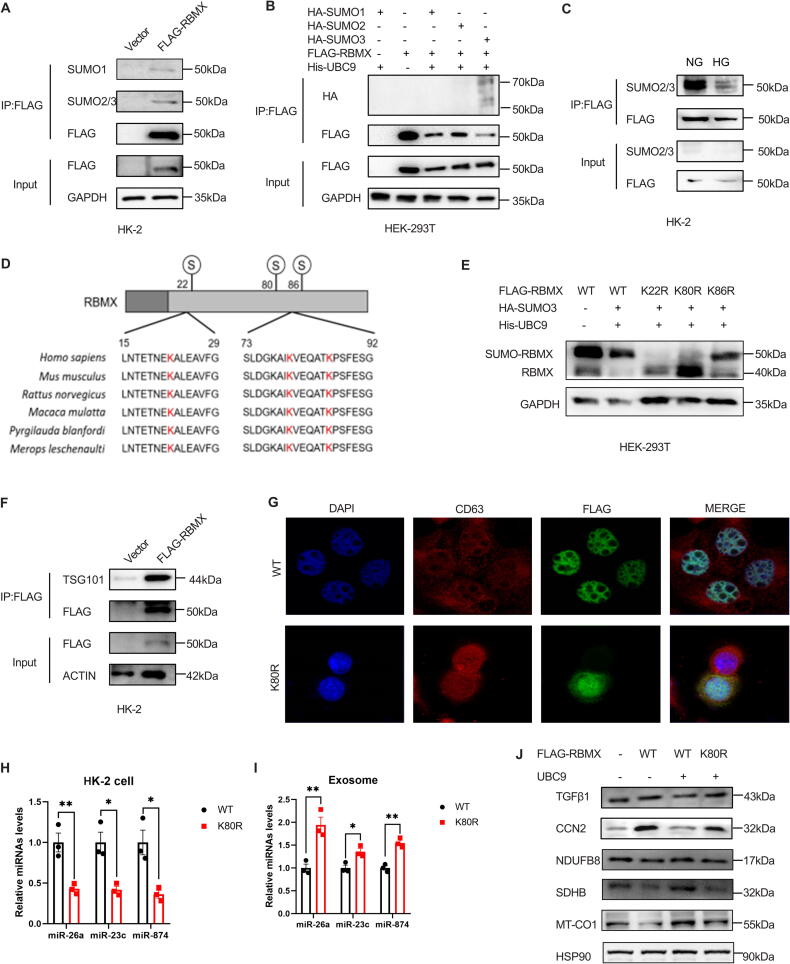
图5A:Co-IP显示,HK-2细胞中RBMX可与SUMO1、SUMO2/3结合。
图5B:HEK-293T细胞中,RBMX与SUMO3结合最强(His-UBC9共转染)。
图5C:HG处理的HK-2细胞中,RBMX的SUMO2/3修饰水平显著降低。
图5D-E:Western blot显示,RBMX的K22R、K80R突变(预测SUMO化位点)可抑制其SUMO化,其中K80R效果更显著。
图5F:Co-IP显示,RBMX与外泌体标志物TSG101结合增强。
图5G:免疫荧光显示,RBMX K80R突变体在CD63阳性多囊泡体(MVBs)中富集。
图5H-I:HK-2细胞转染RBMX K80R后,细胞内miR-26a、miR-23c、miR-874表达降低,外泌体中升高。
图5J:Western blot显示,K80R突变体组纤维化标志物(TGFβ1、CCN2)升高,线粒体蛋白(NDUFB8等)降低。
这些结果表明,RBMX的K80位点去SUMO化可促进其与外泌体相关蛋白结合,增强外泌体miRNA分选,加剧纤维化和线粒体损伤。
6.RBMX直接结合miRNA介导其外泌体分选
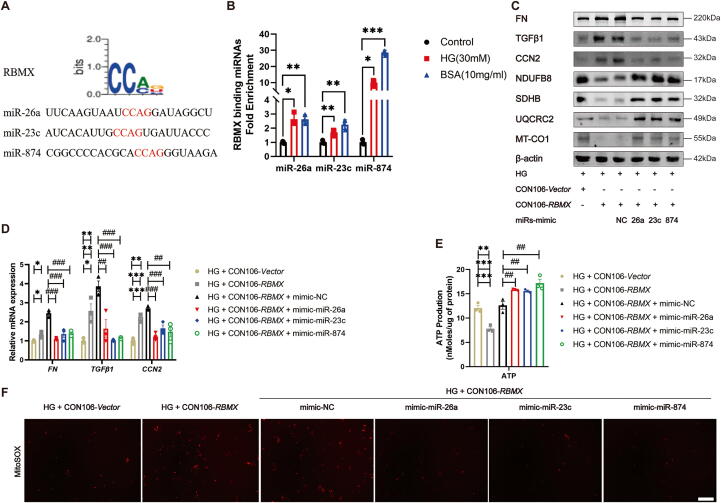
图6A:序列分析显示,miR-26a、miR-23c、miR-874含CCAG基序,可与RBMX结合。
图6B:RIP实验显示,HG或BSA处理后,HK-2细胞中RBMX与上述miRNA的结合显著增加。
图6C:Western blot显示,HG处理的HK-2细胞共转染RBMX过表达质粒与miRNA mimic后,纤维化标志物(FN、TGFβ1)降低,线粒体蛋白(NDUFB8等)回升。
图6D:qRT-PCR验证纤维化因子mRNA降低。
图6E-F:ATP含量增加,线粒体ROS减少。
这些结果表明,RBMX通过直接结合miR-26a、miR-23c、miR-874,调控其外泌体分选,进而影响线粒体功能和纤维化。
7.miR-26a、miR-23c、miR-874作为保护性miRNA在DKD中发挥作用
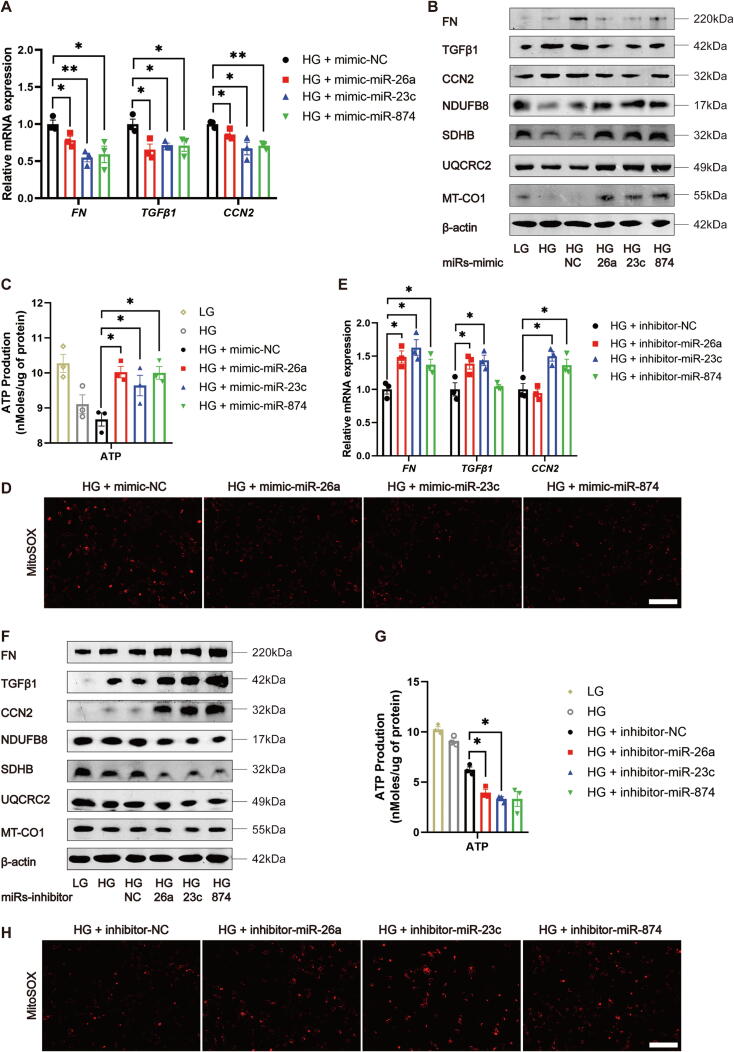
图7A-B:qRT-PCR和Western blot显示,HG处理的HK-2细胞转染上述miRNA mimic后,纤维化标志物(FN、TGFβ1)降低,线粒体蛋白(NDUFB8等)升高。
图7C-D:ATP含量增加,线粒体ROS减少。
图7E-F:转染miRNA抑制剂后,纤维化标志物升高,线粒体蛋白降低。
图7G-H:ATP含量减少,线粒体ROS增加。
这些结果表明,miR-26a、miR-23c、miR-874是保护性miRNA,可抑制DKD中的纤维化和线粒体损伤。
8.CERS6是miR-26a、miR-23c、miR-874的共同靶基因
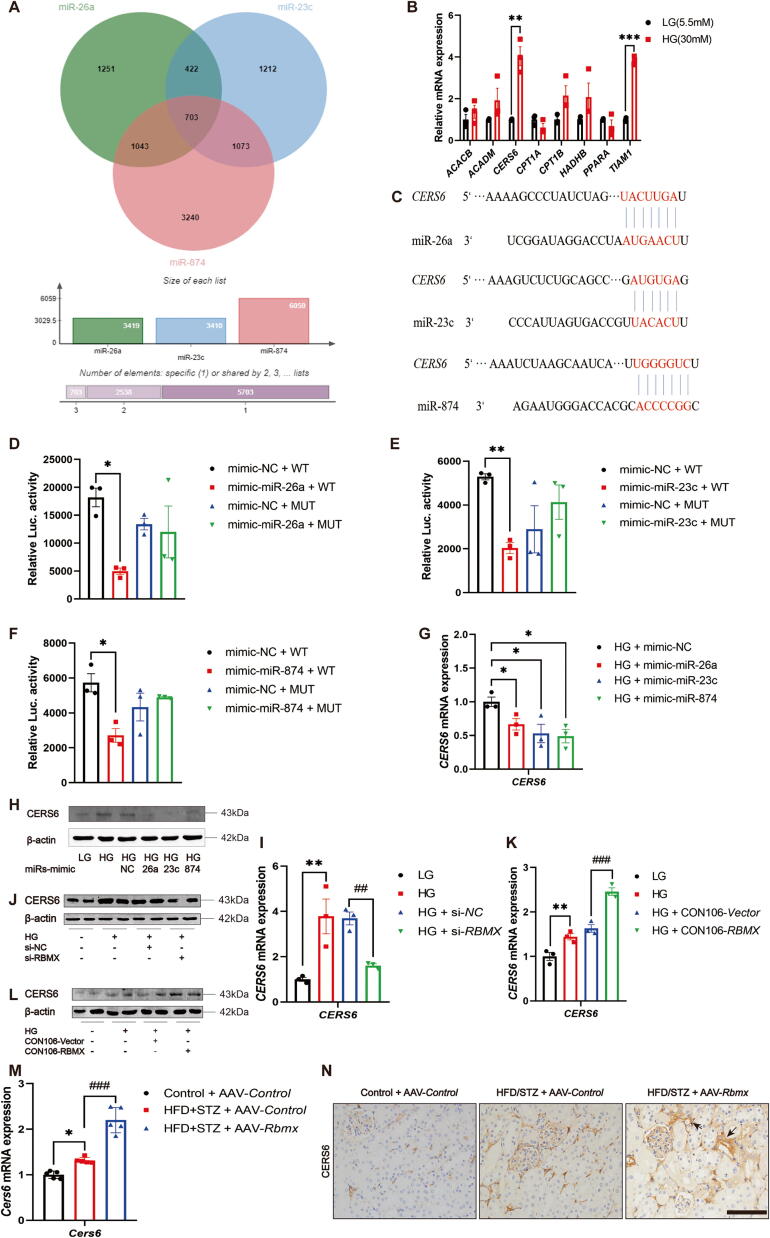
图8A:靶基因预测显示,CERS6是三者的共同靶基因。
图8B:qRT-PCR显示,HG处理的HK-2细胞中CERS6 mRNA表达显著升高。
图8C:序列分析显示,三者与CERS63'UTR存在结合位点。
图8D-F:双荧光素酶实验显示,miRNA mimic可显著降低野生型CERS63'UTR的luciferase活性,突变型无显著变化。
图8G-J:HG处理的HK-2细胞转染miRNA mimic或si-RBMX后,CERS6蛋白表达降低。
图8K-N:过表达RBMX或Rbmx的HK-2细胞及DKD小鼠中,CERS6蛋白表达升高。
这些结果表明,miR-26a、miR-23c、miR-874通过靶向抑制CERS6,减轻DKD中的线粒体损伤和纤维化。
结论
本研究证实,在糖尿病肾病(DKD)中,肾小管上皮细胞中高表达的RBMX通过其K80位点的去SUMO化修饰,增强与miR-26a、miR-23c、miR-874的结合,并促进这些保护性miRNA分选至外泌体中分泌。这导致细胞内保护性miRNA减少,其对靶基因CERS6的抑制作用减弱,CERS6异常升高,最终加剧线粒体损伤和肾小管间质纤维化。该研究揭示了RBMX的去SUMO化在调控外泌体miRNA分选及DKD进展中的关键作用,提示靶向抑制RBMX表达或干预其去SUMO化过程,可能成为DKD治疗的新策略。






