研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
1个月见刊?聚焦外泌体与表观调控交叉:改善椎间盘退变的国自然研究新视角!
245 人阅读发布时间:2025-08-08 14:37
想要在国自然项目申报中脱颖而出?你的热点选好了吗?外泌体作为当下国自然热点,正引领着科研新潮流,而今天要剖析的这篇文献,聚焦外泌体与表观调控交叉领域,从投稿到发表仅耗时1个月,为改善椎间盘退变提供了全新研究视角!它采用了一系列前沿技术,层层深入探究背后机制,整个研究思路清晰且极具创新性。想学习如何借鉴其技术思路助力自己的科研?现在,就让我们一同揭开这篇文献的神秘面纱,探寻其中蕴含的科研宝藏!

今天分享的是一篇发表在【Free Radical Biology and Medicine】(IF:8.2)上题为“Exosome-Functionalized Hydrogels Improve Cartilage Repair by Modulating BMSCs Migration and Differentiation”的研究,该研究发现氧化应激诱导的溶酶体膜通透性(LMP)损伤是髓核细胞(NPCs)衰老的驱动因素,这可能为椎间盘退变(IVDD)的进展创造病理条件;氧化应激导致的活性氧(ROS)积累增加了退变髓核细胞溶酶体膜的通透性,从而破坏了溶酶体自噬功能,加剧了髓核细胞的衰老。相反,间充质干细胞外泌体(MSC-Exos)通过介导Nrf2-m6A修饰发挥抗氧化应激作用,从而减轻LMP损伤,改善髓核细胞衰老。具体而言,MSC-Exo通过促进组蛋白乙酰转移酶(HAT)p300/CBP的活性,促进去甲基化酶FTO启动子的H3K27ac修饰,从而增强FTO的转录,进而促进Nrf2的m6A去甲基化,防止YTHDF2识别Nrf2 mRNA从而导致其降解。
研究成果
1. LMP损伤通过干扰自噬作用,加剧神经前体细胞(NPCs)的衰老和IVDD的进展
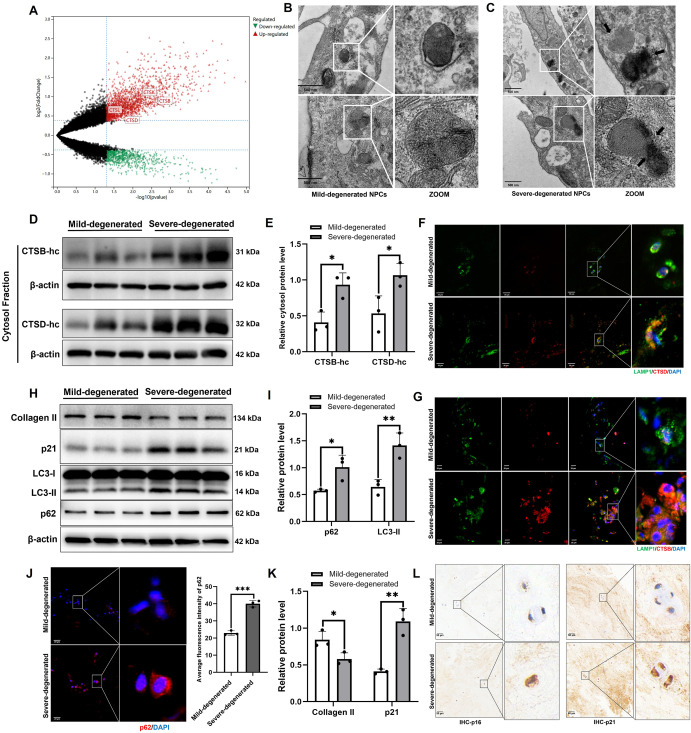
图1 LMP损伤通过破坏自噬加剧NPCs衰老和IVDD进展。
图1A:火山图分析GEO数据库中轻度和重度退变髓核组织的差异表达基因(DEGs)。结果显示溶酶体损伤相关基因(如CTSB等)在重度退变中显著差异表达。
图1B-C:对人类轻度和重度退变的神经元细胞中溶酶体微观结构进行电子显微镜观察。结果证实LMP损伤发生。
图1D-E:通过Western blot评估人类轻度和重度退变的髓核组织中CTSB和CTSD蛋白水平,并进行定量分析。结果显示,重度退变髓核组织的胞质组分中出现酶泄漏。
图1F-G:在人类轻度和重度退变的髓核组织中对CTSD和LAMP1进行共免疫荧光染色。结果进一步证实LMP损伤。
图1H-I:对人类轻度和重度退变的髓核组织进行Western blot检测。结果显示自噬降解功能障碍。
图1J:对人类轻度和重度退变髓核组织中p62的免疫荧光染色以及平均荧光强度的定量分析。结果显示,重度退变样本中p62的胞质积累增加,平均荧光强度显著升高。
图1K:对胶原蛋白II和p21表达量的定量分析。结果显示,重度退变样本中II型胶原(细胞外基质成分)减少,衰老标志物p21增加。
图1L:对人类轻度和重度退变髓核组织中p16和p21表达的免疫组化分析。结果显示,重度退变样本中衰老标志物p16和p21的表达显著升高。
这些结果表明,LMP损伤通过破坏溶酶体-自噬功能,加剧NPCs衰老和IVDD进展。
2. MSC-Exos可减轻氧化应激对退化神经前体细胞造成的LMP损伤
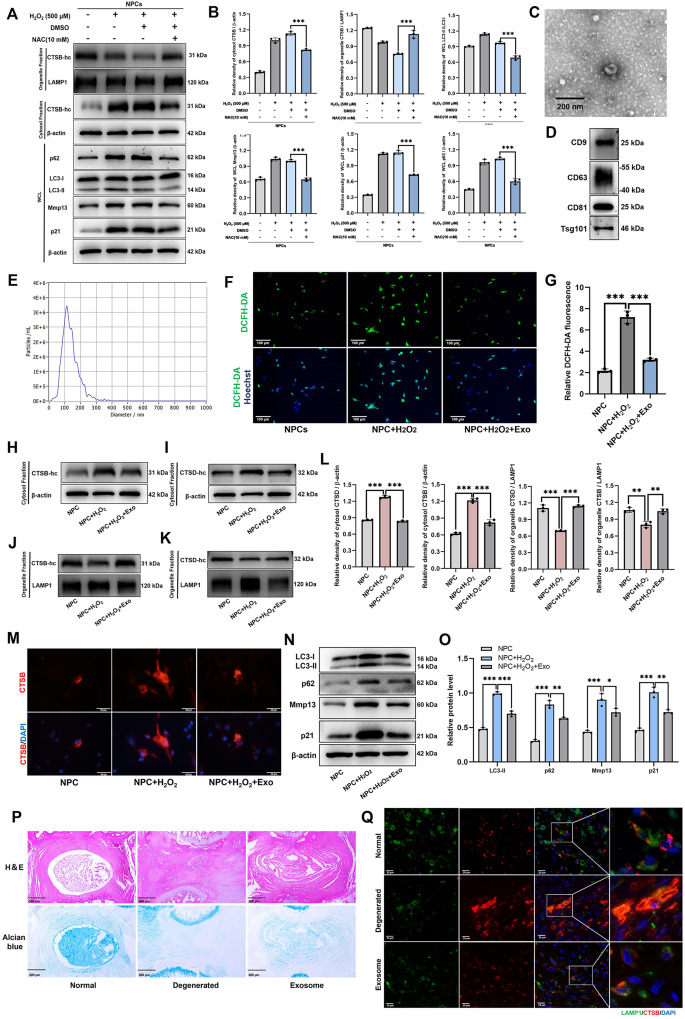
图2 MSC-Exos可抑制氧化应激引起的NPCs的LMP损伤。
图2A-B:通过Western blot评估H₂O₂刺激的NPCs中的细胞器CTSB、细胞质CTSB、WCL-p62、WCL-LC3、WCL-Mmp13和WCL-p21蛋白水平并进行定量分析。结果证实氧化应激是LMP损伤的诱因。
图2C:通过透射电子显微镜(TEM)观察MSC-Exos的形态。结果显示MSC-Exos呈均匀杯状结构。
图2D:通过Western blot检测包括CD9、CD63、CD81和Tsg101在内的MSC-Exos标志物。结果检测到MSC-Exos表达特征蛋白CD9、CD63、CD81、Tsg101。
图2E:通过纳米颗粒追踪分析(NTA)检测MSC-Exos的大小分布。结果显示MSC-Exos平均直径约123.3nm。
图2F-G:通过DCFH-DA检测细胞内活性氧水平,并对H2O2刺激的NPCs进行定量分析。结果显示,H₂O₂刺激的NPCs中ROS水平升高,MSC-Exos处理后显著降低。
图2H-L:通过Western blot检测H2O2刺激的神经前体细胞(NPCs)中胞质CTSB、胞质CTSD、细胞器CTSB和细胞器CTSD的蛋白水平,同时对MSC-Exos处理组和未处理组进行定量分析。结果显示,MSC-Exos处理后,H₂O₂刺激的NPCs中胞质CTSB、CTSD减少,细胞器中含量增加,提示LMP损伤减轻。
图2M:H₂O₂刺激的神经前体细胞(NPCs)处理组和未处理组中CTSB的免疫荧光染色。结果显示,MSC-Exos抑制H₂O₂诱导的CTSB在细胞内的扩散。
图2N-O:通过Western blot检测H₂O₂刺激的神经前体细胞(NPCs)处理组和未处理组中LC3、p62、Mmp13和p21的蛋白水平。结果显示,MSC-Exos改善H₂O₂诱导的自噬抑制(p62减少、LC3-II/LC3-I比值正常化),降低p21和Mmp13表达。
图2P:在大鼠尾椎间盘退变模型中进行H&E和阿尔新蓝染色。结果显示MSC-Exos注射显著延缓IVDD进展。
图2Q:对注射了或未注射间充质干细胞外泌体的实验鼠退化的尾部组织中CTSB和LAMP1的共免疫荧光染色。结果显示,MSC-Exos抑制大鼠退变椎间盘内CTSB的扩散。
这些结果表明,MSC-Exos可通过减轻氧化应激,抑制LMP损伤,从而缓解NPCs功能障碍和IVDD进展。
3. MSC-Exos通过在转录水平上激活Nrf2的表达来发挥抗氧化应激的作用
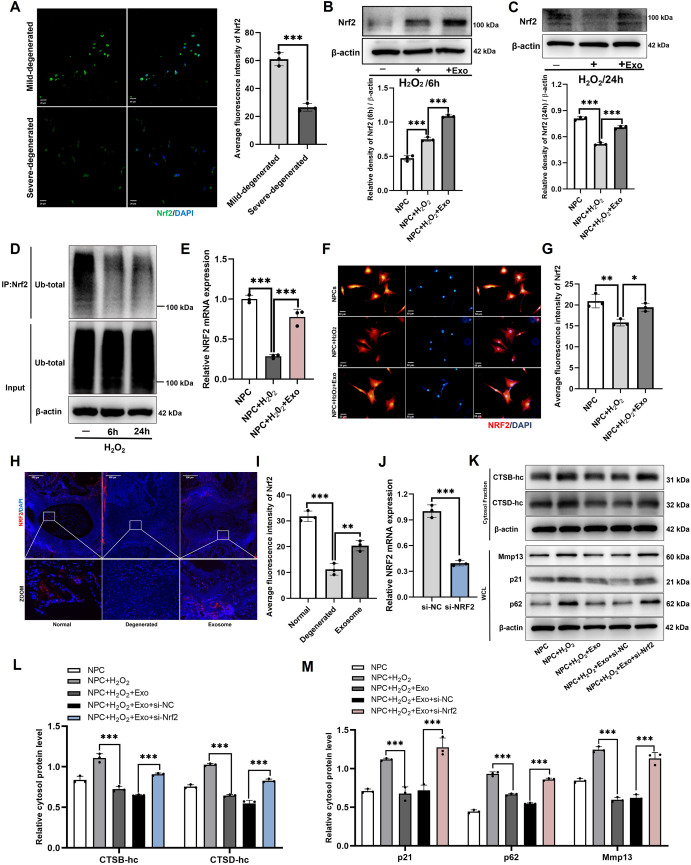
图3 MSC-Exos通过在转录水平上激活Nrf2表达来发挥抗氧化应激作用。
图3A:对人类轻度和重度退化髓核组织中的Nrf2进行免疫荧光染色。结果显示,重度退变髓核组织中Nrf2的平均荧光强度显著低于轻度退变组织。
图3B:通过Western blot评估H₂O₂刺激6小时后神经干细胞(NPCs)中Nrf2蛋白水平。结果显示,H₂O₂处理6h后NPCs中Nrf2蛋白上调,MSC-Exos处理后上调更显著。
图3C:通过Western blot评估H₂O₂刺激24小时后神经干细胞(NPCs)中Nrf2蛋白水平。结果显示,H₂O₂处理24h后Nrf2蛋白下调,MSC-Exos可逆转这一趋势。
图3D:通过共免疫沉淀(Co-IP)和Western blot评估在H₂O₂作用下培养6小时和24小时的神经前体细胞中Nrf2的泛素化水平。结果显示,H₂O₂处理6h后Nrf2泛素化水平降低,24h泛素化水平无显著变化。
图3E:通过逆转录定量聚合酶链反应(RT-qPCR)对H₂O₂作用下接受或未接受MSC-Exos处理的神经前体细胞中的Nrf2 mRNA表达进行定量分析。结果显示,H₂O₂抑制Nrf2 mRNA表达,MSC-Exos处理后显著恢复。
图3F-G:对H₂O₂作用下接受或未接受MSC-Exos处理的神经前体细胞中的Nrf2进行免疫荧光染色。结果显示,MSC-Exos促进H₂O₂刺激的NPCs中Nrf2核转位,核内荧光强度增加。
图3H-I:对在8周时接受或未接受MSC-Exos注射的啮齿动物退化尾盘中的Nrf2进行免疫荧光染色。结果显示,大鼠退变椎间盘经MSC-Exos处理后,Nrf2表达显著上调。
图3J:通过RT-qPCR对接受或未接受Nrf2敲低处理的神经前体细胞中的Nrf2 mRNA表达进行定量分析。结果证实si-Nrf2可有效敲低Nrf2 mRNA。
图3K-M:采用Western blot检测经MSC-Exos处理且Nrf2被敲低的H₂O₂刺激的神经前体细胞中胞质CTSB、胞质CTSD、WCL-Mmp13、WCL-p21和WCL-p62的蛋白水平。结果显示,敲低Nrf2逆转MSC-Exos对H₂O₂诱导的胞质CTSB、CTSD升高及p21、Mmp13、p62上调的抑制作用。
这些结果表明,MSC-Exos通过在转录水平激活Nrf2表达,增强其抗氧化应激功能,从而减轻LMP损伤和NPCs衰老。
4. MSC-Exos通过抑制YTHDF2介导的m6A降解来增强Nrf2的表达
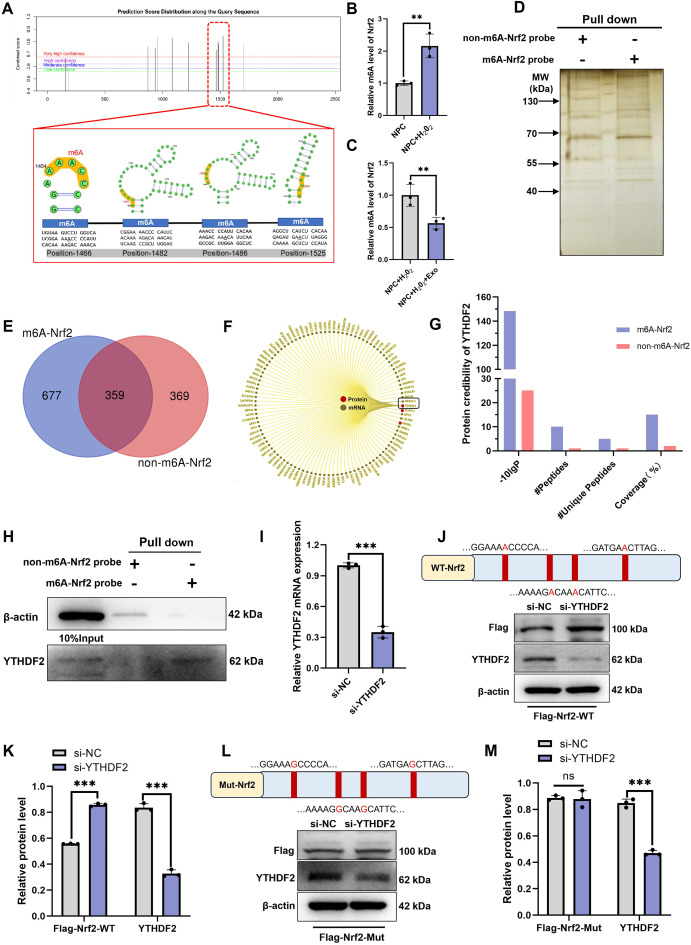
图4 MSC-Exos通过抑制m6A修饰来增强Nrf2的表达。
图4A:使用SRAMP网站预测Nrf2的m6A修饰位点。结果显示,Nrf2转录本在1466、1482、1486、1525位腺嘌呤存在高概率m6A修饰位点。
图4B-C:对H₂O₂刺激的神经前体细胞中Nrf2的m6A水平进行MeRIP-qPCR分析。结果显示,H₂O₂刺激后Nrf2的m6A修饰水平显著升高,MSC-Exos处理后降低。
图4D:使用m6A-Nrf2探针或非m6A-Nrf2探针进行不同蛋白质的RNA pulldown及银染。结果显示,m6A修饰的Nrf2探针与非修饰探针结合的蛋白存在差异。
图4E:使用m6A-Nrf2探针或非m6A-Nrf2探针对不同蛋白质进行RNA pulldown及LC-MS/MS分析。结果显示m6A可能促进mRNA降解。
图4F:通过RNA-蛋白质相互作用网站RNAInter预测YTHDF2对Nrf2 mRNA的识别情况。结果预测Nrf2与m6A读取蛋白YTHDF2存在相互作用。
图4G:使用LC-MS/MS对与m6A-Nrf2探针或非m6A-Nrf2探针相互作用的YTHDF2蛋白的蛋白质可信度进行分析。
图4H:使用RNA pulldown及Western blot评估与m6A-Nrf2探针或非m6A-Nrf2探针相互作用的YTHDF2蛋白质。结果证实,m6A修饰的Nrf2与YTHDF2的结合亲和力显著高于非修饰形式。
图4I:通过RT-qPCR对接受或未接受YTHDF2敲低的神经前体细胞中YTHDF2 mRNA表达量进行定量分析。结果证实si-YTHDF2可有效敲低YTHDF2 mRNA。
图4J-K:通过Western blot检测神经前体细胞中敲除或未敲除YTHDF2基因时Flag-Nrf2-WT和YTHDF2蛋白的水平。结果显示,敲低YTHDF2后,野生型Flag-Nrf2(Flag-Nrf2-WT)表达增加。
图4L-M:通过Western blot检测神经前体细胞中敲除或未敲除YTHDF2基因时Flag-Nrf2-Mut和YTHDF2蛋白的水平。结果显示,敲低YTHDF2对突变型Flag-Nrf2(m6A位点突变,Flag-Nrf2-Mut)表达无显著影响。
这些结果表明,MSC-Exos通过降低Nrf2的m6A修饰,减少YTHDF2介导的降解,从而增强Nrf2表达。
5. MSC-Exos通过上调去甲基化酶FTO来抑制Nrf2-m6A修饰
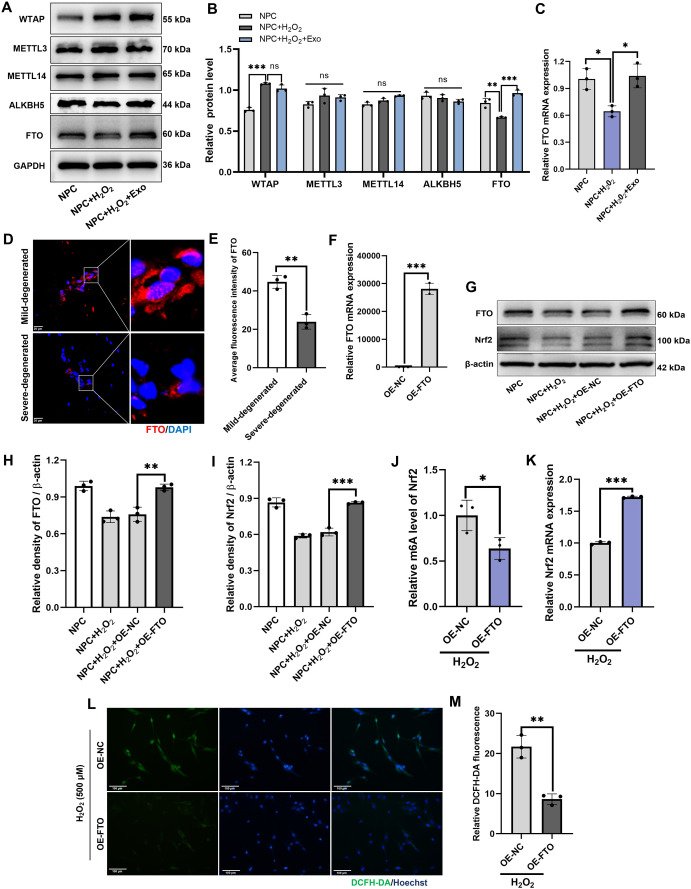
图5 MSC-Exos通过增强FTO的表达来下调Nrf2-m6A水平。
图5A-B:通过Western blot评估H₂O₂刺激的神经前体细胞中WTAP、METTL3、METTL14、ALKBH5和FTO蛋白的水平。结果显示,H₂O₂刺激后,甲基转移酶WTAP上调,去甲基化酶FTO下调,MSC-Exos可逆转FTO的下调(对WTAP无影响)。
图5C:通过RT-qPCR对H₂O₂刺激的神经前体细胞中或未受MSC-Exos处理的细胞中FTO mRNA的表达进行定量分析。结果显示,MSC-Exos显著上调H₂O₂刺激的NPCs中FTO mRNA表达。
图5D-E:在人类轻度和重度退变的髓核组织中对FTO进行免疫荧光染色。结果显示,重度退变髓核组织中FTO的平均荧光强度显著低于轻度退变组织。
图5F:通过RT-qPCR对受FTO过表达和未受FTO过表达的神经前体细胞中FTO mRNA的表达进行定量分析。结果证实过表达载体(OE-FTO)可有效上调FTO mRNA。
图5G-I:通过Western blot评估H₂O₂刺激的神经前体细胞中FTO和Nrf2蛋白的水平,并对它们的表达进行定量分析。结果显示,过表达FTO显著上调H₂O₂刺激的NPCs中Nrf2蛋白表达。
图5J:对H₂O₂刺激的神经前体细胞中FTO过表达与否的Nrf2的m6A水平进行MeRIP-qPCR分析。结果显示,过表达FTO显著降低H₂O₂刺激的NPCs中Nrf2的m6A修饰水平。
图5K:通过RT-qPCR对H₂O₂刺激的神经前体细胞中FTO过表达与否的FTO mRNA表达进行定量分析。结果显示,过表达FTO显著上调H₂O₂刺激的NPCs中Nrf2 mRNA表达。
图5L-M:通过DCFH-DA检测H₂O₂刺激的神经前体细胞中的细胞活性氧水平,并对有或无FTO过表达的细胞的平均荧光强度进行定量。结果显示,过表达FTO显著降低H₂O₂刺激的NPCs中ROS水平。
这些结果表明,MSC-Exos通过上调FTO(m6A去甲基化酶),降低Nrf2的m6A修饰,从而增强Nrf2的抗氧化应激功能。
6. MSC-Exos通过调节FTO-Nrf2-m6A-YTHDF2轴来减轻氧化应激引起的LMP损伤
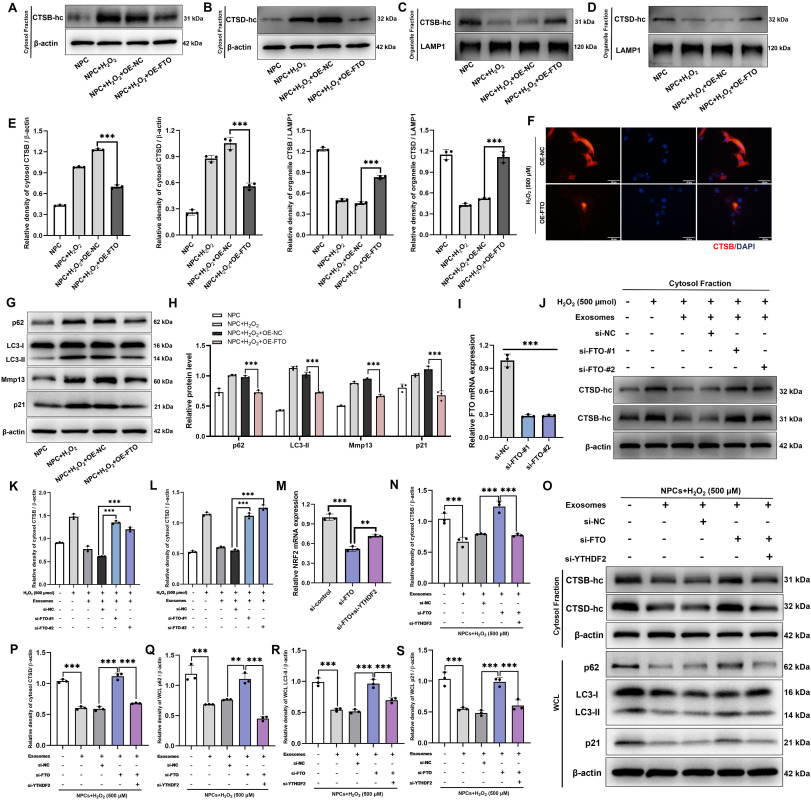
图6 MSC-Exos通过FTO-Nrf2-m6A-YTHDF2轴改善LMP损伤。
图6A-E:通过Western blot评估H₂O₂刺激的神经前体细胞中胞质CTSB、胞质CTSD、细胞器CTSB和细胞器CTSD的蛋白水平。结果表明LMP损伤减轻。
图6F:H₂O₂刺激的神经前体细胞中FTO过表达与否的CTSB免疫荧光染色。结果显示,过表达FTO显著抑制H₂O₂诱导的CTSB在细胞内的扩散。
图6G-H:通过Western blot评估H₂O₂刺激的神经前体细胞中p62、LC3、Mmp13和p21的蛋白水平。结果显示,过表达FTO改善H₂O₂诱导的自噬抑制(p62减少、LC3-II/LC3-I比值正常化),降低p21和Mmp13表达。
图6I:通过RT-qPCR对敲除FTO基因的神经前体细胞(NPCs)与未敲除FTO基因的NPCs中FTO mRNA的表达量进行定量分析。结果证实si-FTO可有效敲低FTO mRNA。
图6J-L:通过Western blot评估H₂O₂刺激的NPCs中经MSC-Exos处理且敲除FTO后的胞质CTSB和胞质CTSD蛋白水平。结果显示,敲低FTO逆转MSC-Exos对H₂O₂诱导的胞质CTSB、CTSD升高的抑制作用。
图6M:通过RT-qPCR对敲除FTO和YTHDF2的NPCs中Nrf2 mRNA的表达量进行定量分析。结果显示,敲低FTO降低Nrf2 mRNA,而同时敲低YTHDF2可逆转这一趋势。
图6N-S:采用Western blot检测经MSC-Exos处理且FTO和YTHDF2基因被敲低的H₂O₂刺激的神经前体细胞中胞质CTSB、胞质CTSD、全细胞p62、全细胞LC3和全细胞p21的蛋白水平。结果显示,敲低YTHDF2可逆转si-FTO对MSC-Exos抑制LMP损伤(胞质CTSB、CTSD降低)和NPCs衰老(p21、Mmp13、p62降低)的阻断作用。
这些结果表明,MSC-Exos通过调控FTO-Nrf2-m6A-YTHDF2轴,改善氧化应激诱导的LMP损伤和NPCs衰老。
7. P300的自动乙酰化作用会激活H3K27ac的修饰过程,从而促进FTO的转录
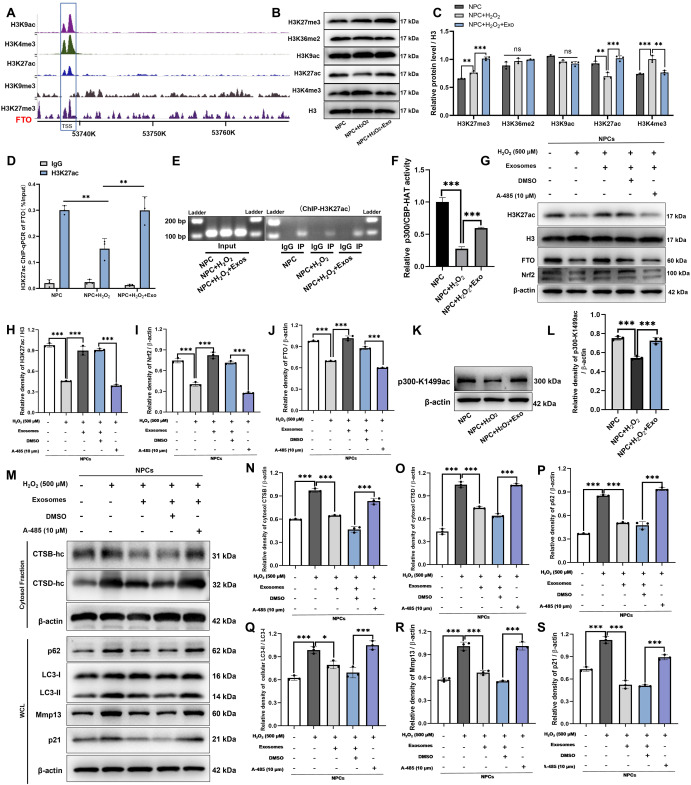
图7 p300自乙酰化激活H3K27ac修饰以促进FTO转录。
图7A:通过WashU表观基因组浏览器预测FTO启动子的组蛋白修饰情况。结果显示,FTO启动子区域存在H3K27ac等组蛋白修饰信号。
图7B-C:通过蛋白质印迹实验评估H₂O₂刺激的神经前体细胞中的H3K27me3、H3K36me2、H3K9ac、H3K27ac和H3K4me3蛋白质水平。结果显示,MSC-Exos处理后,H₂O₂刺激的NPCs中H3K27ac(激活转录)上调,H3K27me3(抑制转录)上调、H3K4me3(激活转录)下调(后两者与FTO表达趋势不符)。
图7D-E:FTO启动子中H3K27ac修饰的ChIP-qPCR和琼脂糖凝胶分析。结果显示,H₂O₂显著降低FTO启动子区H3K27ac的富集,MSC-Exos处理后恢复。
图7F:H₂O₂刺激的神经前体细胞中p300/CBP-HAT活性。结果显示,H₂O₂显著降低p300/CBP的组蛋白乙酰转移酶(HAT)活性,MSC-Exos处理后恢复。
图7G-J:通过Western blot检测在MSC-Exos和A-485处理下,H₂O₂刺激的神经前体细胞中H3K27ac、FTO和Nrf2蛋白的水平,并对它们的表达进行定量分析。结果显示,HAT抑制剂A-485可逆转MSC-Exos对H3K27ac、FTO和Nrf2的上调作用。
图7K-L:通过Western blot检测在有或无MSC-Exos处理的H₂O₂刺激的神经前体细胞中p300-1499ac的水平。结果显示,H₂O₂显著降低p300的K1499位自乙酰化水平(p300-K1499ac),MSC-Exos处理后恢复。
图7M-S:通过Western blot检测在有或无MSC-Exos处理和A-485处理的H₂O₂刺激的神经前体细胞中细胞质CTSB、细胞质CTSB、WCL-p62、WCL-LC3、WCL-Mmp13和WCL-p21蛋白的水平。结果显示,A-485逆转MSC-Exos对H₂O₂诱导的LMP损伤(胞质CTSB、CTSD降低)、自噬功能障碍(p62减少、LC3正常化)和衰老(p21、Mmp13降低)的改善作用。
这些结果表明,MSC-Exos通过促进p300自乙酰化激活其HAT活性,增强FTO启动子区H3K27ac修饰,从而促进FTO转录。
结论
本研究揭示,氧化应激诱导的LMP损伤通过破坏溶酶体-自噬功能,加剧NPCs衰老和IVDD进展,明确了LMP损伤在IVDD中的病理作用,并为MSC-Exos治疗IVDD提供了表观遗传调控靶点。若您也想在这类前沿领域快速推进研究,我们的团队可为您提供从外泌体提取(涵盖体液、组织、细胞上清等多来源)、鉴定(TEM、WB、NTA全流程),到外泌体载药、示踪、测序及细胞/动物功能实验的一站式技术服务,助力你的科研成果高效产出!






