研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
历时1个月10+发文 “外泌体”重磅发现!揭示PD神经炎症新机制,从实验到结论一气呵成!
1630 人阅读发布时间:2025-08-22 15:42
帕金森病(PD)的关键特征之一是神经炎症,表现为小胶质细胞激活及星形胶质细胞向神经毒性表型转化,二者共同加剧神经损伤。小胶质细胞如何驱动神经毒性反应性星形胶质细胞转化的机制尚不明确。外泌体作为细胞间信使,可能参与该过程,而E3泛素连接酶Peli1在小胶质细胞激活和外泌体释放中可能起调控作用。

湾湾今天分享的是一篇发表在【Pharmacological Research】(IF:10.5)上题为“Exosome-mediated microglia-astrocyte interactions drive neuroinflammation in Parkinson's disease with Peli1 as a potential therapeutic target”的研究,该研究探讨了小胶质细胞分泌的外泌体是否有助于神经毒性星形胶质细胞的转化。研究结果表明,通过使用CSF1R抑制剂PLX3397进行小胶质细胞的耗竭显著减轻了α-突触核蛋白预聚纤维(α-syn PFF)诱导的神经毒性反应性星形胶质细胞的形成。关键的是,仅用纯化的小胶质细胞外泌体就能在小鼠中驱动星形胶质细胞向神经毒性表型的极化。从机制上讲,PFF激活的小胶质细胞外泌体携带促炎因子和有毒的α-突触核蛋白寡聚体,这些货物成分通过诱导神经毒性星形胶质细胞表型的形成以及直接对神经元造成损伤,加剧了神经炎症,而在脑室内的注射过程中,这些外泌体被纹状体和黑质中的星形胶质细胞所摄取,从而引发了星形胶质细胞的同步增殖以及神经毒性表型的转变。此外,研究发现Peli1是一种在小胶质细胞中特异性富集的E3蛋白质连接酶,它是小胶质细胞激活和外泌体释放的关键调节因子,抑制Peli1可以减轻小胶质细胞的激活和神经毒性星形胶质细胞的转化。研究揭示了神经毒性星形胶质细胞与小胶质细胞之间的反馈回路,即神经毒性星形胶质细胞会提高小胶质细胞中的Peli1表达,从而进一步促进神经炎症。
研究成果
1.小胶质细胞耗竭缓解了α-突触核蛋白片段诱导的PD小鼠模型中的神经毒性反应性星形胶质细胞
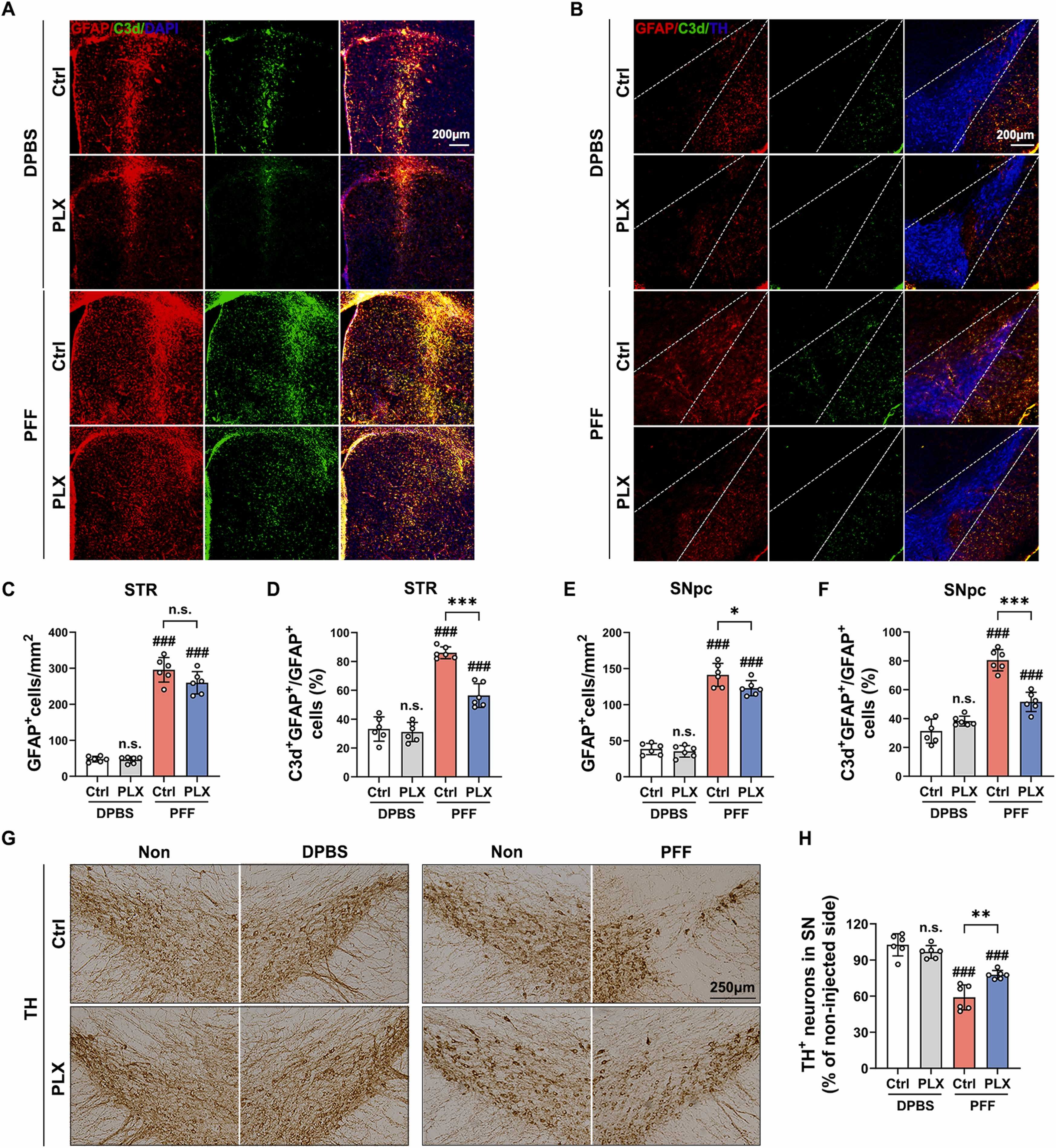
图1A:PFF注射后1个月,纹状体中GFAP(星形胶质细胞标志物)和C3d(神经毒性标志物)阳性细胞的代表性染色图像。结果显示PLX3397处理组(小胶质细胞耗竭)较对照组阳性细胞减少。
图1B:PFF注射后1个月,黑质致密部(SNpc)中GFAP和C3d阳性细胞的代表性染色图像。结果显示PLX3397处理组阳性细胞少于对照组。
图1C:纹状体中GFAP阳性细胞数量的定量分析。结果显示PFF+PLX组较PFF+Ctrl组显著减少。
图1D:纹状体中C3d阳性细胞占GFAP阳性细胞比例的定量分析。结果显示PFF+PLX组较PFF+Ctrl组显著降低。
图1E:SNpc中GFAP阳性细胞数量的定量分析。结果显示PFF+PLX组较PFF+Ctrl组显著减少。
图1F:SNpc中C3d阳性细胞占比的定量分析。结果显示PFF+PLX组较PFF+Ctrl组显著降低。
图1G:PFF注射后6个月,SNpc中TH(多巴胺能神经元标志物)阳性细胞的代表性染色图像。结果显示PLX3397处理组阳性细胞更多。
图1H:SNpc中TH阳性细胞数量的定量分析。结果显示PFF+PLX组较PFF+Ctrl组显著增加。
这些结果表明,小胶质细胞耗竭可减轻α-syn PFF诱导的神经毒性反应性星形胶质细胞生成,并保护多巴胺能神经元。
2. α-syn PFF激活的小胶质细胞外泌体在体内外诱导神经毒性反应性星形胶质细胞
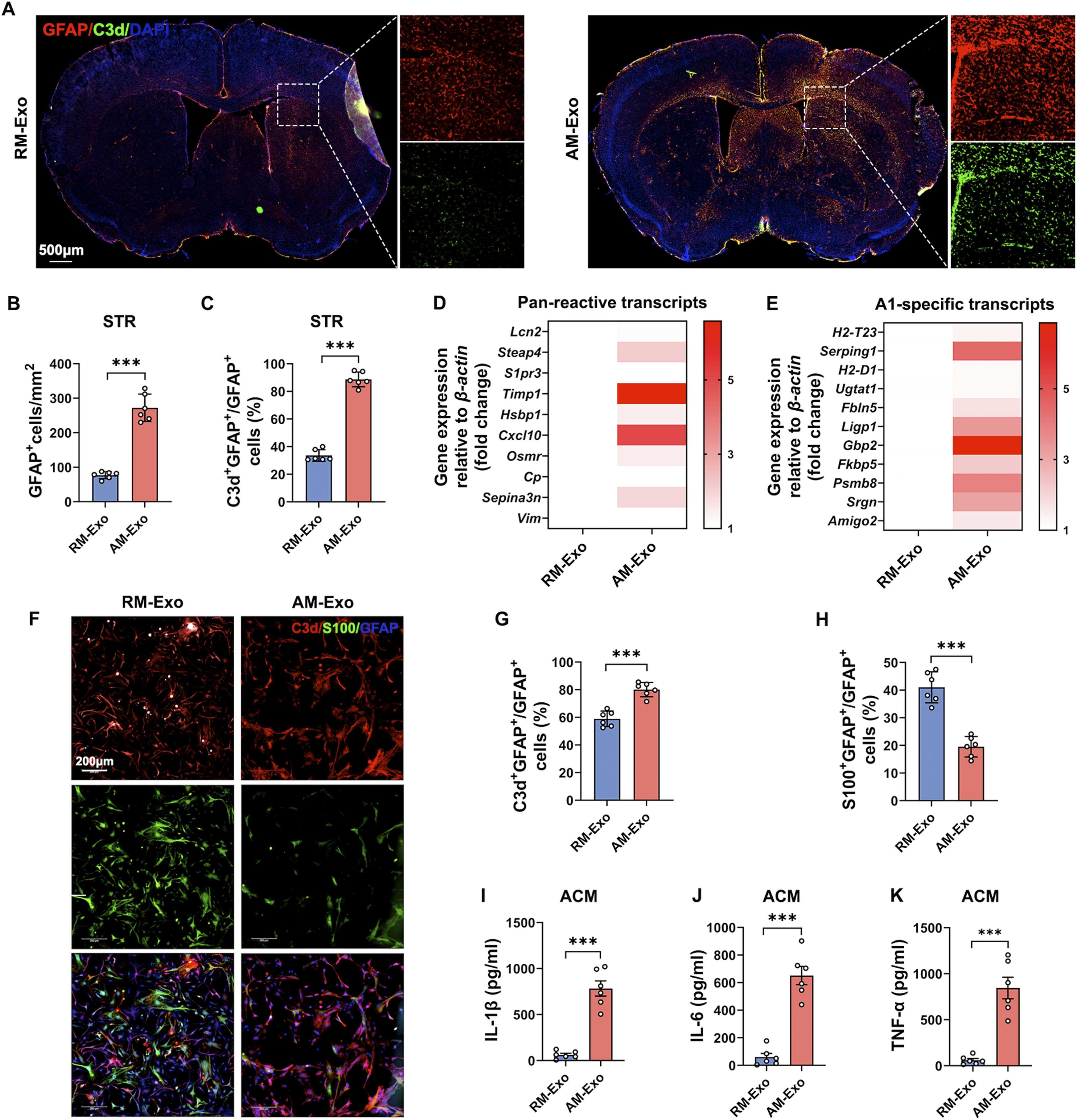
图2A:注射AM-Exo(激活的小胶质细胞外泌体)或RM-Exo(静息的小胶质细胞外泌体)后1个月,纹状体中C3d和GFAP阳性细胞的共聚焦图像。结果显示AM-Exo组阳性细胞更多。
图2B:纹状体中GFAP阳性细胞数量的定量分析。结果显示AM-Exo组较RM-Exo组显著增加。
图2C:纹状体中C3d阳性细胞占GFAP阳性细胞比例的定量分析。结果显示AM-Exo组较RM-Exo组显著升高。
图2D:原代星形胶质细胞经两种外泌体处理后,泛反应性星形胶质细胞标志物的转录组热图。结果显示AM-Exo组标志物表达显著上调。
图2E:原代星形胶质细胞经两种外泌体处理后,A1型星形胶质细胞标志物的转录组热图。结果显示AM-Exo组标志物表达显著上调。
图2F:原代星形胶质细胞经两种外泌体处理后,C3d和S100(神经保护性标志物)阳性细胞的代表性图像。结果显示AM-Exo组C3d阳性细胞更多、S100阳性细胞更少。
图2G:原代星形胶质细胞中C3d阳性细胞占比的定量分析。结果显示AM-Exo组较RM-Exo组显著升高。
图2H:原代星形胶质细胞中S100阳性细胞占比的定量分析。结果显示AM-Exo组较RM-Exo组显著降低。
图2I-K:星形胶质细胞培养基中IL-1β、TNF-α、IL-6水平的ELISA分析。结果显示AM-Exo组较RM-Exo组均显著升高。
这些结果表明,α-syn PFF激活的小胶质细胞外泌体可在体内外诱导星形胶质细胞向神经毒性表型转化。
3. AM-Exo携带高水平促炎因子mRNA和α-syn寡聚体,可独立诱导神经毒性星形胶质细胞表型
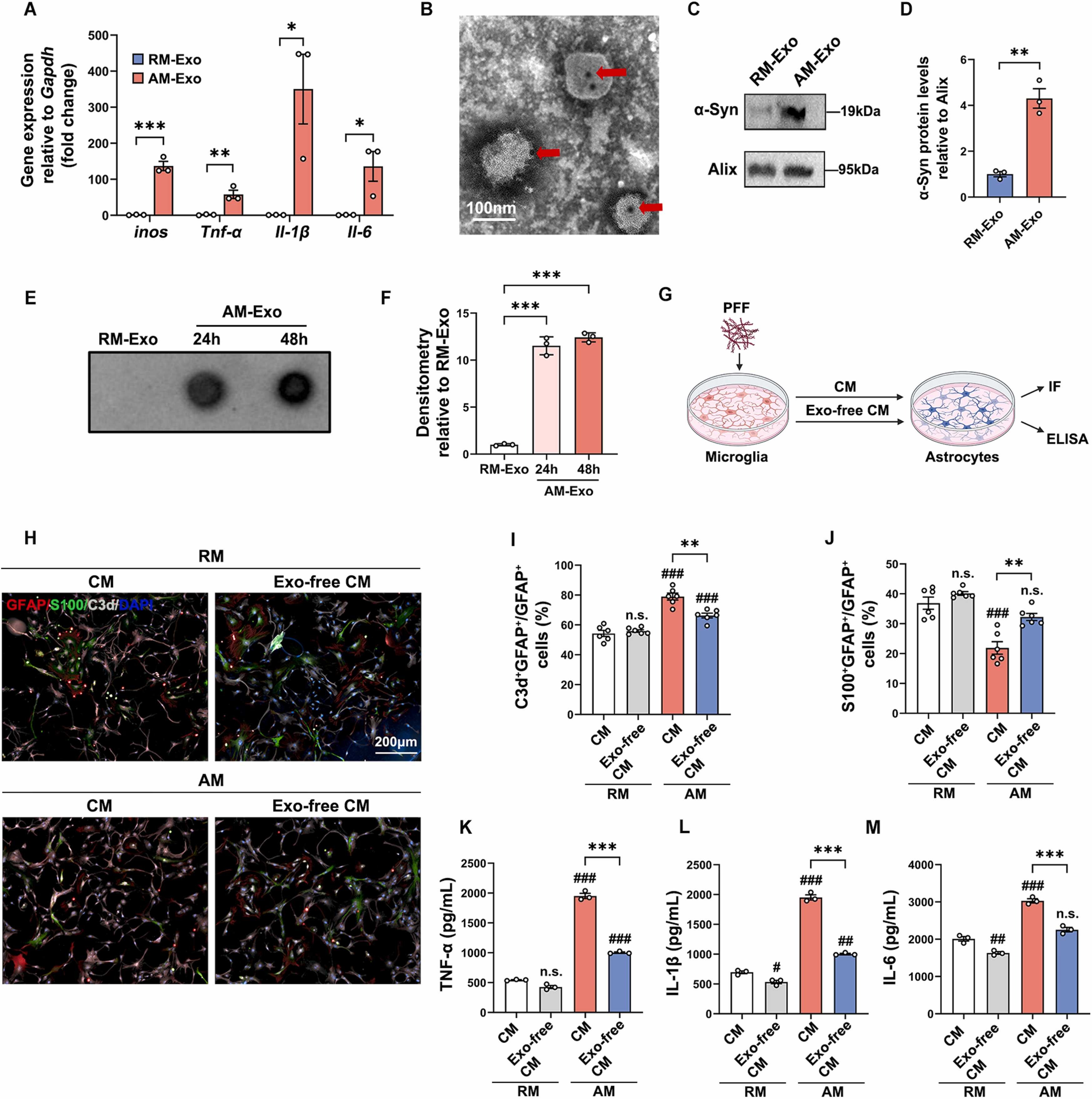
图3A:两种外泌体中促炎因子(iNOS、TNF-α、IL-1β、IL-6)mRNA相对含量的分析。结果显示AM-Exo组均显著高于RM-Exo组。
图3B:AM-Exo中α-syn的免疫电镜图像。结果可见外泌体内α-syn的免疫标记。
图3C:两种外泌体中总α-syn的Western blot分析。结果显示AM-Exo组α-syn水平更高。
图3D:总α-syn相对表达量的定量分析。结果显示AM-Exo组较RM-Exo组显著升高。
图3E:两种外泌体中α-syn纤维的Dot blot分析。结果显示AM-Exo组信号更强。
图3F:Dot blot信号的定量分析。结果显示AM-Exo组较RM-Exo组显著升高。
图3G:验证小胶质细胞外泌体功能的实验设计示意图,比较含外泌体和不含外泌体的条件培养基对星形胶质细胞的影响。
图3H:星形胶质细胞经不同条件培养基处理后,C3d和S100阳性细胞的代表性图像。结果显示AM-CM组C3d阳性细胞更多,去除外泌体后减少。
图3I:C3d阳性细胞占比的定量分析。结果显示AM-CM组较RM-CM组显著升高,AM-Exo-free组较AM-CM组显著降低。
图3J:S100阳性细胞占比的定量分析。结果显示AM-CM组较RM-CM组显著降低,AM-Exo-free组较AM-CM组显著升高。
图3K-M:星形胶质细胞培养基中IL-1β、TNF-α、IL-6水平的ELISA分析。结果显示AM-CM组较RM-CM组显著升高,AM-Exo-free组较AM-CM组显著降低。
这些结果表明,AM-Exo携带的促炎因子和α-syn寡聚体是诱导星形胶质细胞向神经毒性表型转化的关键介质。
4.抑制小胶质细胞中的Peli1蛋白能够减轻AM-Exo引发的神经毒性反应性星形胶质细胞的损伤
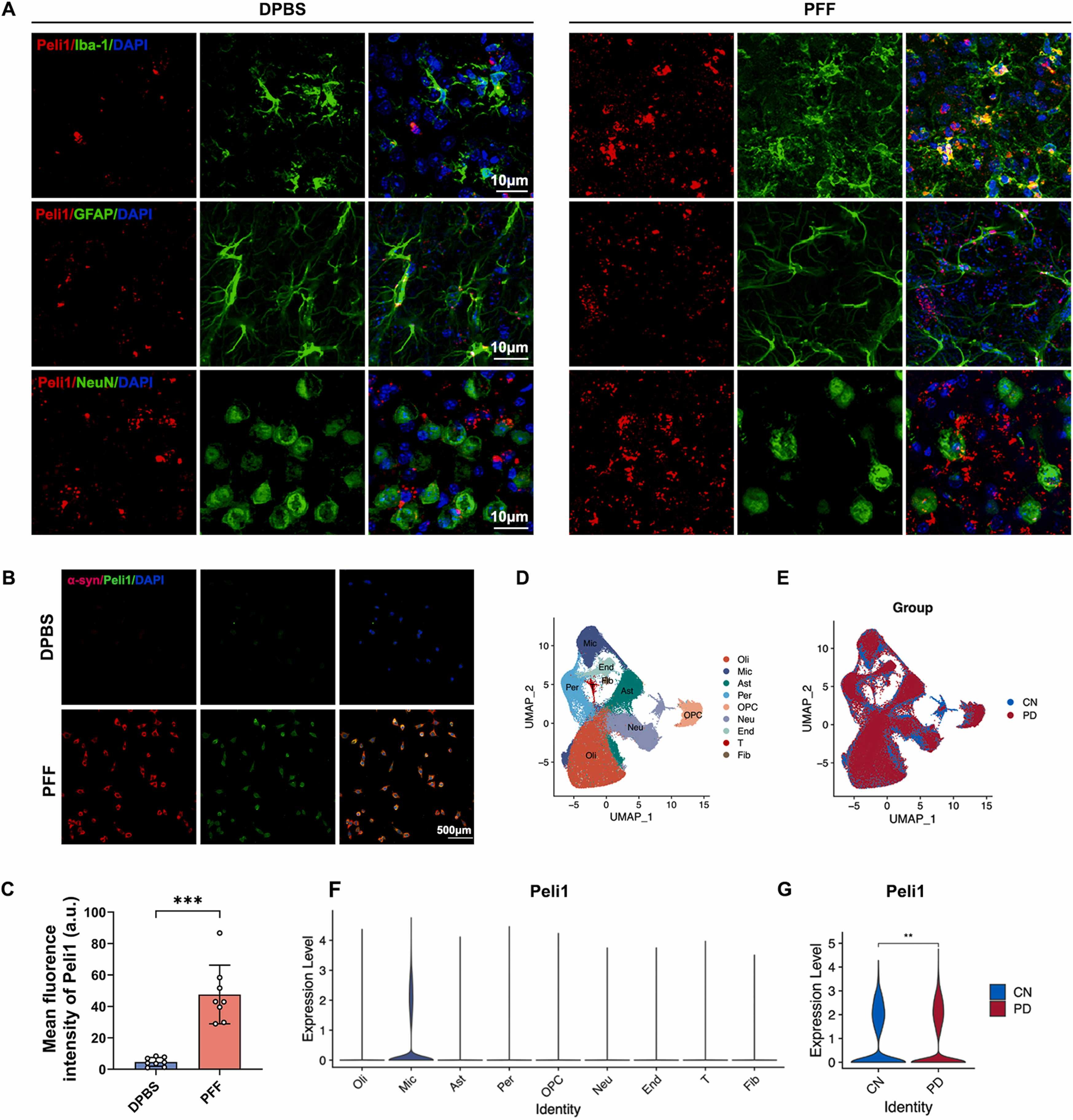
图4A:PFF注射后,纹状体中Peli1与Iba1(小胶质细胞)、GFAP(星形胶质细胞)、NeuN(神经元)的共定位图像。结果显示Peli1主要与Iba1共定位,且PFF组表达更高。
图4B:BV2细胞经PFF或DPBS处理后,Peli1的免疫荧光图像。结果显示PFF组荧光更强。
图4C:BV2细胞中Peli1表达水平的定量分析。结果显示PFF组较DPBS组显著升高。
图4D-E:人类黑质单细胞转录组数据的UMAP聚类图,显示不同细胞类型(星形胶质细胞、小胶质细胞等)的分布。
图4F:不同细胞类型中Peli1的表达模式小提琴图。结果显示小胶质细胞中Peli1表达较高。
图4G:PD患者与健康对照中小胶质细胞Peli1表达水平的小提琴图。结果显示PD患者显著高于健康对照。
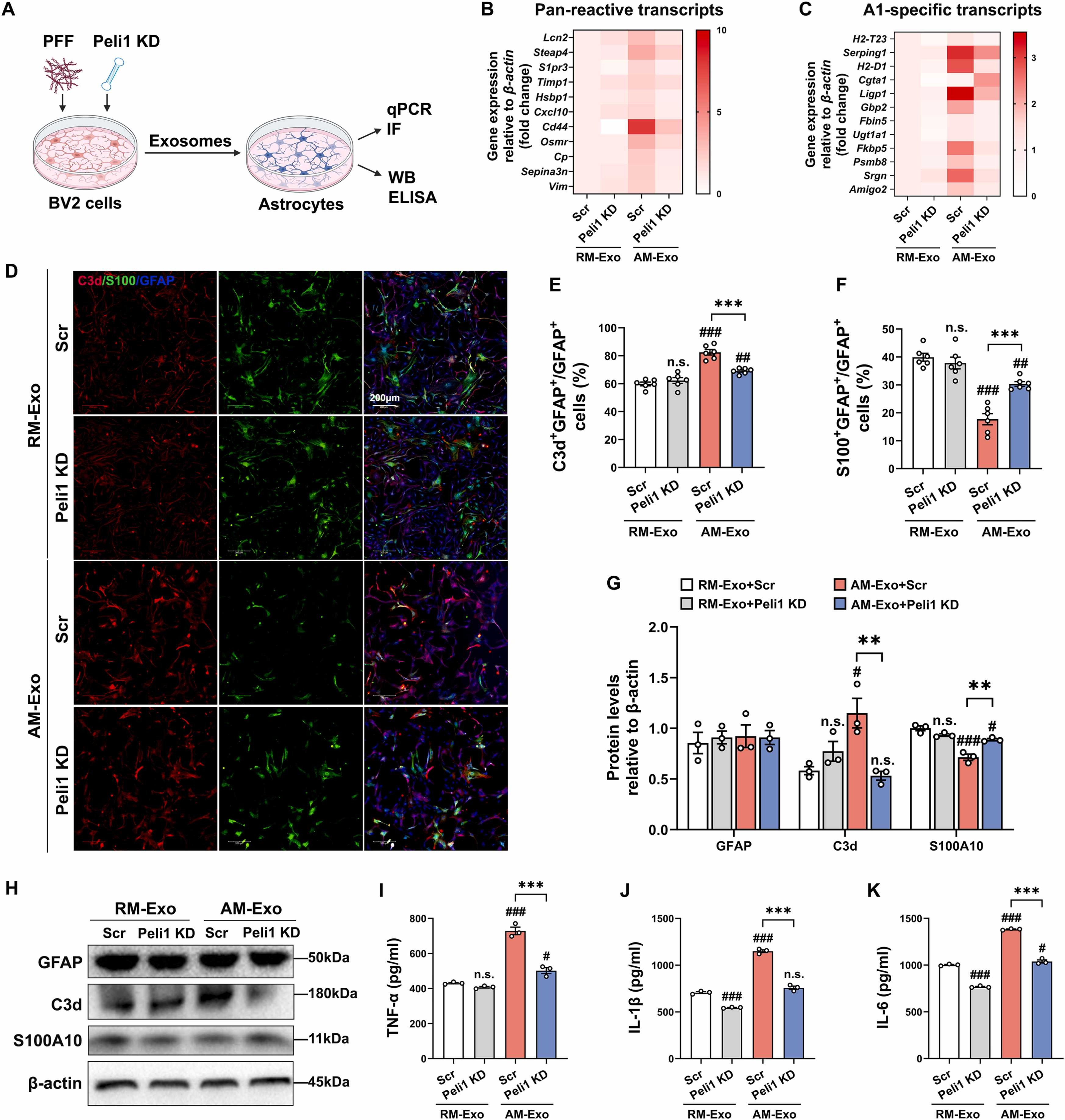
图5A:实验设计示意图,敲低小胶质细胞Peli1后,检测其外泌体对星形胶质细胞的影响。
图5B:星形胶质细胞经不同外泌体处理后,泛反应性标志物的转录组热图。结果显示AM-Exo+Scr组表达上调,AM-Exo+Peli1KD组下调。
图5C:星形胶质细胞经不同外泌体处理后,A1型标志物的转录组热图。结果显示变化趋势同泛反应性标志物。
图5D:星形胶质细胞经不同外泌体处理后,C3d和S100阳性细胞的代表性图像。结果显示AM-Exo+Peli1KD组C3d阳性细胞少于AM-Exo+Scr组。
图5E:C3d阳性细胞占比的定量分析。结果显示AM-Exo+Scr组较RM-Exo+Scr组显著升高,AM-Exo+Peli1KD组较AM-Exo+Scr组显著降低。
图5F:S100阳性细胞占比的定量分析。结果显示变化趋势与C3d相反。
图5G:星形胶质细胞中GFAP、C3d、S100蛋白相对表达量的定量分析。结果显示AM-Exo+Peli1 KD组C3d低于AM-Exo+Scr组,S100高于该组。
图5H:GFAP、C3d、S100的Western blot图像,显示各组蛋白表达差异。
图5I-K:星形胶质细胞培养基中IL-1β、TNF-α、IL-6水平的ELISA分析。结果显示AM-Exo+Peli1KD组较AM-Exo+Scr组显著降低。
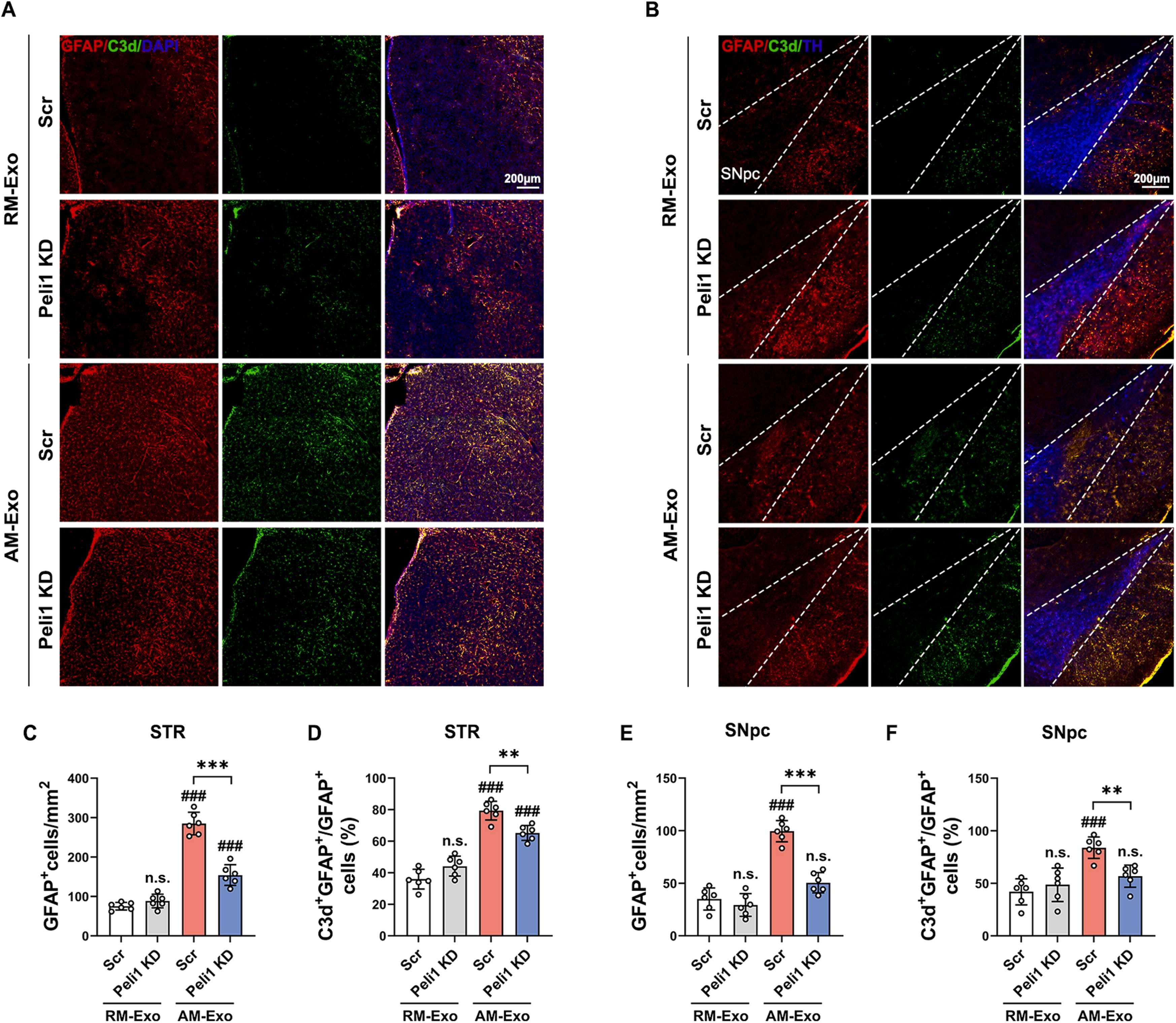
图6A:注射不同外泌体后1个月,纹状体中C3d和GFAP阳性细胞的代表性图像。结果显示AM-Exo+Peli1 KD组阳性细胞少于AM-Exo+Scr组。
图6B:注射不同外泌体后1个月,SNpc中C3d和GFAP阳性细胞的代表性图像。结果显示变化趋势同纹状体。
图6C:纹状体中GFAP阳性细胞数量的定量分析。结果显示AM-Exo+Scr组较RM-Exo+Scr组显著增加,AM-Exo+Peli1 KD组较AM-Exo+Scr组显著减少。
图6D:纹状体中C3d阳性细胞占比的定量分析。结果显示变化趋势同GFAP阳性细胞数量。
图6E:SNpc中GFAP阳性细胞数量的定量分析。结果显示变化趋势同纹状体。
图6F:SNpc中C3d阳性细胞占比的定量分析。结果显示变化趋势同GFAP阳性细胞数量。
以上这些结果表明,Peli1在α-synPFF激活的小胶质细胞中特异性高表达,且PD患者小胶质细胞中Peli1水平升高;敲低小胶质细胞Peli1可抑制其外泌体诱导的星形胶质细胞向神经毒性表型转化及神经毒性反应性星形胶质细胞生成。
5.神经毒性星形胶质细胞会促使小胶质细胞中Peli1基因的表达增加
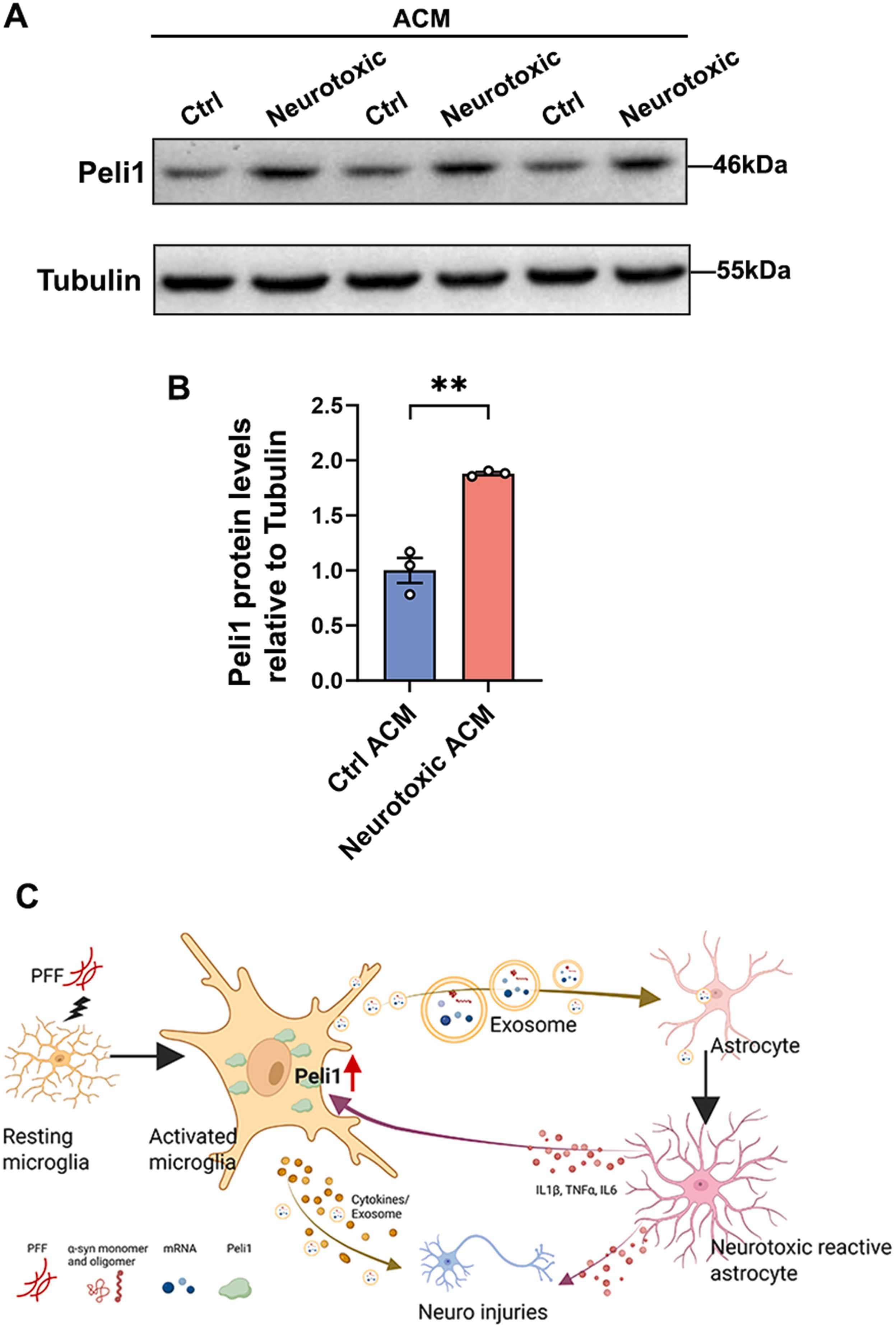
图7A:小胶质细胞经对照星形胶质细胞培养基(CtrlACM)或神经毒性星形胶质细胞培养基(Neurotoxic ACM)处理后,Peli1的Westernblot图像。结果显示后者Peli1水平更高。
图7B:Peli1相对表达量的定量分析。结果显示Neurotoxic ACM组较Ctrl ACM组显著升高。
图7C:神经炎症机制示意图,展示α-syn PFF激活小胶质细胞释放外泌体诱导星形胶质细胞毒性转化,及二者通过Peli1形成正反馈的过程。
这些结果表明,神经毒性星形胶质细胞可通过分泌的因子上调小胶质细胞中Peli1的表达,形成炎症正反馈。
结论
该研究证实,α-syn PFF激活的小胶质细胞释放的外泌体可通过携带促炎因子和α-syn寡聚体,诱导星形胶质细胞向神经毒性表型转化,进而加剧神经元损伤。Peli1作为小胶质细胞中特异性高表达的分子,调控小胶质细胞激活和外泌体释放,而神经毒性星形胶质细胞可上调小胶质细胞中Peli1的表达,形成炎症正反馈。这些发现揭示了外泌体介导的小胶质细胞-星形胶质细胞互作在PD神经炎症中的关键作用,提示Peli1可能是PD干预的潜在治疗靶点。






