研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF:12.6+,hUMSC-Exos打通“鼻脑通路”,多组学+体内外验证锁定HMGB1-TREM1-p38轴,这缺血性中风外泌体机制太硬核了!
1304 人阅读发布时间:2025-08-27 14:58
缺血性中风是全球致死与致残的主要原因,中枢神经系统驻留免疫细胞小胶质细胞的过度激活会加剧神经炎症及继发性脑损伤,严重影响患者预后。人脐带间充质干细胞来源外泌体(hUMSC-Exos)作为无细胞治疗策略,已展现出抗炎症、促神经修复的潜力,但其具体调控小胶质细胞功能以发挥神经保护作用的分子机制尚未明确。

今天分享的是发表在【J Nanobiotechnology】(IF:12.6)上题为“hUMSC-Exosomes suppress TREM1-p38 MAPK signaling via HMGB1-dependent mechanisms to reprogram microglial function and promote neuroprotection in ischemic stroke”的研究。、该研究旨在验证鼻内递送hUMSC-Exos在缺血性中风模型中的靶向性与治疗效果,解析其调控小胶质细胞极化的核心分子通路,明确外泌体cargo(如HMGB1)在“小胶质细胞重编程”中的作用。该研究揭示了hUMSC-Exos作为缺血性脑卒中多靶点治疗策略的潜力。这项突破性研究为阐明hUMSC-Exos恢复神经免疫平衡、促进神经保护作用的分子机制与细胞作用原理提供了关键性见解。
研究结果
1、hUMSC-Exos的鉴定、剂量优化及脑内细胞摄取
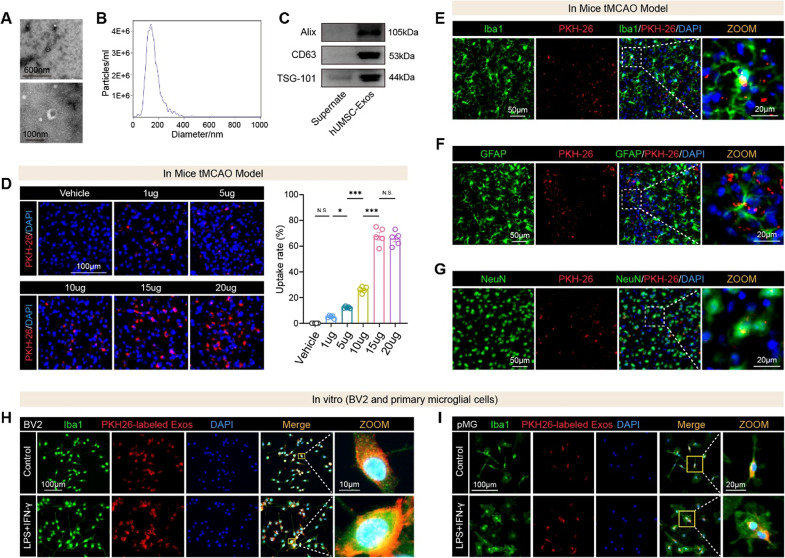
图1A:透射电镜(TEM)显示hUMSC-Exos呈典型杯状形态,符合外泌体特征。
图1B:纳米颗粒追踪分析(NTA)显示hUMSC-Exos粒径分布均一。
图1C:Western blot检测到外泌体标志性蛋白Alix、CD63、TSG101表达,证实外泌体成功分离。
图1D:鼻内递送PKH26标记的hUMSC-Exos后,脑缺血半暗带中Exos摄取量呈剂量依赖性增加,15μg为最优剂量。
图1E:免疫荧光显示PKH26⁺Exos与小胶质细胞标志物Iba1⁺共定位,且在缺血区富集。
图1F:PKH26⁺Exos与星形胶质细胞标志物GFAP⁺共定位,但比例低于小胶质细胞。
图1G:PKH26⁺Exos与神经元标志物NeuN⁺共定位,进一步证实Exos可靶向多种脑内细胞。
图1H:体外实验中,LPS+IFN-γ刺激的BV2小胶质细胞对PKH26⁺Exos的摄取量显著高于未刺激组。
图1I:原代小胶质细胞(pMG)在炎症刺激下,Exos摄取量同样显著增加。
这些结果表明,hUMSC-Exos可通过鼻内递送高效穿透血脑屏障,优先在缺血区富集并被小胶质细胞摄取,且炎症微环境可增强其靶向性。
2、hUMSC-Exos促进缺血性中风后神经功能恢复并减少神经元凋亡
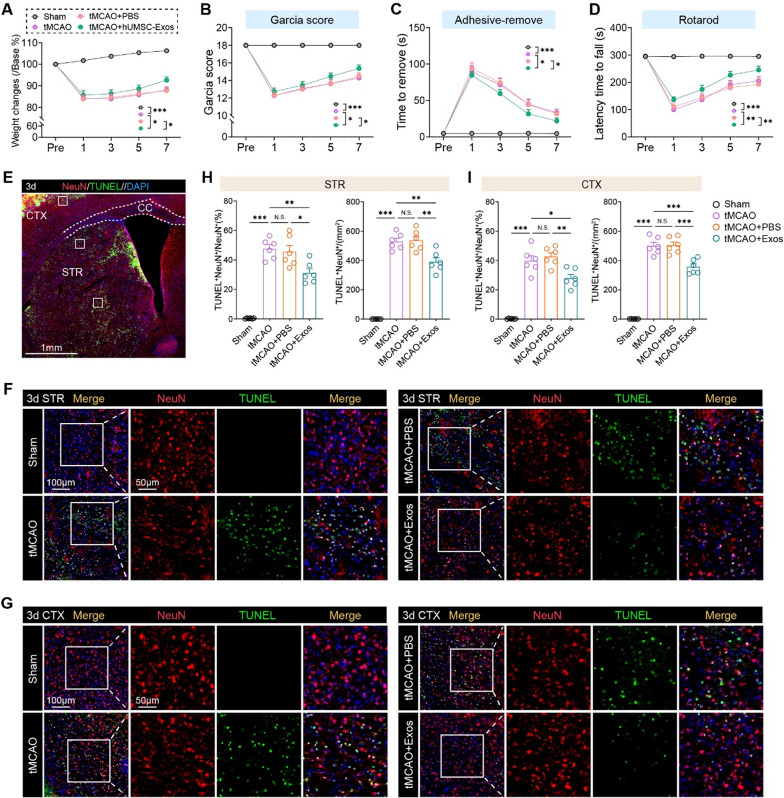
图2A:体重监测显示,hUMSC-Exos处理组小鼠术后体重恢复速度显著快于tMCAO+PBS组。
图2B:Garcia神经功能评分显示,Exos组术后各时间点评分均高于对照组,提示传感器运动功能改善。
图2C:黏附去除实验中,Exos组小鼠检测并移除前爪黏附胶带的潜伏期显著缩短,精细运动功能恢复更佳。
图2D:转棒实验显示,Exos组小鼠在旋转棒上的滞留时间显著延长,运动协调性和耐力提升。
图2E:脑切片示意图标注纹状体(STR)和皮层(CTX)分析区域,这两个区域是缺血性损伤的核心区域。
图2F-G:TUNEL(绿色,凋亡标记)与NeuN(红色,神经元标记)共染显示,Exos组纹状体(F)和皮层(G)中TUNEL⁺NeuN⁺凋亡神经元数量显著减少。
图2H-I:定量分析显示,Exos组纹状体(H)和皮层(I)凋亡神经元比例较对照组降低约50%。
这些结果表明,hUMSC-Exos可通过减少缺血区神经元凋亡,促进小鼠术后体重恢复及传感器运动功能改善,发挥直接神经保护作用。
3、hUMSC-Exos调控小胶质细胞极化并抑制中风后神经炎症
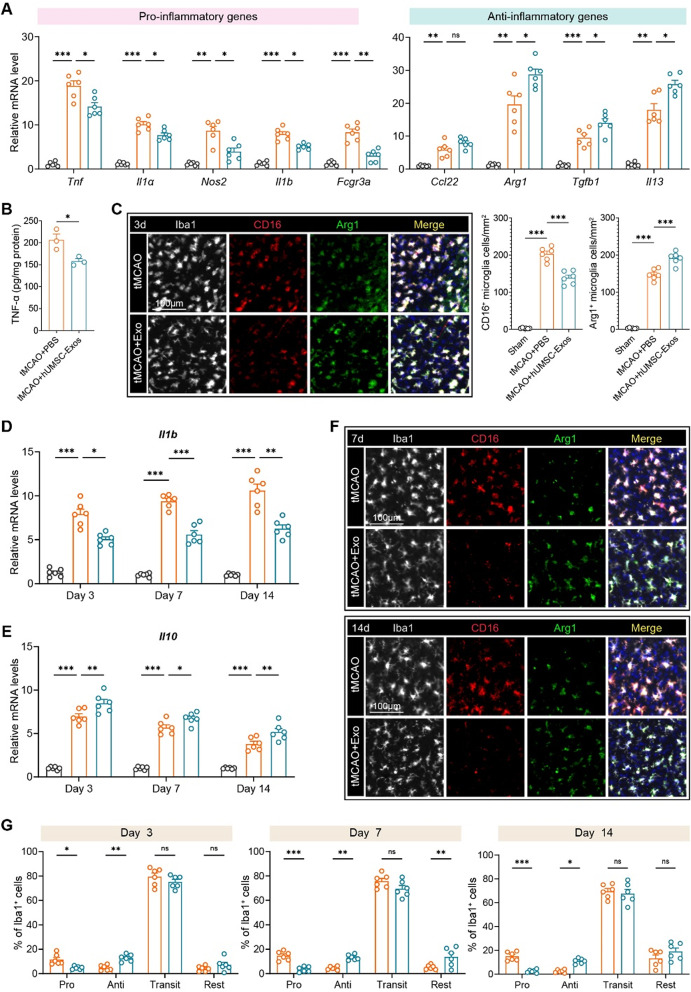
图3A:qRT-PCR显示,术后3天,Exos组缺血半暗带中促炎基因(Tnf、Il1a、Nos2、Il1b、Fcgr3a)mRNA表达显著下调,抗炎基因(Arg1、Tgfb1、Il13)显著上调。
图3B:ELISA检测显示,Exos组血浆TNF-α蛋白水平较对照组降低约40%,证实炎症反应受抑。
图3C:免疫荧光显示,Exos组Iba1⁺小胶质细胞中,促炎表型标志物CD16⁺细胞比例降低,抗炎表型标志物Arg1⁺细胞比例升高。
图3D:时间序列qRT-PCR显示,Exos组Il1b mRNA在术后3、7、14天持续下调,炎症抑制作用具有持续性。
图3E:Exos组Il10(抗炎细胞因子)mRNA在术后3、7、14天持续上调,进一步证实抗炎表型维持。
图3F:术后7、14天confocal成像显示,Exos组小胶质细胞CD16表达持续降低,Arg1表达持续升高。
图3G:小胶质细胞亚型量化显示,Exos组促炎亚型(CD16⁺Arg1⁻)比例降低,抗炎亚型(CD16⁻Arg1⁺)比例升高,过渡亚型(CD16⁺Arg1⁺)无显著变化。
这些结果表明,hUMSC-Exos可重编程小胶质细胞从促炎表型向抗炎表型转化,并持续抑制神经炎症,为长期神经修复奠定微环境基础。
4、hUMSC-Exos在体外抑制小胶质细胞炎症激活并促进抗炎表型
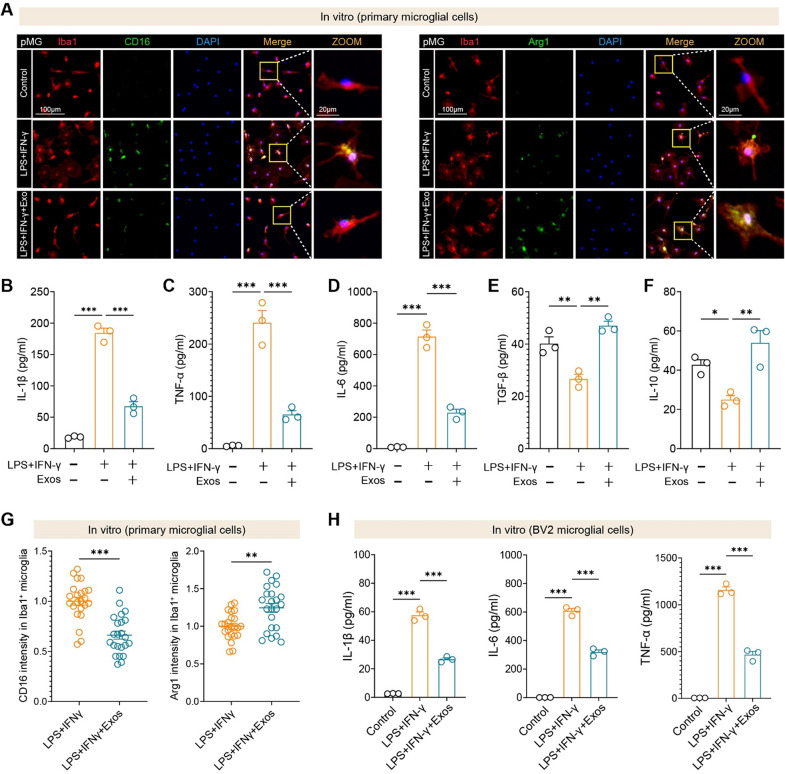
图4A:原代小胶质细胞(pMG)经LPS+IFN-γ刺激后,CD16(促炎)荧光强度升高,Arg1(抗炎)降低;Exos处理后,CD16强度显著降低,Arg1强度显著升高。
图4B:ELISA显示,Exos组原代小胶质细胞上清中IL-1β浓度较LPS+IFN-γ组降低约60%。
图4C:Exos组TNF-α浓度较对照组降低约50%。
图4D:Exos组IL-6浓度较对照组降低约45%。
图4E:Exos组抗炎细胞因子TGF-β浓度较对照组升高约2倍。
图4F:Exos组IL-10浓度较对照组升高约1.8倍。
图4G:定量分析显示,Exos处理使CD16荧光强度降低40%,Arg1升高60%。
图4H:BV2小胶质细胞实验中,Exos同样显著降低IL-1β、IL-6、TNF-α分泌,与原代细胞结果一致。
这些结果表明,hUMSC-Exos在体外可直接调控小胶质细胞极化,抑制促炎因子释放并促进抗炎因子产生,且该效应在原代细胞和永生化细胞中均稳定存在。
5、转录组测序揭示hUMSC-Exos对小胶质细胞转录组的调控
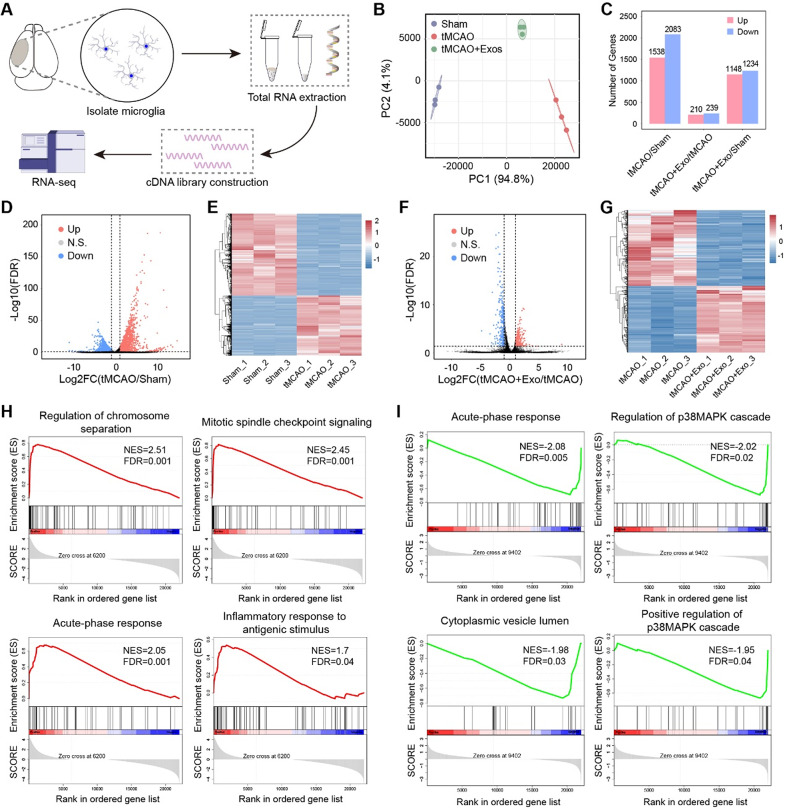
图5A:实验流程示意图:从小鼠脑内分离Sham、tMCAO、tMCAO+Exos三组小胶质细胞,提取RNA进行测序。
图5B:主成分分析(PCA)显示三组小胶质细胞转录组差异显著,组内重复一致性高。
图5C:差异表达基因(DEG)统计:tMCAO vs Sham 组有 1538 个基因上调、2083 个基因下调;tMCAO+Exos vs tMCAO组有210个基因上调、239个基因下调。
图5D:tMCAO vs Sham 组火山图显示,促炎基因(如Il1b、Tnf)显著上调,神经保护基因显著下调。
图5E:tMCAO vs Sham组热图显示,炎症和细胞增殖相关基因集群上调。
图5F:tMCAO+Exos vs tMCAO组火山图显示,Exos可逆转部分中风诱导的基因异常表达。
图5G:tMCAO+Exos vs tMCAO组热图显示,抗炎和免疫调节基因集群上调。
图5H:GSEA分析显示,tMCAO组中“急性期反应”“有丝分裂纺锤体检查点”等炎症和增殖通路显著富集。
图5I:GSEA分析显示,Exos组中“p38MAPK级联调控”“胞质囊泡腔”等促炎通路显著抑制。
这些结果表明,缺血性中风可诱导小胶质细胞发生炎症和增殖相关的转录重编程,而hUMSC-Exos可逆转该异常,抑制促炎通路并激活免疫调节通路。
6、GO富集分析解析hUMSC-Exos的转录调控方向
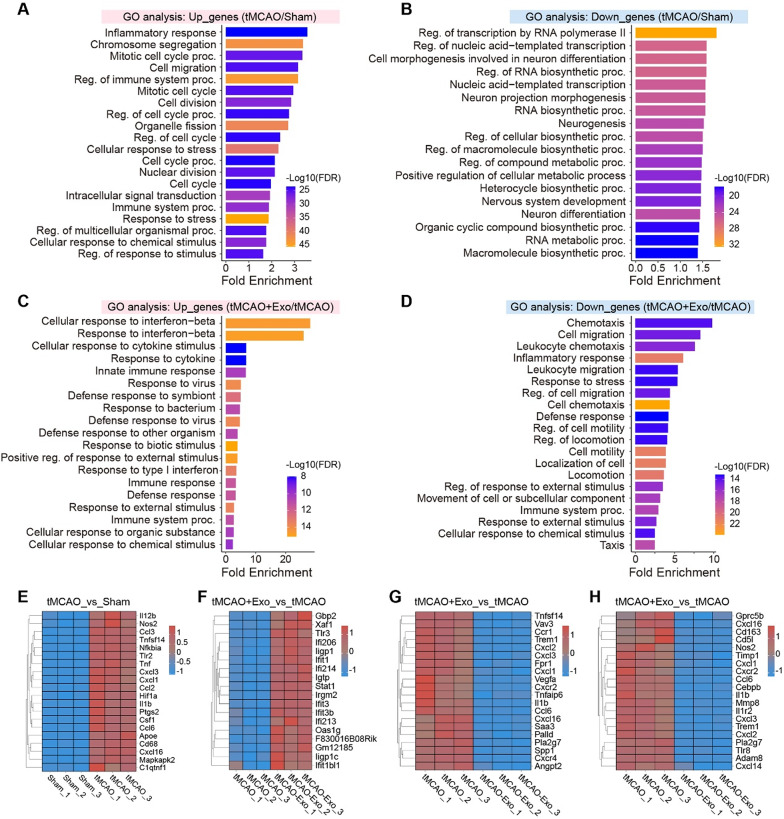
图6A:tMCAO vs Sham组上调基因GO富集显示,显著富集“炎症反应”“细胞分裂”“染色体分离”“细胞迁移”等通路,反映小胶质细胞过度激活。
图6B:tMCAO vs Sham组下调基因GO富集显示,“转录调控”“RNA生物合成”“神经发生”等通路显著抑制,提示神经修复功能受损。
图6C:tMCAO+Exos vs tMCAO组上调基因GO富集显示,“干扰素-β反应”“细胞因子刺激反应”“先天免疫反应”等免疫调节通路显著富集。
图6D:tMCAO+Exos vs tMCAO组下调基因GO富集显示,“趋化作用”“细胞迁移”“炎症反应”等通路显著抑制,与GSEA结果一致。
图6E:热图显示,tMCAO组促炎基因(Il1b、Tnf、Nos2)显著上调,Exos组可逆转该趋势。
图6F:热图显示,Exos组干扰素-β反应基因(Ifit3、Ifi206)显著上调,提示免疫调节激活。
图6G-H:热图显示,Exos组炎症反应和趋化相关基因(Cxcl2、Ccl6)显著下调。
这些结果表明,hUMSC-Exos通过“抑制炎症迁移+激活免疫调节”的双向调控,重塑小胶质细胞转录组,为其抗炎表型提供分子基础。
7、hUMSC-Exos通过抑制TREM1调控小胶质细胞炎症网络
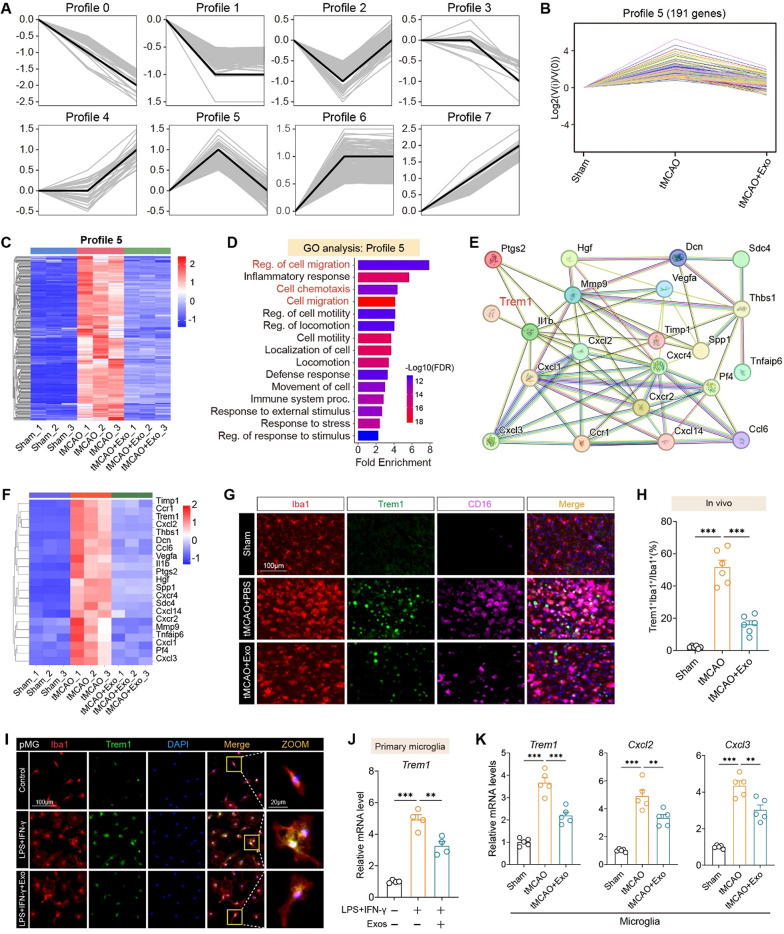
图7A:基因表达趋势分析将DEG分为8个谱图,其中Profile 5包含191个“低-高-低”趋势基因(Sham组低、tMCAO组高、Exos组低)。
图7B:Profile 5基因热图显示,Exos可显著逆转tMCAO诱导的基因上调。
图7C:Profile 5基因GO富集显示,显著富集“细胞迁移”“趋化作用”“炎症反应”等通路。
图7D:蛋白质相互作用(PPI)网络显示,TREM1是连接Cxcl2、Cxcl3、Ccl6等炎症因子的核心节点。
图7E:热图显示,Trem1、Cxcl2、Cxcl3、Mmp9等基因在tMCAO组上调,Exos组下调。
图7F:体内免疫荧光显示,tMCAO组Iba1⁺小胶质细胞中TREM1⁺比例显著升高,Exos组显著降低。
图7G:定量分析显示,Exos组TREM1⁺Iba1⁺细胞比例较tMCAO组降低约55%。
图7H:体外原代小胶质细胞中,LPS+IFN-γ刺激使TREM1表达升高,Exos处理后显著降低。
图7I:qRT-PCR显示,Exos组Trem1 mRNA表达较对照组降低约60%。
图7J-K:体内分离小胶质细胞qRT-PCR显示,Exos组Trem1、Cxcl2、Cxcl3 mRNA均显著下调。
这些结果表明,TREM1是hUMSC-Exos调控小胶质细胞炎症网络的关键靶点,Exos通过抑制TREM1表达,减少下游趋化因子和炎症因子释放。
8、hUMSC-Exos与TREM1抑制剂协同抑制小胶质细胞激活、迁移和增殖
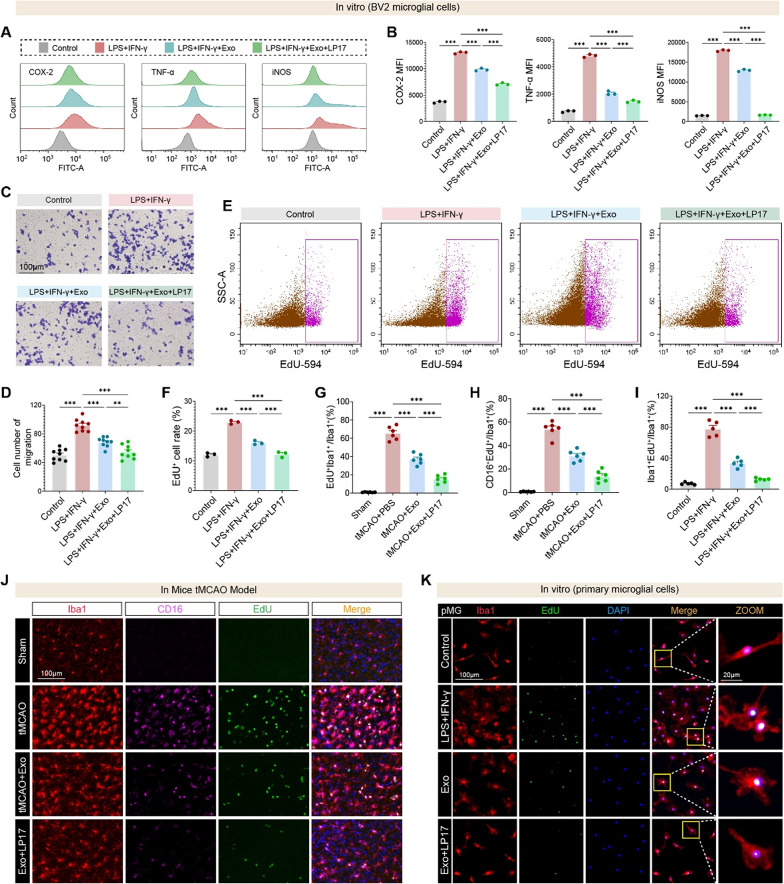
图8A-B:流式细胞术显示,LPS+IFN-γ刺激使BV2细胞COX-2、TNF-α、iNOS表达升高;Exos处理后显著降低,TREM1抑制剂LP17可进一步增强抑制效果。
图8C-D:Transwell实验显示,Exos组BV2细胞迁移数较对照组降低约40%,Exos+LP17组降低约65%。
图8E-F:EdU增殖实验显示,Exos组BV2细胞增殖率较对照组降低约35%,Exos+LP17组降低约55%。
图8G:体内EdU标记显示,tMCAO组Iba1⁺EdU⁺增殖小胶质细胞比例显著升高,Exos组降低,Exos+LP17组进一步降低。
图8H:Exos组CD16⁺EdU⁺促炎增殖小胶质细胞比例较tMCAO组降低约50%。
图8I-K:体外原代小胶质细胞EdU实验显示,Exos+LP17协同抑制炎症诱导的增殖,与体内结果一致。
这些结果表明,hUMSC-Exos与TREM1抑制剂具有协同作用,可更强效地抑制小胶质细胞的炎症激活、迁移和增殖,验证了TREM1作为关键靶点的功能。
9、hUMSC-Exos通过抑制NF-κB和p38 MAPK通路调控TREM1介导的炎症
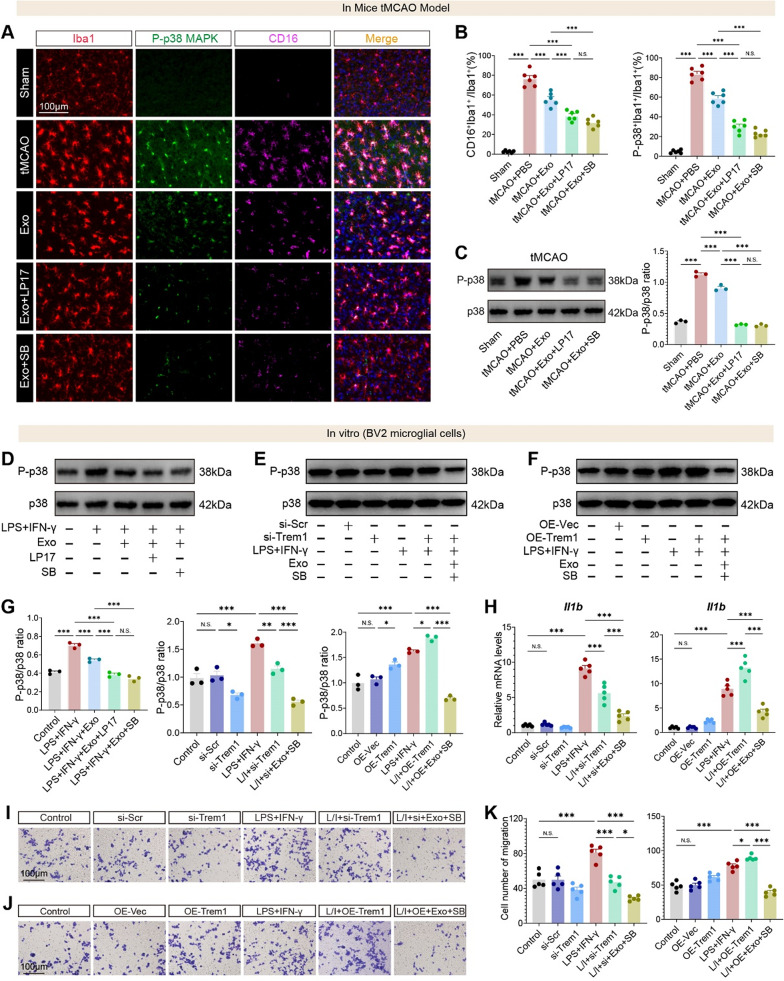
图9A-B:体内免疫荧光显示,tMCAO组CD16⁺Iba1⁺和p-p38⁺Iba1⁺细胞比例显著升高;Exos处理后降低,LP17(TREM1抑制剂)或SB203580(p38抑制剂)可进一步降低。
图9C:Western blot显示,tMCAO组p-p38/p38比值显著升高,Exos组降低,Exos+LP17/SB203580组进一步降低。
图9D:体外BV2细胞中,Exos显著降低LPS+IFN-γ诱导的p-p38表达,LP17/SB203580增强该效应。
图9E:TREM1敲低(si-TREM1)可显著降低p-p38表达,且Exos无额外抑制作用。
图9F:TREM1过表达(OE-TREM1)可逆转Exos对p-p38的抑制,SB203580可重新抑制。
图9G:定量分析显示,OE-TREM1组p-p38/p38比值较Exos组升高约2倍。
图9H:qRT-PCR显示,TREM1敲低或SB203580处理可协同Exos降低Il1b表达;OE-TREM1可恢复Il1b表达,SB203580可逆转。
图9I-K:Transwell实验显示,TREM1敲低或SB203580可协同Exos抑制迁移,OE-TREM1可恢复迁移,SB203580可逆转。
这些结果表明,TREM1位于p38 MAPK通路上游,hUMSC-Exos通过抑制TREM1,进而下调p38MAPK激活,最终抑制小胶质细胞炎症和迁移。
10、hUMSC-Exos通过TREM1-p38 MAPK轴促进长期神经功能恢复
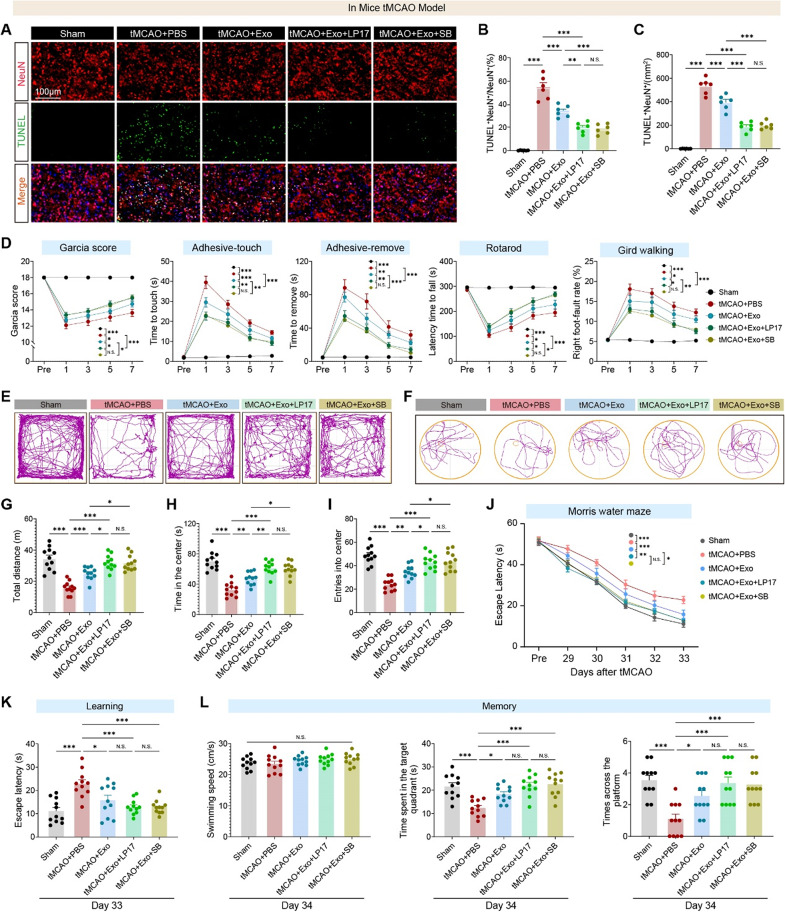
图10A-C:TUNEL/NeuN共染显示,Exos组凋亡神经元比例较tMCAO组降低约50%,Exos+LP17/SB203580组降低约70%。
图10D:行为学检测显示,Exos组Garcia评分、黏附去除速度、转棒潜伏期、网格行走正确率均显著改善,LP17/SB203580可进一步增强。
图10E-I:旷场实验显示,Exos组总移动距离、中心停留时间、中心进入次数均显著增加,焦虑样行为减轻,LP17/SB203580增强该效应。
图10J-K:Morris水迷宫训练期(29-33天)显示,Exos组逃避潜伏期显著缩短,LP17/SB203580组接近Sham组。
图10L:探针实验(34天)显示,Exos组在目标象限停留时间、平台穿越次数显著增加,LP17/SB203580组进一步提升。
这些结果表明,hUMSC-Exos通过抑制TREM1-p38MAPK轴,不仅减少急性期神经元凋亡,还能改善长期传感器运动功能、情绪状态和空间学习记忆,实现全面神经保护。
11、hUMSC-Exos通过HMGB1调控TREM1-p38 MAPK轴
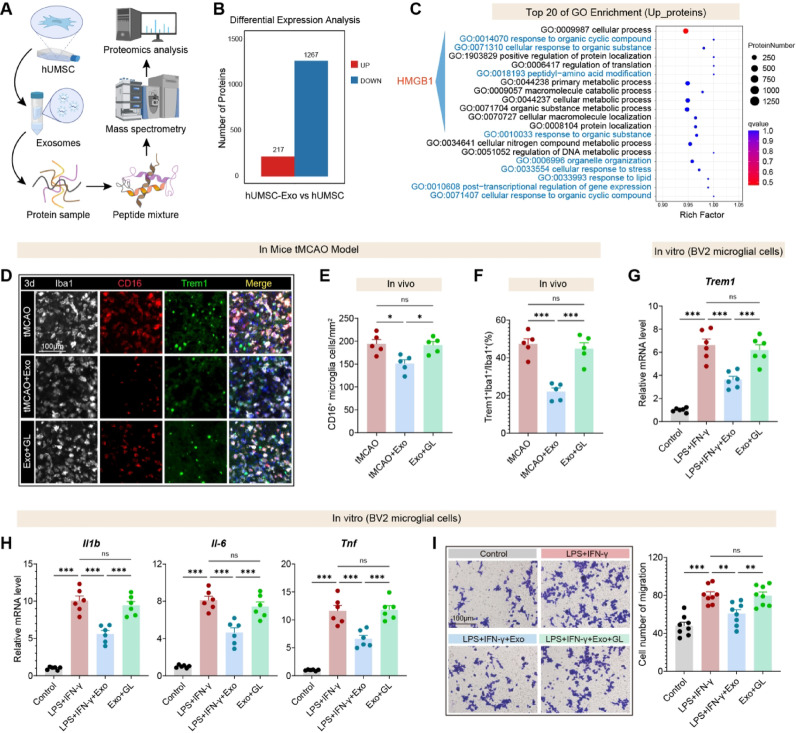
图11A:蛋白质组实验流程:对比hUMSC-Exos与hUMSC全细胞裂解液的差异蛋白。
图11B:差异蛋白统计:hUMSC-Exos中217个蛋白显著上调,1267个蛋白显著下调。
图11C:GO富集显示,上调蛋白显著富集“HMGB1相关炎症信号”“应激反应”等通路。
图11D-F:体内实验显示,Exos组CD16⁺和TREM1⁺小胶质细胞比例显著降低;HMGB1抑制剂甘草酸(GL)处理可部分逆转该抑制。
图11G:体外BV2细胞中,Exos显著降低Trem1 mRNA表达,GL处理可恢复约50%。
图11H:Exos显著降低Il1b、Il6、Tnf mRNA表达,GL处理可部分恢复。
图11I:Transwell实验显示,Exos显著抑制BV2细胞迁移,GL处理可部分恢复。
这些结果表明,HMGB1是hUMSC-Exos的关键cargo,通过调控下游TREM1-p38 MAPK轴,介导小胶质细胞重编程,且抑制HMGB1可部分逆转Exos的治疗效应。
结论
本研究揭示人脐带间充质干细胞来源外泌体(hUMSC-Exos)通过“HMGB1-TREM1-p38 MAPK”轴重编程小胶质细胞功能,在缺血性中风中发挥显著神经保护作用:鼻内递送的hUMSC-Exos可穿透血脑屏障并优先在缺血区富集,被小胶质细胞高效摄取;其携带的关键cargo HMGB1作为上游信号,抑制小胶质细胞中TREM1的表达,进而下调p38 MAPK通路激活,减少NF-κB介导的促炎因子释放并促进抗炎因子产生,实现小胶质细胞从促炎表型向抗炎表型的转化;该调控不仅能减少急性期缺血区神经元凋亡,还可改善小鼠长期传感器运动功能、情绪状态及空间学习记忆,且与TREM1或p38抑制剂联用具有协同增效作用。此外,hUMSC-Exos作为无细胞疗法,规避了干细胞移植的免疫排斥风险,鼻内递送方式安全无创,为缺血性中风及相关神经炎症疾病的临床治疗提供了新型候选策略,未来可通过优化Exos制备工艺与递送效率、探索HMGB1包装机制进一步增强其治疗效果。






