研载生物科技(上海)有限公司
9 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
8+论文揭示外泌体关键作用!嗜碱性粒细胞来源外泌体如何“搅乱”系统性红斑狼疮?
1107 人阅读发布时间:2025-08-29 16:00
系统性红斑狼疮(SLE)是一种复杂的自身免疫性疾病,B细胞的增殖与活化在其发病机制中起核心作用,而嗜碱性粒细胞在SLE中的作用已得到认可(如通过IgE免疫复合物介导活化、调控免疫细胞迁移等),但嗜碱性粒细胞来源外泌体对B细胞增殖与活化的影响尚未被深入探究。本研究旨在明确活化嗜碱性粒细胞来源外泌体对SLE患者B细胞的作用,并揭示其核心功能分子(尤其是miR-24550)的调控机制,为SLE的预防和治疗提供新的理论依据与潜在靶点。

湾湾今天分享的是一篇发表在【BMC Med】(IF:8.3)上题为“Basophil-derived exosomes exacerbate systemic lupus erythematosus by regulating B-cell proliferation via miR-24550”的研究,该研究分离和表征了处于静息和激活状态的人嗜碱性粒细胞的外泌体,然后将其与B细胞共培养,以评估它们对B细胞存活和增殖的影响。随后为了研究体内作用,利用Mcpt8flox/flox、CAGGCre-ERTM小鼠狼疮模型,分析其脾肾嗜碱性粒细胞来源的外泌体积累情况,评价其对免疫细胞增殖和浆细胞-浆母细胞平衡的影响。之后对嗜碱性粒细胞来源的外泌体进行转录组学分析,将SLE患者的外周血单核细胞(PBMC)移植到免疫缺陷小鼠体内,对狼疮小鼠进行人源化,评估干预miR-24550对B细胞的影响。结果证实嗜碱性粒细胞来源的外泌体miR-24550通过靶向KLF5促进B细胞增殖和活化,从而加剧SLE进展。
研究成果
1.嗜碱性粒细胞分泌的外泌体增强系统性红斑狼疮患者中B细胞的存活和增殖能力
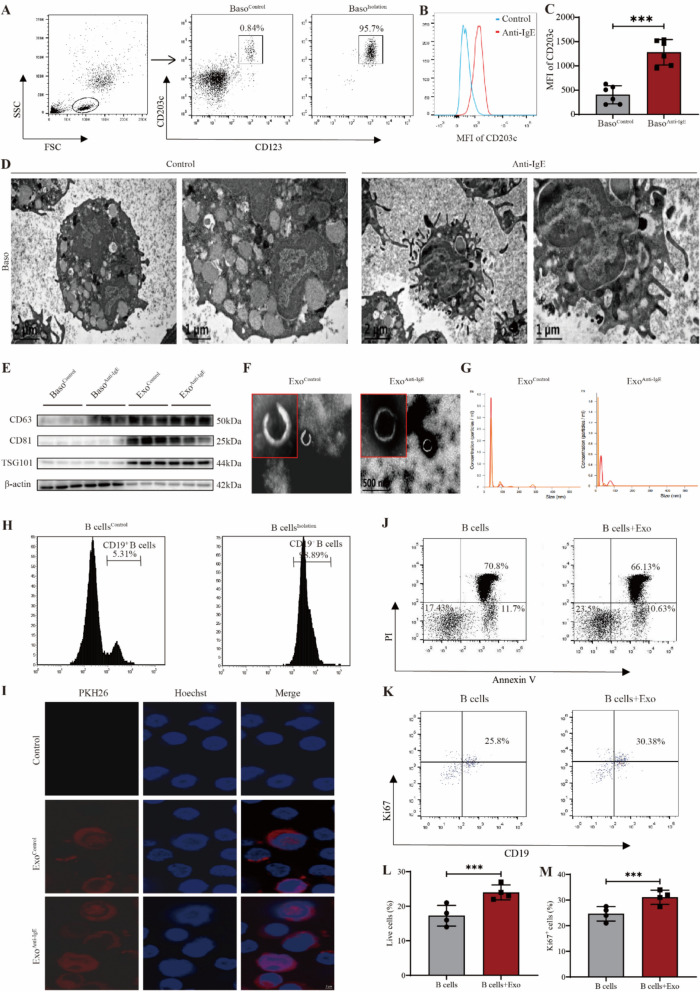
图1嗜碱性粒细胞来源外泌体促进SLE患者B细胞存活和增殖。
图1A:CD123⁺CD203c⁺嗜碱性粒细胞纯度的流式细胞术分析。结果显示分选后纯度提升。
图1B:人类嗜碱性粒细胞CD203c表达的流式细胞术分析。
图1C:人类嗜碱性粒细胞CD203c表达的统计分析。结果显示抗IgE成功诱导嗜碱性粒细胞活化。
图1D:人类嗜碱性粒细胞形态的透射电镜图。结果显示活化组(抗IgE刺激)细胞内囊泡样和颗粒样物质减少,伸出更多伪足,呈现典型的活跃状态;对照组细胞形态相对静止。
图1E:人类嗜碱性粒细胞及其外泌体的Western blot分析。结果显示外泌体提取成功。
图1F:人类嗜碱性粒细胞来源外泌体形态的透射电镜图。结果显示两组外泌体均呈圆形,具有清晰的外膜边界和典型“碟状”结构,直径约100nm,符合外泌体形态特征。
图1G:嗜碱性粒细胞来源外泌体大小的纳米颗粒追踪分析(NTA)。结果显示两组外泌体粒径峰值为30-50 nm,整体分布范围80-100 nm,平均粒径53.1±11.8 nm,平均浓度1.59×10⁹±1.93×10⁸颗粒/mL。
图1H:CD19⁺B细胞纯度的流式细胞术分析。结果显示SLE患者B细胞分选后纯度满足后续实验需求。
图1I:嗜碱性粒细胞来源外泌体与B细胞共定位的免疫荧光分析。结果显示PKH26(红色)标记的外泌体与Hoechst标记的CD19⁺B细胞共定位,且外泌体主要分布于B细胞细胞质,证明B细胞可摄取嗜碱性粒细胞来源外泌体。
图1J:B细胞存活的流式细胞术分析。结果显示评估外泌体促进B细胞存活。
图1K:B细胞增殖的流式细胞术分析。结果显示外泌体促进B细胞增殖。
图1L:B细胞存活的统计分析。结果显示添加活化嗜碱性粒细胞外泌体的SLE患者B细胞存活率显著高于无外泌体对照组。
图1M:B细胞增殖的统计分析。结果显示添加活化嗜碱性粒细胞外泌体的SLE患者B细胞增殖能力显著增强。
这些结果表明,活化嗜碱性粒细胞来源外泌体可被SLE患者B细胞有效摄取,并显著促进B细胞的存活与增殖,提示其在SLEB细胞异常活化中起关键作用。
2.嗜碱性粒细胞来源外泌体在Pristane-Mcpt8flox/flox,CAGGCre−ERTM狼疮小鼠中迁移至脾脏和肾脏
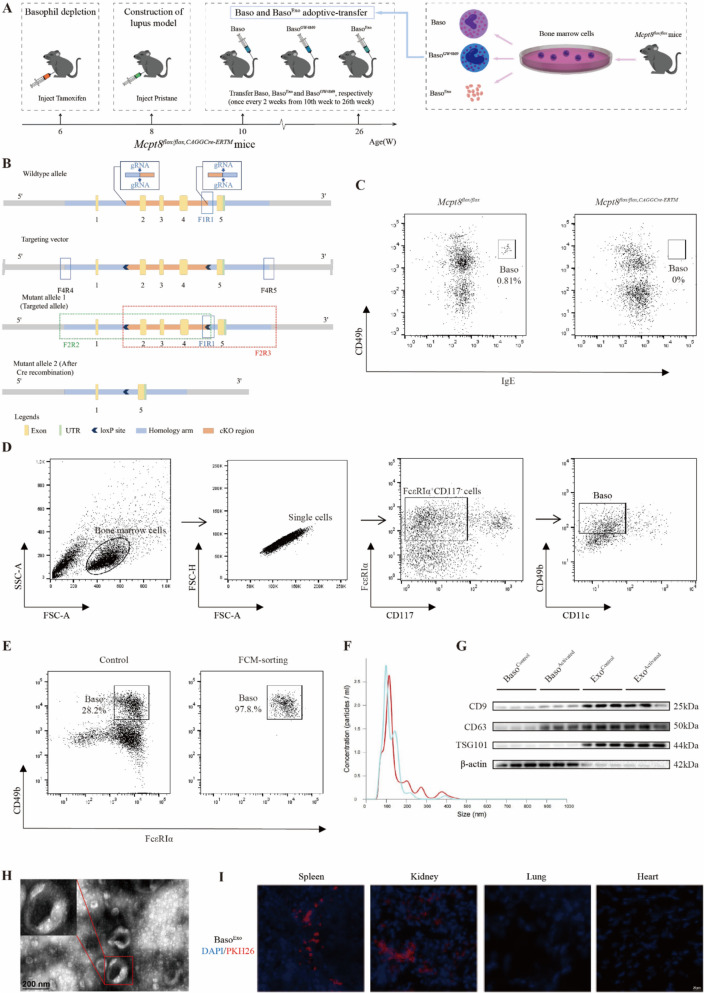
图2嗜碱性粒细胞来源外泌体在Pristane-Mcpt8flox/flox,CAGGCre−ERTM狼疮小鼠中迁移至脾脏和肾脏
图2A:Mcpt8flox/flox,CAGGCre−ERTM小鼠中嗜碱性粒细胞和外泌体转移的时间线。
图2B:Mcpt8flox/flox,CAGGCre−ERTM小鼠构建的示意图。结果显示成功实现了嗜碱性粒细胞特异性敲除。
图2C:Mcpt8flox/flox,CAGGCre−ERTM小鼠外周血中嗜碱性粒细胞比例的流式细胞术分析。结果证实嗜碱性粒细胞缺失模型构建成功。
图2D:小鼠骨髓诱导嗜碱性粒细胞分选的流式门控策略。结果显示成功实现特异性筛选骨髓来源嗜碱性粒细胞。
图2E:分选后小鼠嗜碱性粒细胞纯度的流式细胞术分析。结果显示分选后嗜碱性粒细胞纯度达97.8%,满足后续外泌体提取需求。
图2F:小鼠嗜碱性粒细胞外泌体大小的NTA分析。结果显示外泌体粒径峰值为100 nm,整体分布范围200-400 nm,符合小鼠来源外泌体的粒径特征。
图2G:小鼠嗜碱性粒细胞及其外泌体的Western blot分析。结果显示外泌体中CD9、CD63、TSG101(外泌体标志物)表达水平高于嗜碱性粒细胞,无β-actin表达,证实小鼠嗜碱性粒细胞外泌体提取成功。
图2H:小鼠嗜碱性粒细胞外泌体形态的透射电镜图。结果显示外泌体呈圆形,具有清晰外膜边界和“碟状”结构,与人类嗜碱性粒细胞外泌体形态一致。
图2I:Pristane-Mcpt8flox/flox,CAGGCre−ERTM狼疮小鼠中嗜碱性粒细胞来源外泌体分布的免疫荧光分析。结果显示外泌体在体内主要靶向免疫器官(脾脏)和SLE易损器官(肾脏)。
这些结果表明,成功构建了嗜碱性粒细胞缺失的Pristane诱导狼疮小鼠模型及高纯度小鼠嗜碱性粒细胞来源外泌体,且该外泌体在体内具有器官靶向性,主要定位于脾脏和肾脏,为后续探究其在狼疮病理中的作用奠定基础。
3.嗜碱性粒细胞来源外泌体加重Pristane-Mcpt8flox/flox,CAGGCre−ERTM狼疮小鼠疾病进展
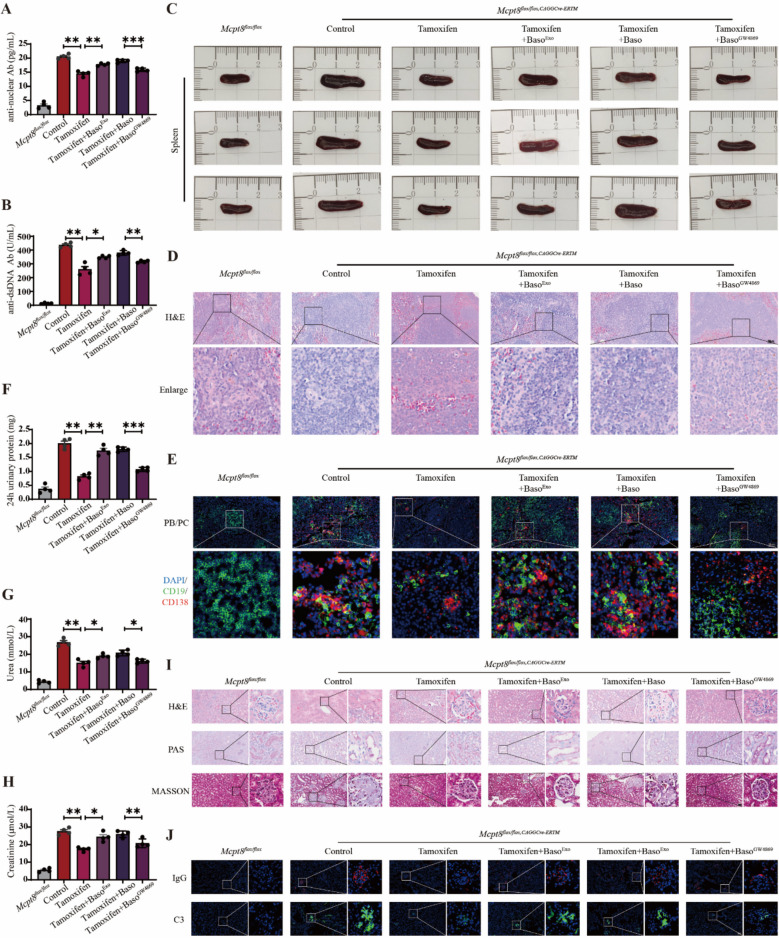
图3嗜碱性粒细胞来源外泌体加重Pristane-Mcpt8flox/flox,CAGGCre−ERTM狼疮小鼠疾病进展。
图3A:小鼠血浆抗核抗体(ANA)的统计分析。结果提示外泌体促进自身抗体产生。
图3B:小鼠血浆抗双链DNA抗体(抗dsDNA)的统计分析。结果进一步证实外泌体推动致病性自身抗体生成。
图3C:小鼠脾脏形态分析。结果表明外泌体促进脾脏增生。
图3D:小鼠脾脏病理的HE染色分析。结果表明外泌体加剧脾脏免疫炎症反应。
图3E:小鼠脾脏中浆细胞(PC)和浆母细胞(PB)比例的免疫荧光染色分析。结果说明外泌体破坏浆细胞平衡,促进B细胞向效应细胞分化。
图3F:小鼠24小时尿蛋白水平的统计分析。结果表明提示外泌体加重肾脏损伤(蛋白尿是狼疮肾炎的核心指标)。
图3G:小鼠尿素水平的统计分析。结果证实外泌体加剧肾脏代谢障碍。
图3H:小鼠肌酐水平的统计分析。结果显示趋势与尿素一致,进一步验证外泌体对肾功能的破坏作用。
图3I:小鼠肾脏病理的HE、PAS和MASSON染色分析。结果从病理形态学证实外泌体加重肾脏损伤。
图3J:小鼠肾脏中IgG和C3沉积的免疫荧光染色分析。结果表明外泌体促进肾脏免疫复合物沉积,加剧狼疮肾炎。
这些结果表明,嗜碱性粒细胞来源外泌体可通过促进自身抗体产生、破坏脾脏免疫平衡、加重肾脏损伤(蛋白尿、代谢障碍、病理改变及免疫复合物沉积),显著加剧狼疮小鼠疾病进展;而抑制外泌体释放可缓解上述病理过程,明确外泌体在狼疮中的致病性作用。
4.嗜碱性粒细胞来源外泌体中的miR-24550对其功能至关重要
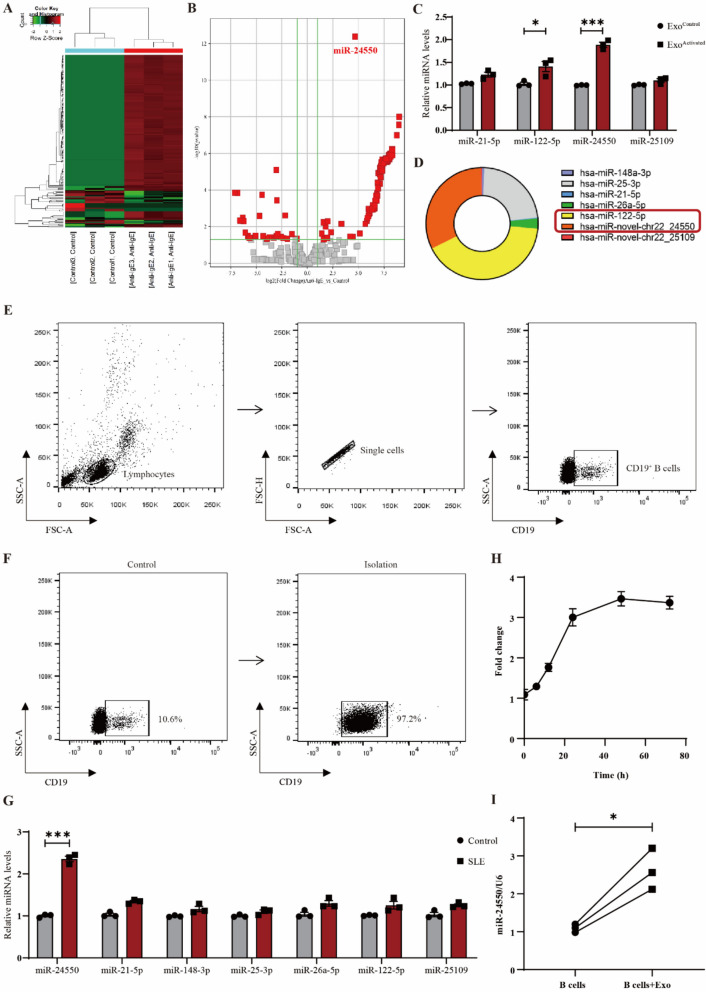
图4嗜碱性粒细胞来源外泌体中的miR-24550对其功能至关重要。
图4A:miRNA差异表达热图。结果证明活化状态显著改变嗜碱性粒细胞外泌体的miRNA谱。
图4B:miRNA差异表达火山图。结果表明外泌体中核酸成分随嗜碱性粒细胞活化发生广泛改变。
图4C:活化前后嗜碱性粒细胞来源外泌体中miRNA的相对表达水平。qRT-PCR验证显示,miR-21-5p、miR-122-5p、miR-24550、miR-25109在活化外泌体中显著上调,其余3个候选miRNA(miR-148a-3p、miR-25-3p、miR-26a-5p)在静息外泌体中未检测到。
图4D:活化嗜碱性粒细胞来源外泌体中miRNA的相对表达水平。结果显示在4个上调miRNA中,miR-122-5p和miR-24550表达量相对更高。
图4E:检测CD19⁺B细胞的流式门控方案。结果特异性识别出B细胞。
图4F:负选前后CD19⁺B细胞纯度的流式分析。结果显示分选后B细胞纯度达97.2%,保证后续B细胞相关实验的特异性。
图4G:健康志愿者和SLE患者B细胞中miRNA的表达水平。结果显示miR-24550与SLEB细胞异常相关。
图4H:嗜碱性粒细胞活化后miR-24550表达水平的变化。结果表明活化可动态上调嗜碱性粒细胞中miR-24550的表达。
图4I:活化嗜碱性粒细胞来源外泌体与SLE患者B细胞共培养后B细胞中miR-24550的相对表达水平。结果表明外泌体可将miR-24550传递至B细胞。
这些结果表明,miR-24550是活化嗜碱性粒细胞来源外泌体中特异性高表达的miRNA,且其在SLE患者B细胞中表达异常升高;外泌体可作为载体将miR-24550传递至B细胞,提示miR-24550可能是外泌体调控B细胞功能的核心分子。
5. MiR-24550促进B细胞增殖
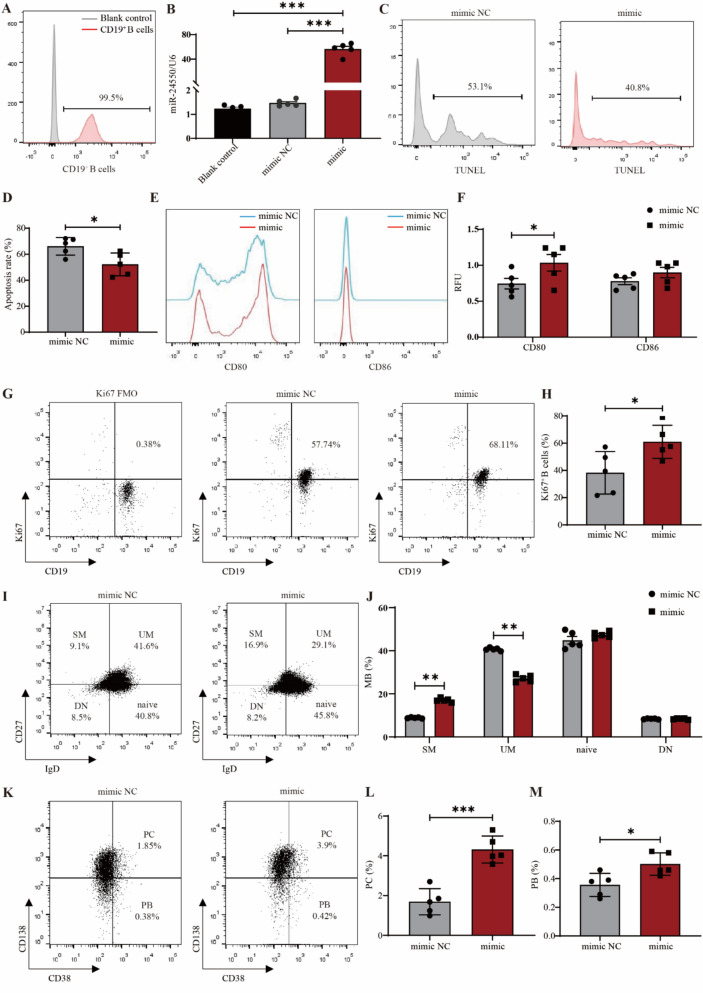
图5 miR-24550促进B细胞增殖和活化。
图5A:负选前后CD19⁺B细胞纯度的流式分析。结果显示健康志愿者B细胞分选后纯度达99.5%。
图5B:B细胞中miR-24550过表达效率的qPCR分析。结果证实miR-24550过表达B细胞模型构建成功。
图5C:miR-24550过表达对B细胞凋亡影响的TUNEL检测。结果显示miR-24550过表达可显著降低B细胞凋亡率。
图5D:miR-24550过表达对B细胞凋亡影响的统计分析。结果表明miR-24550可提高B细胞存活率。
图5E:miR-24550过表达对B细胞活化标志物CD80和CD86表达影响的流式分析。结果显示促进了B细胞活化。
图5F:miR-24550过表达对B细胞活化标志物CD80和CD86表达影响的统计分析。结果显示miR-24550可特异性促进B细胞活化。
图5G:miR-24550过表达对B细胞增殖标志物Ki-67表达影响的流式分析。结果显示CD19⁺Ki-67⁺细胞增殖能力增强。
图5H:miR-24550过表达对B细胞增殖标志物Ki-67表达影响的统计分析。结果证实miR-24550可促进B细胞增殖。
图5I:miR-24550过表达对记忆B细胞亚群影响的流式分析。结果显示miR-24550过表达对记忆B细胞亚群产生显著影响。
图5J:miR-24550过表达对记忆B细胞亚群影响的统计分析。结果表明miR-24550调控记忆B细胞亚群分化。
图5K:miR-24550过表达对浆细胞(PC,CD138⁺)和plasmablast(PB,CD38⁺CD27⁺)影响的流式分析。结果显示PC、PB比例升高。
图5L:miR-24550过表达对浆细胞影响的统计分析。结果显示过表达组PC比例显著升高。
图5M:miR-24550过表达对plasmablast影响的统计分析。结果显示过表达组PB比例显著升高,进一步证实miR-24550促进B细胞向效应细胞分化。
这些结果表明,miR-24550可通过提高B细胞存活率、促进活化标志物(CD80)表达、增强增殖能力(Ki-67⁺细胞比例升高),并调控B细胞亚群分化(增加SM、PC、PB比例,减少UM比例),最终推动B细胞的活化与功能异常。
6. B细胞miR-24550敲低改善了人源化SLE小鼠的病程进展
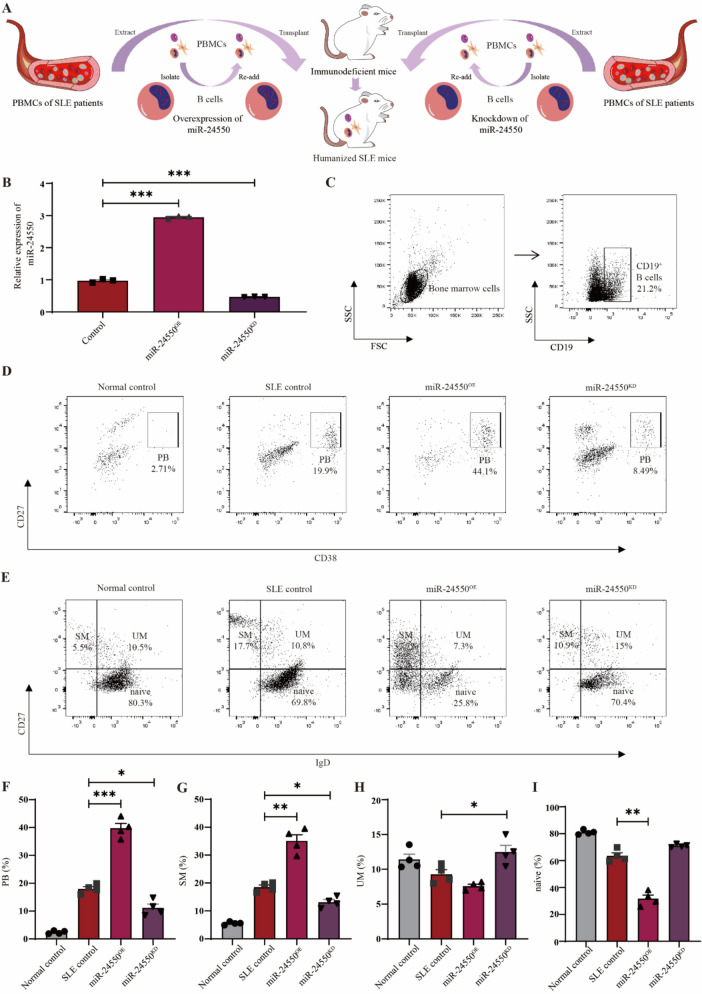
图6构建人源化SLE小鼠模型。
图6A:人源化SLE小鼠模型构建流程。
图6B:SLE患者B细胞中miR-24550过表达和敲低效率的qRT-PCR分析。结果显示B细胞miR-24550过表达(miR-24550 OE)组表达量显著高于对照组,B细胞miR-24550敲低(miR-24550 KD)组显著低于对照组,证实B细胞中miR-24550的干预模型构建成功。
图6C:人源化SLE小鼠骨髓中CD19⁺B细胞的流式分析。结果显示在小鼠骨髓中检测到大量人CD19⁺B细胞,证明人源化模型构建成功。
图6D:人源化SLE小鼠骨髓中plasmablast(PB,CD27⁺CD38⁺)的流式分析。
图6E:人源化SLE小鼠骨髓中记忆B细胞的流式分析。
图6F:人源化SLE小鼠骨髓中PB比例的统计分析。结果显示SLE对照组PB比例显著高于正常对照组,miR-24550 OE组高于SLE对照组,miR-24550 KD组低于SLE对照组,提示miR-24550促进PB生成。
图6G:人源化SLE小鼠骨髓中SMB细胞比例的统计分析。结果显示SLE对照组SM比例显著高于正常对照组,miR-24550 OE组高于SLE对照组,miR-24550 KD组低于SLE对照组,与体外实验结果一致。
图6H:人源化SLE小鼠骨髓中UMB细胞比例的统计分析。结果显示SLE对照组UM比例显著低于正常对照组,miR-24550 OE组低于SLE对照组,miR-24550 KD组高于SLE对照组,表明miR-24550敲低可恢复UM比例。
图6I:人源化SLE小鼠骨髓中初始B细胞比例的统计分析。结果显示SLE对照组初始B细胞比例低于正常对照组,miR-24550 OE组低于SLE对照组,miR-24550 KD组高于SLE对照组,提示miR-24550敲低可改善初始B细胞消耗。
这些结果表明,成功构建了移植SLE患者PBMC的人源化SLE小鼠模型,且该模型可模拟人类SLE的B细胞亚群异常;B细胞中miR-24550的表达水平直接调控骨髓中B细胞亚群分化,敲低miR-24550可显著改善B细胞分化紊乱,为体内验证miR-24550的致病性提供了模型支持。
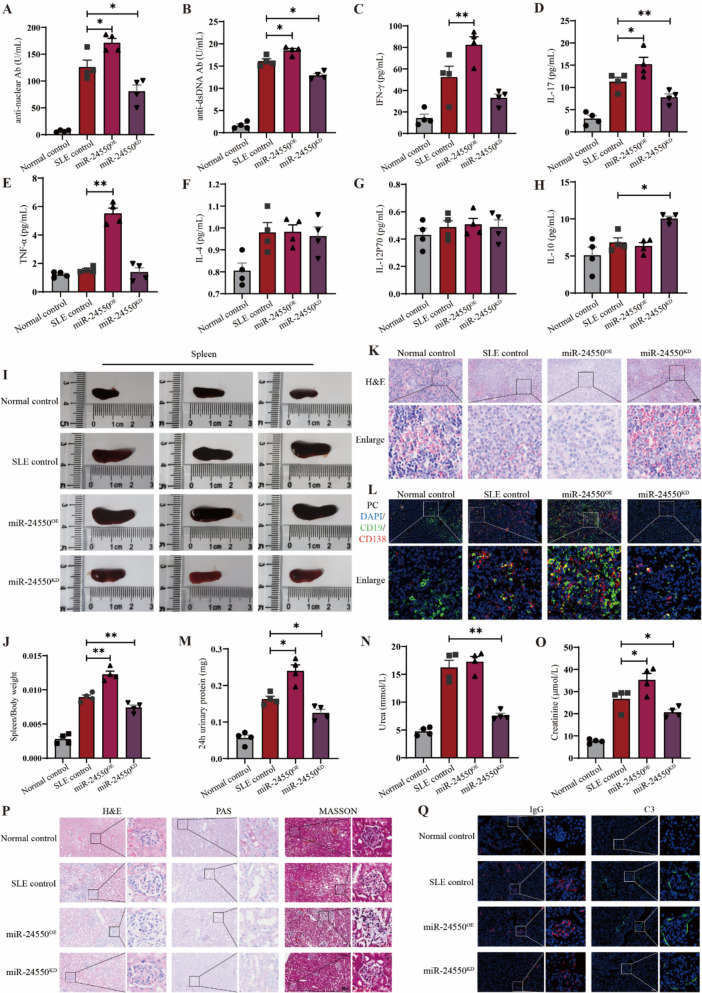
图7 B细胞中miR-24550敲低改善人源化SLE小鼠疾病进展。
图7A:人源化SLE小鼠血浆抗核抗体的统计分析。结果显示miR-24550 OE组ANA水平显著高于SLE对照组,miR-24550 KD组显著低于SLE对照组,表明敲低miR-24550可减少自身抗体产生。
图7B:人源化SLE小鼠血浆抗dsDNA抗体的统计分析。结果显示趋势与ANA一致:miR-24550OE组抗dsDNA水平显著高于SLE对照组,miR-24550 KD组显著低于SLE对照组,进一步证实miR-24550敲低的抗自身免疫作用。
图7C:人源化SLE小鼠血浆中细胞因子IFN-γ的统计分析。结果显示miR-24550 OE组IFN-γ水平显著高于SLE对照组,miR-24550 KD组呈下降趋势,提示miR-24550调控促炎细胞因子分泌。
图7D:人源化SLE小鼠血浆中自身免疫炎症核心因子IL-17的统计分析。。结果显示miR-24550 OE组IL-17水平显著高于SLE对照组,miR-24550 KD组显著低于SLE对照组,证实miR-24550敲低可抑制IL-17介导的炎症反应。
图7E:人源化SLE小鼠血浆TNF-α的统计分析。结果显示miR-24550 OE组TNF-α水平显著高于SLE对照组,miR-24550 KD组无显著差异,提示miR-24550对不同促炎因子的调控存在差异。
图7F:人源化SLE小鼠血浆IL-4的统计分析。结果显示各组间IL-4水平无显著差异,表明miR-24550对Th2型细胞因子IL-4无明显调控作用。
图7G:人源化SLE小鼠血浆IL-12P70的统计分析。结果显示各组间IL-12P70水平无显著差异,进一步说明miR-24550对细胞因子的调控具有特异性。
图7H:人源化SLE小鼠血浆中抗炎症因子IL-10的统计分析。结果显示miR-24550 KD组IL-10水平显著高于SLE对照组,miR-24550 OE组无显著差异,提示miR-24550敲低可增强抗炎反应。
图7I:人源化SLE小鼠脾脏形态分析。结果显示miR-24550 OE组脾脏显著大于SLE对照组,miR-24550 KD组脾脏小于SLE对照组,表明miR-24550敲低可缓解脾脏增生。
图7J:人源化SLE小鼠脾重/体重比的统计分析。结果显示miR-24550 OE组比值显著高于SLE对照组,miR-24550 KD组显著低于SLE对照组,量化验证脾脏增生的改善。
图7K:人源化SLE小鼠脾脏病理的HE染色分析。结果显示miR-24550 OE组脾脏免疫细胞浸润多于SLE对照组,miR-24550 KD组少于SLE对照组,说明miR-24550敲低可减轻脾脏炎症。
图7L:人源化SLE小鼠脾脏中浆细胞(PC)的免疫荧光染色分析。结果显示miR-24550 OE组PC比例高于SLE对照组,miR-24550 KD组低于SLE对照组,提示miR-24550敲低可减少效应B细胞数量。
图7M:人源化SLE小鼠24小时尿蛋白水平的统计分析。结果显示miR-24550 OE组尿蛋白水平显著高于SLE对照组,miR-24550 KD组显著低于SLE对照组,表明miR-24550敲低可改善肾脏损伤。
图7N:人源化SLE小鼠血浆尿素水平的统计分析。结果显示miR-24550 OE组尿素水平高于SLE对照组,miR-24550 KD组显著低于SLE对照组,证实miR-24550敲低恢复肾脏代谢功能。
图7O:人源化SLE小鼠血浆肌酐水平的统计分析。结果显示miR-24550 OE组肌酐水平显著高于SLE对照组,miR-24550 KD组显著低于SLE对照组,进一步验证肾功能改善。
图7P:人源化SLE小鼠肾脏病理的HE、PAS和MASSON染色分析。结果显示miR-24550 OE组肾新月体形成多、刷状缘脱落严重、纤维化重,miR-24550 KD组相反,从病理形态学证实肾脏损伤的缓解。
图7Q:人源化SLE小鼠肾脏中IgG和C3沉积的免疫荧光染色分析。结果显示miR-24550 OE组IgG/C3沉积多于SLE对照组,miR-24550 KD组少于SLE对照组,提示miR-24550敲低减少肾脏免疫复合物沉积。
这些结果表明,在人源化SLE小鼠中,敲低B细胞中的miR-24550可通过减少自身抗体(ANA、抗dsDNA)产生、下调促炎细胞因子(IFN-γ、IL-17、TNF-α)、上调抗炎因子(IL-10)、缓解脾脏炎症增生、改善肾脏损伤(蛋白尿、代谢障碍、病理改变及免疫复合物沉积),显著减轻疾病进展;且该效应与抑制嗜碱性粒细胞外泌体释放的作用一致,进一步证实miR-24550是外泌体调控SLE的核心分子。
7. miR-24550通过抑制KLF5的表达来促进B细胞的增殖和活化
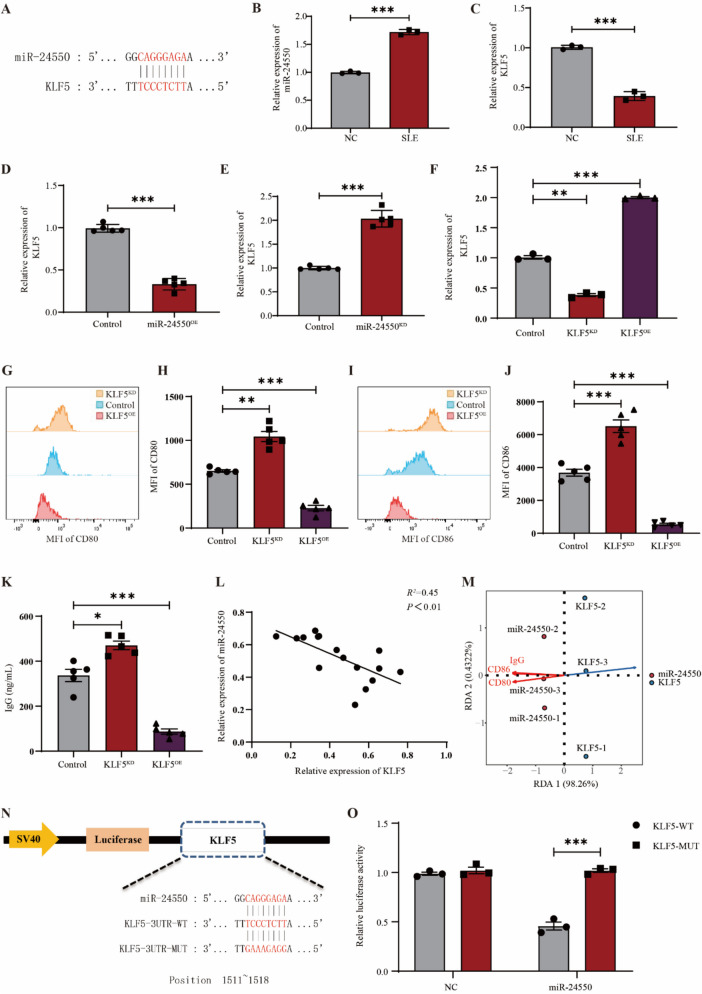
图8 miR-24550通过抑制KLF5表达促进B细胞增殖和活化。
图8A:miR-24550靶向KLF5的生物信息学预测(基于miRDB数据库)。结果显示miR-24550的序列可与KLF5 mRNA的3'-UTR区域互补结合,提示KLF5可能是miR-24550的靶基因。
图8B:健康志愿者和SLE患者B细胞中miR-24550水平的qRT-PCR分析。结果显示SLE患者B细胞中miR-24550表达显著高于健康志愿者。
图8C:健康志愿者和SLE患者B细胞中KLF5水平的qRT-PCR分析。结果显示SLE患者B细胞中KLF5表达显著低于健康志愿者,与miR-24550表达呈反向趋势。
图8D:B细胞中miR-24550过表达后KLF5水平的qRT-PCR分析。结果显示过表达miR-24550显著降低B细胞中KLF5的表达。
图8E:B细胞中miR-24550敲低后KLF5水平的qRT-PCR分析。结果显示敲低miR-24550显著升高B细胞中KLF5的表达,提示miR-24550负调控KLF5表达。
图8F:B细胞miR-24550水平调控后KLF5水平的qRT-PCR分析。结果显示成功构建KLF5敲低(KLF5 KD)和过表达(KLF5 OE)B细胞模型。
图8G:KLF5敲低后B细胞中CD80水平的流式分析。
图8H:KLF5敲低后CD80水平的统计分析。结果显示KLF5 KD组CD80表达显著高于对照组,KLF5 OE组显著低于对照组,表明KLF5抑制CD80表达。
图8I:KLF5敲低后B细胞中CD86水平的流式分析。
图8J:KLF5敲低后CD86水平的统计分析。结果显示KLF5 KD组CD86表达显著高于对照组,KLF5 OE组显著低于对照组,证实KLF5抑制B细胞活化。
图8K:KLF5调控后B细胞IgG分泌的统计分析。结果显示KLF5 KD组IgG释放显著增加,KLF5 OE组显著减少,提示KLF5抑制B细胞的抗体分泌功能。
图8L:miR-24550与KLF5表达的相关性分析。结果显示二者呈显著负相关,进一步验证靶向调控关系。
图8M:miR-24550、KLF5、CD80、CD86和IgG表达水平的相关性分析。结果显示miR-24550与CD80、CD86、IgG呈正相关,KLF5与三者呈负相关,提示miR-24550通过抑制KLF5调控B细胞活化与抗体分泌。
图8N:miR-24550靶向KLF5的双荧光素酶报告质粒设计,构建包含KLF53'-UTR野生型(KLF5-WT-3'-UTR)和突变型(KLF5-MUT-3'-UTR,突变miR-24550结合位点)的荧光素酶报告质粒。
图8O:miR-24550靶向KLF5的双荧光素酶报告基因分析。结果显示KLF5-WT-3'-UTR+miR-24550组的相对荧光素酶活性显著低于KLF5-WT-3'-UTR+miR-NC组,而突变体质粒组(KLF5-MUT-3'-UTR)无显著差异,直接证实miR-24550可特异性结合KLF5的3'-UTR并抑制其表达。
这些结果表明,miR-24550通过靶向结合KLF5 mRNA的3'-UTR在转录后水平抑制KLF5表达;KLF5作为负调控因子,可抑制B细胞活化标志物(CD80、CD86)表达和IgG分泌;因此,miR-24550通过下调KLF5解除其对B细胞的抑制,最终促进B细胞增殖、活化及自身抗体产生,明确了“miR-24550-KLF5”轴在SLEB细胞异常中的核心调控机制。
结论
看完这篇研究不难发现,它能发8分+的关键在于“小切口深挖掘”:聚焦嗜碱性粒细胞外泌体这一细分方向,先证实其能被SLE患者B细胞摄取并促其活化,再锁定miR-24550-KLF5轴为核心机制,最后在两种动物模型中验证干预效果,逻辑闭环且数据详实。这种思路特别适合资源有限的团队——无需复杂实验设备,部分分析靠常规工具就能实现。若你想在SLE免疫调控、外泌体功能等领域突破,却卡在思路梳理或实验对接上,联系我们准没错!






