研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
外泌体-脂质体杂化:DR5 靶向+双药共递+代谢调控三重buff拉满,精准打击肺转移黑色素瘤,从机制到PDX模型全是硬货!
7177 人阅读发布时间:2025-09-05 10:57
肺转移性黑色素瘤(PMM)是一种侵袭性极强的恶性肿瘤,对化疗、放疗、免疫治疗等现有疗法响应有限,且易快速产生耐药性,患者5年生存率不足17%。雷公藤甲素(TP)作为一种具有抗肿瘤活性的天然化合物,因被CYP3A4酶快速代谢(约90%的TP代谢由其介导),导致半衰期短、治疗窗窄,且全身毒性显著,限制了临床应用。

今天分享的是发表在【Science Advances】(IF:12.5)上题为“Engineering hybrid nanoparticles for targeted codelivery of triptolide and CYP3A4-siRNA against pulmonary metastatic melanoma”的研究,该研究开发了一种靶向仿生递送系统TP-siRC@tHyNPs:将高表达DR5单链可变片段(DR5-scFv)的工程化外泌体(DR5-Exo)与共包载TP和CYP3A4-siRNA的脂质体(TP-siRC@Lip)融合,通过DR5-scFv与肿瘤细胞表面DR5受体的特异性结合实现靶向递送,同时利用CYP3A4-siRNA抑制TP代谢以延长其作用时间,最终协同增强抗肿瘤效果并降低毒性。
研究结果
1、TP-siRC@tHyNPs的制备及抗PMM协同作用示意图
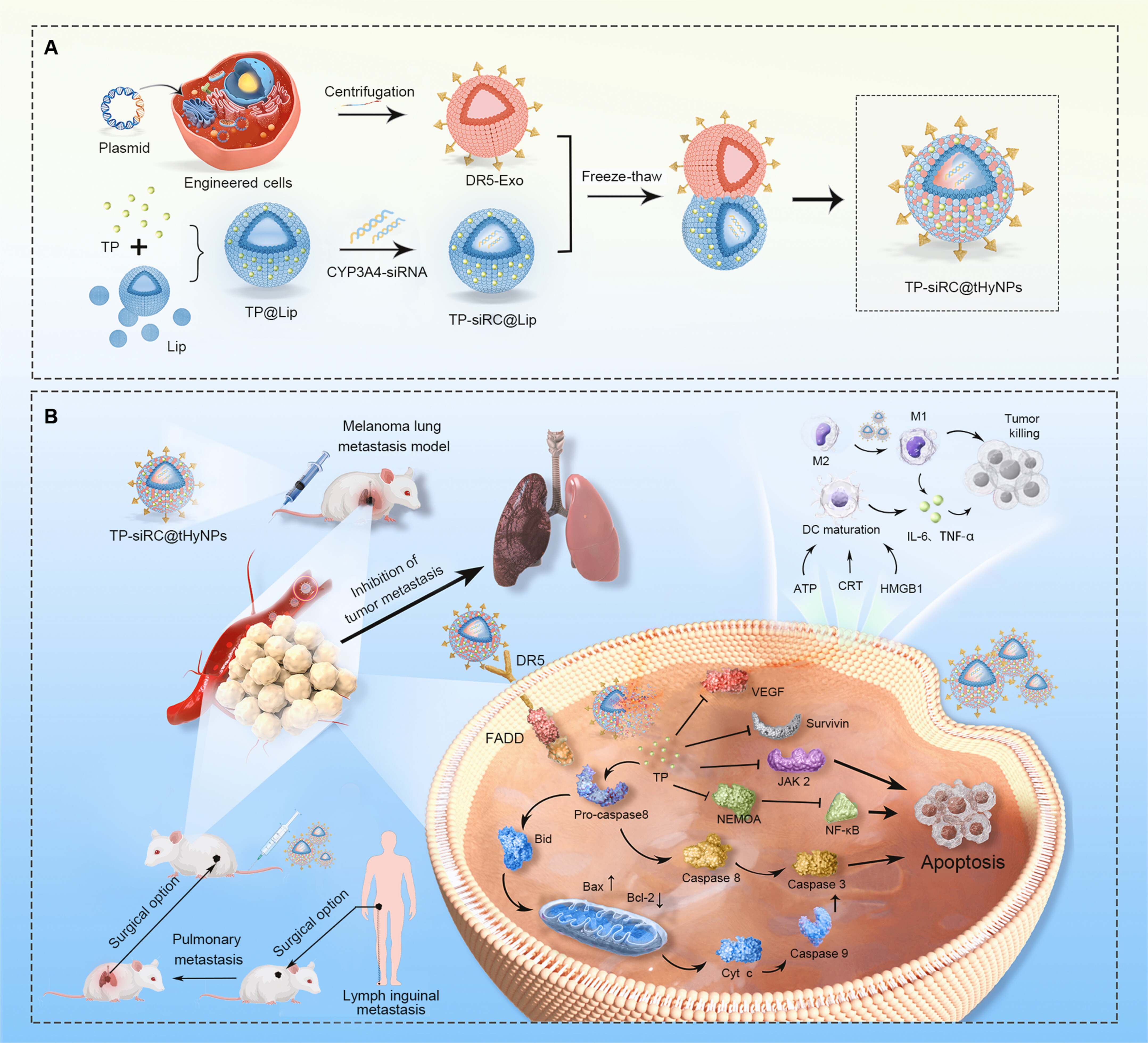
图1A:制备流程示意图。通过慢病毒转染构建高表达DR5-scFv的293T细胞,分离其分泌的DR5-Exo;将TP和CYP3A4-siRNA包载入脂质体(TP-siRC@Lip);通过冻融法将DR5-Exo与TP-siRC@Lip融合,形成TP-siRC@tHyNPs。
图1B:作用机制示意图。尾静脉注射后,TP-siRC@tHyNPs通过DR5-scFv靶向识别PMM细胞表面DR5受体并被内化;CYP3A4-siRNA抑制TP代谢,延长其半衰期;TP与DR5-scFv协同激活凋亡通路、诱导免疫原性细胞死亡(ICD)、重塑巨噬细胞表型,最终抑制肿瘤生长和转移。
这些结果表明,TP-siRC@tHyNPs通过“靶向递送-代谢调控-多机制协同”模式,实现对PMM的高效治疗。
2、DR5-scFv的构建及抗肿瘤效果验证
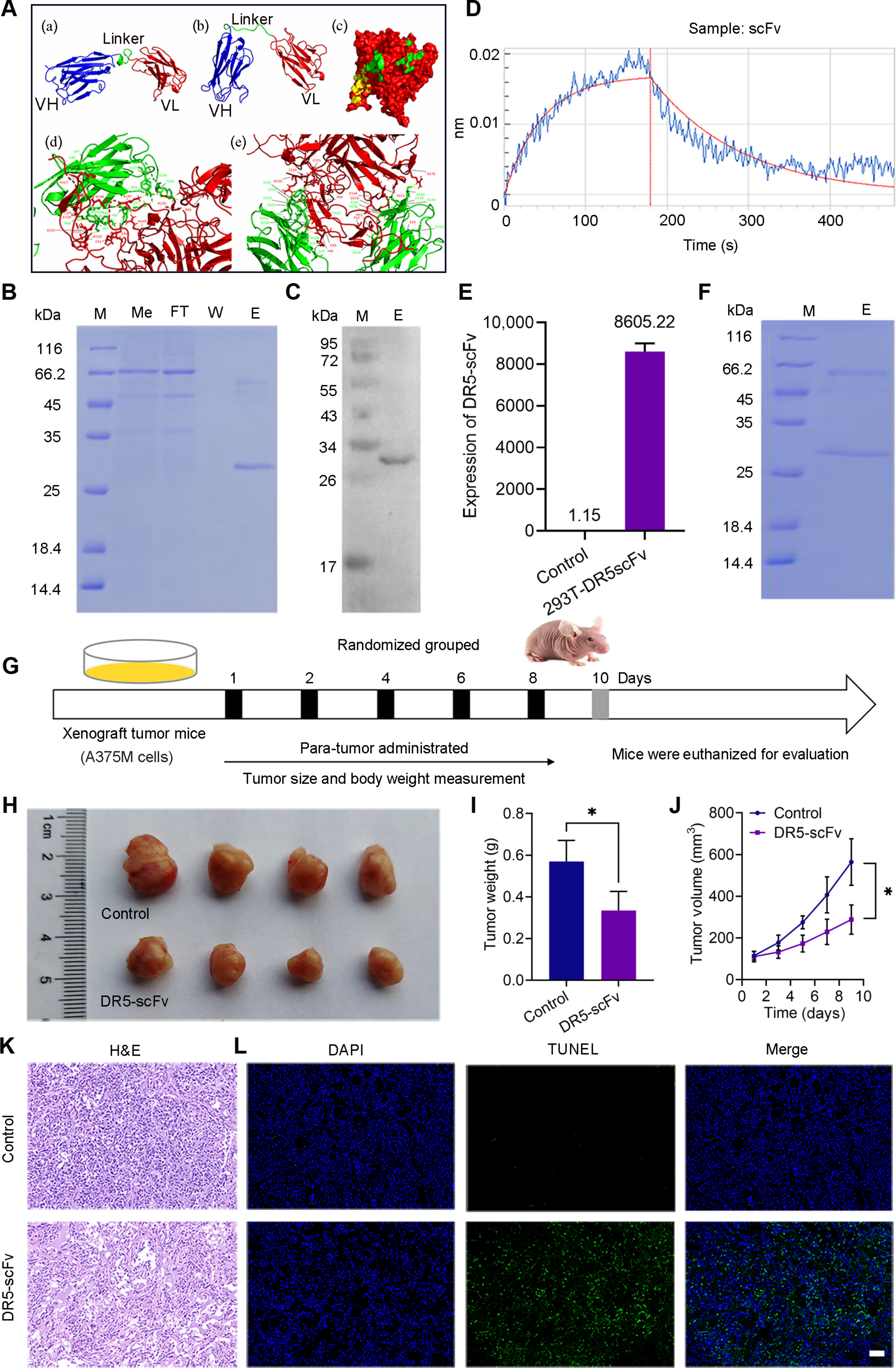
图2A:分子对接显示DR5-scFv(模型01和02)与DR5受体存在特异性结合界面,通过氢键等相互作用稳定结合。
图2B-C:考马斯亮蓝染色和Western blot验证DR5-scFv在293T细胞培养液中成功表达并纯化。
图2D:生物层干涉法测定DR5-scFv与DR5受体的结合常数为7×10-⁸M,表明高亲和力。
图2E-F:RT-qPCR和考马斯亮蓝染色证实DR5-scFv在293T-DR5-scFv细胞中稳定表达。
图2G-J:动物实验显示,DR5-scFv处理组A375M荷瘤小鼠的肿瘤体积、重量显著小于对照组,且肿瘤生长曲线斜率更低。
图2K-L:HE染色显示DR5-scFv组肿瘤组织出现明显坏死;TUNEL染色显示凋亡细胞比例显著增加。
这些结果表明,DR5-scFv可通过特异性结合DR5受体抑制PMM细胞增殖并诱导凋亡,具有直接抗肿瘤活性。
3、TP-siRC@tHyNPs的制备与表征
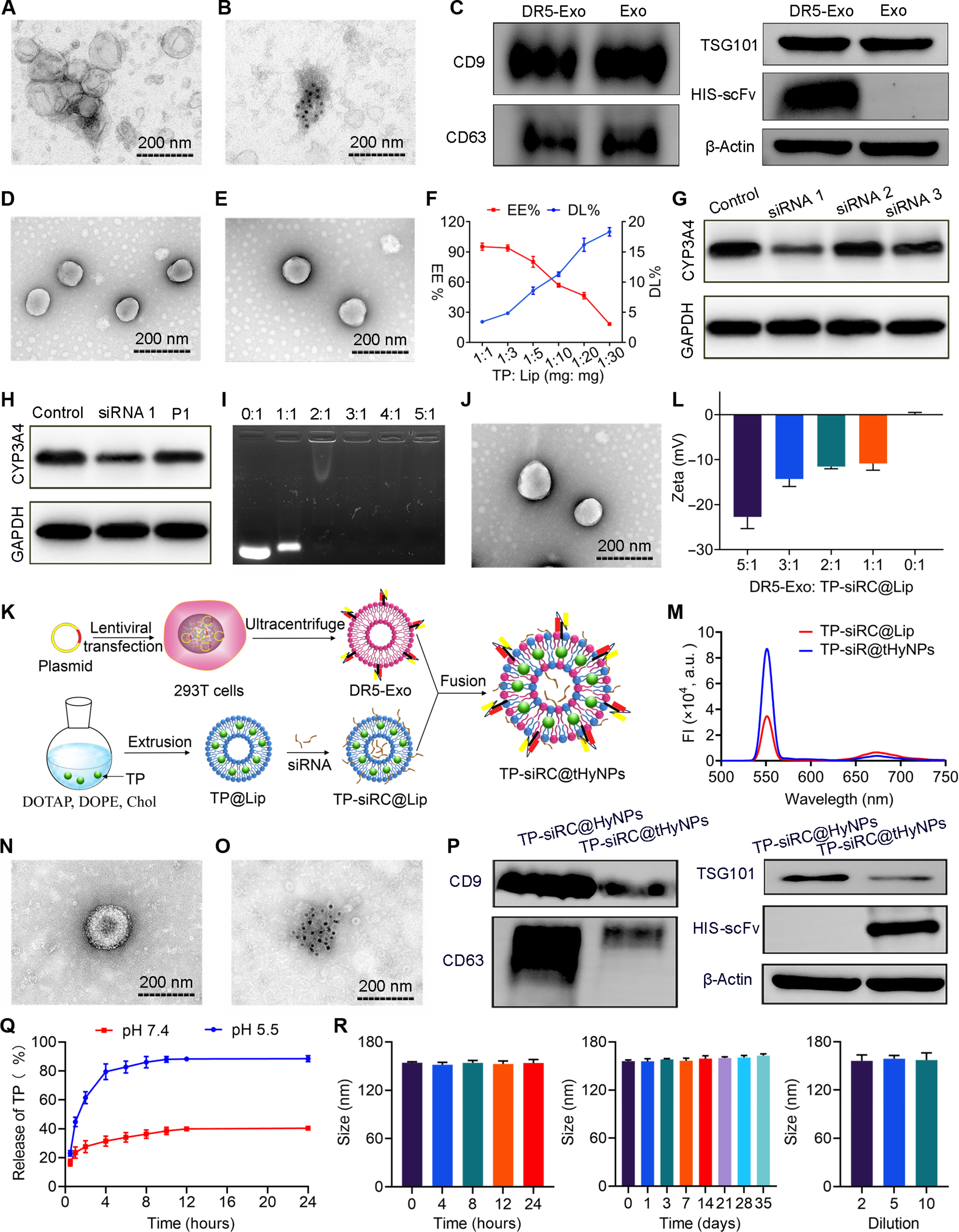
图3A-B:透射电镜(TEM)和免疫电镜显示DR5-Exo呈典型囊泡结构,表面可见DR5-scFv标记。
图3C:Western blot证实DR5-Exo表达外泌体标志物CD9、CD63、TSG101及DR5-scFv的表达。
图3D-E:TEM显示脂质体(Lip)和TP包载脂质体(TP@Lip)为球形,粒径均一。
图3F:当TP与脂质质量比为1:10时,包封率(EE%)达86.17±5.36%,载药量(DL%)为9.25±0.59%。
图3G-H:Westernblot显示CYP3A4-siRNA(siRNA1)对A375M细胞中CYP3A4的抑制率达51.84±6.55%,但传代后表达略有回升。
图3I-J:琼脂糖凝胶电泳(AGE)显示N/P比3:1时TP-siRC@Lip形成稳定复合物;TEM显示其为球形(约135nm)。
图3K-L:冻融法融合DR5-Exo与TP-siRC@Lip(质量比2:1)形成TP-siRC@tHyNPs,zeta电位稳定在-11mV左右。
图3M:荧光共振能量转移(FRET)证实DR5-Exo与TP-siRC@Lip成功融合(荧光强度下降)。
图3N-O:TEM和免疫电镜显示TP-siRC@tHyNPs为融合囊泡结构,表面保留DR5-scFv。
图3P:Western blot证实TP-siRC@tHyNPs同时表达外泌体标志物和DR5-scFv。
图3Q:pH响应释放曲线显示,pH5.5(模拟内体环境)下4小时TP释放率达79.46±4.14%,显著高于pH7.4(生理环境)。
图3R:稳定性实验显示,TP-siRC@tHyNPs在血浆、PBS中储存及稀释后粒径无显著变化。
这些结果表明,TP-siRC@tHyNPs制备工艺稳定,具有理想的理化性质、pH响应释放特性和生物稳定性,可高效共递送TP和CYP3A4-siRNA。
4、细胞内摄取、分布及代谢分析
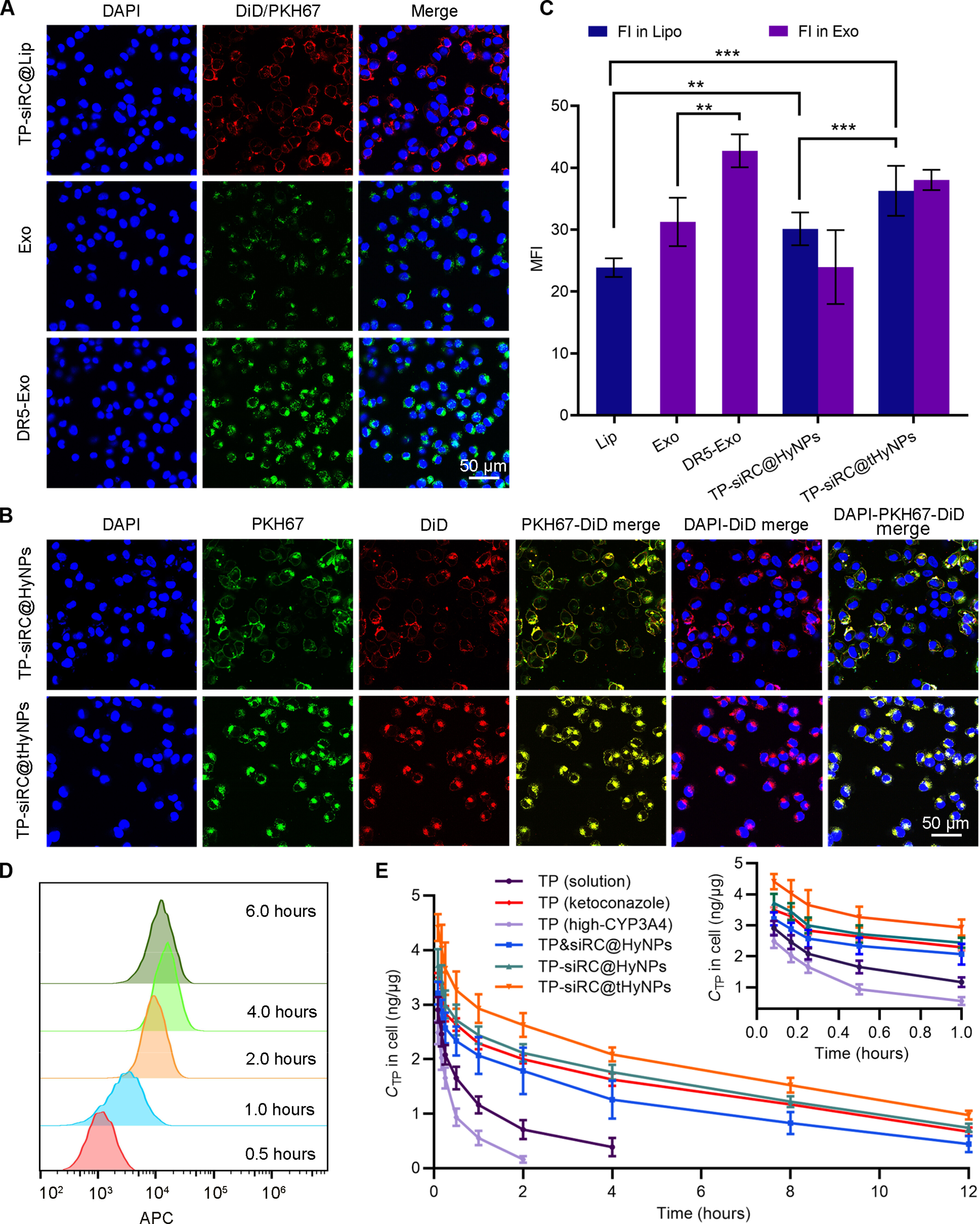
图4A:共聚焦显示,DiD标记的TP-siRC@Lip(红色)主要分布在A375M细胞核周围,PKH67标记的DR5-Exo(绿色)内化效率高于未修饰外泌体(Exo)。
图4B:双标共聚焦显示,TP-siRC@tHyNPs组(DR5-Exo+TP-siRC@Lip)的细胞内荧光共定位(黄色)强度显著高于TP-siRC@HyNPs组(未修饰Exo+TP-siRC@Lip)。
图4C:定量分析显示,TP-siRC@tHyNPs组的脂质体(红色)和外泌体(绿色)荧光强度均最高。
图4D:流式细胞术显示,TP-siRC@tHyNPs在A375M细胞中的摄取呈时间依赖性,4小时达峰(MFI最高)。
图4E:细胞药代动力学显示,TP-siRC@tHyNPs组TP半衰期(t₁/₂=5.08±0.51h)是游离TP组(1.71±0.45h)的2.97倍,AUC和Cmax显著升高;CYP3A4过表达则加速TP清除(t₁/₂=0.64±0.12h)。
这些结果表明,DR5修饰增强了TP-siRC@tHyNPs的细胞靶向摄取,且CYP3A4-siRNA可有效延长TP的细胞内半衰期。
5、体外抗肿瘤活性评估
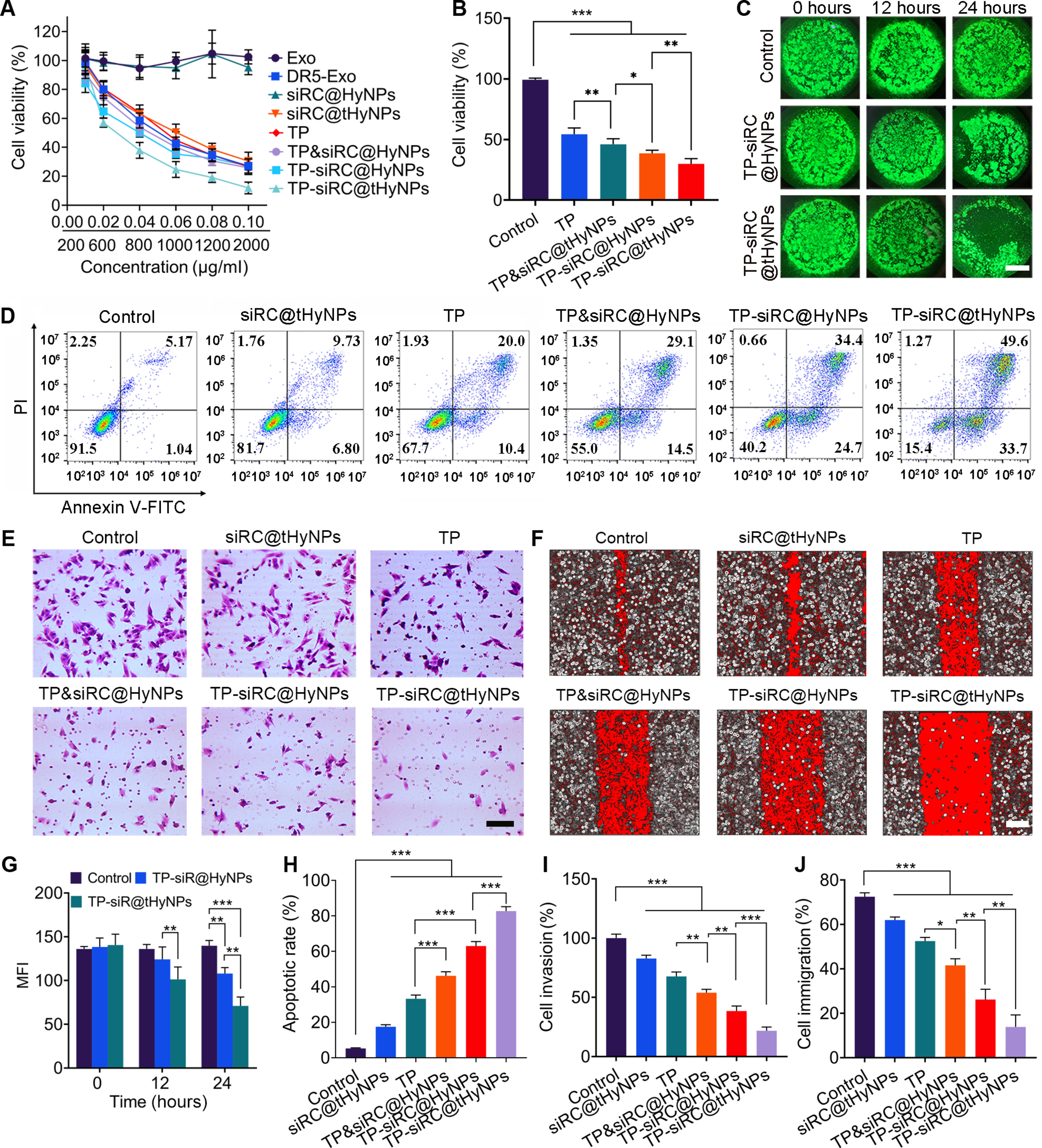
图5A-B:CCK-8实验显示,TP-siRC@tHyNPs对A375M细胞的增殖抑制率(IC50最低)显著高于TP单药、TP&siRC@HyNPs(物理混合组)等,且呈浓度依赖性。
图5C-G:3D肿瘤球模型中,TP-siRC@tHyNPs组的凋亡荧光强度最高,肿瘤球体积最小。
图5D-H:流式凋亡检测显示,TP-siRC@tHyNPs组A375M细胞凋亡率达82.69±2.48%,显著高于其他组。
图5E-I:Transwell实验显示,TP-siRC@tHyNPs对细胞侵袭的抑制率达21.78±3.16%。
图5F-J:划痕实验显示,其对细胞迁移的抑制率达13.83±5.41%。
这些结果表明,TP-siRC@tHyNPs在体外可显著抑制PMM细胞增殖、诱导凋亡并阻断侵袭迁移。
6、体外抗肿瘤机制研究
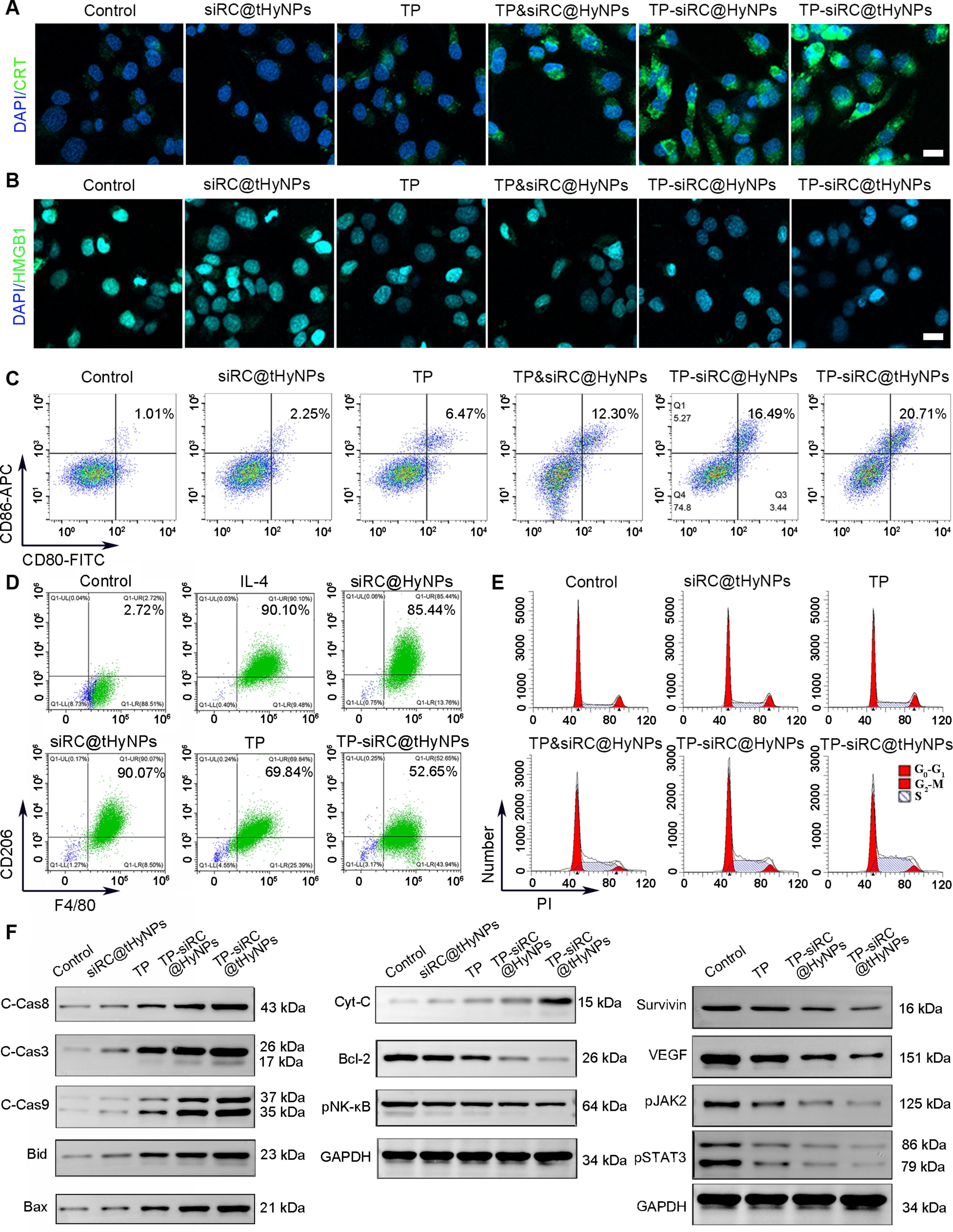
图6A-B:共聚焦显示,TP-siRC@tHyNPs组A375M细胞表面钙网蛋白(CRT)暴露增加,高迁移率族蛋白B1(HMGB1)释放增多,提示诱导ICD。
图6C:流式显示,TP-siRC@tHyNPs处理可促进树突状细胞(DCs)成熟(CD80⁺CD86⁺比例最高)。
图6D:流式显示,TP-siRC@tHyNPs可将M2型巨噬细胞(CD206⁺F4/80⁺)重编程为M1型(CD86⁺),M2标志物表达降低。
图6E:细胞周期分析显示,TP-siRC@tHyNPs组S期细胞比例显著升高,提示S期阻滞。
图6F:Western blot显示,TP-siRC@tHyNPs组凋亡相关蛋白(Cleaved-caspase3/8/9、Bax、Cyto-C)表达上调,抗凋亡蛋白(Bcl-2、Survivin)及VEGF、p-JAK2、p-STAT3表达下调。
这些结果表明,TP-siRC@tHyNPs通过诱导ICD、重塑巨噬细胞表型、阻滞细胞周期及激活内源性/外源性凋亡通路发挥抗肿瘤作用。
7、TP-siRC@tHyNPs 的体内药代动力学与生物分布
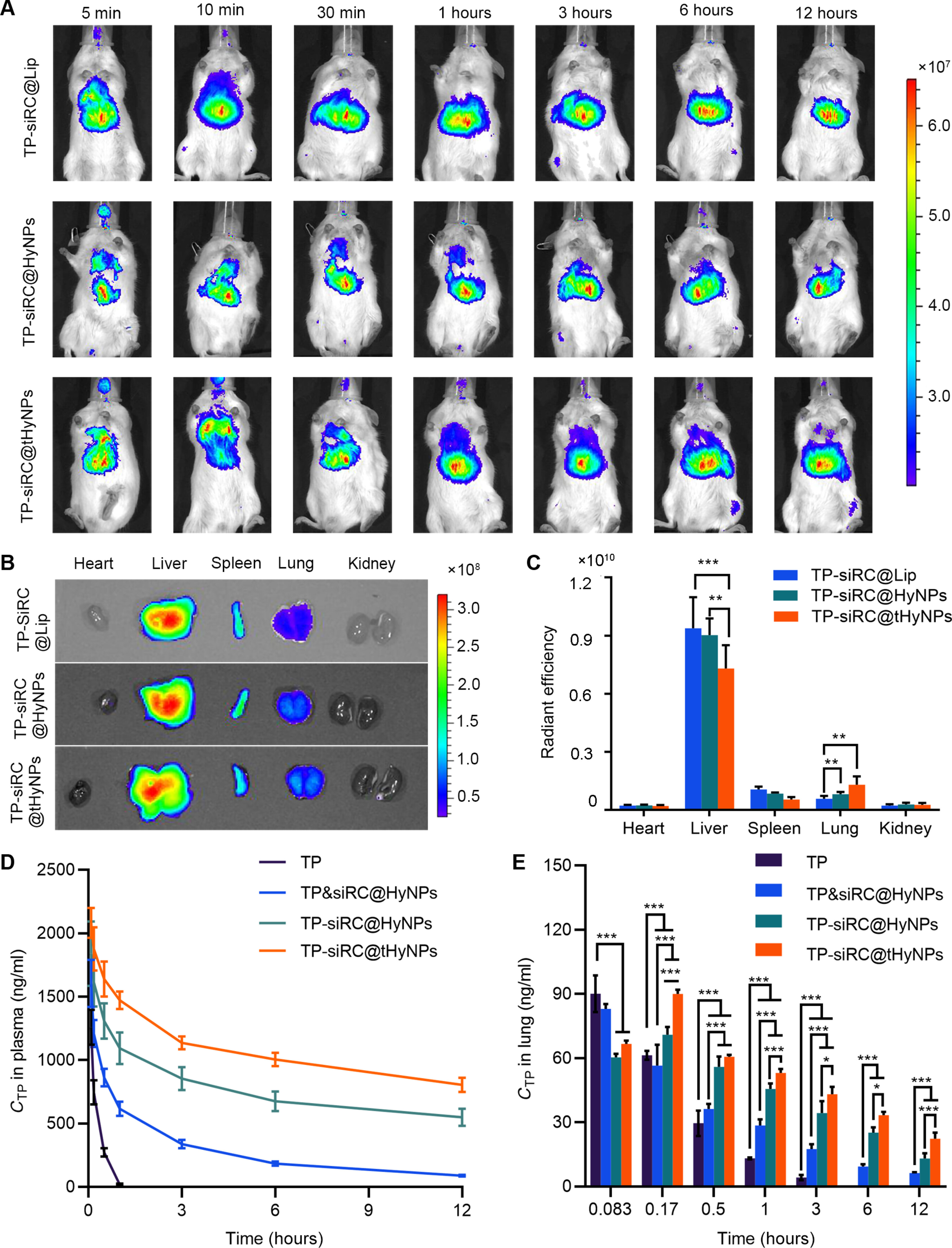
图7A-C:活体成像显示,TP-siRC@tHyNPs在PMM模型小鼠肺部的荧光信号强度最高,且12小时仍保持高滞留,其他器官分布较少。
图7D:血浆药代动力学显示,TP-siRC@tHyNPs组TP半衰期(t₁/₂)是游离TP组的58倍,AUC显著增加。
图7E:组织分布显示,TP-siRC@tHyNPs在肺组织(肿瘤部位)的药物浓度显著高于其他组,且12小时仍维持较高水平。
这些结果表明,TP-siRC@tHyNPs可特异性靶向富集于肺部转移灶,显著延长TP的体内半衰期。
8、体内抗PMM效果评估
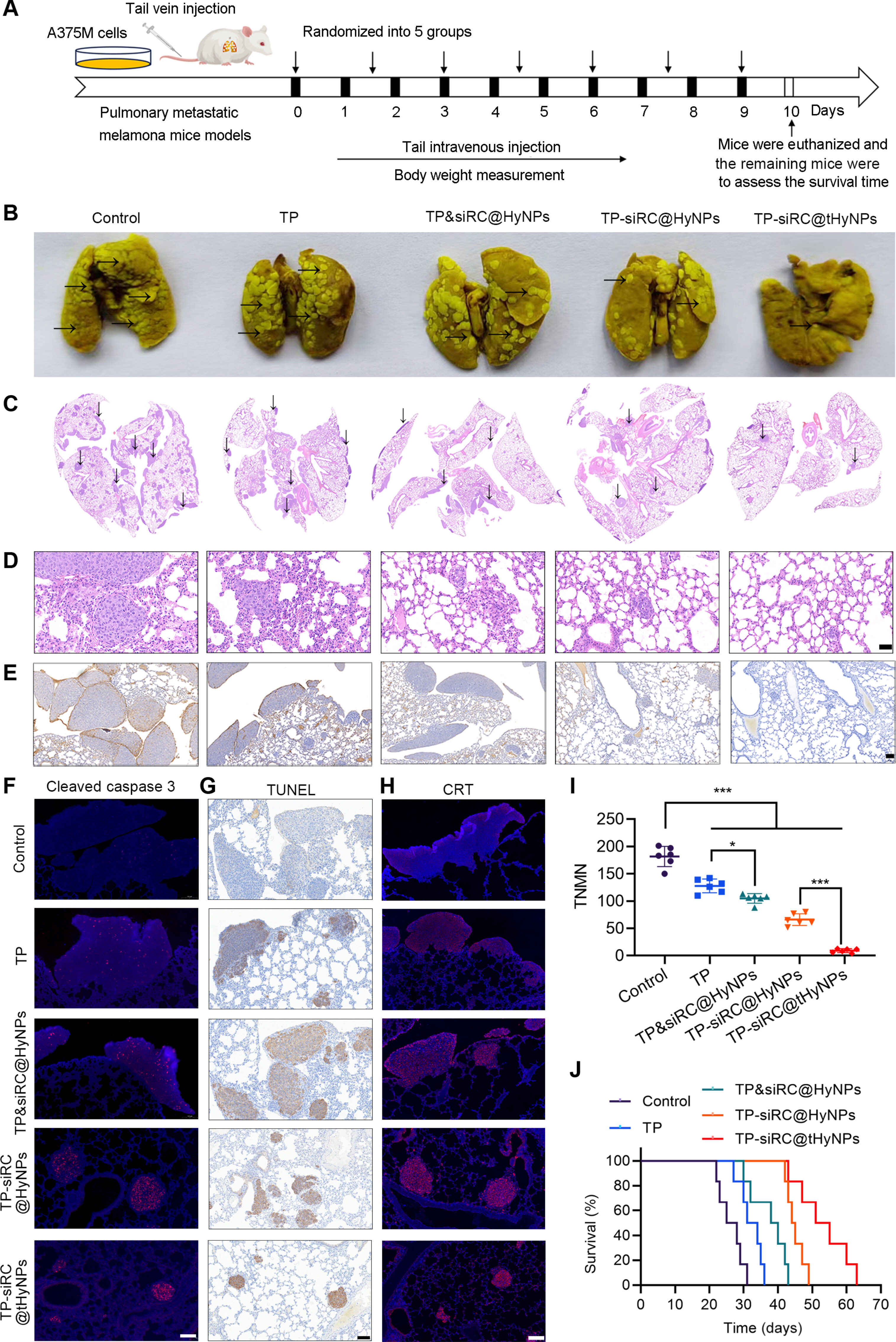
图8A:实验设计:A375M肺转移模型小鼠每3天尾静脉注射一次药物,共7次,监测肿瘤及生存情况。
图8B-I:Bouin染色显示,TP-siRC@tHyNPs组肺转移结节总数(TNMN)显著减少;HE染色显示肺组织结构更完整,肿瘤浸润少;Ki67(增殖标志物)表达降低,Cleaved-caspase3和TUNEL阳性细胞(凋亡)及CRT(ICD)表达显著增加。
图8J:生存曲线显示,TP-siRC@tHyNPs组小鼠中位生存期最长(>70天),显著高于对照组(<30天)。
这些结果表明,TP-siRC@tHyNPs可显著抑制PMM肺转移,延长荷瘤小鼠生存期。
9、患者来源异种移植(PDX)模型中的疗效验证
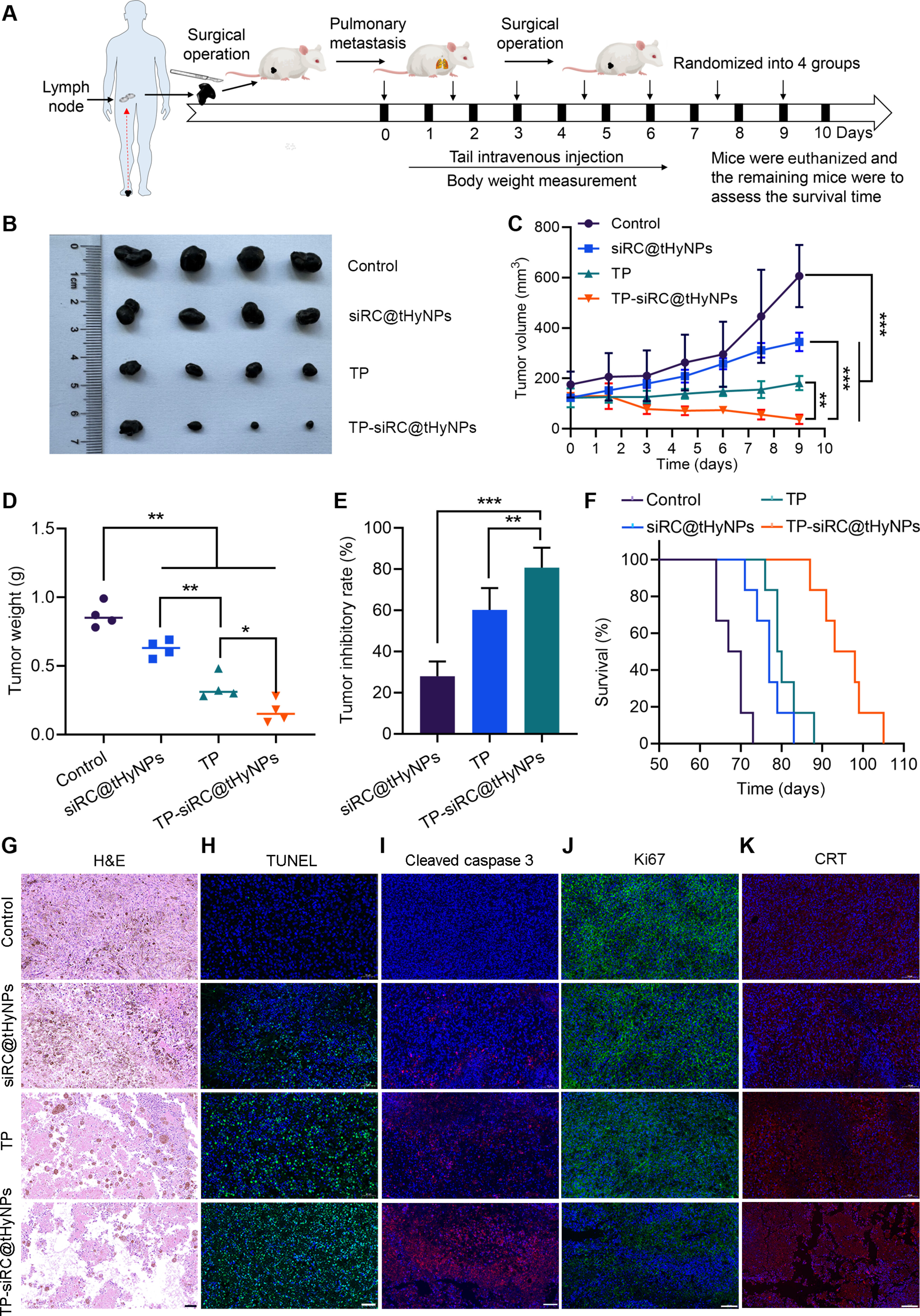
图9A:实验设计。将患者转移灶组织移植到B-NDG小鼠,建立PDX模型,评估TP-siRC@tHyNPs的疗效。
图9B-E:TP-siRC@tHyNPs组肿瘤体积、重量最小,抑制率达91.00±3.83%。
图9F:生存曲线显示,TP-siRC@tHyNPs组PDX小鼠生存期最长(>110天)。
图9G-K:HE显示肿瘤坏死明显;TUNEL、Cleaved-caspase3阳性细胞增加,Ki67降低,CRT暴露增加,验证了凋亡和ICD诱导效果。
这些结果表明,TP-siRC@tHyNPs在PDX模型中仍具有显著抗肿瘤活性,临床转化潜力高。
结论
本研究针对肺转移性黑色素瘤(PMM)治疗中现有疗法响应有限、雷公藤甲素(TP)代谢快且毒性大的问题,成功构建了靶向杂化纳米递送系统TP-siRC@tHyNPs。该系统通过融合高表达DR5单链可变片段(DR5-scFv)的工程化外泌体与共包载TP和CYP3A4-siRNA的脂质体,实现了多重协同效应:DR5-scFv介导对PMM细胞的特异性靶向,提升药物在肺部转移灶的富集;CYP3A4-siRNA有效抑制TP代谢,显著延长其半衰期(体内延长58倍);TP与DR5-scFv协同通过诱导免疫原性细胞死亡、重塑巨噬细胞表型、阻滞细胞周期及激活凋亡通路,强效抑制肿瘤生长与转移。在动物模型及患者来源异种移植(PDX)模型中,TP-siRC@tHyNPs均显著减少肺转移结节、延长生存期,且无明显系统毒性。该研究不仅为PMM的精准治疗提供了新型策略,也为解决天然药物代谢快、靶向性差的问题奠定了实验基础,具有重要的临床转化价值。

科研产品1:外泌体工程化系列
装载小分子药物+验证(紫外方法):焕新价3000元
装载miRNA+验证(qPCR方法):焕新价5000元
科研产品2:植物外泌体提取鉴定系列
服务内容:提取+粒径 +透射电镜,焕新价1999元/样本
活动时间:2025年9月4日-2025年9月30日
活动说明:本活动最终解释权归研载生物科技(上海)有限公司所有。






