研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Adv Sci】14+,工程化外泌体“新标杆”!IgG Fc修饰构建TExo-Fc,多技术验证+巨噬细胞吞噬,免疫应答直接拉满!
733 人阅读发布时间:2025-09-10 11:29
肿瘤来源外泌体(TExo)是阻碍抗肿瘤治疗的关键因素,其携带的PD-L1可耗尽CD8⁺细胞毒性T细胞以抑制免疫应答,还能在远端器官构建前转移微环境促进肿瘤转移。更关键的是,临床一线化疗药物(如阿霉素DOX)会刺激肿瘤释放更多TExo,加剧免疫抑制与转移风险,形成治疗恶性循环。现有TExo清除策略存在明显局限,GW4869等抑制剂仅能抑制TExo生成,无法清除已进入循环的TExo;适配体修饰纳米材料依赖TExo表面特异性标志物,阳性率低限制应用。

今天分享的是发表在【Advanced Science】(IF:14.1)上题为“Enhancing Chemotherapy‐Related Immune Responses via Bioorthogonal Metabolic Engineering‐Driven Tumor Exosomes Elimination”的研究。该研究开发“生物正交反应驱动外泌体清除(Biordee)”策略,通过代谢糖工程标记内源性TExo,结合生物正交反应将IgG Fc片段修饰于TExo表面(TExo-Fc),利用IgG Fc与巨噬细胞FcγRII/III受体的相互作用促进TExo吞噬,旨在打破化疗相关免疫抑制、抑制肿瘤转移,为增强化疗疗效提供新方案。
研究结果
1、Biordee策略清除TExo的机制示意图
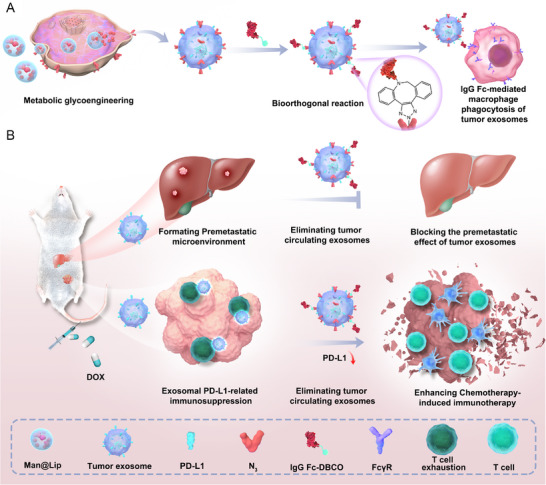
图1A:TExo-Fc构建与吞噬机制:①代谢糖工程:Man@Lip(甘露糖-N₃脂质体)被肿瘤细胞摄取,通过糖代谢将N₃基团标记于肿瘤细胞膜;②生物正交反应:肿瘤细胞分泌携带N₃的TExo(TExo-N₃),与DBCO修饰的IgG Fc(IgG Fc-DBCO)发生点击反应,生成TExo-Fc;③巨噬细胞吞噬:TExo-Fc表面的IgG Fc与巨噬细胞FcγRII/III受体结合,促进TExo被吞噬清除。
图1B:Biordee策略的治疗效应:①清除循环TExo,减少外泌体PD-L1介导的免疫抑制,增强化疗相关免疫应答;②阻断TExo构建前转移微环境的作用,抑制化疗诱导的乳腺癌肝转移;③DOX通过诱导肿瘤免疫原性死亡(ICD)激活免疫,Biordee策略通过清除TExo维持T细胞功能,二者协同增强抗肿瘤效果。
这些结果表明,Biordee策略通过“代谢标记-生物正交修饰-巨噬细胞吞噬”的三步流程,可针对性清除内源性TExo,同时解决化疗加剧TExo释放的问题,为协同增强化疗与免疫应答提供机制框架。
2、TExo-Fc的构建与表征
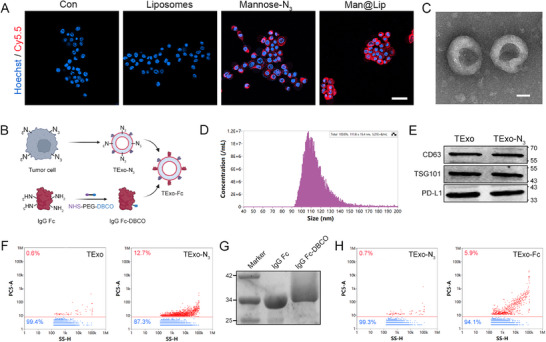
图2A:4T1细胞代谢标记验证。共聚焦成像显示,Man@Lip组4T1细胞膜被DBCO-CY5.5标记(红色荧光强),而PBS组、空白脂质体组、游离甘露糖-N₃组荧光弱,证实Man@Lip可高效通过糖代谢将N₃基团标记于肿瘤细胞膜。
图2B:TExo-Fc构建流程。TExo-N₃(肿瘤细胞分泌的N₃标记TExo)与IgG Fc-DBCO通过生物正交反应结合,生成TExo-Fc。
图2C:TExo-N₃的TEM表征。透射电镜显示TExo-N₃为典型杯状结构,粒径约100nm。
图2D:TExo-N₃的NTA分析。纳米颗粒追踪显示TExo-N₃粒径集中在80-120nm,浓度约1×10⁷particles/mL,符合外泌体特征。
图2E:TExo与TExo-N₃的Western blot验证。二者均表达外泌体标志物CD63、TSG101,且均携带immunosuppressive蛋白PD-L1,证实N₃标记不影响TExo的核心蛋白组成。
图2F:TExo与TExo-N₃的纳米流式分析。TExo-N₃被DBCO-CY5.5标记的阳性率(12.7%)显著高于未标记TExo(0.6%),证实N₃基团成功修饰于TExo表面。
图2G:IgG Fc-DBCO的考马斯亮蓝染色。IgG Fc-DBCO的电泳迁移速率慢于未修饰IgG Fc,且条带弥散,证实DBCO成功偶联于IgG Fc。
图2H:TExo-N₃与TExo-Fc的纳米流式分析。TExo-Fc的FITC荧光阳性率(5.9%)显著高于TExo-N₃(0.7%),证实IgG Fc通过生物正交反应成功修饰于TExo-N₃表面。
这些结果表明,通过代谢糖工程与生物正交反应,可高效构建TExo-Fc,且修饰过程不破坏TExo的基本结构与蛋白组成,为后续体内清除奠定基础。
3、IgG Fc促进巨噬细胞吞噬TExo
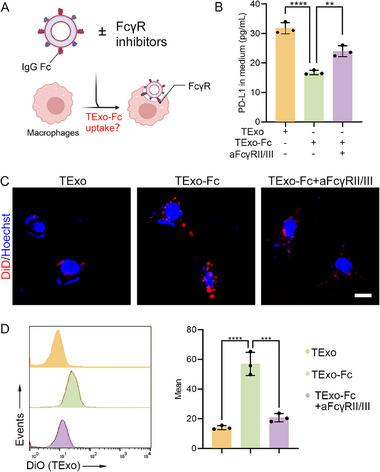
图3A:巨噬细胞吞噬TExo-Fc的机制示意图。TExo-Fc表面的IgG Fc与巨噬细胞表面FcγRII/III受体结合,触发吞噬信号,促进TExo-Fc被吞噬;加入抗FcγRII/III抗体可阻断该相互作用。
图3B:培养基中Exo-PD-L1的ELISA检测。与TExo组相比,TExo-Fc组培养基中PD-L1含量显著降低(约50%);加入抗FcγRII/III抗体后,PD-L1含量回升,证实巨噬细胞通过FcγRII/III受体吞噬TExo-Fc。
图3C:巨噬细胞吞噬的共聚焦成像。DiO标记的TExo-Fc(绿色)与巨噬细胞(蓝色细胞核)共定位信号强,加入抗FcγRII/III抗体后共定位减弱,直观证实FcγRII/III介导的吞噬作用。
图3D:流式细胞术定量。TExo-Fc组巨噬细胞吞噬率(约45%)显著高于TExo组(约15%),抗FcγRII/III抗体可将吞噬率降至约20%,进一步验证吞噬机制。
这些结果表明,TExo-Fc可通过IgG Fc与FcγRII/III的相互作用,显著促进巨噬细胞吞噬TExo,且该过程可被FcγRII/III抗体特异性阻断,证实机制的特异性。
4、清除内源性TExo抑制肿瘤生长
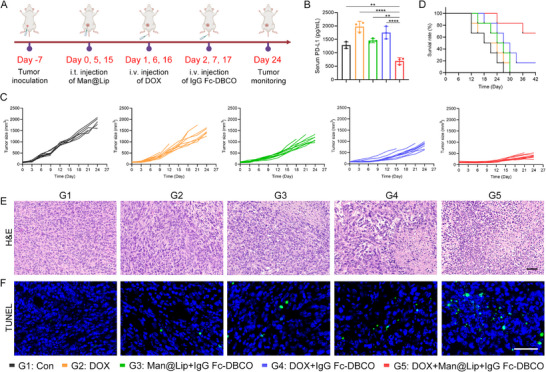
图4A:乳腺癌化疗模型实验设计。4T1荷瘤小鼠分为5组(G1:对照;G2:DOX;G3:Man@Lip+IgG Fc-DBCO;G4:DOX+IgG Fc-DBCO;G5:DOX+Man@Lip+IgG Fc-DBCO),第0、5、15天瘤内注射Man@Lip,第1、6、16天静脉注射DOX,第2、7、17天静脉注射IgG Fc-DBCO,监测肿瘤生长至第24天。
图4B:外周血Exo-PD-L1的ELISA检测。G5组外周血Exo-PD-L1水平(约10pg/mL)显著低于G2组(约20pg/mL)和G4组(约15pg/mL),证实Biordee策略可有效清除循环TExo;同时观察到DOX组(G2)Exo-PD-L1高于对照组(G1),证实化疗刺激TExo释放。
图4C:肿瘤生长曲线。G5组肿瘤体积(约150mm³)显著小于G2组(约400mm³)、G3组(约350mm³)和G4组(约250mm³),证实Biordee策略与DOX协同抑制肿瘤生长。
图4D:小鼠生存曲线。G5组小鼠中位生存期(约30天)显著长于G2组(约20天)、G3组(约22天)和G4组(约25天),证实策略可改善预后。
图4E:肿瘤组织HE染色。G5组肿瘤组织坏死区域显著大于其他组,证实协同治疗加剧肿瘤组织损伤。
图4F:肿瘤组织TUNEL染色。G5组TUNEL阳性细胞比例(约30%)显著高于其他组(G2组约10%,G4组约15%),证实协同治疗促进肿瘤细胞凋亡。
这些结果表明,Biordee策略可在体内有效清除化疗诱导释放的TExo,与DOX协同抑制肿瘤生长、促进肿瘤细胞凋亡,并延长荷瘤小鼠生存期,且无明显毒性。
5、清除内源性TExo增强全身抗肿瘤免疫应答
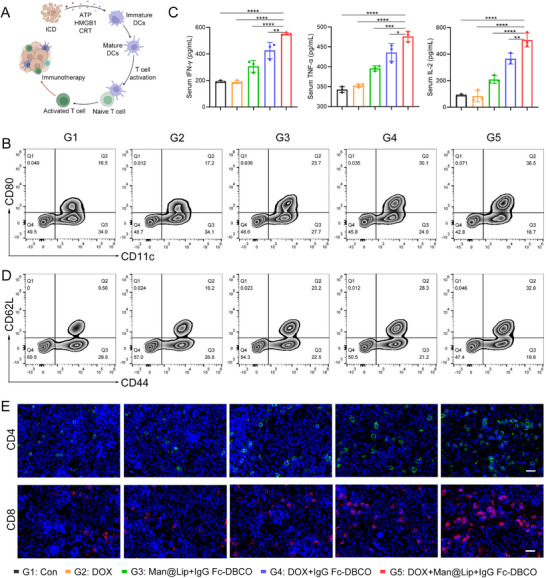
图5A:DOX诱导免疫应答的机制示意图。DOX诱导肿瘤细胞发生免疫原性死亡(ICD),释放ATP、HMGB1、CRT等损伤相关分子模式(DAMPs),激活树突状细胞(DC),进而促进T细胞活化与增殖。
图5B:脾脏DC成熟的流式分析。G5组CD11c⁺CD80⁺成熟DC比例(约7%)显著高于G2组(约4%)和G4组(约5%),证实清除TExo可进一步促进DC成熟;G3组(无DOX)也观察到DC成熟(约3%),推测与IgG Fc介导的抗体依赖细胞吞噬(ADCP)相关。
图5C:血清细胞因子的ELISA检测。G5组血清中IFN-γ(约500pg/mL)、TNF-α(约450pg/mL)、IL-2(约200pg/mL)水平显著高于G2组和G4组,证实清除TExo增强免疫细胞分泌促炎细胞因子。
图5D:脾脏记忆T细胞的流式分析。G5组CD44⁺CD62L⁺记忆T细胞比例(约7%)显著高于G2组(约3%)和G4组(约4%),证实清除TExo可促进记忆T细胞生成,有助于预防肿瘤复发。
图5E:脾脏T细胞的免疫荧光。G5组CD4⁺T细胞(红色)和CD8⁺T细胞(绿色)浸润密度显著高于其他组,直观证实全身T细胞应答增强。
这些结果表明,清除TExo可通过促进DC成熟、增强细胞因子分泌、增加记忆T细胞比例,强化DOX诱导的全身抗肿瘤免疫应答,为免疫协同治疗提供依据。
6、清除内源性TExo改善肿瘤免疫微环境
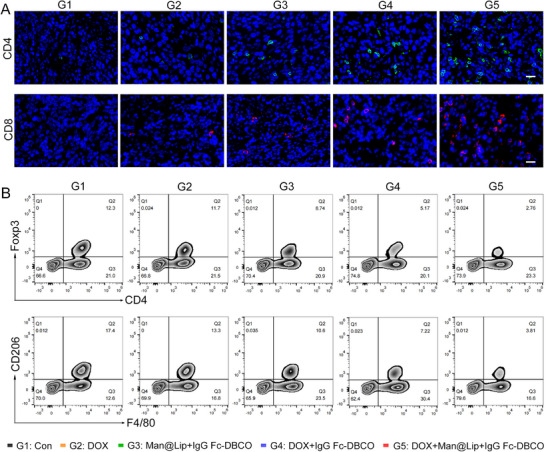
图6A:肿瘤组织T细胞的免疫荧光。G5组肿瘤内CD4⁺T细胞(红色)和CD8⁺T细胞(绿色)浸润密度显著高于G2组、G3组和G4组,证实清除TExo促进T细胞向肿瘤微环境浸润。
图6B:肿瘤组织免疫抑制性细胞的流式分析。G5组CD4⁺Foxp3⁺调节性T细胞(Treg,约2%)和F4/80⁺CD206⁺M2型巨噬细胞(约3%)比例显著低于G2组(Treg约5%,M2约7%)和G4组(Treg约4%,M2约5%),证实清除TExo可减少免疫抑制性细胞浸润。
这些结果表明,Biordee策略可通过“促进T细胞浸润+减少免疫抑制性细胞”双重作用,重塑肿瘤免疫微环境,打破免疫抑制状态。
7、清除内源性TExo抑制乳腺癌肝转移
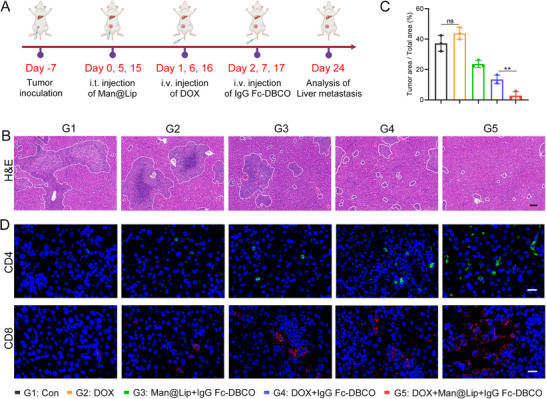
图7A:乳腺癌肝转移模型实验设计。与图4A一致,第24天解剖小鼠,分析肝脏转移情况。
图7B:肝脏组织HE染色。G2组(DOX单独处理)肝脏可见大量转移灶,G5组转移灶数量显著减少,证实Biordee策略抑制化疗诱导的肝转移。
图7C:肝脏转移灶定量。G5组肝脏转移灶数量(约5个/视野)显著低于G2组(约20个/视野)和G4组(约12个/视野)。
图7D:肝脏组织T细胞的免疫荧光。G5组肝脏内CD4⁺T细胞(红色)和CD8⁺T细胞(绿色)浸润密度显著高于其他组,证实免疫应答增强与转移抑制相关。
这些结果表明,Biordee策略可有效阻断TExo构建前转移微环境的作用,抑制化疗诱导的乳腺癌肝转移,且该效应与增强肝脏局部免疫应答相关。
结论
本研究成功开发“生物正交反应驱动外泌体清除(Biordee)”策略,通过代谢糖工程使肿瘤细胞分泌携带N₃基团的TExo(TExo-N₃),再经生物正交反应将IgG Fc修饰于TExo-N₃表面形成TExo-Fc,借助IgG Fc与巨噬细胞FcγRII/III受体的相互作用实现循环TExo的高效清除。体外实验证实该修饰过程不破坏TExo基本结构,且能显著促进巨噬细胞吞噬TExo;4T1乳腺癌小鼠模型中,Biordee策略与DOX协同作用,可清除化疗诱导释放的TExo,减少外泌体PD-L1介导的免疫抑制,促进树突状细胞成熟与T细胞活化,减少调节性T细胞和M2型巨噬细胞等免疫抑制细胞浸润,重塑肿瘤免疫微环境,最终抑制肿瘤生长与肝转移并延长小鼠生存期;在PD-L1低表达的231乳腺癌模型中,该策略仍能有效抑制转移,证实普适性。不过,策略的长期毒性(如是否误清除生理必需外泌体)、Man@Lip的靶向递送效率仍需进一步优化,为后续临床转化奠定基础。效率仍需进一步优化,为后续临床转化奠定基础。






