研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
“植物外泌体”临床转化新潜力!低成本PEG分离+FSTL1验证,实现发文8+,操作简单易复现!
534 人阅读发布时间:2025-09-12 16:25
植物来源的外泌体样纳米囊泡(PDNVs)是从可食用植物中分离的类外泌体囊泡,内部包裹多种具有治疗价值的植物生物活性物质,且具有良好的生物利用度,还可作为纳米载体递送 cargo 分子,同时兼容工业化纯化工艺,是潜在的新型局部治疗剂。

湾湾今天分享的是一篇发表在【International Journal of Biological Macromolecules】(IF:8.5)上题为“Mango ginger-derived exosome-like nanovesicles promotes diabetic wound healing via inducing the promigratory protein, follistatin-like 1”的研究,该研究从姜科和柑橘植物中分离出PDNVs,并研究它们对HaCaT角质细胞的作用,在划痕伤口实验中观察神经细胞迁移情况。在所筛选的七种PDNV中,芒果姜PDNVs(MGDNV)显著促进了体外伤口愈合,而其他PDNVs则对角质形成细胞迁移具有抑制作用或没有影响。此外,研究还证明,MGDNVs可能通过下调其上游调节因子KSRP蛋白来诱导FSTL1的表达,从而促进角质形成细胞迁移,在HaCaT细胞中诱导FSTL1的表达可使MGDNV水凝胶制剂的局部应用恢复糖尿病小鼠的缺陷性伤口愈合。除了这一功能之外,MGDNV的局部治疗还对伤口环境产生了有益的免疫调节作用。同时,MGDNV在猪耳皮肤中的经皮渗透性,使其非常适合用于人类皮肤应用,这是首次关于从芒果姜中分离并鉴定出具有明确生物学功能的PDNVs的报告。综合来看,研究结果证实了MGDNV在安全有效治疗糖尿病溃疡伤口方面的潜力。
研究成果
1.芒果姜PDNVs(MGDNV)促进体外伤口愈合
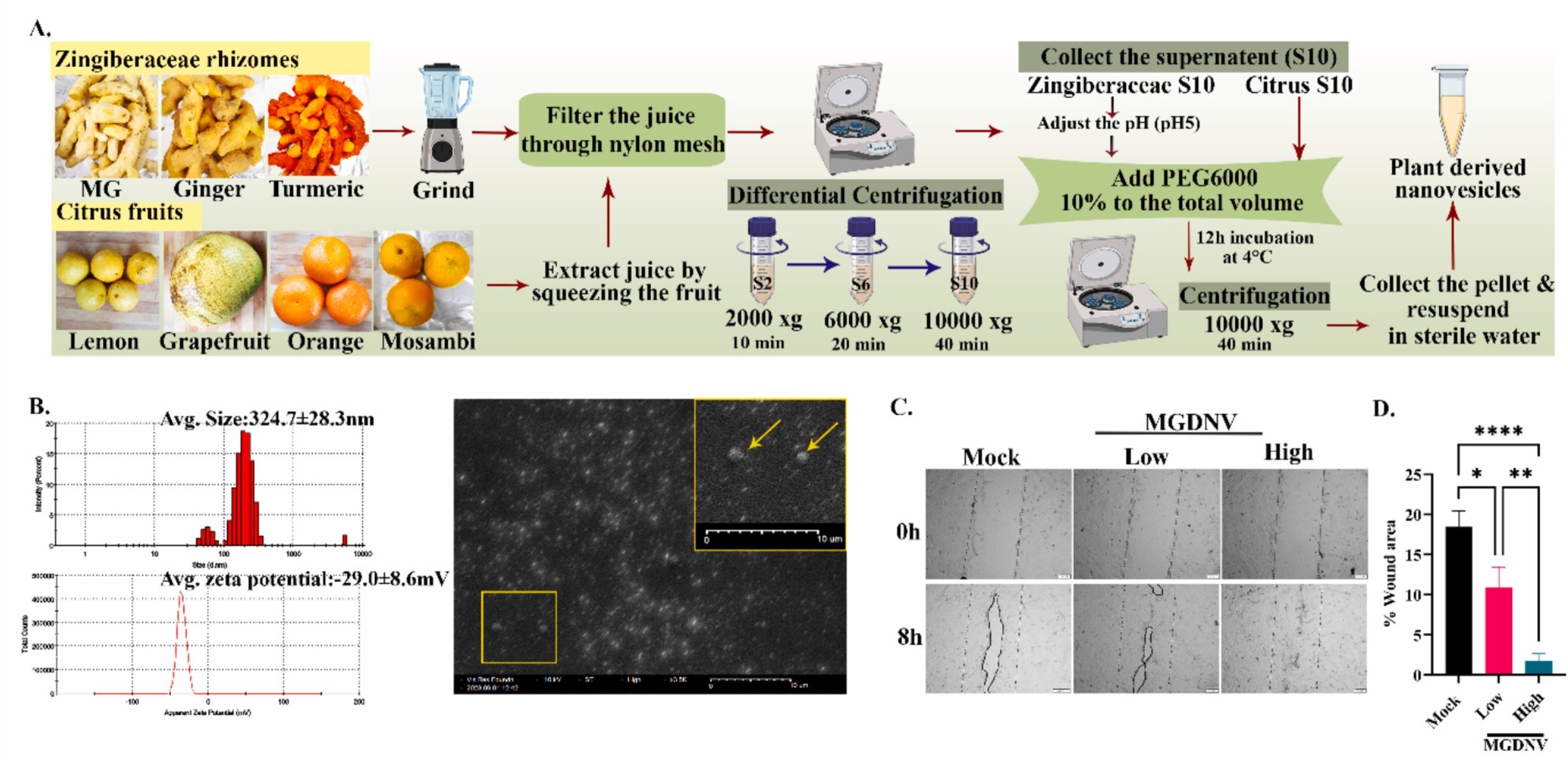
图1A:PDNVs的分离流程图。
图1B:MGDNV的生物物理特性。结果显示其平均粒径为324.7±28.3 nm,zeta电位为-29.0±8.6 mV,扫描电镜(SEM)图像显示其具有典型的纳米囊泡形态,且zeta电位提示良好的胶体稳定性。
图1C:HaCaT细胞划痕实验的代表性图像。结果显示在8h时,未处理组(Mock)伤口愈合缓慢,低浓度和高浓度MGDNV处理组伤口愈合明显加快,高浓度组愈合效果更优。
图1D:相对伤口闭合率的量化结果。结果显示8h时MGDNV低、高浓度组的相对伤口闭合率显著高于未处理组,且呈剂量依赖性。
这些结果表明,从芒果姜中分离的MGDNV具有合适的纳米粒径和良好的胶体稳定性,且能在体外显著促进HaCaT角质形成细胞的划痕伤口愈合,其促愈合效果具有剂量依赖性。
2. MGDNV通过诱导FSTL1的表达促进HaCaT细胞的伤口愈合
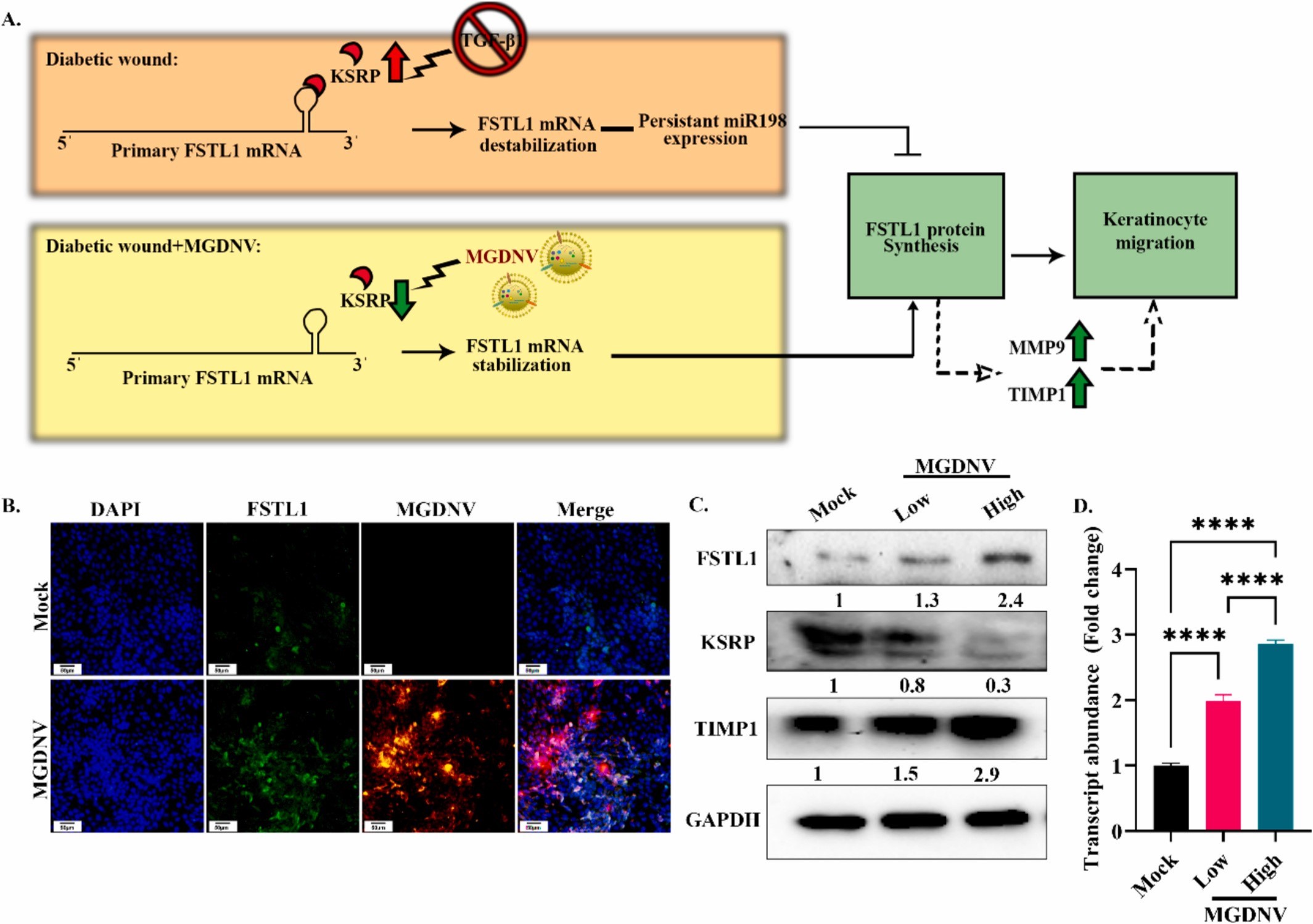
图2A:KSRP-FSTL1分子轴及MGDNV作用机制的示意图。
图2B:HaCaT细胞经MGDNV处理24h后的免疫细胞化学图像。结果显示MGDNV处理组FSTL1阳性细胞数量显著多于未处理组,且MGDNV内化的细胞中FSTL1染色更亮,提示MGDNV内化与FSTL1诱导存在直接关联。
图2C:Westernblot检测。结果显示HaCaT细胞经低、高浓度MGDNV处理后,FSTL1和其下游靶蛋白TIMP1的表达呈剂量依赖性升高,而KSRP蛋白表达呈剂量依赖性降低。
图2D:qRT-PCR检测MMP9 mRNA相对表达量的柱状图。结果显示MGDNV处理组MMP9 mRNA表达显著高于未处理组,证实FSTL1下游靶基因表达上调。
这些结果表明,MGDNV通过下调KSRP蛋白表达,解除其对FSTL1mRNA的不稳定性调控,促进FSTL1蛋白合成,并上调其下游靶标(MMP9、TIMP1)的表达,进而推动HaCaT角质形成细胞迁移。
3.MGDNV的细胞内摄取机制
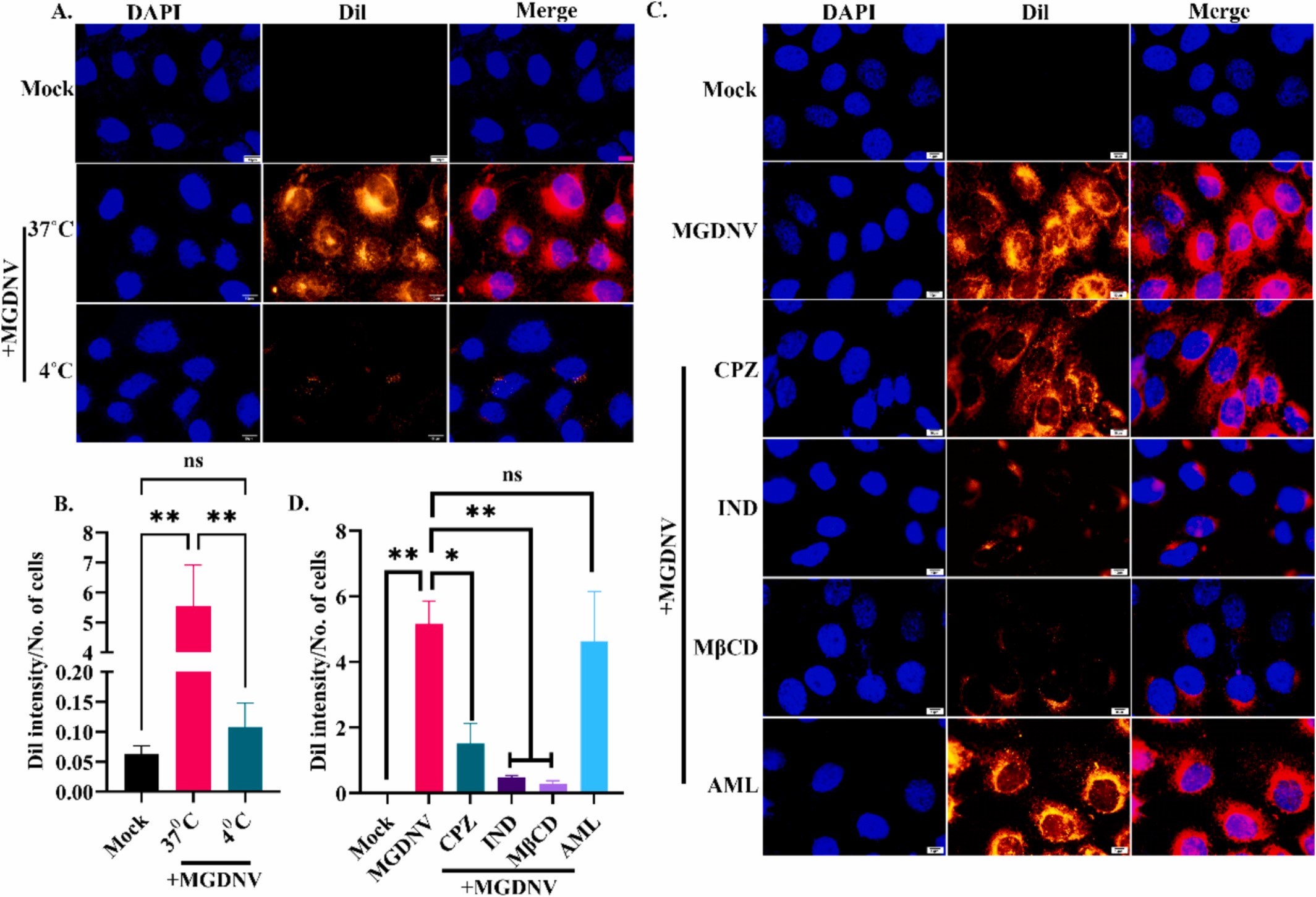
图3A:HaCaT细胞在37℃和4℃下与Dil标记MGDNV孵育4h的荧光图像。结果显示37℃组细胞内红色荧光显著强于4℃组,表明MGDNV的细胞摄取为温度依赖性的主动内吞过程。
图3B:相对Dil荧光强度的量化结果。结果显示37℃组相对荧光强度显著高于4℃组,进一步证实主动内吞的必要性。
图3C:HaCaT细胞经不同内吞抑制剂预处理后的荧光图像。结果显示脂筏抑制剂甲基-β-环糊精(MβCD)和小窝蛋白抑制剂吲哚美辛(IND)预处理组细胞内红色荧光显著减弱,网格蛋白抑制剂氯丙嗪(CPZ)组部分减弱,巨胞饮抑制剂阿米洛利(AML)组无明显变化。
图3D:相对Dil荧光强度的量化。结果显示MβCD和IND组相对荧光强度显著低于对照组,CPZ组部分降低,AML组无显著差异。
这些结果表明,MGDNV通过主动内吞作用进入HaCaT细胞,具体依赖于胆固醇/小窝蛋白介导、网格蛋白介导的内吞途径,而不依赖于巨胞饮途径。
4. STZ诱导糖尿病小鼠模型与MGDNV水凝胶制备
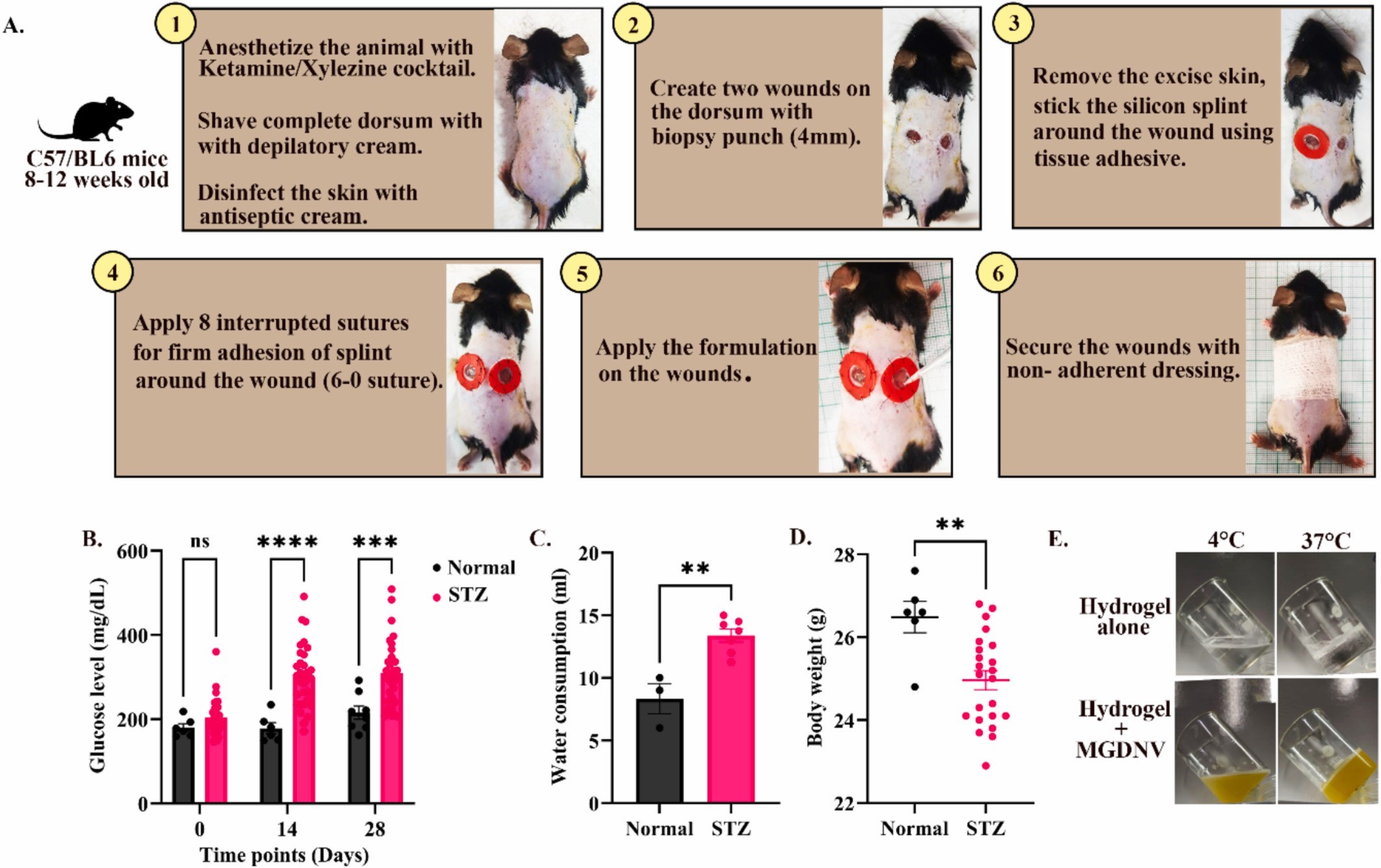
图4A:小鼠夹板伤口模型建立的流程图。
图4B:STZ注射后不同时间点小鼠血糖水平的折线图。结果显示正常组血糖维持在正常范围,STZ处理组血糖从注射后逐渐升高,14天和28天显著高于正常组,证实糖尿病模型建立。
图4C:正常组与STZ处理组小鼠饮水量的柱状图。结果显示STZ处理组饮水量显著高于正常组,符合糖尿病小鼠多饮的典型症状。
图4D:正常组与STZ处理组小鼠体重的柱状图。结果显示STZ处理组体重显著低于正常组,符合糖尿病小鼠体重下降的特征。
图4E:MGDNV水凝胶的物态图。结果显示制备的水凝胶在4℃时为液态(便于混合MGDNV),37℃时固化(适合局部给药后滞留伤口),证实其温敏特性。
这些结果表明,通过连续腹腔注射STZ成功建立小鼠1型糖尿病模型(血糖升高、多饮、体重下降),且制备的MGDNV温敏水凝胶具有合适的温度响应性,可满足局部给药需求。
5.外用MGDNV水凝胶通过诱导FSTL1促进糖尿病小鼠伤口愈合
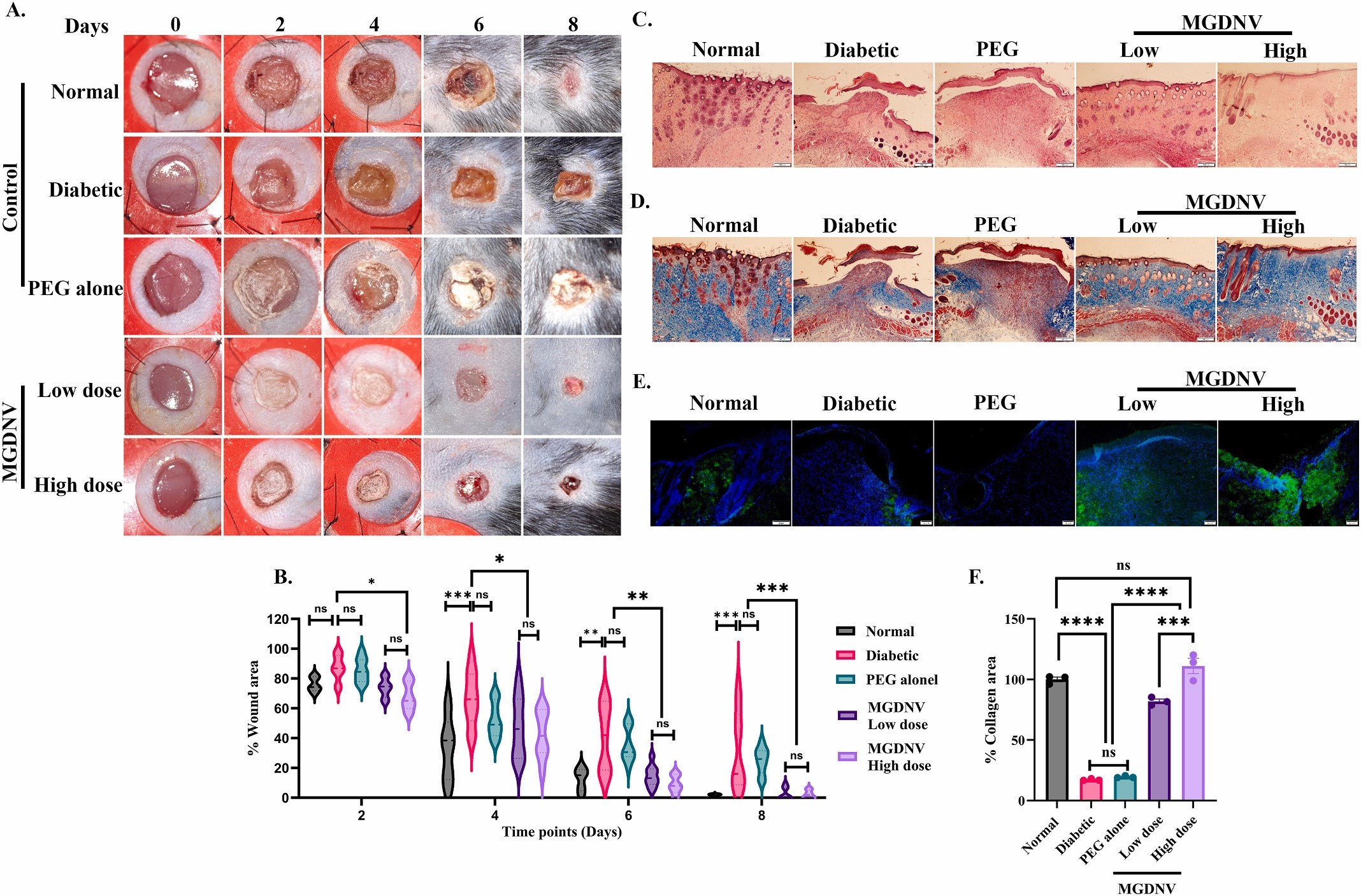
图5A:不同组小鼠伤口在0、2、4、6、8天的代表性图像。结果显示MGDNV处理组伤口愈合速度显著快于糖尿病组和PEG对照组,8天时接近正常组愈合状态。
图5B:不同组小鼠相对伤口面积的折线图。结果显示8天时MGDNV低、高剂量组伤口闭合率>90%,显著高于糖尿病组和PEG组。
图5C:伤口组织HE染色图像。结果显示正常组和MGDNV处理组伤口处可见明显的增生表皮(表皮舌),而糖尿病组和PEG组缺乏增生表皮,提示MGDNV促进角质形成细胞迁移和表皮再生。
图5D:伤口组织Masson三色染色图像。结果显示MGDNV处理组伤口处胶原沉积量显著高于糖尿病组和PEG组,接近正常组,表明MGDNV促进细胞外基质合成。
图5E:伤口组织FSTL1免疫组化图像。结果显示正常组皮肤中FSTL1表达于真皮成纤维细胞,糖尿病组和PEG组伤口处无FSTL1阳性染色,MGDNV处理组在增生表皮和真皮细胞(免疫细胞和成纤维细胞)中均有显著FSTL1表达。
图5F:伤口组织胶原阳性面积的量化柱状图。结果显示MGDNV处理组胶原阳性面积显著高于糖尿病组和PEG组。
这些结果表明,局部应用MGDNV水凝胶可显著修复糖尿病小鼠的伤口愈合缺陷,通过诱导FSTL1表达,促进伤口闭合、表皮增生和胶原沉积,恢复正常伤口愈合进程。
6. MGDNV调控糖尿病伤口局部免疫微环境
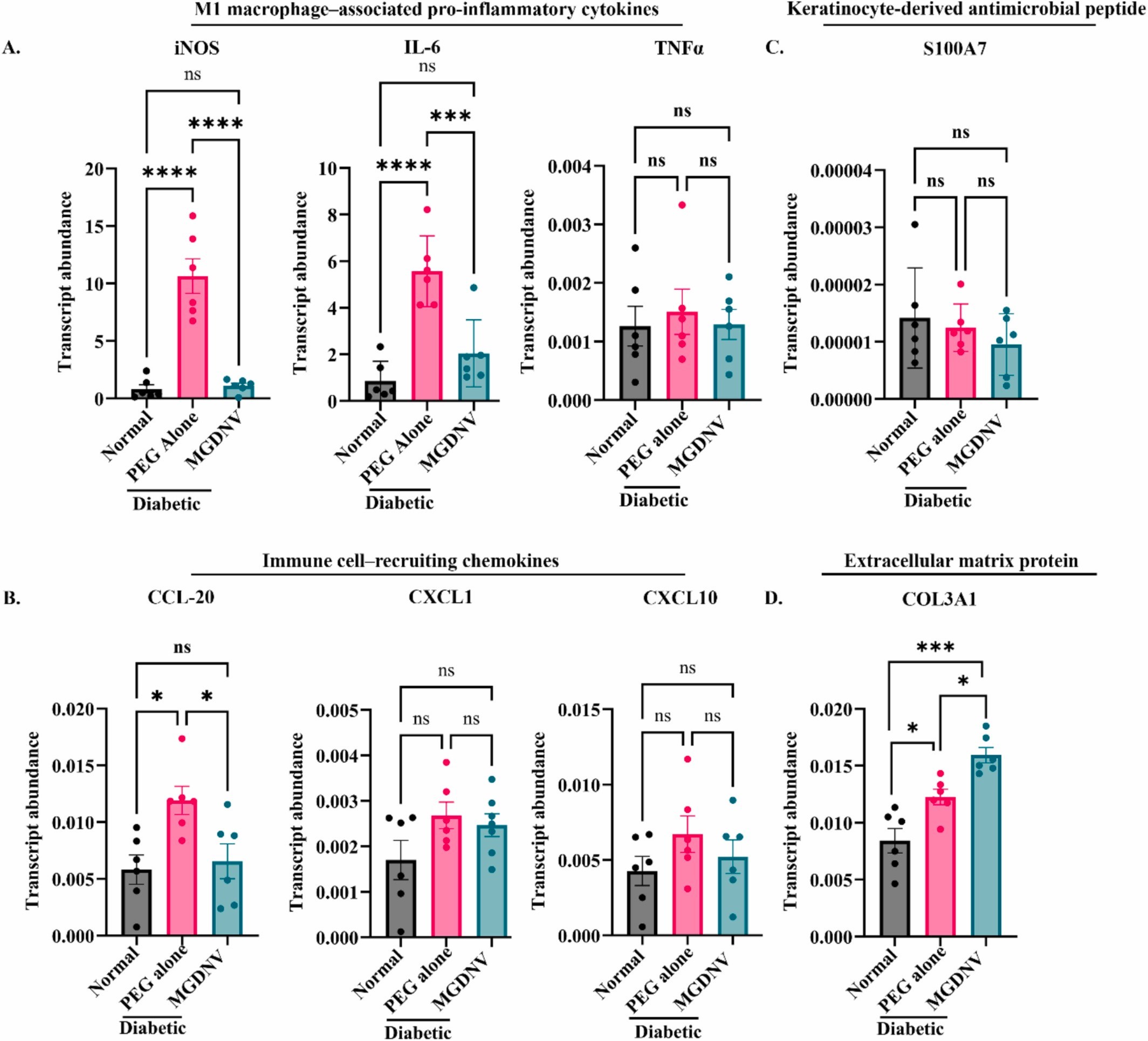
图6A:伤口组织M1巨噬细胞相关促炎因子mRNA表达的柱状图。结果显示糖尿病组iNOS和IL-6mRNA表达显著高于正常组,TNF-α无显著变化;MGDNV处理组iNOS和IL-6表达显著下调,提示MGDNV抑制M1型炎症反应。
图6B:伤口组织趋化因子mRNA表达的柱状图。结果显示糖尿病组CCL20(募集树突状细胞和Th17细胞)表达显著升高,CXCL1和CXCL10无显著变化;MGDNV处理组CCL20表达显著下调,CXCL1和CXCL10无显著变化,表明MGDNV选择性调节趋化因子。
图6C:伤口组织抗菌肽S100A7mRNA表达的柱状图。结果显示各组间S100A7表达无显著差异,提示MGDNV不影响角质形成细胞抗菌肽分泌。
图6D:伤口组织COL3A1(III型胶原编码基因)mRNA表达的柱状图。结果显示MGDNV处理组COL3A1表达显著高于糖尿病组和PEG组,证实MGDNV促进细胞外基质修复。
这些结果表明,MGDNV通过抑制M1巨噬细胞相关促炎因子(iNOS、IL-6)和趋化因子CCL20的表达,上调细胞外基质蛋白COL3A1,优化伤口局部免疫微环境,进而促进糖尿病伤口愈合,且不影响抗菌肽S100A7的表达。
7. MGDNV对小鼠重要器官无毒性
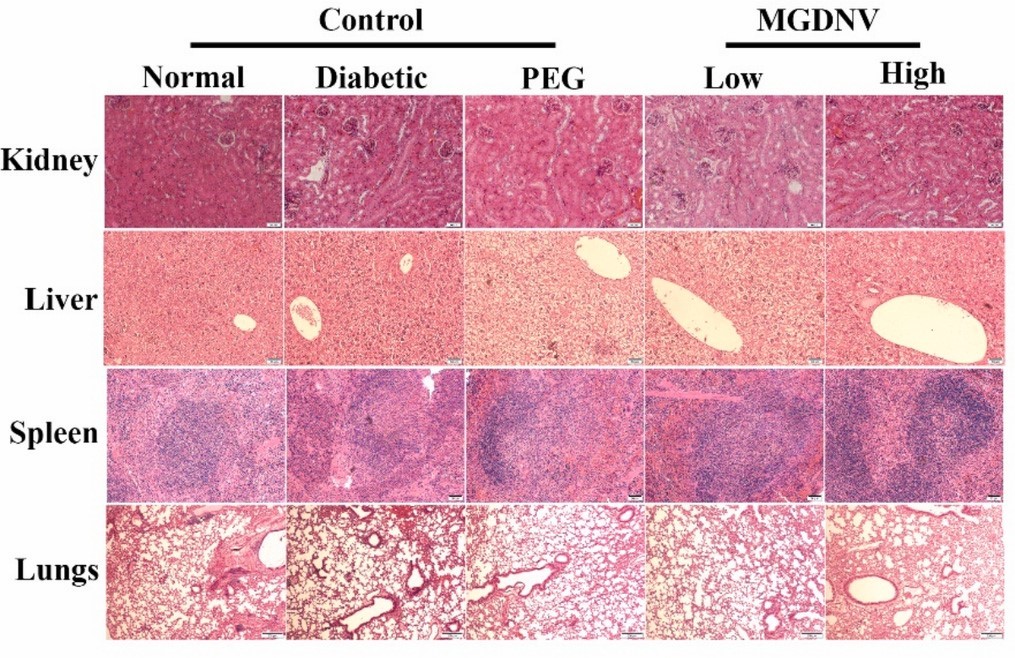
图7:不同组小鼠肾脏、肝脏、脾脏、肺脏的HE染色图像。结果显示所有组小鼠的肾脏(肾小球、肾小管)、肝脏(肝细胞、肝小叶)、脾脏(脾小结、红髓)、肺脏(肺泡、支气管)均无明显组织学异常。
这表明,局部应用MGDNV水凝胶不会对小鼠肾脏、肝脏、脾脏、肺脏等重要器官造成毒性损伤,提示MGDNV具有良好的体内生物安全性。
8. MGDNVs在猪的体外皮肤实验中表现出经皮穿透性
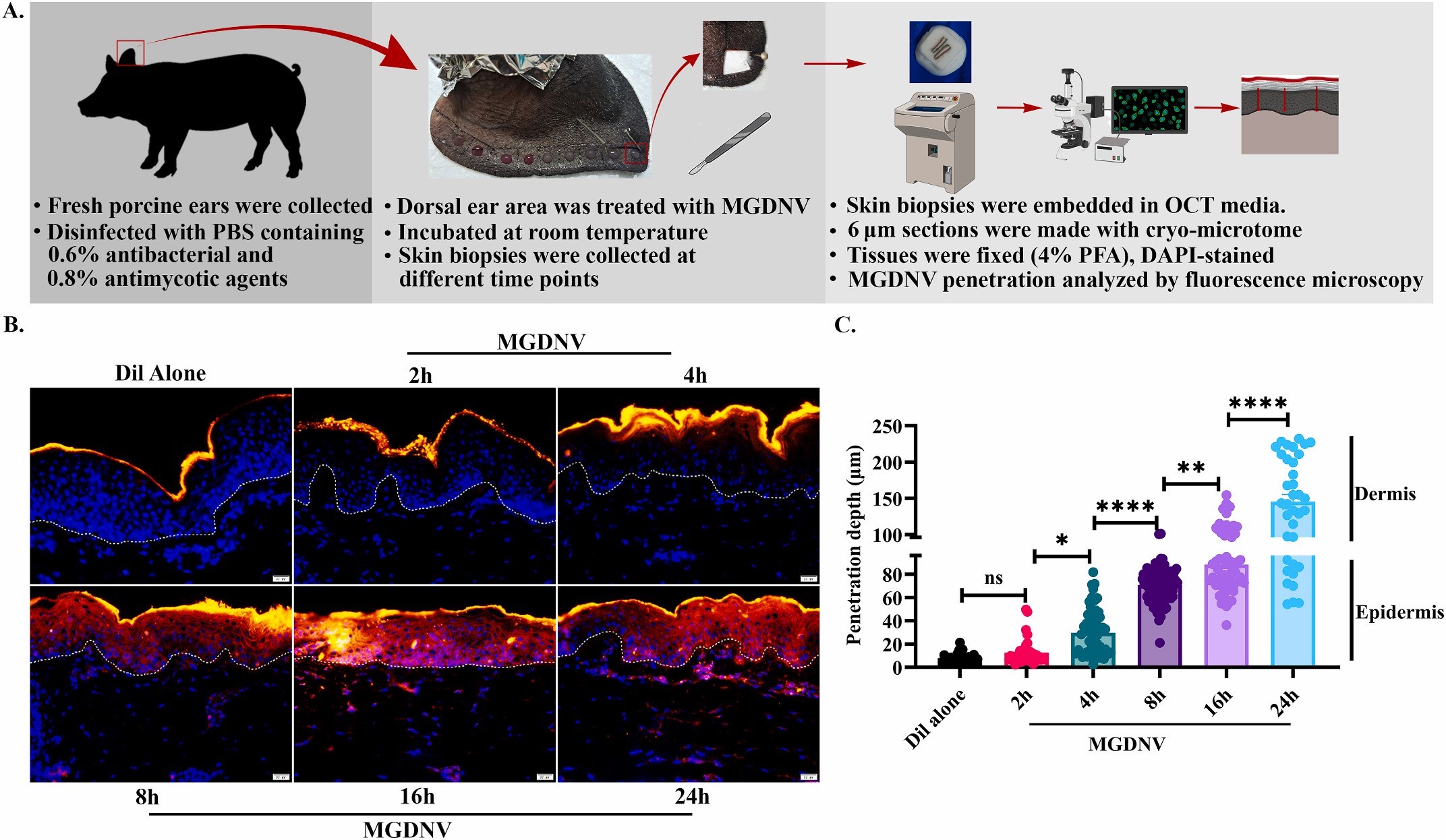
图8A:猪皮肤经皮渗透实验的流程图。
图8B:猪皮肤切片的荧光图像。结果显示单独Dil的荧光仅局限于角质层,MGDNV结合的Dil荧光呈时间依赖性穿透表皮,2h时达表皮浅层,8h至表皮中层,16h接近真皮层,24h到达真皮乳头层。
图8C:MGDNV在猪皮肤中渗透距离的量化柱状图。结果显示渗透距离随孵育时间延长而显著增加,24h时渗透距离显著大于2h、8h、16h。
这些结果表明,MGDNV在离体猪皮肤中具有良好的经皮渗透能力,且渗透深度呈时间依赖性,能穿透表皮到达真皮层;由于猪皮肤与人类皮肤的结构和功能高度相似,提示MGDNV在人类糖尿病伤口局部治疗中具有潜在应用可行性。
结论
本研究围绕糖尿病慢性伤口治疗的临床需求,从姜科和柑橘科植物中筛选并鉴定出芒果姜来源的外泌体样纳米囊泡(MGDNV),并通过“体外筛选-机制解析-体内验证-透皮评估”的研究链证实了其促伤口愈合功效及机制。






