研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
缺氧下MSC细胞分泌的携带miR-216a-5p外泌体可通过调控小胶质细胞M1/M2极化修复外伤性脊髓损伤
3894 人阅读发布时间:2020-02-17 11:23
脊髓损伤(SCI)可能导致严重的运动和感觉功能障碍,致残率和死亡率较高。近年来,间充质干细胞(MSC)分泌的外泌体已显示出促SCI后功能行为恢复的巨大潜力。然而,MSC通常在体外暴露于常氧,这与体内低氧微环境有很大的不同。因此,由南京医科大学第一医院骨科的刘伟在Journal of Neuroinflammation杂志上发表的一篇文章,确定了在小鼠SCI后,低氧MSC的外泌体(HExos)对SCI正常行为恢复表现出更大的作用,并探究了其潜在机制。
文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7001326/

研究结果:
1.骨髓间充质干细胞的鉴定
从小鼠体内分离的骨髓间充质干细胞(BMSC)形态呈纺锤状(图SA)。茜素红,奥利红O和阿尔辛蓝染色分别鉴定BMSC的成骨,成脂和成软骨分化(图S1B)。流式细胞仪分析确认了CD73和CD105呈阳性表达,但对CD34和CD45呈阴性(图S1C)。表明成功分离培养BMSC细胞。
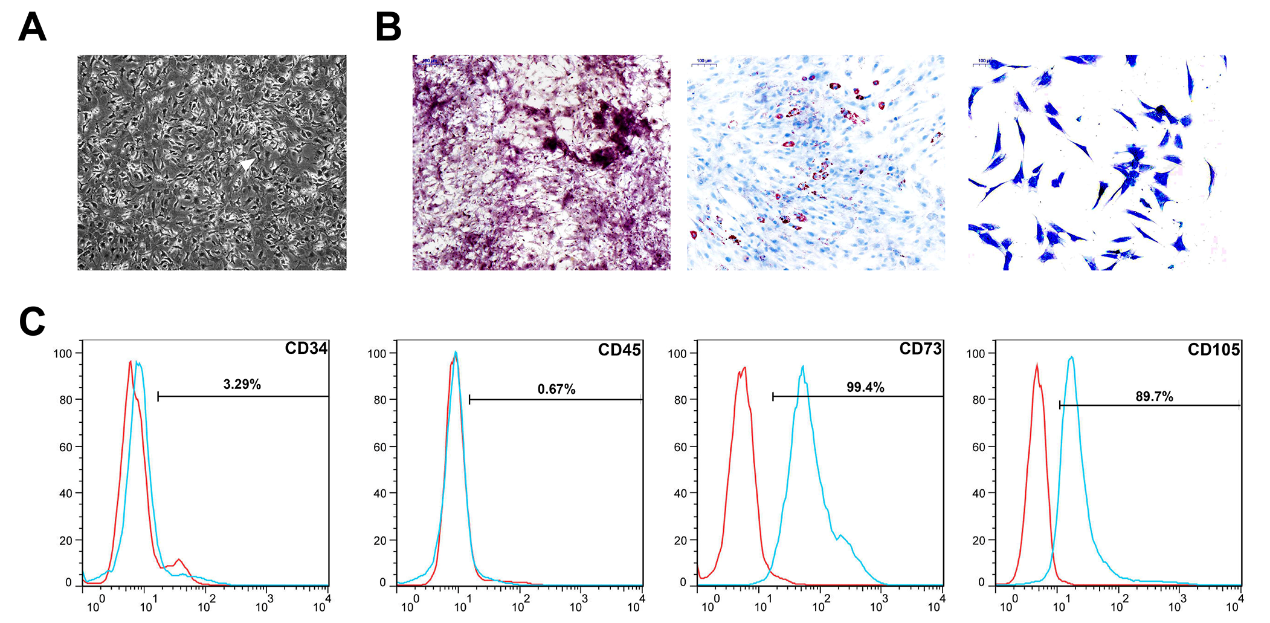
Figure S1 骨髓间充质干细胞的鉴定
2.低氧促进BMSC细胞释放外泌体
使用TEM、NTA和Western blot对BMSCs在常氧和低氧(1%O 2)培养条件下分泌的外泌体进行分析鉴定(图 1A,B)。两组之间在大小,形状或电子密度方面均未观察到形态学差异。Western blot发现TSG101,CD9,CD63,CD81在低氧组中表达较常氧高(图1C)。此外,与常氧Exos相比,低氧组HExos的蛋白质浓度更高(图 1D)。表明低氧可诱导外泌体的释放。
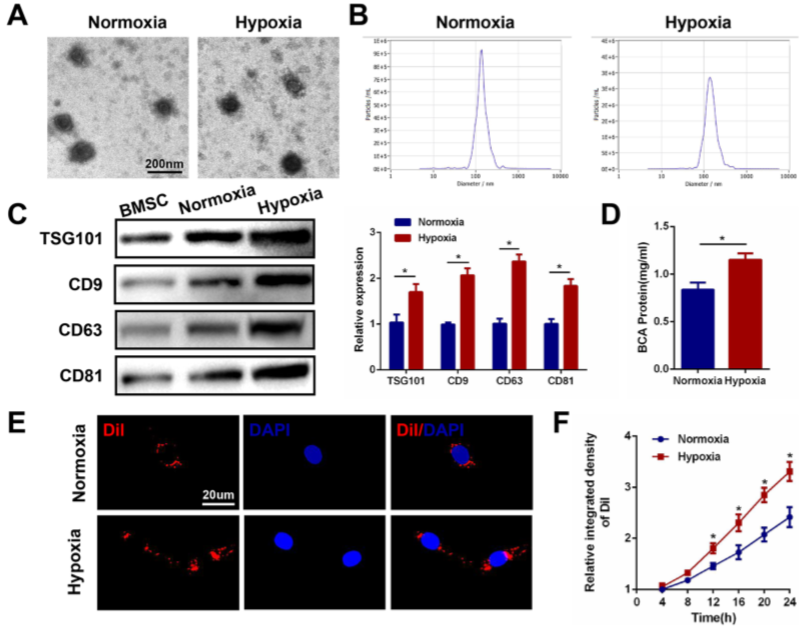
Figure 1 低氧促进BMSC细胞释放外泌体
3.BV2细胞摄取外泌体的差异取决于氧
为了探究BV2细胞是否正常吸收了Exos和HExos,使用Dil标记外泌体,与BV2共培养24hrs。如图1E所示,与Exos相比,BV2细胞对摄取较多,图 1F表明两组之间在12hrs后有明显统计学差异显著,表明HExos更易被BV2细胞吸收。
4.与Exos相比HExos促进SCI后的功能行为恢复
为研究HExos是否能比Exos对SCI后的功能行为恢复更有益,使用BMS评估小鼠的功能行为恢复,如图 2A,HExos组和的小鼠比PBS组的小鼠表现出更好的功能改善,但HExos组效果更佳。与PBS组和Exos组小鼠相比,HExos组小鼠显示更快步态恢复和运动的协调(图 2B)。用Exos或HExos治疗后,脊髓病变面积明显小于PBS组(图 2C),且HExos组的病变面积明显小于Exos组。在SCI后第3天对小鼠进行MRI分析,与Exos组相比注射HExos显著减少病变区域(图 2C)。同时如图2E,与PBS组相比,Exos组的NeuN阳性神经元数量增加,HExos组的神经元数量明显多于Exos组。通过对神经丝(NF200)的200 kDa亚基进行免疫染色分析,损伤28天后与远区相比,HExos组病变区域NF200的染色减少(图2F)。为了进一步研究运动功能行为恢复,应用了电生理分析,如图2G,MEP振幅检测表明HExos组比Exos组显示出更高的电生理功能恢复。综上所述,Exos和HExos均可促进小鼠SCI后的功能行为恢复,但HExos治疗效果更为明显。
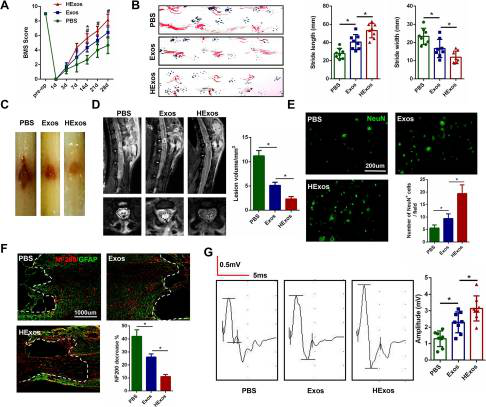
Figure 2 与Exos相比HExos促进SCI后的功能行为恢复
5.HExos给药促进体内小胶质细胞/巨噬细胞极化从M1变为M2表型
ELISA测定不同组脊髓中促炎细胞因子(TNF-α,IL-1β和IL-6)的浓度以及抗炎细胞因子(TGF-β,IL-4和IL-10)的浓度,结果显示,与PBS组相比,用Exos和HExos可以降低促炎细胞因子的浓度并提高抗炎细胞因子的浓度。但是,与Exos相比,HExos作用更加显著(图 3A)。如图3B,与PBS组相比,Exos组和HExos组M2基因(Arg1,CD206,YM1 / 2)表达增加,M1基因(iNOS,TNF-α,IL-1β)的表达减少。与Exos组相比,HExos组的M2基因表达较高,而M1表达较低。Western blot也证实了此结果(图3C)。 此外,对iNOS、Arg1和Iba1进行双免疫荧光染色,评估了SCI后不同组中小胶质细胞/巨噬细胞的极化特性,如图3D-F,三组中Iba1阳性小胶质细胞/巨噬细胞的数量没有显着差异,但在病变处观察到iNOS阳性小胶质细胞显着减少,而Arg1阳性小胶质细胞/巨噬细胞较多。与Exos组相比,HExos组中iNOS阳性小胶质细胞/巨噬细胞的数量趋于减少,而Arg1阳性小胶质细胞/巨噬细胞的数量增加。因此,HExos对SCI后抗炎表型与促炎表型的比率具有显着影响,并且可能使小胶质细胞/巨噬细胞从M1极化为M2。
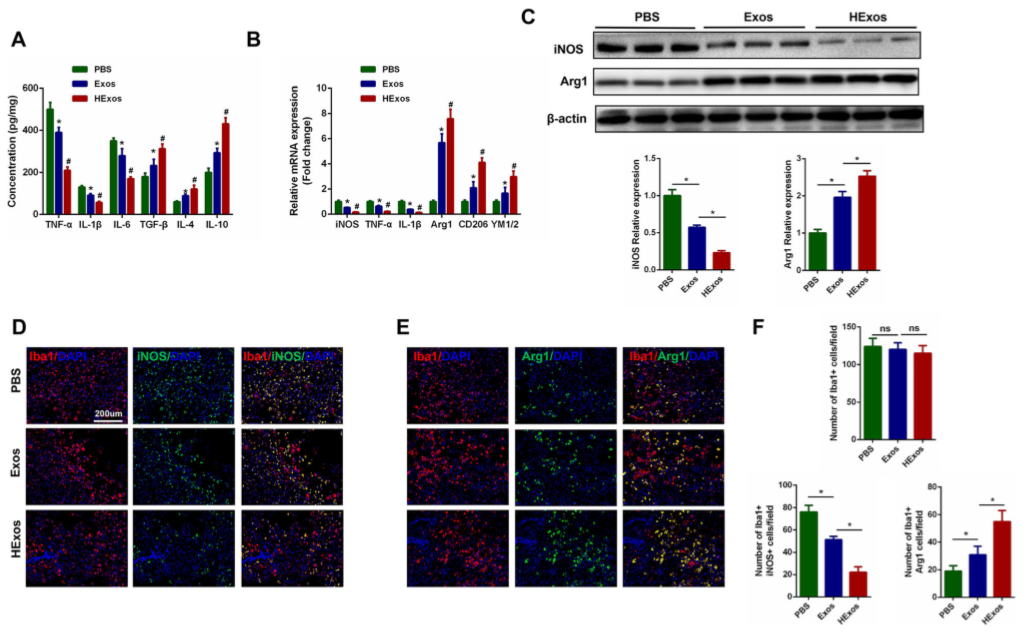
Figure 3 SCI后HExos处理可促进小鼠体内小胶质细胞/巨噬细胞从M1极化为M2
6.HExos 在体外促BV2细胞和PM细胞从M1极化为M2
LPS处理BV2细胞和原代胶质细胞(PM)24hrs,以模拟SCI环境,再加入PBS,Exos或HExos之前处理,48hrs后,发现Exos和HExos均可抑制TNF-α, IL-1β和 IL-6浓度并促进TGF-β, IL-4和IL-10分泌(图 4A,C)。且HExos发挥了更大的作用。同时Exos和HExos可降低M1标志基因的表达并增加M2标志基因的表达,且HExos作用更显著,这与体内结果相似(图 4B-F)。iNOS和Arg1的表达水平亦受HExos的影响(图4G,H)。因此,在体外,HExos可将BV2和PM细胞极化为M2。
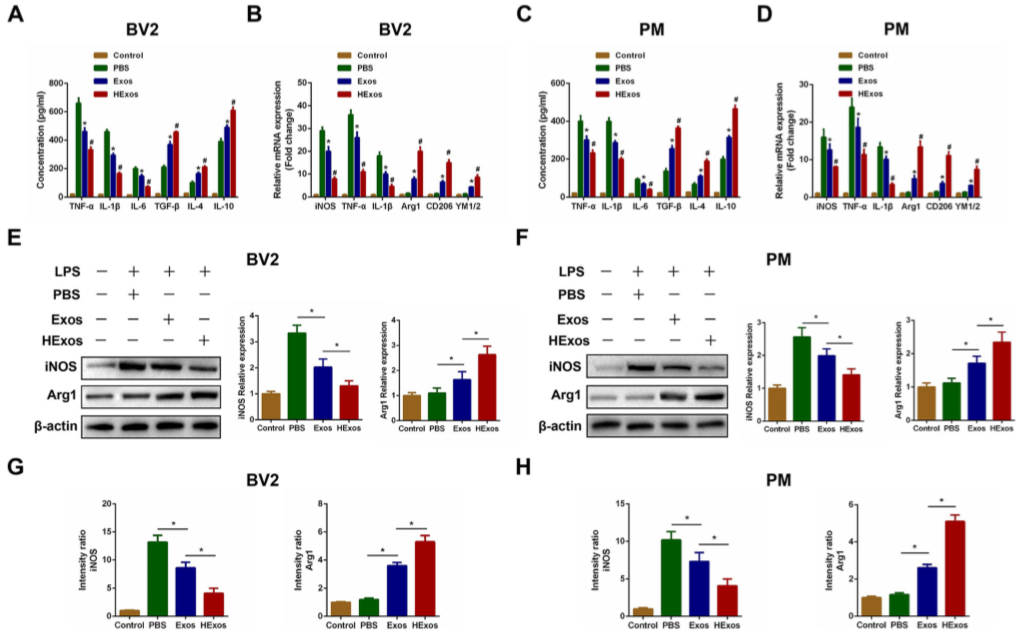
Figure 3 SCI后HExos处理可促进小鼠体内小胶质细胞/巨噬细胞从M1极化为M2
6.HExos 在体外促BV2细胞和PM细胞从M1极化为M2
LPS处理BV2细胞和原代胶质细胞(PM)24hrs,以模拟SCI环境,再加入PBS,Exos或HExos之前处理,48hrs后,发现Exos和HExos均可抑制TNF-α, IL-1β和 IL-6浓度并促进TGF-β, IL-4和IL-10分泌(图 4A,C)。且HExos发挥了更大的作用。同时Exos和HExos可降低M1标志基因的表达并增加M2标志基因的表达,且HExos作用更显著,这与体内结果相似(图 4B-F)。iNOS和Arg1的表达水平亦受HExos的影响(图4G,H)。因此,在体外,HExos可将BV2和PM细胞极化为M2。
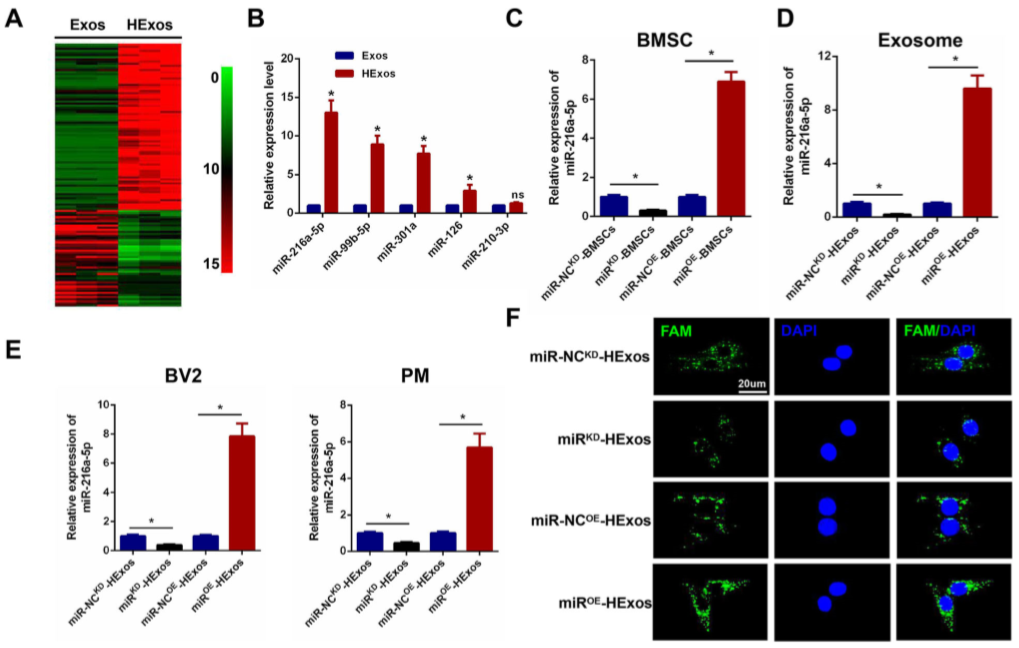
Figure 5 miR-216a-5p在HExos中上调,并通过外泌体转移到BV2和PM细胞中
8.在体内HEXos通过miR-216a-5p促进小胶质细胞/巨噬细胞从M1型转为M2型
如图6A,C,miR OE -HExos的使用可下调SCI小鼠脊髓组织中的促炎细胞因子,上调脊髓组织中的抑炎细胞因子。miROE -HExos促进小胶质细胞/巨噬细胞从M1型转M2型,而miR KD -HExos的使用得到相反的结果(图6B-F)。同时,IF结果证实此结果(图6G)。
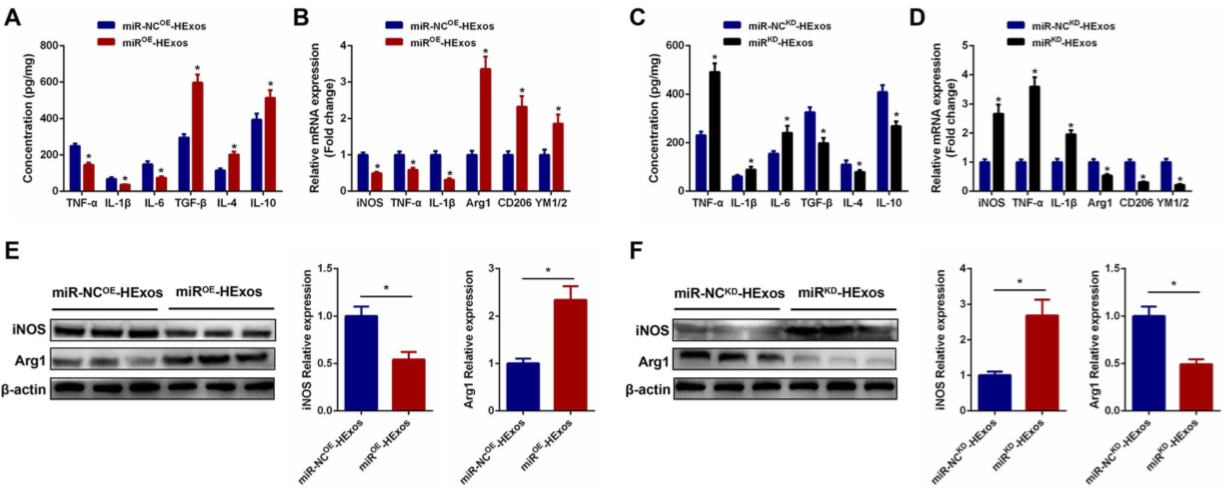
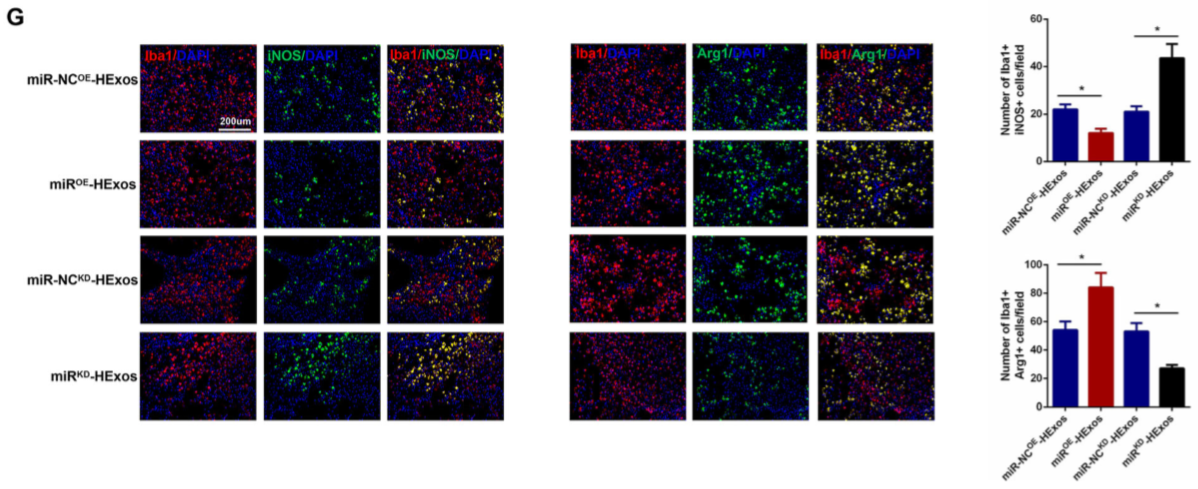
Figure 6 在体内HEXos通过miR-216a-5p促进小胶质细胞/巨噬细胞从M1型转为M2型
9.HEXos通过miR-216a-5p促进BV2和PM细胞极化从M1型转为M2型
miR-NC OE -HExos和miR OE -HExos处理BV2细胞,并将miR-NC KD -HExos和miR KD -HExos处理PM细胞。miR OE -HExos组的促炎细胞因子减少而抗炎细胞因子增加(图 7A)。miROE-HExos将BV2细胞极化为M2型(图 7B,D,E,F,G,H),表明,在体外HExos通过miR-216a-5p促BV2和PM细胞极化从M1转为M2。
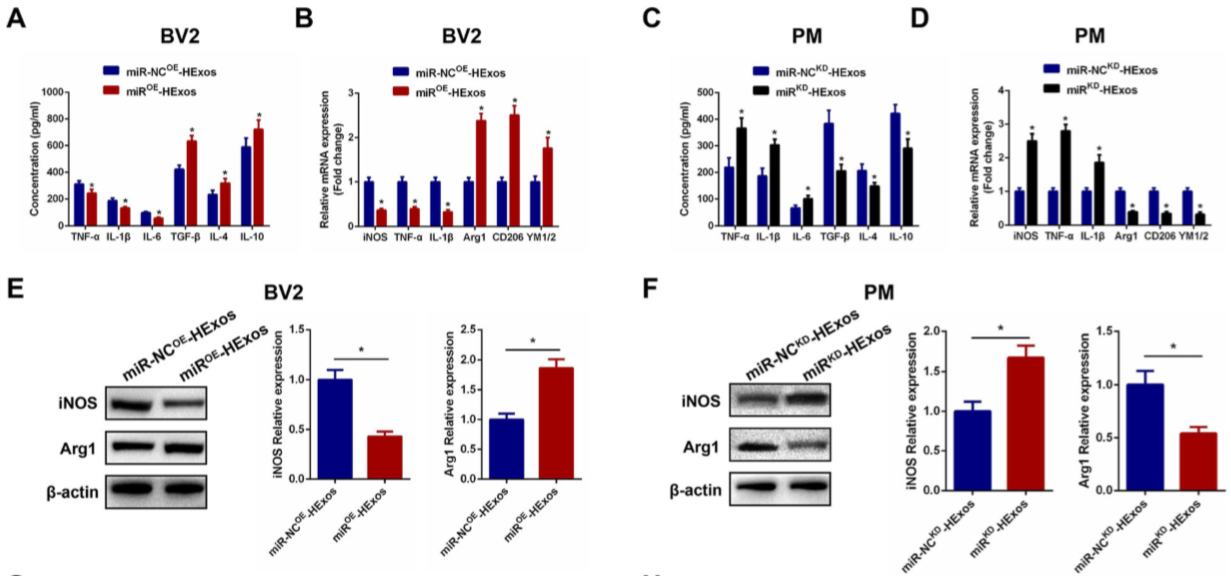
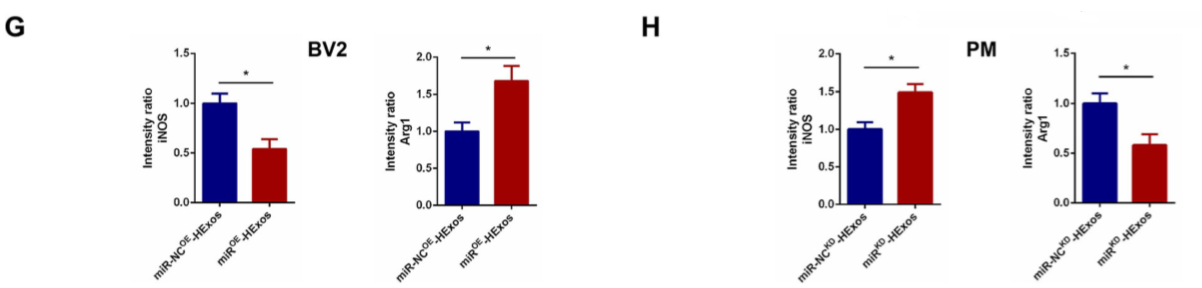
Figure 7 HEXos通过miR-216a-5p促进BV2和PM细胞极化从M1型转为M2型
10.miR-216a-5p通过靶向3'-UTR来调节TLR4
根据miRNA靶标的在线数据库分析发现TLR4可能是miR-216a-5p的靶基因。构建了TLR4的野生型(WT)和突变型(MUT)3'-UTR序列(图 8A)。miR-216a-5p和WT-3'UTR共转染到BV2和PM细胞中时,可降低萤光素酶的活性(图 8B)。miR-216A-5P过表达后,RNA-ChIP分析出TLR4 mRNA富集于Ago2/ RISC(图8C)。在miR-216a-5p过表达的细胞中观察到了掺入RISC的TLR4水平的富集。此外,miR-216A-5P过表达降低TLR4 mRNA和蛋白水平,miR-216A-5P的下调增加了TLR4 mRNA和蛋白表达水平(图8D-E),其进一步证实TLR4是miR-216a-5p的下游靶基因。
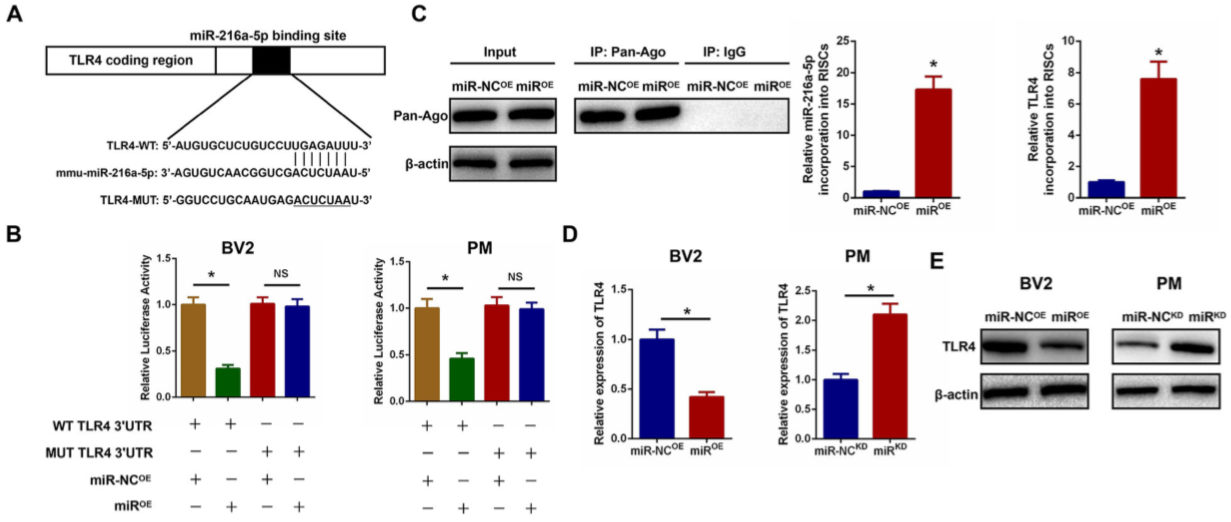
Figure 8 miR-216a-5p通过靶向3'-UTR来调节TLR4
11.外泌体miR-216a-5p通过靶向TLR4调节小胶质细胞M1/M2极化
为了验证外泌体miR-216a-5p对调节小胶质细胞表型转变是通过调节TLR4介导的,如图 9A,C,TLR4的过表达促进促炎细胞因子的释放并抑制抗炎细胞因子的释放,而TLR4的敲低显示相反的作用。TLR4过表达能有效逆转miROE-HExos的作用,促进M2向M1极化(图 9B-H)。表明外泌体miR-216a-5p通过靶向TLR4来调节小胶质细胞M1 / M2极化。
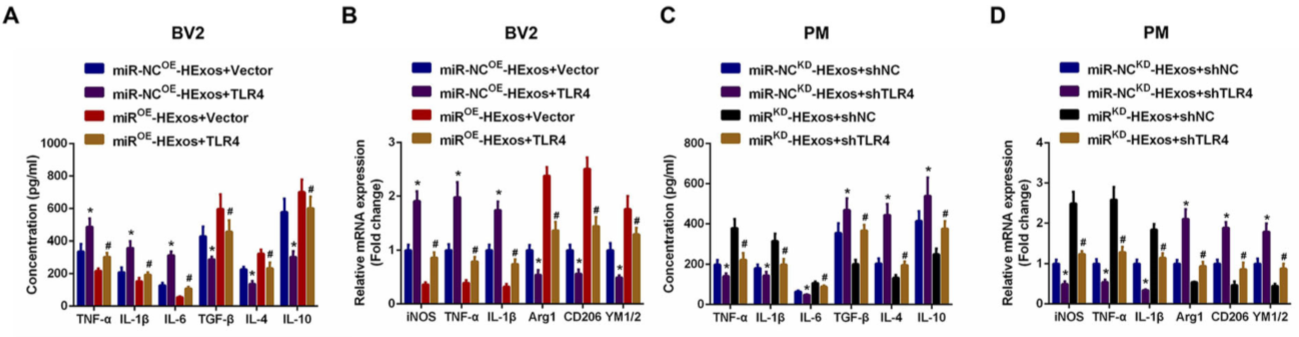
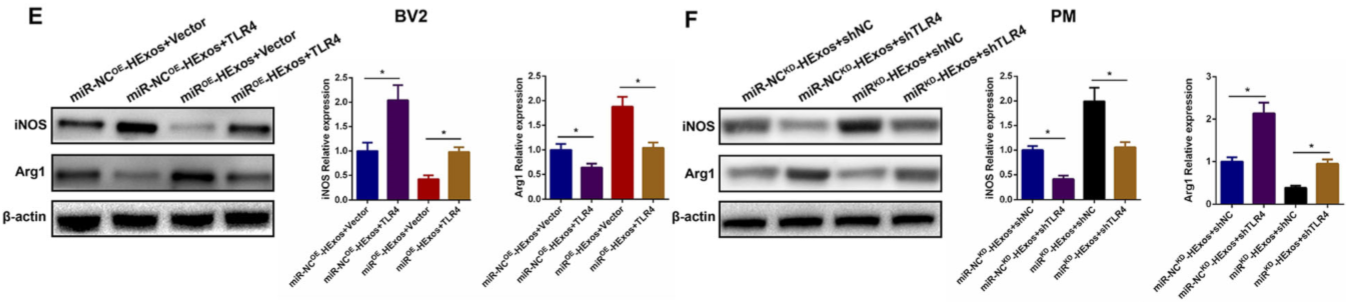
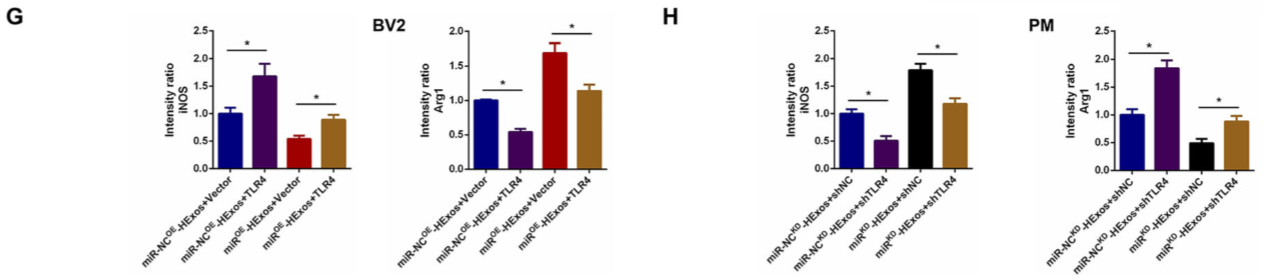
Figure 9 外泌体miR-216a-5p通过靶向TLR4调节小胶质细胞M1/M2极化
12.外泌体miR-216a-5p通过TLR4 /NF-κB/ PI3K / AKT信号级联反应调节小胶质细胞M1 / M2极化
miROE-HExos 处理BV2细胞后,TLR4、p-P65、MyD88和iNOS的蛋白质水平显著下调和p-PI3K,p-AKT,和Arg1的蛋白质水平受到上调(图 10A)。同时,miRKD-HExos处理PM细胞后,TLR4、p-P65、MyD88和iNOS的表达水平上调和p-PI3K、p-AKT和Arg1的表达水平下调(图 10B)。这些研究表明,外泌体miR-216a-5p通过靶向TLR4 /NF-κB/ PI3K / AKT信号级联反应而参与了HExos介导的小胶质细胞极化。
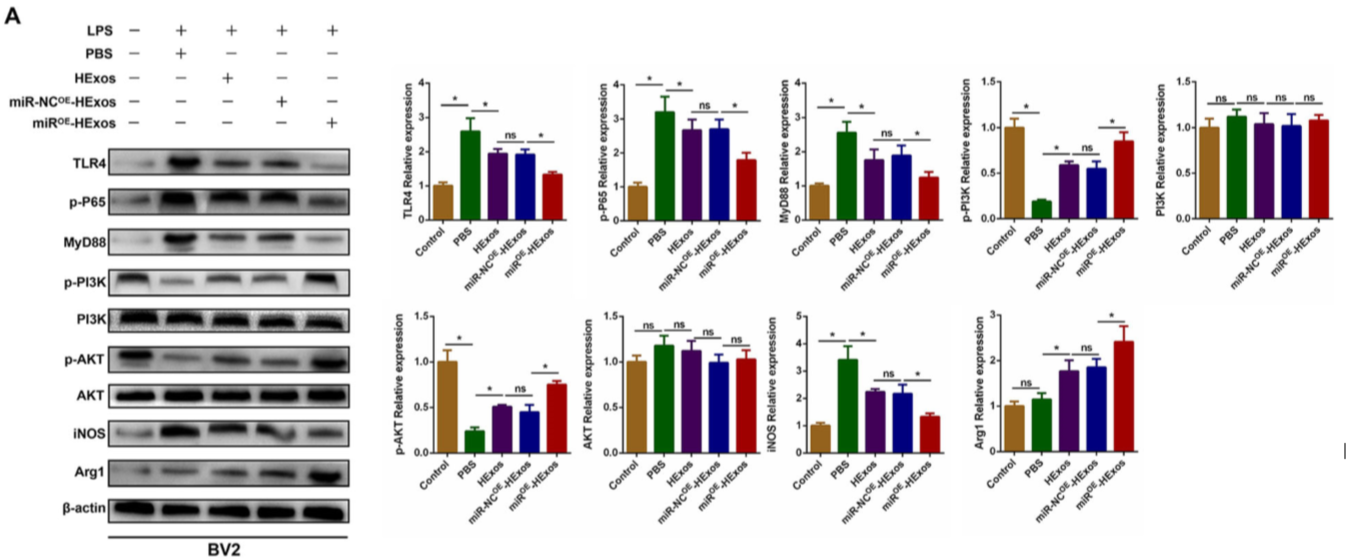
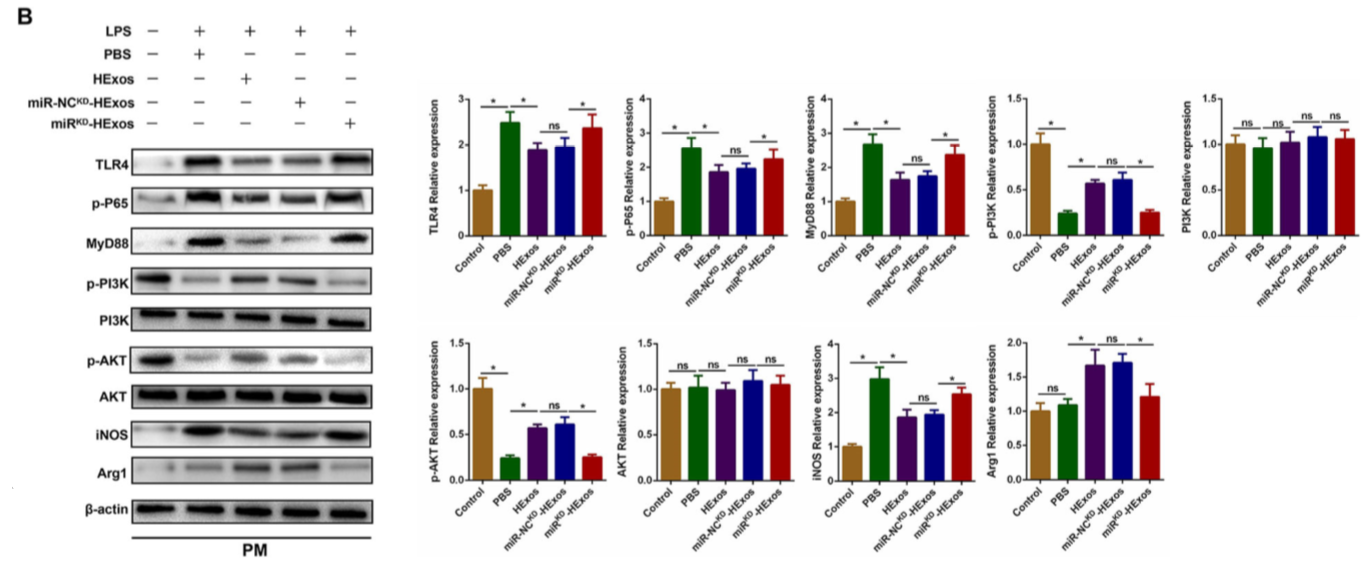
Figure 10 外泌体miR-216a-5p通过TLR4 /NF-κB/ PI3K / AKT信号级联反应调节小胶质细胞M1 / M2极化
总之,作者发现来自缺氧MSC的外泌体通过miR-216a-5p能促进小鼠SCI后的功能行为恢复,miR-216a-5p靶向TLR4抑制TLR4/NF-KB激活PI3K/AKT信号通路,从而诱导小胶质细胞M1 / M2极化。缺氧预处理优化了MSC外泌体的治疗效果,这是一种有前景的方法,而miRNA和MSC来源的外泌体的组合可能是一种有价值的微创治疗SCI的方法。
文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7001326/

研究结果:
1.骨髓间充质干细胞的鉴定
从小鼠体内分离的骨髓间充质干细胞(BMSC)形态呈纺锤状(图SA)。茜素红,奥利红O和阿尔辛蓝染色分别鉴定BMSC的成骨,成脂和成软骨分化(图S1B)。流式细胞仪分析确认了CD73和CD105呈阳性表达,但对CD34和CD45呈阴性(图S1C)。表明成功分离培养BMSC细胞。

Figure S1 骨髓间充质干细胞的鉴定
2.低氧促进BMSC细胞释放外泌体
使用TEM、NTA和Western blot对BMSCs在常氧和低氧(1%O 2)培养条件下分泌的外泌体进行分析鉴定(图 1A,B)。两组之间在大小,形状或电子密度方面均未观察到形态学差异。Western blot发现TSG101,CD9,CD63,CD81在低氧组中表达较常氧高(图1C)。此外,与常氧Exos相比,低氧组HExos的蛋白质浓度更高(图 1D)。表明低氧可诱导外泌体的释放。

Figure 1 低氧促进BMSC细胞释放外泌体
3.BV2细胞摄取外泌体的差异取决于氧
为了探究BV2细胞是否正常吸收了Exos和HExos,使用Dil标记外泌体,与BV2共培养24hrs。如图1E所示,与Exos相比,BV2细胞对摄取较多,图 1F表明两组之间在12hrs后有明显统计学差异显著,表明HExos更易被BV2细胞吸收。
4.与Exos相比HExos促进SCI后的功能行为恢复
为研究HExos是否能比Exos对SCI后的功能行为恢复更有益,使用BMS评估小鼠的功能行为恢复,如图 2A,HExos组和的小鼠比PBS组的小鼠表现出更好的功能改善,但HExos组效果更佳。与PBS组和Exos组小鼠相比,HExos组小鼠显示更快步态恢复和运动的协调(图 2B)。用Exos或HExos治疗后,脊髓病变面积明显小于PBS组(图 2C),且HExos组的病变面积明显小于Exos组。在SCI后第3天对小鼠进行MRI分析,与Exos组相比注射HExos显著减少病变区域(图 2C)。同时如图2E,与PBS组相比,Exos组的NeuN阳性神经元数量增加,HExos组的神经元数量明显多于Exos组。通过对神经丝(NF200)的200 kDa亚基进行免疫染色分析,损伤28天后与远区相比,HExos组病变区域NF200的染色减少(图2F)。为了进一步研究运动功能行为恢复,应用了电生理分析,如图2G,MEP振幅检测表明HExos组比Exos组显示出更高的电生理功能恢复。综上所述,Exos和HExos均可促进小鼠SCI后的功能行为恢复,但HExos治疗效果更为明显。

Figure 2 与Exos相比HExos促进SCI后的功能行为恢复
5.HExos给药促进体内小胶质细胞/巨噬细胞极化从M1变为M2表型
ELISA测定不同组脊髓中促炎细胞因子(TNF-α,IL-1β和IL-6)的浓度以及抗炎细胞因子(TGF-β,IL-4和IL-10)的浓度,结果显示,与PBS组相比,用Exos和HExos可以降低促炎细胞因子的浓度并提高抗炎细胞因子的浓度。但是,与Exos相比,HExos作用更加显著(图 3A)。如图3B,与PBS组相比,Exos组和HExos组M2基因(Arg1,CD206,YM1 / 2)表达增加,M1基因(iNOS,TNF-α,IL-1β)的表达减少。与Exos组相比,HExos组的M2基因表达较高,而M1表达较低。Western blot也证实了此结果(图3C)。 此外,对iNOS、Arg1和Iba1进行双免疫荧光染色,评估了SCI后不同组中小胶质细胞/巨噬细胞的极化特性,如图3D-F,三组中Iba1阳性小胶质细胞/巨噬细胞的数量没有显着差异,但在病变处观察到iNOS阳性小胶质细胞显着减少,而Arg1阳性小胶质细胞/巨噬细胞较多。与Exos组相比,HExos组中iNOS阳性小胶质细胞/巨噬细胞的数量趋于减少,而Arg1阳性小胶质细胞/巨噬细胞的数量增加。因此,HExos对SCI后抗炎表型与促炎表型的比率具有显着影响,并且可能使小胶质细胞/巨噬细胞从M1极化为M2。

Figure 3 SCI后HExos处理可促进小鼠体内小胶质细胞/巨噬细胞从M1极化为M2
6.HExos 在体外促BV2细胞和PM细胞从M1极化为M2
LPS处理BV2细胞和原代胶质细胞(PM)24hrs,以模拟SCI环境,再加入PBS,Exos或HExos之前处理,48hrs后,发现Exos和HExos均可抑制TNF-α, IL-1β和 IL-6浓度并促进TGF-β, IL-4和IL-10分泌(图 4A,C)。且HExos发挥了更大的作用。同时Exos和HExos可降低M1标志基因的表达并增加M2标志基因的表达,且HExos作用更显著,这与体内结果相似(图 4B-F)。iNOS和Arg1的表达水平亦受HExos的影响(图4G,H)。因此,在体外,HExos可将BV2和PM细胞极化为M2。

Figure 3 SCI后HExos处理可促进小鼠体内小胶质细胞/巨噬细胞从M1极化为M2
6.HExos 在体外促BV2细胞和PM细胞从M1极化为M2
LPS处理BV2细胞和原代胶质细胞(PM)24hrs,以模拟SCI环境,再加入PBS,Exos或HExos之前处理,48hrs后,发现Exos和HExos均可抑制TNF-α, IL-1β和 IL-6浓度并促进TGF-β, IL-4和IL-10分泌(图 4A,C)。且HExos发挥了更大的作用。同时Exos和HExos可降低M1标志基因的表达并增加M2标志基因的表达,且HExos作用更显著,这与体内结果相似(图 4B-F)。iNOS和Arg1的表达水平亦受HExos的影响(图4G,H)。因此,在体外,HExos可将BV2和PM细胞极化为M2。

Figure 5 miR-216a-5p在HExos中上调,并通过外泌体转移到BV2和PM细胞中
8.在体内HEXos通过miR-216a-5p促进小胶质细胞/巨噬细胞从M1型转为M2型
如图6A,C,miR OE -HExos的使用可下调SCI小鼠脊髓组织中的促炎细胞因子,上调脊髓组织中的抑炎细胞因子。miROE -HExos促进小胶质细胞/巨噬细胞从M1型转M2型,而miR KD -HExos的使用得到相反的结果(图6B-F)。同时,IF结果证实此结果(图6G)。


Figure 6 在体内HEXos通过miR-216a-5p促进小胶质细胞/巨噬细胞从M1型转为M2型
9.HEXos通过miR-216a-5p促进BV2和PM细胞极化从M1型转为M2型
miR-NC OE -HExos和miR OE -HExos处理BV2细胞,并将miR-NC KD -HExos和miR KD -HExos处理PM细胞。miR OE -HExos组的促炎细胞因子减少而抗炎细胞因子增加(图 7A)。miROE-HExos将BV2细胞极化为M2型(图 7B,D,E,F,G,H),表明,在体外HExos通过miR-216a-5p促BV2和PM细胞极化从M1转为M2。


Figure 7 HEXos通过miR-216a-5p促进BV2和PM细胞极化从M1型转为M2型
10.miR-216a-5p通过靶向3'-UTR来调节TLR4
根据miRNA靶标的在线数据库分析发现TLR4可能是miR-216a-5p的靶基因。构建了TLR4的野生型(WT)和突变型(MUT)3'-UTR序列(图 8A)。miR-216a-5p和WT-3'UTR共转染到BV2和PM细胞中时,可降低萤光素酶的活性(图 8B)。miR-216A-5P过表达后,RNA-ChIP分析出TLR4 mRNA富集于Ago2/ RISC(图8C)。在miR-216a-5p过表达的细胞中观察到了掺入RISC的TLR4水平的富集。此外,miR-216A-5P过表达降低TLR4 mRNA和蛋白水平,miR-216A-5P的下调增加了TLR4 mRNA和蛋白表达水平(图8D-E),其进一步证实TLR4是miR-216a-5p的下游靶基因。

Figure 8 miR-216a-5p通过靶向3'-UTR来调节TLR4
11.外泌体miR-216a-5p通过靶向TLR4调节小胶质细胞M1/M2极化
为了验证外泌体miR-216a-5p对调节小胶质细胞表型转变是通过调节TLR4介导的,如图 9A,C,TLR4的过表达促进促炎细胞因子的释放并抑制抗炎细胞因子的释放,而TLR4的敲低显示相反的作用。TLR4过表达能有效逆转miROE-HExos的作用,促进M2向M1极化(图 9B-H)。表明外泌体miR-216a-5p通过靶向TLR4来调节小胶质细胞M1 / M2极化。



Figure 9 外泌体miR-216a-5p通过靶向TLR4调节小胶质细胞M1/M2极化
12.外泌体miR-216a-5p通过TLR4 /NF-κB/ PI3K / AKT信号级联反应调节小胶质细胞M1 / M2极化
miROE-HExos 处理BV2细胞后,TLR4、p-P65、MyD88和iNOS的蛋白质水平显著下调和p-PI3K,p-AKT,和Arg1的蛋白质水平受到上调(图 10A)。同时,miRKD-HExos处理PM细胞后,TLR4、p-P65、MyD88和iNOS的表达水平上调和p-PI3K、p-AKT和Arg1的表达水平下调(图 10B)。这些研究表明,外泌体miR-216a-5p通过靶向TLR4 /NF-κB/ PI3K / AKT信号级联反应而参与了HExos介导的小胶质细胞极化。


Figure 10 外泌体miR-216a-5p通过TLR4 /NF-κB/ PI3K / AKT信号级联反应调节小胶质细胞M1 / M2极化
总之,作者发现来自缺氧MSC的外泌体通过miR-216a-5p能促进小鼠SCI后的功能行为恢复,miR-216a-5p靶向TLR4抑制TLR4/NF-KB激活PI3K/AKT信号通路,从而诱导小胶质细胞M1 / M2极化。缺氧预处理优化了MSC外泌体的治疗效果,这是一种有前景的方法,而miRNA和MSC来源的外泌体的组合可能是一种有价值的微创治疗SCI的方法。






