研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
化学治疗药物刺激细胞外囊泡的释放和再循环以帮助癌细胞发展出紧急的化学抗性
1690 人阅读发布时间:2020-02-19 15:04
化学疗法是广泛使用的癌症治疗方法。然而,获得性多药耐药性(MDR)的发展是一个严重的问题。新兴数据表明,细胞外囊泡(EVs)介导MDR,但其潜在机制仍不清楚,尤其是化疗药对该过程的影响。由中山大学肿瘤防治中心癌症医学协同创新中心符立梧课题组在2019年12月发表在Mol Cancer杂志上的一篇文献,短暂暴露于化疗药可以显著增加Rab8B介导的从耐药细胞释放包含ABCB1的细胞外囊泡(EV),并加速这些EV膜循环到敏感癌细胞的质膜上,赋予一些药物敏感癌细胞以快速但不可持续的药物耐受性,以逃避化疗药物的细胞毒性。
文献链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6907227/

技术路线:
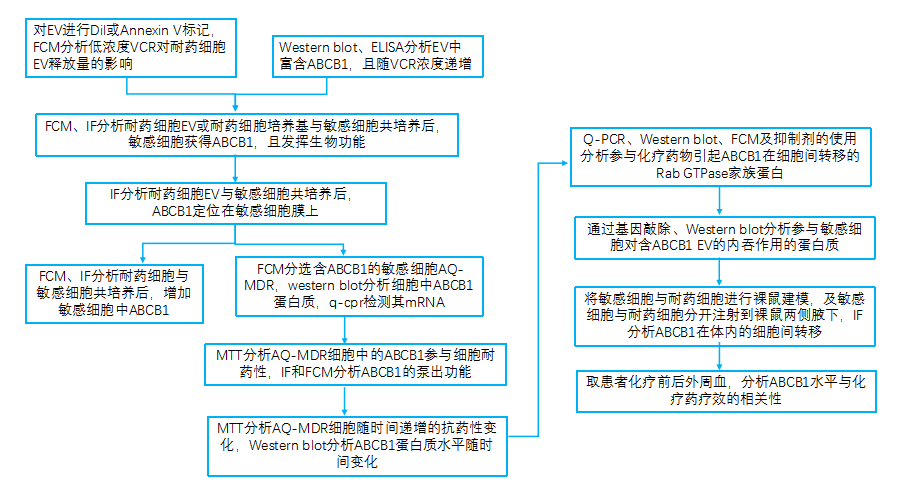
研究结果:
1.化疗药物促进耐药细胞释放EV
低剂量无明显致死作用的化疗药物长春新碱(VCR)处理等数量耐药细胞KBv200(VCR的IC50为1.318±0.256μM),提取EV,用Dil/Annexin V标记EV,FCM分析出低剂VCR可促进EV的量(Figure 1A-D)。VCR-处理和未处理细胞的EV,TEM结果无差异(Figure 1E),但EV中可检测到ABCB1表达(Figure 1F,G),且随VCR浓度的增加,ABCB1和CD9表达增加(Figure 1H-J)。说明低浓度的VCR刺激耐药细胞KBv200释放更多的含ABCB1的EV。
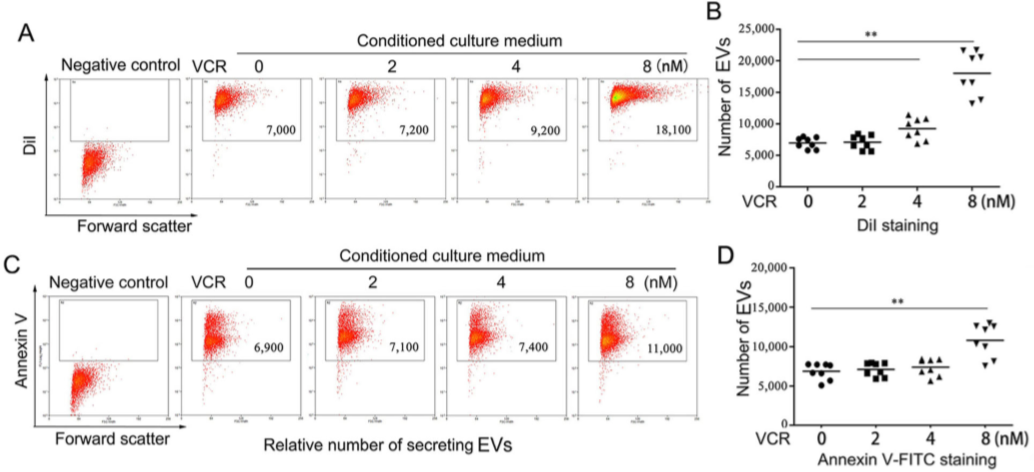
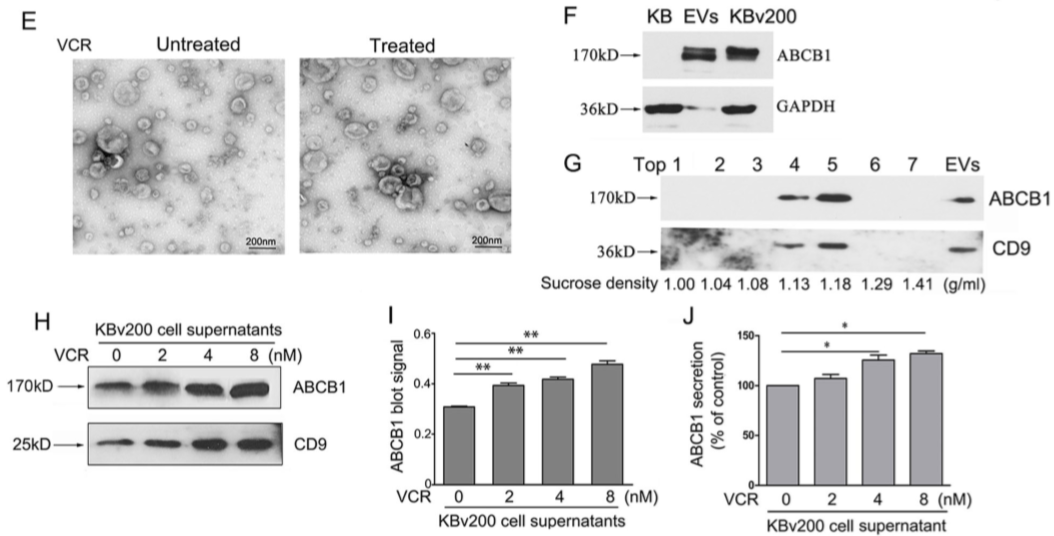
Figure 1 化疗药物促进VCR分泌富含ABCB1的 EV
2.EV可通过剂量依赖性的方式被药物敏感癌细胞内化
KBv200的EV处理药物敏感细胞KB 后,KB细胞中ABCB1水平得以增加(Figure 2A,B)。通过建立GFP-KB细胞与KB或KBv200的培养基共培养,ABCB1+KB细胞在KBv200培养基刺激下增加(Figure 2C-E)。FCM检测EV处理后的KB细胞中ABCB1的底物Rho 123被泵出情况显示EV促进Rho 123外排,而在使用ABCB1抑制剂维拉帕米VRP后,便抑制Rho 123外排(Figure 2G-J)。表明KB细胞可通过EV获得ABCB1蛋白,并发挥其外排泵的作用。
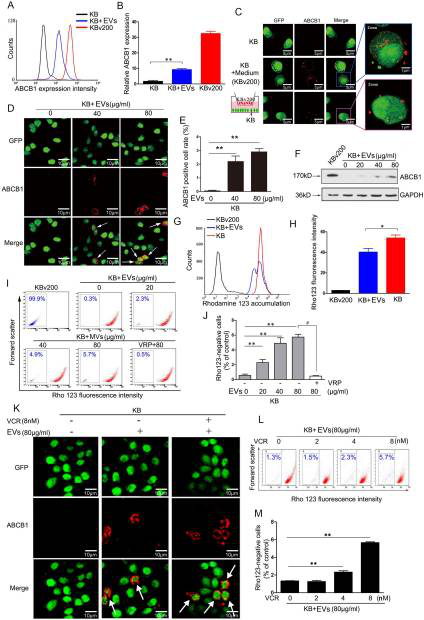
Figure 2 EV以剂量依赖性地转移到敏感癌细胞上
3.VCR促进EV的循环利用
作为跨膜糖蛋白的ABCB1,在VCR的参与下,EV被KB摄取后,致ABCB1定位到细胞膜上(Figure 2K),且KB-Rho 123 free的细胞比例增加(Figure 2L,M),说明KB细胞摄取EV后,VCR可诱导ABCB1再转移至膜上。
4.VCR促进ABCB1在细胞间转移
GFP-KB与KBv200共培养后,KB细胞中ABCB1在VCR、顺铂DDP作用下增加(Figure 3A-F),但这并非由于VCR短期刺激KB细胞造成的。分选出共培养细胞中无ABCB1的 KB细胞和含ABCB1的KB细胞(Aq-MDR)(Figure 3G-H), 在Aq-MDR细胞中检测到ABCB1蛋白质(Figure 3I),但检测不到其mRNA(Figure 3J),表明ABCBA1从KBv200细胞向KB细胞中转移是非遗传机制。
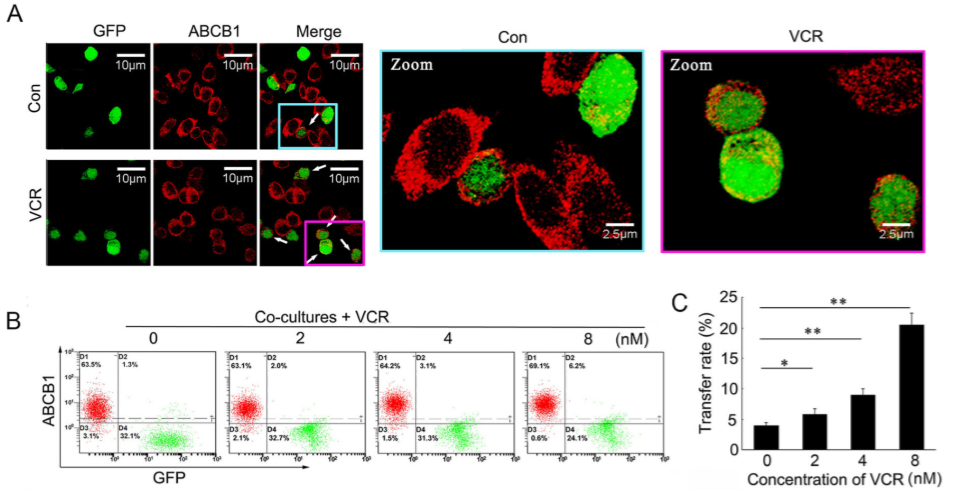
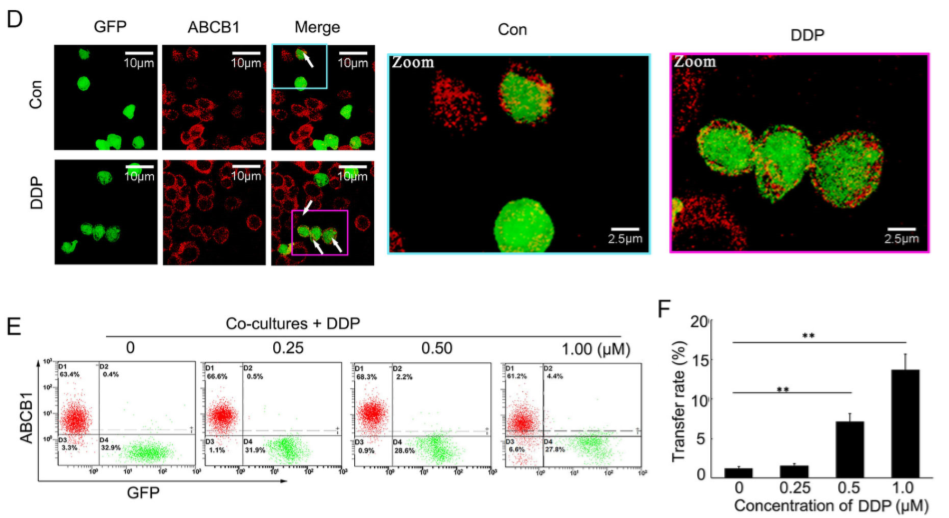
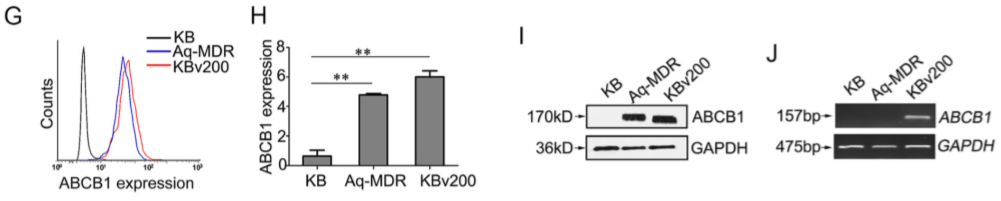
Figure 3 化疗药物促进ABCB1在细胞间转移
5.ABCB1通过EV在细胞间转移赋予KB细胞短暂的耐药性
MTT实验分析发现AQ-MDR细胞耐药性强于KB细胞,表明ABCB1可发挥耐药作用(Figure 4A),同时VRP可增加AQ-MDR细胞对Dox的敏感性(Figure 4C)。转移的ABCB1降低了Rho123和Dox在Aq- MDR细胞中的保留率(Figure 4D-G)。但Rho-123和Dox的细胞内积累水平均与培养时间的延长逐渐增加,这意味着ABCB1的泵出活性是时间依赖性降低(Figure 4H-K), AQ-MDR细胞对药物的抗性亦随时间延长而降低,ABCB1的蛋白质水平逐渐降低(Figure 4L-N)。说明转移到AQ-MDR细胞的ABCB1蛋白质分子不是永久地稳定的。
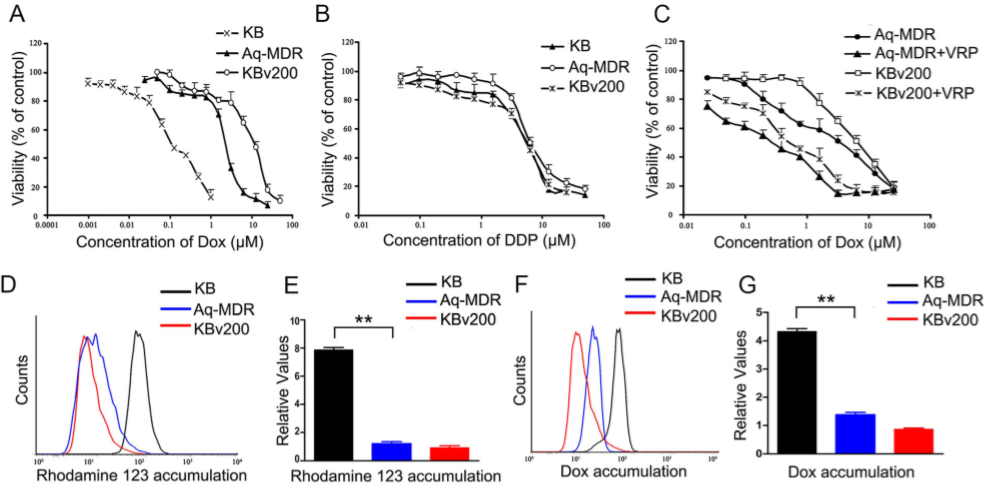
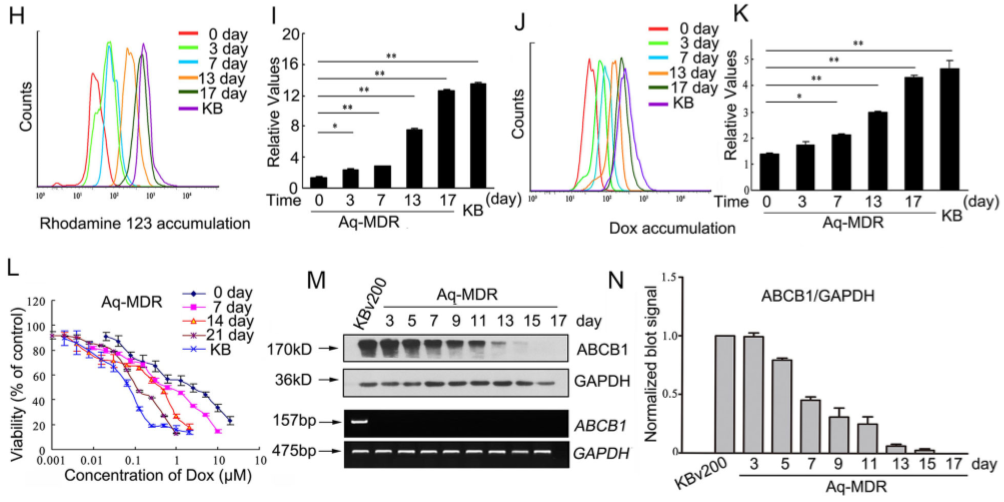
Figure 4 EV介导的ABCB1蛋白转移并赋予敏感癌细胞短暂的耐药性
6.Rab8B和Rab5的失调在VCR促进ABCB1的细胞间转移中起关键作用
鉴于Rab GTPase家族对于细胞外囊泡的形成和分泌至关重要,作者分析出Rab8B在VCR处理得KBv200细胞中高表达(Figure 5A,B,D)。在KBv200细胞中沉默Rab8B后(Figure 5E,F), 伴随EV的分泌量亦略又下降(Figure 5I,J),ABCB1在细胞间转移受到抑制(Figure 5G,H)。沉默Rab8B降低了ABCB1蛋白的分泌(Figure 5K,L)。表明在KBv200细胞中Rab8B的上调是负责通过调节EV的释放增强ABCB1的细胞间转移。
而Rab5的mRNA和蛋白质水平在VCR作用的KB细胞中表达降低(Figure 5A,M,N),将KB细胞中Rab5沉默后,发现ABCB1转移率有所增加(Figure 5P,Q),说明Rab5的下调参与化疗药物促进的EV循环,影响ABCB1的细胞间转移。
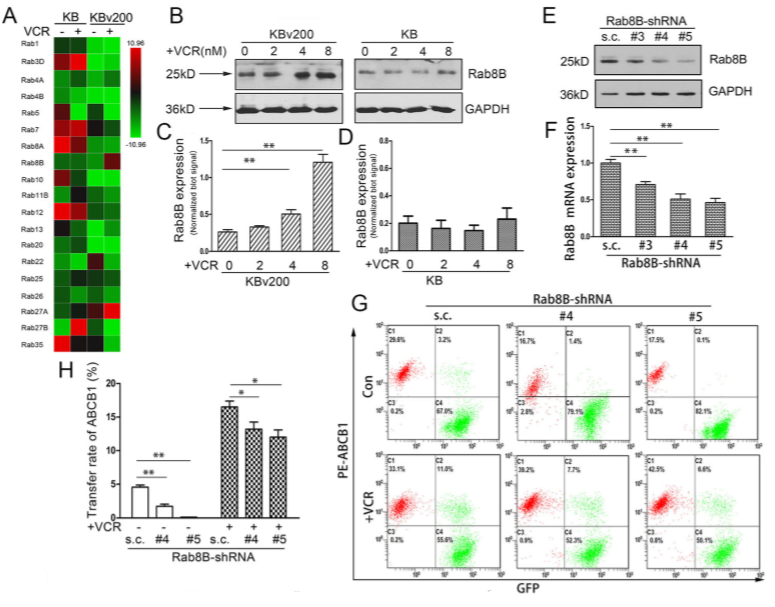
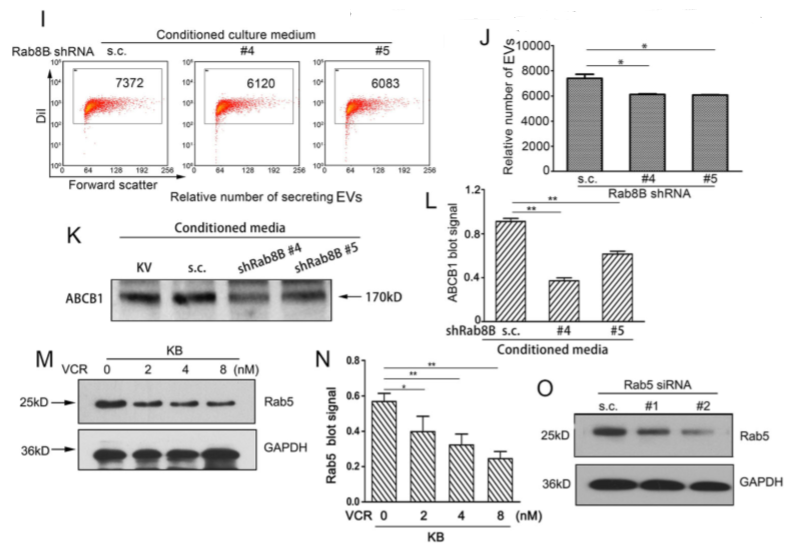
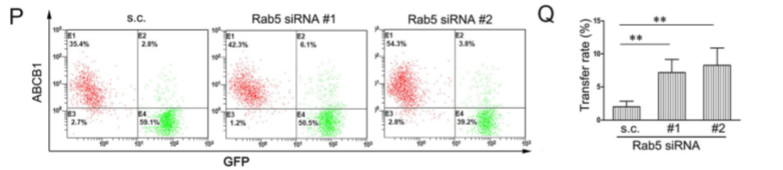
Figure 5 VCR诱导的Rab8B上调导致富含ABCB1的EV分泌增加
7.Dynamin 2 和 Clathrin介导KB细胞对富含ABCB1 EV的摄取
过表达ABCB1的KBv200细胞与caveolin-1干扰后的KB细胞共培养,对ABCB1在细胞间转移无影响(Figure 6A,B)。caveolin的抑制剂filipin III和methyl-β cyclodextrin的使用亦证明了这一点(Figure 6C,D)。但若抑制clathrin表达,可下调ABCB1的转移(Figure 6E,F)。另Dynamin 2也被证明出与ABCB1的转移有关(Figure 6G,J)。敏感的KB细胞通过Dynamin 2和Clathrin介导的方式内化EV,并通过降低Rab5的表达来加速ABCB1循环回到质膜。
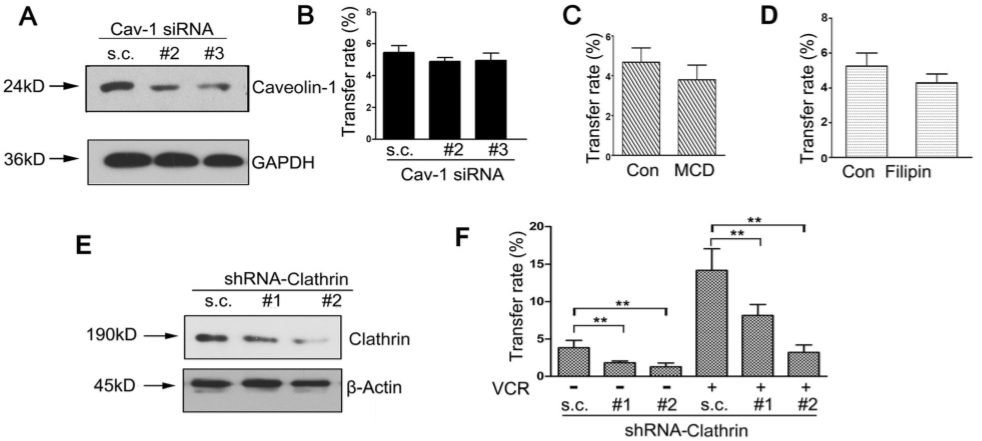
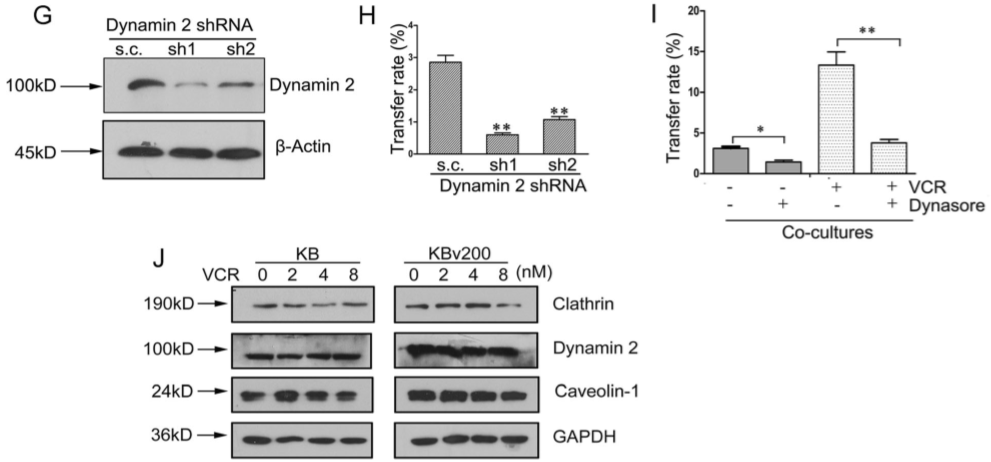
Figure 6 Dynamin 2 和 Clathrin介导受体的癌细胞对含有ABCB1-EV的内吞作用
8.化疗药物在体内促进ABCB1在细胞间转移
ABCB1 negative KB 和ABCB1 positive KBv200混合注射裸鼠皮下建立的肿瘤中有ABCB1 positive KB细胞存在(Figure 7A,B)。GFP 阳性 KB细胞和KBv200细胞分开注射到小鼠腋窝两侧建立肿瘤模型,有含ABCB1 的KB细胞存在(Figure 7D,E)。意味着ABCB1的细胞间转移可能是对体内化疗局部或全身反应。
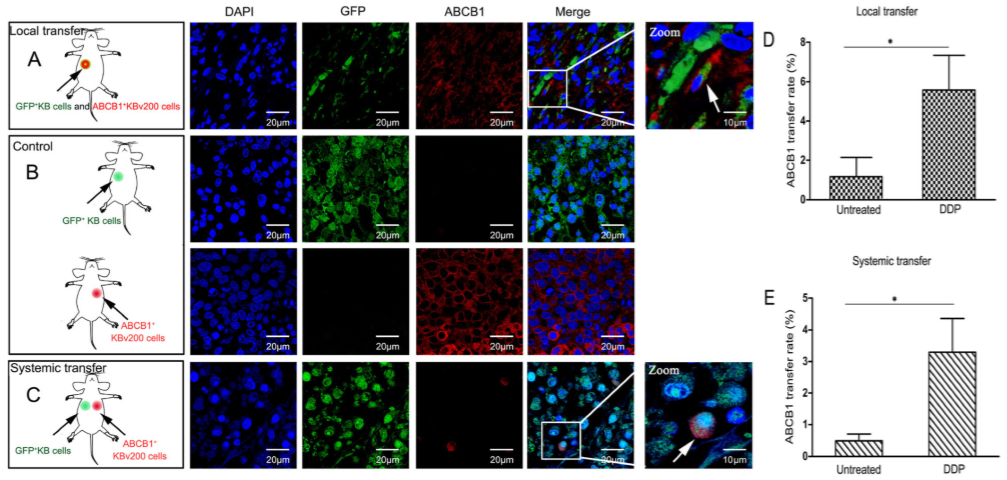
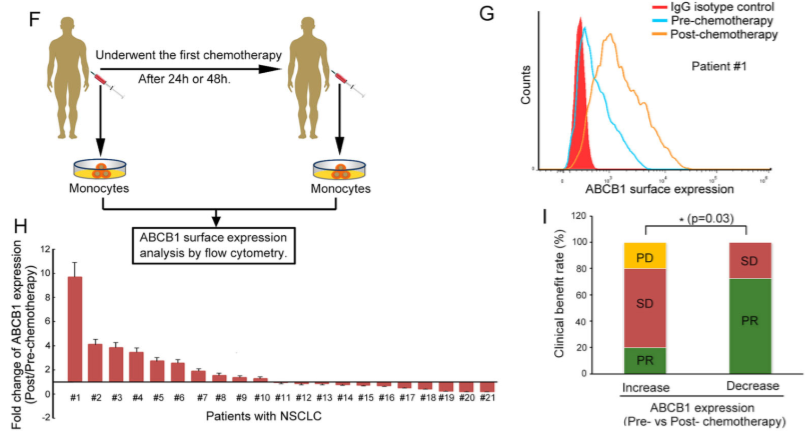
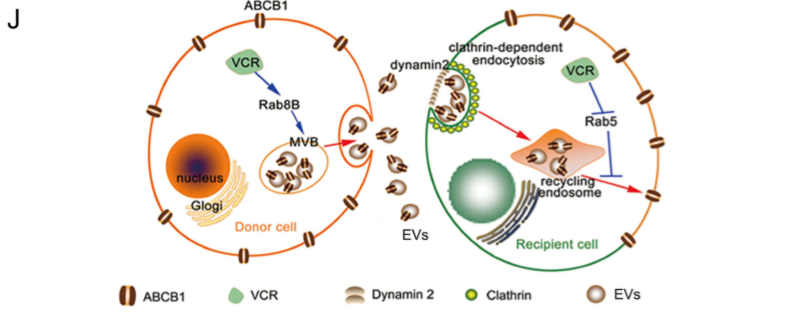
Figure 7 在体内化疗药物促进ABCB1在细胞间转移并与患者的化学治疗功效有关
9.ABCB1表达的快速改变可能是癌症患者化疗疗效的潜在预测指标
通过分析NSCLC外周血中ABCB1在24h或48h化疗前后ABCB1表达水平的变化(Figure 7F-I),表明化疗前后ABCB1表达的快速增加与化疗疗效有关。
总结:
本研究提出了一种化学治疗药物如何协 助敏感癌细胞获得紧急耐药的新机制。即化学治疗剂通过Rab8B和Rab5的失调刺激富含ABCB1的细胞外囊泡的分泌和循环利用,从而导致ABCB1细胞间转移的显着增加,从而帮助敏感的癌细胞发展出紧急的抗性表型(Figure 7J)。
文献链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6907227/

技术路线:

研究结果:
1.化疗药物促进耐药细胞释放EV
低剂量无明显致死作用的化疗药物长春新碱(VCR)处理等数量耐药细胞KBv200(VCR的IC50为1.318±0.256μM),提取EV,用Dil/Annexin V标记EV,FCM分析出低剂VCR可促进EV的量(Figure 1A-D)。VCR-处理和未处理细胞的EV,TEM结果无差异(Figure 1E),但EV中可检测到ABCB1表达(Figure 1F,G),且随VCR浓度的增加,ABCB1和CD9表达增加(Figure 1H-J)。说明低浓度的VCR刺激耐药细胞KBv200释放更多的含ABCB1的EV。


Figure 1 化疗药物促进VCR分泌富含ABCB1的 EV
2.EV可通过剂量依赖性的方式被药物敏感癌细胞内化
KBv200的EV处理药物敏感细胞KB 后,KB细胞中ABCB1水平得以增加(Figure 2A,B)。通过建立GFP-KB细胞与KB或KBv200的培养基共培养,ABCB1+KB细胞在KBv200培养基刺激下增加(Figure 2C-E)。FCM检测EV处理后的KB细胞中ABCB1的底物Rho 123被泵出情况显示EV促进Rho 123外排,而在使用ABCB1抑制剂维拉帕米VRP后,便抑制Rho 123外排(Figure 2G-J)。表明KB细胞可通过EV获得ABCB1蛋白,并发挥其外排泵的作用。

Figure 2 EV以剂量依赖性地转移到敏感癌细胞上
3.VCR促进EV的循环利用
作为跨膜糖蛋白的ABCB1,在VCR的参与下,EV被KB摄取后,致ABCB1定位到细胞膜上(Figure 2K),且KB-Rho 123 free的细胞比例增加(Figure 2L,M),说明KB细胞摄取EV后,VCR可诱导ABCB1再转移至膜上。
4.VCR促进ABCB1在细胞间转移
GFP-KB与KBv200共培养后,KB细胞中ABCB1在VCR、顺铂DDP作用下增加(Figure 3A-F),但这并非由于VCR短期刺激KB细胞造成的。分选出共培养细胞中无ABCB1的 KB细胞和含ABCB1的KB细胞(Aq-MDR)(Figure 3G-H), 在Aq-MDR细胞中检测到ABCB1蛋白质(Figure 3I),但检测不到其mRNA(Figure 3J),表明ABCBA1从KBv200细胞向KB细胞中转移是非遗传机制。



Figure 3 化疗药物促进ABCB1在细胞间转移
5.ABCB1通过EV在细胞间转移赋予KB细胞短暂的耐药性
MTT实验分析发现AQ-MDR细胞耐药性强于KB细胞,表明ABCB1可发挥耐药作用(Figure 4A),同时VRP可增加AQ-MDR细胞对Dox的敏感性(Figure 4C)。转移的ABCB1降低了Rho123和Dox在Aq- MDR细胞中的保留率(Figure 4D-G)。但Rho-123和Dox的细胞内积累水平均与培养时间的延长逐渐增加,这意味着ABCB1的泵出活性是时间依赖性降低(Figure 4H-K), AQ-MDR细胞对药物的抗性亦随时间延长而降低,ABCB1的蛋白质水平逐渐降低(Figure 4L-N)。说明转移到AQ-MDR细胞的ABCB1蛋白质分子不是永久地稳定的。


Figure 4 EV介导的ABCB1蛋白转移并赋予敏感癌细胞短暂的耐药性
6.Rab8B和Rab5的失调在VCR促进ABCB1的细胞间转移中起关键作用
鉴于Rab GTPase家族对于细胞外囊泡的形成和分泌至关重要,作者分析出Rab8B在VCR处理得KBv200细胞中高表达(Figure 5A,B,D)。在KBv200细胞中沉默Rab8B后(Figure 5E,F), 伴随EV的分泌量亦略又下降(Figure 5I,J),ABCB1在细胞间转移受到抑制(Figure 5G,H)。沉默Rab8B降低了ABCB1蛋白的分泌(Figure 5K,L)。表明在KBv200细胞中Rab8B的上调是负责通过调节EV的释放增强ABCB1的细胞间转移。
而Rab5的mRNA和蛋白质水平在VCR作用的KB细胞中表达降低(Figure 5A,M,N),将KB细胞中Rab5沉默后,发现ABCB1转移率有所增加(Figure 5P,Q),说明Rab5的下调参与化疗药物促进的EV循环,影响ABCB1的细胞间转移。



Figure 5 VCR诱导的Rab8B上调导致富含ABCB1的EV分泌增加
7.Dynamin 2 和 Clathrin介导KB细胞对富含ABCB1 EV的摄取
过表达ABCB1的KBv200细胞与caveolin-1干扰后的KB细胞共培养,对ABCB1在细胞间转移无影响(Figure 6A,B)。caveolin的抑制剂filipin III和methyl-β cyclodextrin的使用亦证明了这一点(Figure 6C,D)。但若抑制clathrin表达,可下调ABCB1的转移(Figure 6E,F)。另Dynamin 2也被证明出与ABCB1的转移有关(Figure 6G,J)。敏感的KB细胞通过Dynamin 2和Clathrin介导的方式内化EV,并通过降低Rab5的表达来加速ABCB1循环回到质膜。


Figure 6 Dynamin 2 和 Clathrin介导受体的癌细胞对含有ABCB1-EV的内吞作用
8.化疗药物在体内促进ABCB1在细胞间转移
ABCB1 negative KB 和ABCB1 positive KBv200混合注射裸鼠皮下建立的肿瘤中有ABCB1 positive KB细胞存在(Figure 7A,B)。GFP 阳性 KB细胞和KBv200细胞分开注射到小鼠腋窝两侧建立肿瘤模型,有含ABCB1 的KB细胞存在(Figure 7D,E)。意味着ABCB1的细胞间转移可能是对体内化疗局部或全身反应。



Figure 7 在体内化疗药物促进ABCB1在细胞间转移并与患者的化学治疗功效有关
9.ABCB1表达的快速改变可能是癌症患者化疗疗效的潜在预测指标
通过分析NSCLC外周血中ABCB1在24h或48h化疗前后ABCB1表达水平的变化(Figure 7F-I),表明化疗前后ABCB1表达的快速增加与化疗疗效有关。
总结:
本研究提出了一种化学治疗药物如何协 助敏感癌细胞获得紧急耐药的新机制。即化学治疗剂通过Rab8B和Rab5的失调刺激富含ABCB1的细胞外囊泡的分泌和循环利用,从而导致ABCB1细胞间转移的显着增加,从而帮助敏感的癌细胞发展出紧急的抗性表型(Figure 7J)。






