研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
LncRNA BCRT1通过靶向miR-1303/PTBP3来促进乳腺癌的进展
2173 人阅读发布时间:2020-05-29 14:53
研究背景:
乳腺癌是全世界女性最常见的恶性肿瘤之一。尽管在诊断和联合治疗方面取得了进展,但是乳腺癌患者的预后仍然不令人满意。转移是肿瘤致死的主要原因之一,严重阻碍了治疗的成功。因此,更全面地了解乳腺癌的进展和转移机制,对改善乳腺癌患者的预后具有重要意义。
近年来,lncRNAs被发现参与多种生理和病理过程,尤其是在癌症。已经有研究证明,lncRNAs在癌症中经常失调,并参与多种恶性肿瘤的进展和转移。LncRNA-ANCR介导EZH2的降解,从而减弱乳腺癌的转移能力。此外,lncRNA AGAP2-AS1在乳腺癌中被发现上调,并与曲妥珠单抗耐药相关。然而,绝大多数lncRNAs在乳腺癌调控中的临床意义和生物学机制仍不清楚。
一些研究表明,lncRNAs可能作为ceRNAs,来调节microRNAs的生物学功能或表达。例如,lncRNA-LINC00963通过充当乳腺癌细胞miR-324-3p的ceRNA促进肿瘤的发生和抗辐射性。以往的研究表明,缺氧是肿瘤微环境的一个重要标志,与许多实体瘤的进展和转移有关。HIF-1α是一种广泛研究的缺氧诱导因子,通过下游靶基因的反式激活介导细胞对缺氧的反应。在常氧条件下,HIF-1α受到蛋白酶体降解,而缺氧条件则保护HIF-1α不被降解,从而允许HIF-1α转运到细胞核中启动基因表达。近年来,缺氧条件在调节lncRNAs表达中的作用受到广泛关注,各种缺氧反应性lncRNAs在肿瘤发生和发展中起着重要作用。然而,对于缺氧介导lncRNA异常表达的机制以及lncRNA在乳腺癌中的作用尚需进一步研究。
在本研究中,通过分析公共微阵列数据,筛选在乳腺癌中差异表达的lncRNAs。其中,LncRNA-BCRT1(乳腺癌相关转录本1)在乳腺癌组织中显著高表达,与乳腺癌患者预后不良相关,被选作进一步的研究。LncRNA-BCRT1通过与miR-1303竞争性结合发挥肿瘤启动子的作用,保护PTBP3不被降解,从而促进乳腺癌细胞在体内外的生长和进展。此外,lncRNA-BCRT1可以通过外泌体转移到巨噬细胞中,促进M2极化,增强其对肿瘤进展的作用。进一步的研究表明,lncRNA-BCRT1是通过HIF-1α依赖性转录调控在缺氧条件下诱导的,从而促进了缺氧诱导的EMT。我们的研究结果为乳腺癌的转移机制提供了新的见解,为乳腺癌的治疗提供了一个有希望的靶点。
技术路线:
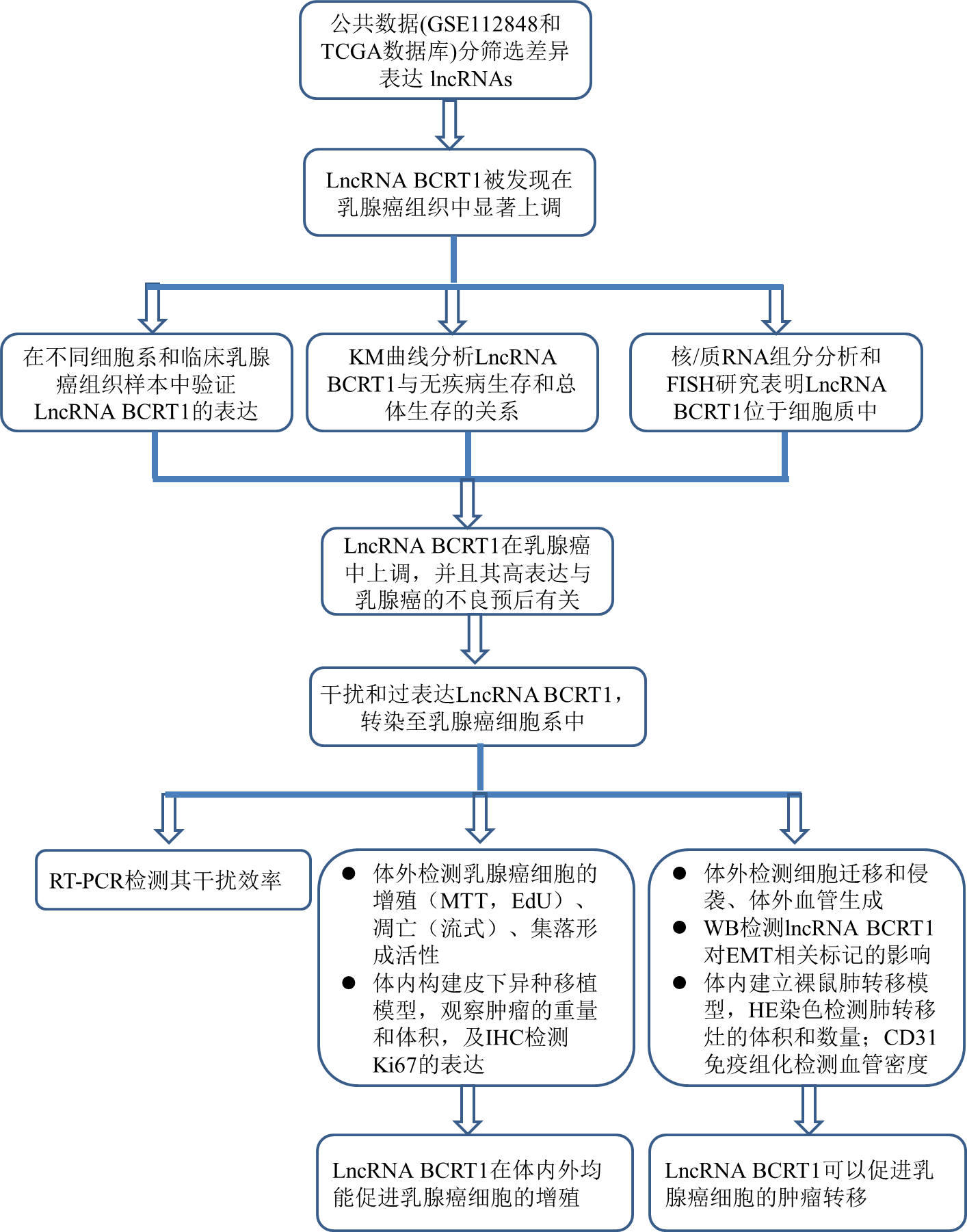
1. LncRNA BCRT1在乳腺癌中的机制
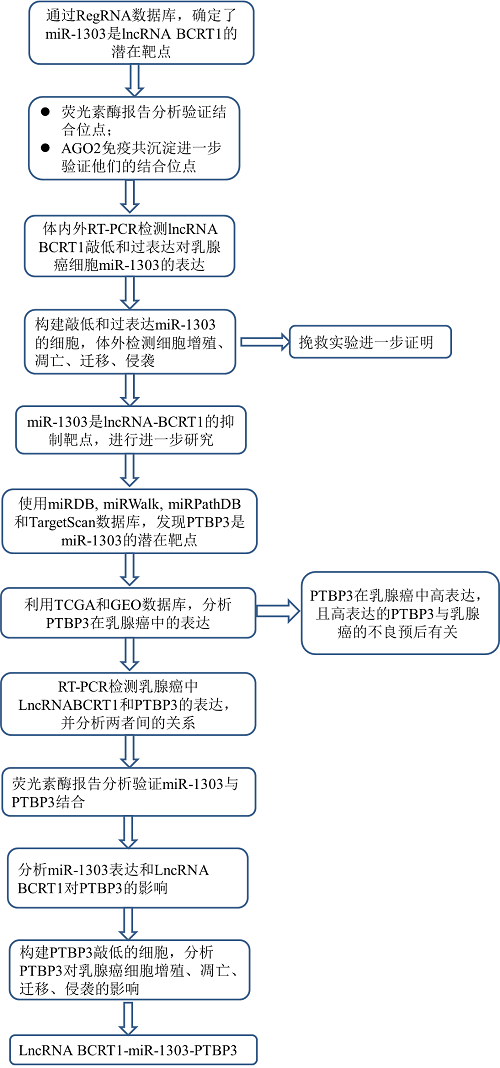
2. LncRNA BCRT1-miR1303-PTBP3
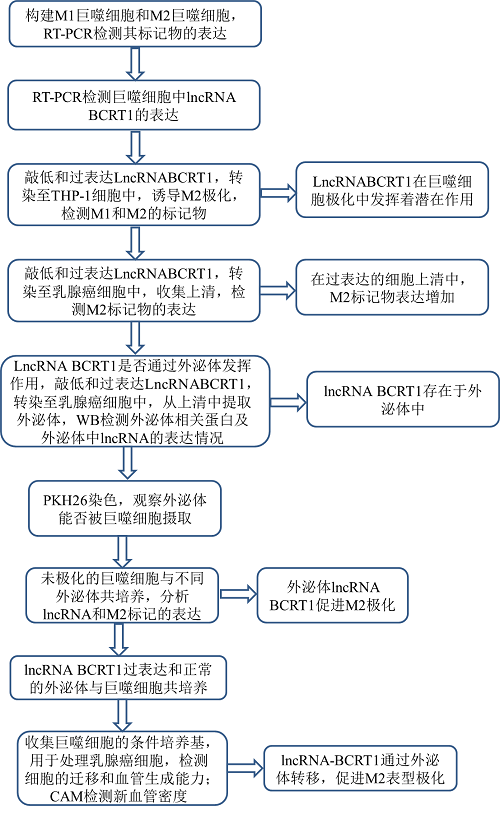
3. 外泌体lncRNA BCRT1对巨噬细胞极化的影响
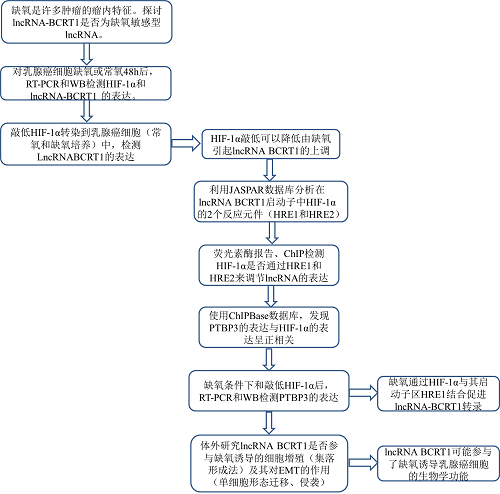
4. LncRNA BCRT1和缺氧的关系
结果:
1.LncRNA BCRT1在乳腺癌中表达上调,与预后不良有关
为了确定可能参与乳腺癌进展的重要lncRNA,我们使用公共数据库(GSE112848和TCGA数据集)分析了lncRNA表达谱(图1a-b)。在本研究中,我们主要关注上调的lncRNAs,因为这些lncRNAs可能作为治疗靶点或预后生物标记物。其中,lncRNA BCRT1是乳腺癌组织中显著上调的lncRNAs之一,作为后续的研究。
图1c,lncRNA BCRT1在不同细胞系中的表达情况。结果发现:与正常乳腺上皮细胞(MCF10A)相比,在其他四种乳腺癌细胞株中lncRNA-BCRT1的表达明显增高。此外,利用RT-qPCR进一步分析了18对乳腺癌组织和正常乳腺组织中lncRNA-BCRT1的表达水平,结果显示,lncRNA-BCRT1在乳腺癌组织中明显高于相邻正常组织(图1d)。此外,在有远处转移的乳腺癌组织中LncRNA BCRT1过表达(图1d),并且LncRNA BCRT1的高表达水平与无病生存期(DFS)和总生存期(OS)显著缩短有关(图1e)。单变量和多变量分析进一步表明,lncRNA BCRT1表达是乳腺癌患者的主要预后因素(附表5)。图1f核质RNA分离结果表明lncRNA BCRT1主要位于细胞质中,荧光原位杂交(FISH)分析进一步证实了这一点(图1g)。
这些发现揭示了lncRNA BCRT1在乳腺癌中上调,并且lncRNA BCRT1的高表达与乳腺癌的不良预后相关。
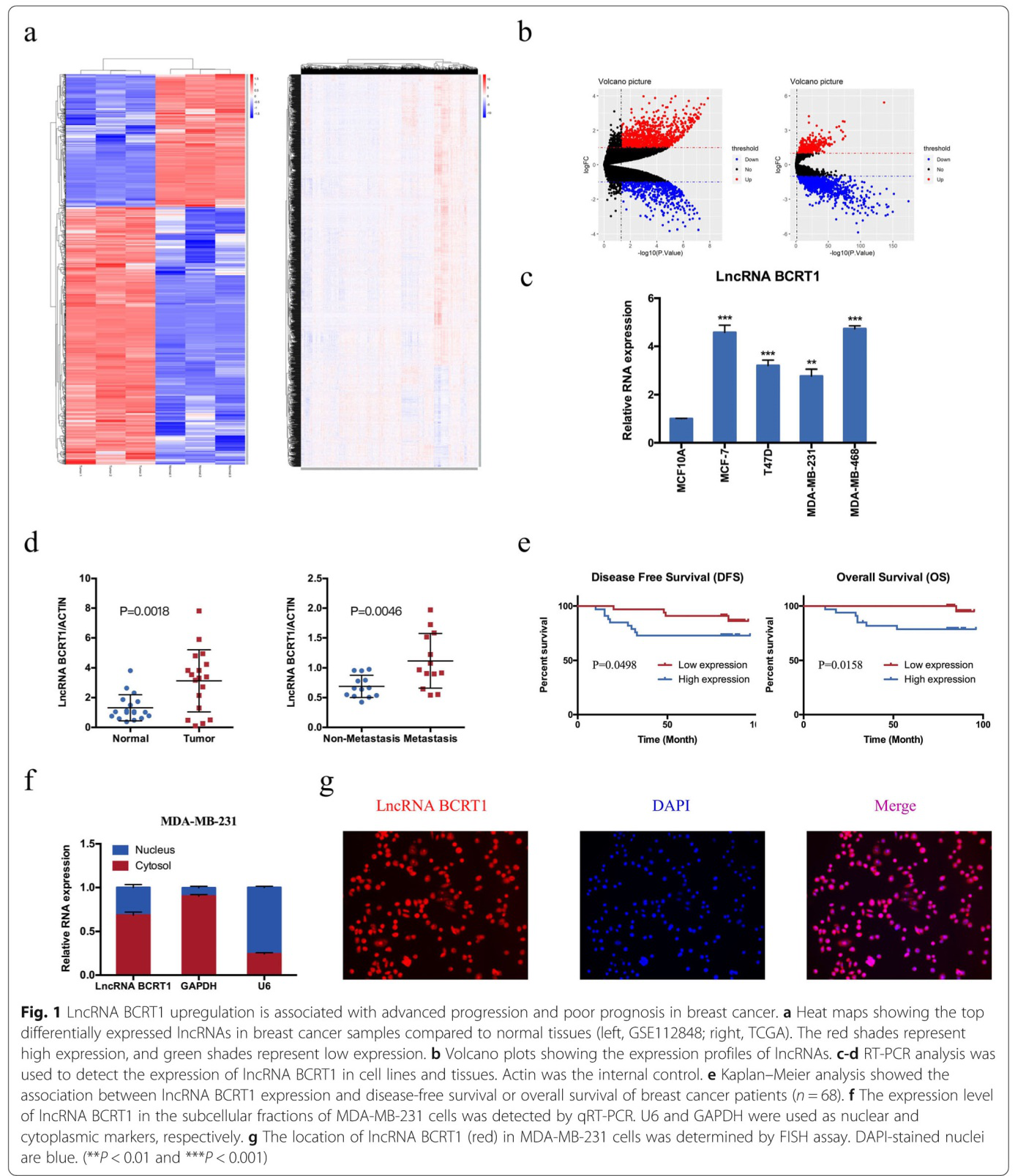
图1 LncRNA-BCRT1上调与乳腺癌的进展和预后不良有关。a热图显示乳腺癌样本中与正常组织相比,差异表达的lncRNAs(左,GSE112848;右,TCGA)。红色代表高表达,绿色代表低表达。b火山图显示lncRNAs表达谱。c-d采用RT-PCR方法检测lncRNA-BCRT1在细胞系和组织中的表达。肌动蛋白为内参。e Kaplan-Meier分析显示lncRNA-BCRT1的表达与乳腺癌患者的无病生存率或总生存率之间存在相关性(n=68)。f qRT-PCR检测lncRNA-BCRT1在MDA-MB-231细胞中的表达水平。U6和GAPDH分别作为核质和细胞质标记。g FISH测定lncRNA-BCRT1(red)在MDA-MB-231细胞中的定位。DAPI染色的细胞核呈蓝色。
2.LncRNA-BCRT1促进乳腺癌细胞增殖和肿瘤生长
为了确定lncRNA-BCRT1在乳腺癌细胞中的生物学功能,应用siRNAs lncRNA-BCRT1(si-BCRT1)干扰进行敲除,并通过RT-PCR证实敲除效率(图2a)。lncRNA BCRT1基因敲除后,乳腺癌细胞的增殖、集落形成能力和DNA合成活性均显著降低(图2b-d)。流式细胞术结果显示,lncRNA-BCRT1基因敲除明显增加乳腺癌细胞的总凋亡率(图2e)。另一方面,当lncRNA BCRT1过表达时,乳腺癌细胞的增殖和集落形成显著增加(图2f-g)。此外,利用皮下异种移植模型验证了lncRNA-BCRT1在体内的生物学功能。与体外实验结果一致,与对照组相比,lncRNA BCRT1的过度表达显著增加了肿瘤的重量和体积(图2h-i)。免疫组织化学(IHC)检测证实lncRNA BCRT1过表达导致Ki67(细胞增殖中不可缺少的)表达增加(图2j),表明细胞增殖增强。结果表明,lncRNA-BCRT1在体内外均能促进乳腺癌细胞的增殖。
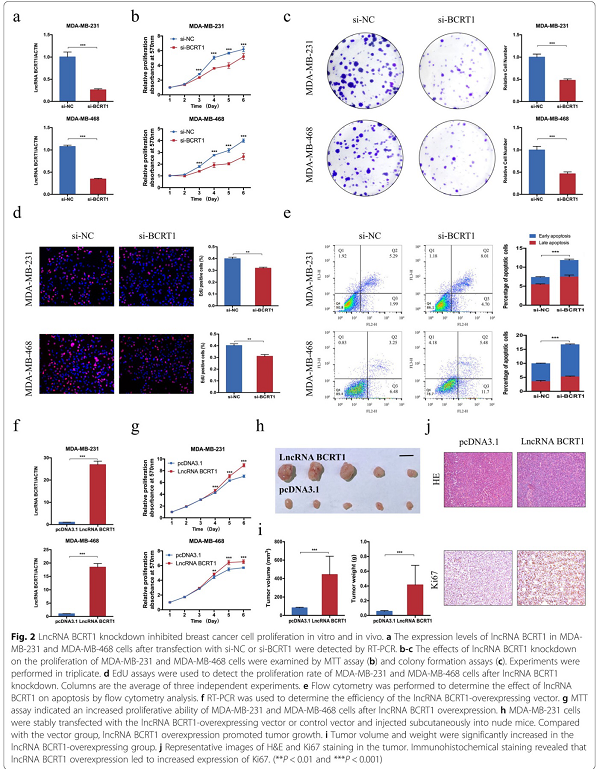
图2 LncRNA BCRT1基因敲除抑制乳腺癌细胞体外和体内增殖。a用RT-PCR法检测转染si-NC或si-BCRT1后,lncRNA-BCRT1在MDA-MB-231和MDA-MB-468细胞中的表达水平。b-c用MTT法(b)和菌落形成法(c)检测lncRNA-BCRT1基因敲除对MDA-MB-231和MDA-MB-468细胞增殖的影响。d采用EdU法检测lncRNA-BCRT1基因敲除后MDA-MB-231和MDA-MB-468细胞的增殖率。e流式细胞术lncRNA-BCRT1对细胞凋亡的影响。f用RT-PCR检测lncRNA-BCRT1过表达的转染效率。g MTT法检测lncRNA-BCRT1过表达后,MDA-MB-231和MDA-MB-468细胞增殖能力增强。h 用lncRNA-BCRT1过表达载体或对照载体稳定转染h-MDA-MB-231细胞后,皮下注射裸鼠。与对照组相比,lncRNA-BCRT1过表达促进肿瘤生长。i 在lncRNA-BCRT1过表达组中,肿瘤体积和重量明显增加。j 肿瘤的H&E和Ki67染色的代表性图像。免疫组化染色显示lncRNA-BCRT1过表达导致Ki67表达增加。(**P<0.01和**P<0.001)
3.LncRNA-BCRT1促进乳腺癌细胞迁移和肿瘤转移
接着,我们研究了lncRNA BCRT1在乳腺癌细胞运动中的作用。结果显示,lncRNA-BCRT1基因敲除显著损害了乳腺癌细胞的迁移和侵袭能力,而lncRNA-BCRT1基因过表达导致细胞迁移率增加(图3a-b)。此外,我们使用乳腺癌选择培养基刺激血管内皮细胞的血管生成,以评估体外血管生成活性。结果表明,与si-NC组相比,si-BCRT1组的相对血管长度明显缩短。另一方面,lncRNA BCRT1过表达导致血管长度显著增加(图3c)。鉴于上皮-间质转化(EMT)是肿瘤转移的主要机制之一,我们进一步评价了lncRNA-BCRT1对EMT相关标记物的影响。Western blot分析显示,lncRNA-BCRT1基因敲除可增加上皮标志物(E-cadherin)的表达,降低间充质标志物(如纤维连接蛋白、N-cadherin和Vimentin)的表达(图3d),提示lncRNA-BCRT1可调节EMT过程,从而来介导乳腺癌的进展。为了在体内证实这些发现,我们通过尾静脉注射乳腺癌细胞建立裸鼠肺转移模型。对照组注射乳腺癌细胞的5只中有2只(2/5)小鼠和lncRNA-BCRT1高表达组注射乳腺癌细胞的5只(5/5)小鼠在4周后出现肺转移灶(图3e)。然后,处死所有小鼠,并对其肺进行苏mu精和伊红(H&E)染色。结果显示,与对照组相比,lncRNA-BCRT1过表达显著增加了肺转移灶的体积和数量(图3f)。同样,lncRNA BCRT1过度表达组的血管密度增加(图3f)。综上所述,这些数据表明lncRNA BCRT1促进乳腺癌细胞的肿瘤转移。
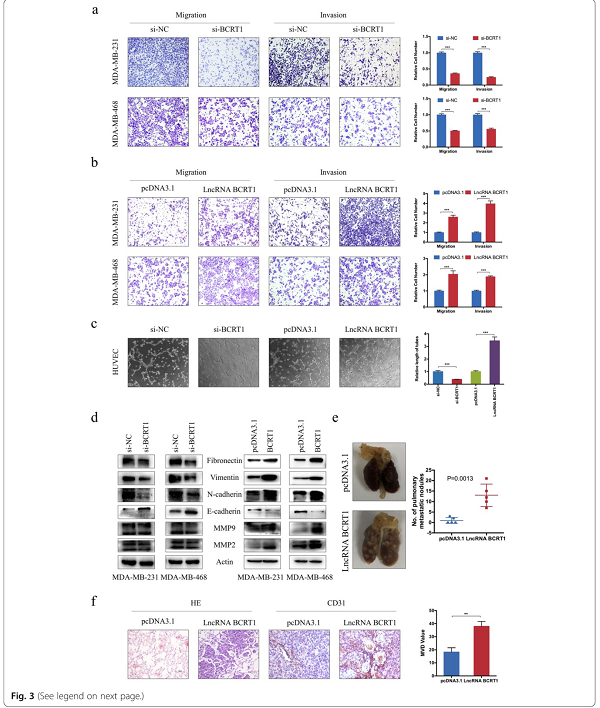
图3 LncRNA-BCRT1基因敲除抑制乳腺癌细胞体内外的转移。a Transwell迁移和侵袭实验用来评估转染si-NC和si-BCRT1的MDA-MB-231和MDA-MB-468细胞的运动能力。b LncRNA-BCRT1过表达导致MDA-MB-231和MDA-MB-468细胞迁移和侵袭能力增加。c 转染si-BCRT1的MDA-MB-231细胞的选择培养基中能抑制HUVECs血管的形成,而过表达lncRNA-BCRT1能促进血管的形成。d western blot检测lncRNA-BCRT1基因敲除或过表达后MDA-MB-231和MDA-MB-468细胞的EMT相关蛋白表达。e 将lncRNA-BCRT1过表达后的MDA-MB-231细胞尾静脉注入裸鼠(n=5)。小鼠肺的代表性图像和肺的H&E染色。LncRNA BCRT1过表达导致肺转移数量增加。f 在异种移植中,代表性的CD31免疫组织化学染色及相应的统计图分析。(P<0.01和**P<0.001)
4.LncRNA BCRT1作用于miR-1303在乳腺癌细胞中发挥作用
最近,许多lncRNA被报道作为ceRNAs调节miRNAs的表达和生物学功能。由于lncRNA BCRT1主要分布在细胞浆中,我们推测lncRNA BCRT1可能作为miRNA海绵阻止miRNA与其靶mRNA结合。通过RegRNA数据库,我们确定miR-1303是lncRNA BCRT1的潜在靶点(图4a)。为了验证结合位点,我们进行了双荧光素酶报告分析。miR-1303的过表达显著降低了pmirGLO-BCRT1-wt载体的荧光素酶活性,但未能降低突变载体的荧光素酶活性(图4b)。AGO2免疫沉淀试验表明,AGO2抗体能够同时拉下内源性lncRNA BCRT1和miR-1303(图4c),进一步验证了它们的结合潜力。此外,lncRNA BCRT1基因敲除促进miR-1303的表达(图4d),而lncRNA BCRT1过表达抑制miR-1303的表达(图S3a)。这些结果表明:在乳腺癌中,miR-1303是lncRNA-BCRT1的抑制靶点。在异种移植瘤中也检测到lncRNA BCRT1和miR-1303之间的负相关(附图S3b)。
然后,检测了miR-1303在乳腺癌中的作用。根据LinkedDomics数据库显示,miR-1303的高表达与乳腺癌患者更好的总体生存率相关(附图 S3c),表明miR-1303在乳腺癌中起抑癌作用。RT-PCR测定miR-1303-mimics的转染效率(图4e和附图S3d),miR-1303过表达导致乳腺癌细胞增殖率降低和凋亡率增加(图4f-g和附图S3e)。此外,miR-1303过表达减少了细胞迁移和侵袭(图4h和附图S3f)。重要的是,挽救实验进一步验证了lncRNA BCRT1和miR-1303之间的功能关系(图3i-k)。此外,在乳腺癌细胞中miR-1303过度表达后,lncRNA-BCRT1表达降低(附图S3g),表明它们之间存在相互抑制作用。总之,我们选择miR-1303作为lncRNA-BCRT1的抑制靶点,以进一步研究乳腺癌。
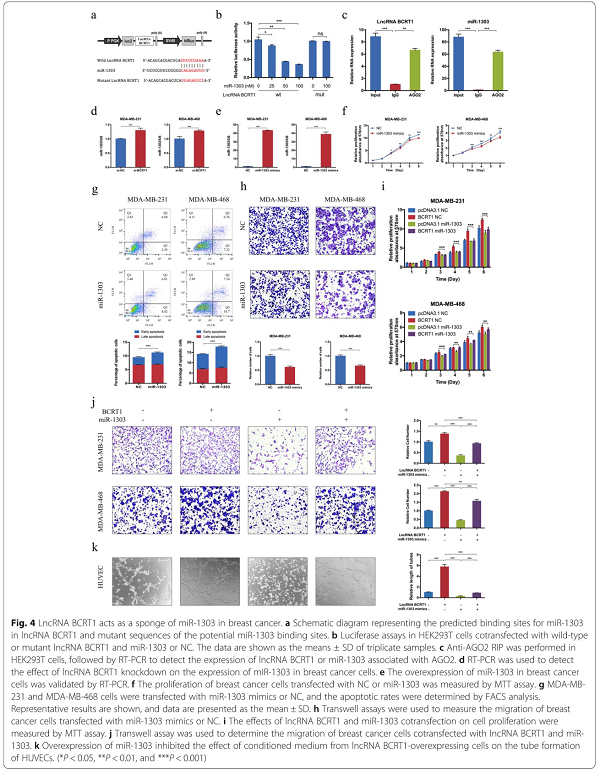
图4 LncRNA-BCRT1在乳腺癌中充当miR-1303的海绵。a lncRNA BCRT1中miR-1303的预测结合位点和潜在miR-1303结合位点的突变序列的示意图。b与野生型或突变型lncRNA-BCRT1和miR-1303或NC共转染HEK293T细胞的双荧光素酶报告检测。c在HEK293T细胞中进行,anti-AGO2-RIP和RT-PCR检测与AGO2相关的lncRNA BCRT1或miR-1303的表达。d RT-PCR检测lncRNA-BCRT1基因敲除对乳腺癌细胞miR-1303表达的影响。e通过RT-PCR检测miR-1303在乳腺癌细胞中的过表达。f MTT法检测转染NC或miR-1303的乳腺癌细胞的增殖情况。g用miR-1303-mimics或NC转染MDA-MB-231和MDA-MB-468细胞,用流式细胞仪检测细胞凋亡率。h Transwell法检测miR-1303-mimics或NC转染的乳腺癌细胞的迁移。i用MTT法检测lncRNA-BCRT1和miR-1303共转染对细胞增殖的影响。j Transwell法检测lncRNA-BCRT1和miR-1303共转染乳腺癌细胞的迁移。k miR-1303过表达抑制了lncRNA-BCRT1过表达细胞选择培养基对HUVECs成管的影响。(*P<0.05,**P<0.01和**P<0.001).
5.LncRNA-BCRT1通过抑制miR-1303调节PTBP3的表达
使用miRDB、miRWalk、miRPathDB和TargetScan数据库,我们发现PTBP3是miR-1303的潜在靶标(图5a)。此外,我们发现,使用TCGA和GEO数据库发现,与正常组织相比,乳腺癌组织中PTBP3的表达升高(图5b),并且PTBP3的高表达与乳腺癌患者的不良预后相关(附图S4)。此外,我们发现在乳腺癌细胞中,PTBP3的表达与lncRNA BCRT1的表达呈正相关(图5c)。因此,我们选择PTBP3作为miR-1303的靶点进行进一步的观察。荧光素酶检测显示miR-1303的过表达降低了野生型PTBP3报告者的荧光素酶活性(图5d),表明PTBP3是miR-1303的直接靶点。此外,miR-1303过度表达(图5e)或lncRNA-BCRT1基因敲除(图5f)降低了PTBP3的mRNA和蛋白水平。在挽救实验中,miR-1303的过表达可以部分抵消lncRNA-BCRT1在乳腺癌细胞中过表达诱导的PTBP3表达的相应增加(图5g)。此外,lncRNA BCRT1的过表达也导致PTBP3在异种移植瘤中的表达增加(附图S5a-b)。图5h-j表明PTBP3基因敲除显著抑制细胞增殖,增加细胞凋亡。此外,Transwell分析显示PTBP3基因敲除缓解了乳腺癌细胞的迁移和侵袭能力(图5k)。这些结果表明, PTBP3在乳腺癌中起促进肿瘤的作用,并且lncRNA-BCRT1通过调节miR-1303在调节PTBP3表达中起重要作用。
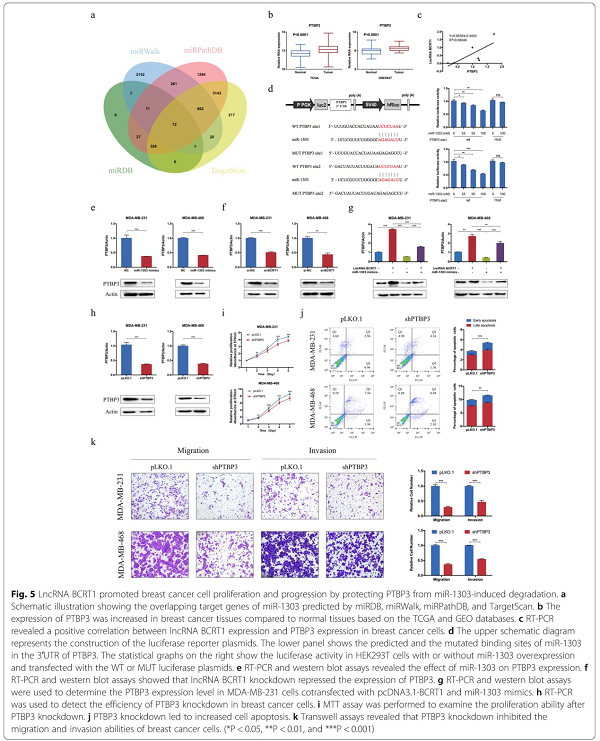
图5 LncRNA-BCRT1通过保护PTBP3免受miR-1303诱导的降解而促进乳腺癌细胞的增殖和进展。a 由miRDB、miRWalk、miRPathDB和TargetScan预测的miR-1303重叠靶基因的示意图。b基于TCGA和GEO数据库,PTBP3在乳腺癌组织中的表达较正常组织增加。c RT-PCR显示乳腺癌细胞中lncRNA-BCRT1表达与PTBP3表达呈正相关。d上面表示荧光素酶报告质粒的构建。下面显示了miR-1303在PTBP3的3′UTR中的预测和突变结合位点。右边的统计图显示了miR-1303高表达和转染WT或MUT荧光素酶质粒的HEK293T细胞的荧光素酶活性。e RT-PCR和western blot检测显示miR-1303对PTBP3表达有影响。f RT-PCR和western blot检测表明,lncRNA-BCRT1基因敲除抑制了PTBP3的表达。g用RT-PCR和western blot方法检测pcDNA3.1-BCRT1和miR-1303-mimics共转染的MDA-MB-231细胞中PTBP3的表达水平。h RT-PCR检测PTBP3基因在乳腺癌细胞中的敲除效率。i MTT法检测PTBP3基因敲除后的增殖能力。j PTBP3基因敲除导致细胞凋亡增加。k Transwell显示PTBP3基因敲除抑制了乳腺癌细胞的迁移和侵袭能力。(*P<0.05,**P<0.01和**P<0.001)
6.外泌体lncRNA-BCRT1促进M2表型极化并促进巨噬细胞诱导的肿瘤进展
先前的研究报道,肿瘤相关巨噬细胞(TAM)被认为具有M2样表型,是肿瘤微环境(TME)中最丰富的免疫相关细胞,通过介导血管生成、转移和免疫逃逸参与肿瘤发展。为了探讨lncRNA-BCRT1是否参与M2极化,我们评估了在未极化巨噬细胞、LPS/INF-γ诱导的M1巨噬细胞和IL-4/IL-13诱导的M2巨噬细胞中lncRNA-BCRT1、 M1标记物和M2标记物的表达。图6a显示,M1相关基因(CD80、MCP-1、iNOS和IL-6)在M1巨噬细胞中的表达水平显著上调,而M2相关基因(包括CD206和MRC-2)在M2巨噬细胞中的表达水平显著上调,表明单核细胞成功极化。此外,与M1巨噬细胞相比,lncRNA BCRT1在M2巨噬细胞中的表达升高(图6b),表明lncRNA BCRT1在巨噬细胞极化中的潜在作用。PMA处理24小时后,用si-NC或si-BCRT1转染THP-1细胞,然后加入IL-4和IL-13诱导M2表型。结果表明,si-BCRT1组M1标记显著增加,M2标记显著减少(图6c)。相应地,lncRNA BCRT1过表达导致相反的结果(图6d)。此外,与对照组相比,lncRNA BCRT1过表达MDA-MB-231细胞的上清液中,M2标记物的表达升高(图6e)。
然后,我们试图探讨乳腺癌细胞与巨噬细胞间通讯的介导机制。研究报道lncRNAs可以通过外泌体转移来调节肿瘤微环境。为了研究lncRNA BCRT1是否能被包装到外泌体中,我们从培养的乳腺癌细胞上清液中提取外体,并用western blotting检测外泌体相关蛋白的表达,如CD63、HSP70和HSP90(图6f)。LncRNA-BCRT1在MDA-MB-231细胞中的过表达导致在分泌的外泌体中LncRNA-BCRT1水平的增加,而LncRNA-BCRT1基因敲除则产生相反的结果(图6g),表明外泌体中存在LncRNA-BCRT1。我们用PKH26标记MDA-MB-231细胞来源的外泌体,并与巨噬细胞孵育以检测外泌体的摄入情况,并确认标记的外泌体RNAs可被巨噬细胞内化(图6h)。然后,我们将未极化的巨噬细胞与从lncRNA BCRT1过表达或对照MDA-MB-231细胞中分离的外泌体共培养。lncRNA BCRT1和M2表型标记(CD206和MRC-2)在lncRNA BCRT1高表达组中的表达明显高于对照组(图6i),表明外泌体lncRNA BCRT1促进M2极化。然后,我们研究了lncRNA BCRT1在调节巨噬细胞中的作用。lncRNA BCRT1过表达细胞的上清液促进巨噬细胞的迁移能力,并显示出增强的趋化性(附图S6a-b)。此外,与对照组相比,lncRNA BCRT1过表达细胞的上清液或外泌体促进了TGF-β的表达和分泌(附图S6c-e)。为了进一步研究lncRNA-BCRT1培养的M2表型巨噬细胞是否具有促进肿瘤的特征性功能,我们用从lncRNA-BCRT1过表达细胞或对照细胞中分离的外泌体或上清液处理巨噬细胞。然后,收集巨噬细胞的条件培养基,用于治疗乳腺癌细胞或HUVECs。结果表明,用lncRNA BCRT1过表达组中分离的外泌体或上清液处理的巨噬细胞显著促进细胞迁移和血管生成(图6j-k)。此外,鸡胚绒毛尿囊膜(CAM)检测显示,用从lncRNA-BCRT1过表达组中分离的外泌体或上清液处理的巨噬细胞注射的鸡胚,新血管密度增加(图6l)。综上所述,这些结果提示lncRNA-BCRT1可以通过外泌体转移,从而促进M2表型极化,增强其促肿瘤作用。
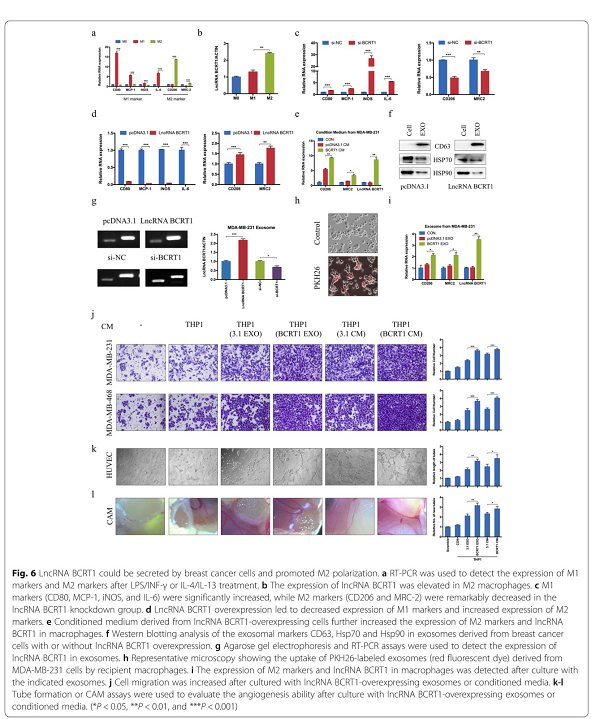
图6 乳腺癌细胞可分泌LncRNA-BCRT1,促进M2极化。a 用RT-PCR方法检测LPS/INF-γ或IL-4/IL-13处理后M1和M2标记物的表达。b M2巨噬细胞中lncRNA-BCRT1表达升高。c 在lncRNA-BCRT1基因敲除组中M1标记(CD80、MCP-1、iNOS和IL-6)显著升高,M2标记(CD206和MRC-2)显著降低。d LncRNA-BCRT1过表达导致M1标记表达降低,M2标记表达增加。e 来自lncRNA BCRT1过表达细胞的培养基进一步增加了巨噬细胞中M2标记物和lncRNA BCRT1的表达。f 乳腺癌细胞外泌体CD63、Hsp70和Hsp90的Western印迹分析。g 采用琼脂糖凝胶电泳和RT-PCR方法检测外泌体中lncRNA-BCRT1的表达。h巨噬细胞摄取来自MDA-MB-231细胞的PKH26标记的外泌体(红色荧光染料)。i用外泌体培养后,检测巨噬细胞中M2标记物和lncRNA-BCRT1的表达。j用lncRNA BCRT1过表达的外泌体或培养基培养后,细胞迁移增加。k-l采用管形成或CAM法检测lncRNA-BCRT1过表达外泌体或条件培养液培养后血管生成能力。(*P<0.05,**P<0.01和**P<0.001)
7.缺氧条件下HIF-1α对LncRNA-BCRT1的转录调控
缺氧是许多肿瘤的主要瘤内特征之一,已有研究表明,肿瘤的缺氧微环境可能是某些lncRNAs异常表达的原因之一。为探讨lncRNA-BCRT1是否为缺氧敏感型lncRNA,对乳腺癌细胞缺氧或常氧48h。结果表明,随着HIF-1α表达的增加,lncRNA-BCRT1的表达明显升高(图7a-b)。HIF-1α基因敲除显著降低HIF-1α和lncRNA-BCRT1在正常和缺氧条件下的表达(图7c-e)。此外,HIF-1α的敲除大大减弱了缺氧诱导的lncRNA-BCRT1上调(图7c-e)。为了阐明缺氧诱导lncRNA-BCRT1上调的潜在机制,我们分析了JASPAR数据库,并鉴定了lncRNA-BCRT1启动子中两个假定的HIF-1α反应元件(HREs)(图7f-g)。为了确定HIF-1α是否通过这些HREs调控lncRNA-BCRT1的表达,我们构建了两个荧光素酶报告载体,其中包含全长lncRNA-BCRT1启动子(HRE1和HRE2)和一个截短片段(HRE2)。与对照细胞相比,缺氧处理显著提高了转染全长lncRNA-BCRT1启动子载体的细胞中的荧光素酶活性,而缺乏HRE1则损害了荧光素酶活性,这表明HRE1对lncRNA-BCRT1转录至关重要(图7h)。此外,HIF-1α基因敲除逆转了缺氧诱导的荧光素酶活性(图7h),表明缺氧通过HIF-1α与启动子区HRE1结合促进lncRNA-BCRT1转录。我们用HIF-1α抗体进行染色质免疫沉淀(ChIP)分析,进一步证实HIF-1α与lncRNA BCRT1启动子中两个预测的HREs结合(图7i),结果证实lncRNA BCRT1启动子中的HRE1是介导HIF-1α诱导转录调控的主要区域。使用ChIPBase数据库,我们发现PTBP3的表达与HIF-1α的表达呈正相关(图7j)。此外,缺氧处理导致PTBP3在mRNA和蛋白质水平上的表达升高(图7k),而HIF-1α的敲除减弱了这种作用(图7l)。这些结果提示缺氧通过HIF-1α与启动子上的HRE1直接结合调节lncRNA-BCRT1的表达。

图7缺氧时HIF-1α对LncRNA-BCRT1进行转录调控。a-b western blot和RT-PCR方法,检测培养48h后MDA-MB-231和MDA-MB-468细胞中HIF-1α蛋白(a)和lncRNA-BCRT1 mRNA(b)的表达水平。c-d RT-PCR和western blot检测HIF-1α基因敲除效率。e HIF-1α基因敲除抑制正常或缺氧条件下MDA-MB-231和MDA-MB-468细胞lncRNA-BCRT1的表达。f来自JASPAR数据库的HIF-1α识别基序。g lncRNA-BCRT1启动子近端区域和假定的缺氧反应元件(HREs)的示意图。h 用含pGL3报告载体的lncRNA-BCRT1启动子转染h-MDA-MB-231细胞,进一步用缺氧或缺氧联合siHIF-1α处理。48h后,用双荧光素酶报告系统测定荧光素酶活性。i 用抗HIF-1α抗体进行ChIP检测,以验证在常氧和缺氧条件下,HIF-1α与lncRNA-BCRT1启动子HREs的结合。j 用starBase数据库分析TCGA乳腺癌数据集中PTBP3和HIF-1α的表达。k缺氧条件下PTBP3的mRNA和蛋白表达升高。l HIF-1α基因敲除后,用RT-PCR和western blot检测正常或缺氧条件下MDA-MB-231和MDA-MB-468细胞PTBP3的表达。(*P<0.05,**P<0.01和**P<0.001)
8.LncRNA-BCRT1介导缺氧诱导的乳腺癌细胞恶性特性
缺氧是肿瘤微环境的一个标志,与各种实体瘤的增殖、转移和耐药性有关。因此,我们首先研究了lncRNA BCRT1是否参与缺氧诱导的细胞增殖。缺氧处理导致lncRNA BCRT1和PTBP3的表达增加,这与细胞增殖增强有关(图8a-c,附图S7a-c)。此外,HIF-1α或lncRNA-BCRT1基因敲除减弱了缺氧诱导的效应,而lncRNA-BCRT1过表达部分逆转了HIF-1α基因敲除的抑制效应(图8a-c,附图S7a-c)。以往的研究表明缺氧与EMT密切相关,因此进一步探讨了lncRNA-BCRT1在缺氧诱导EMT中的作用。缺氧处理后,MDA-MB-231细胞表现出更像成纤维细胞的形态和更高的迁移能力,HIF-1α或lncRNA-BCRT1的敲除显著逆转了这一点(图8d-f,附图S7d-e)。此外,缺氧条件下siHIF-1α抑制的EMT谱明显被lncRNA-BCRT1的过度表达所挽救(图8d-f,附图S7d-e)。这些结果表明lncRNA BCRT1可能参与了缺氧诱导乳腺癌细胞的生物学功能。
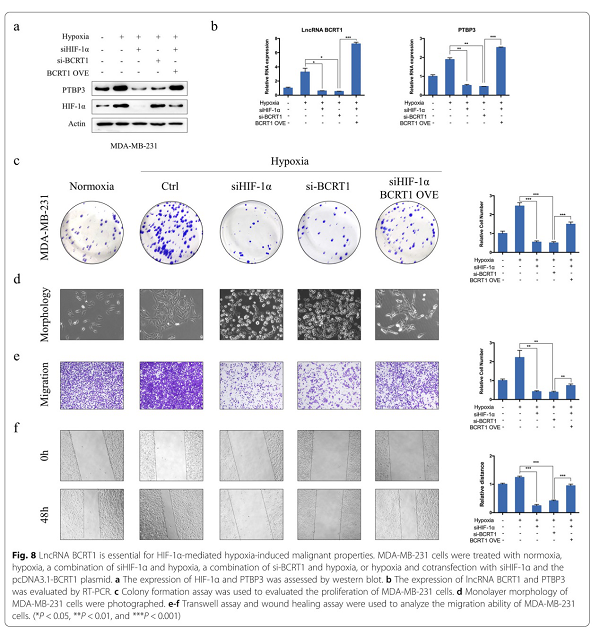
图8 LncRNA-BCRT1是HIF-1α介导的缺氧诱导的恶性肿瘤的关键。MDA-MB-231细胞经常氧、缺氧、siHIF-1α结合缺氧、si-BCRT1结合缺氧、或者缺氧与siHIF-1α和pcDNA3.1-BCRT1质粒共转染处理。a western blot检测HIF-1α和PTBP3的表达。b RT-PCR法检测lncRNA-BCRT1和PTBP3的表达。c集落形成法检测MDA-MB-231细胞增殖情况。d对MDA-MB-231细胞进行了单层形态学观察。e-f Transwell 和wound healing法分析MDA-MB-231细胞的迁移能力。
综上所述,我们认为缺氧反应性lncRNA BCRT1是乳腺癌的一个肿瘤促进因子,lncRNA BCRT1的高表达与肿瘤转移和预后不良有关。LncRNA BCRT1作为miR-1303的海绵,减弱其对PTBP3的抑制作用,并且通过外泌体介导的转移促进M2极化。
乳腺癌是全世界女性最常见的恶性肿瘤之一。尽管在诊断和联合治疗方面取得了进展,但是乳腺癌患者的预后仍然不令人满意。转移是肿瘤致死的主要原因之一,严重阻碍了治疗的成功。因此,更全面地了解乳腺癌的进展和转移机制,对改善乳腺癌患者的预后具有重要意义。
近年来,lncRNAs被发现参与多种生理和病理过程,尤其是在癌症。已经有研究证明,lncRNAs在癌症中经常失调,并参与多种恶性肿瘤的进展和转移。LncRNA-ANCR介导EZH2的降解,从而减弱乳腺癌的转移能力。此外,lncRNA AGAP2-AS1在乳腺癌中被发现上调,并与曲妥珠单抗耐药相关。然而,绝大多数lncRNAs在乳腺癌调控中的临床意义和生物学机制仍不清楚。
一些研究表明,lncRNAs可能作为ceRNAs,来调节microRNAs的生物学功能或表达。例如,lncRNA-LINC00963通过充当乳腺癌细胞miR-324-3p的ceRNA促进肿瘤的发生和抗辐射性。以往的研究表明,缺氧是肿瘤微环境的一个重要标志,与许多实体瘤的进展和转移有关。HIF-1α是一种广泛研究的缺氧诱导因子,通过下游靶基因的反式激活介导细胞对缺氧的反应。在常氧条件下,HIF-1α受到蛋白酶体降解,而缺氧条件则保护HIF-1α不被降解,从而允许HIF-1α转运到细胞核中启动基因表达。近年来,缺氧条件在调节lncRNAs表达中的作用受到广泛关注,各种缺氧反应性lncRNAs在肿瘤发生和发展中起着重要作用。然而,对于缺氧介导lncRNA异常表达的机制以及lncRNA在乳腺癌中的作用尚需进一步研究。
在本研究中,通过分析公共微阵列数据,筛选在乳腺癌中差异表达的lncRNAs。其中,LncRNA-BCRT1(乳腺癌相关转录本1)在乳腺癌组织中显著高表达,与乳腺癌患者预后不良相关,被选作进一步的研究。LncRNA-BCRT1通过与miR-1303竞争性结合发挥肿瘤启动子的作用,保护PTBP3不被降解,从而促进乳腺癌细胞在体内外的生长和进展。此外,lncRNA-BCRT1可以通过外泌体转移到巨噬细胞中,促进M2极化,增强其对肿瘤进展的作用。进一步的研究表明,lncRNA-BCRT1是通过HIF-1α依赖性转录调控在缺氧条件下诱导的,从而促进了缺氧诱导的EMT。我们的研究结果为乳腺癌的转移机制提供了新的见解,为乳腺癌的治疗提供了一个有希望的靶点。
技术路线:
1. LncRNA BCRT1在乳腺癌中的机制

2. LncRNA BCRT1-miR1303-PTBP3

3. 外泌体lncRNA BCRT1对巨噬细胞极化的影响

4. LncRNA BCRT1和缺氧的关系

结果:
1.LncRNA BCRT1在乳腺癌中表达上调,与预后不良有关
为了确定可能参与乳腺癌进展的重要lncRNA,我们使用公共数据库(GSE112848和TCGA数据集)分析了lncRNA表达谱(图1a-b)。在本研究中,我们主要关注上调的lncRNAs,因为这些lncRNAs可能作为治疗靶点或预后生物标记物。其中,lncRNA BCRT1是乳腺癌组织中显著上调的lncRNAs之一,作为后续的研究。
图1c,lncRNA BCRT1在不同细胞系中的表达情况。结果发现:与正常乳腺上皮细胞(MCF10A)相比,在其他四种乳腺癌细胞株中lncRNA-BCRT1的表达明显增高。此外,利用RT-qPCR进一步分析了18对乳腺癌组织和正常乳腺组织中lncRNA-BCRT1的表达水平,结果显示,lncRNA-BCRT1在乳腺癌组织中明显高于相邻正常组织(图1d)。此外,在有远处转移的乳腺癌组织中LncRNA BCRT1过表达(图1d),并且LncRNA BCRT1的高表达水平与无病生存期(DFS)和总生存期(OS)显著缩短有关(图1e)。单变量和多变量分析进一步表明,lncRNA BCRT1表达是乳腺癌患者的主要预后因素(附表5)。图1f核质RNA分离结果表明lncRNA BCRT1主要位于细胞质中,荧光原位杂交(FISH)分析进一步证实了这一点(图1g)。
这些发现揭示了lncRNA BCRT1在乳腺癌中上调,并且lncRNA BCRT1的高表达与乳腺癌的不良预后相关。

图1 LncRNA-BCRT1上调与乳腺癌的进展和预后不良有关。a热图显示乳腺癌样本中与正常组织相比,差异表达的lncRNAs(左,GSE112848;右,TCGA)。红色代表高表达,绿色代表低表达。b火山图显示lncRNAs表达谱。c-d采用RT-PCR方法检测lncRNA-BCRT1在细胞系和组织中的表达。肌动蛋白为内参。e Kaplan-Meier分析显示lncRNA-BCRT1的表达与乳腺癌患者的无病生存率或总生存率之间存在相关性(n=68)。f qRT-PCR检测lncRNA-BCRT1在MDA-MB-231细胞中的表达水平。U6和GAPDH分别作为核质和细胞质标记。g FISH测定lncRNA-BCRT1(red)在MDA-MB-231细胞中的定位。DAPI染色的细胞核呈蓝色。
2.LncRNA-BCRT1促进乳腺癌细胞增殖和肿瘤生长
为了确定lncRNA-BCRT1在乳腺癌细胞中的生物学功能,应用siRNAs lncRNA-BCRT1(si-BCRT1)干扰进行敲除,并通过RT-PCR证实敲除效率(图2a)。lncRNA BCRT1基因敲除后,乳腺癌细胞的增殖、集落形成能力和DNA合成活性均显著降低(图2b-d)。流式细胞术结果显示,lncRNA-BCRT1基因敲除明显增加乳腺癌细胞的总凋亡率(图2e)。另一方面,当lncRNA BCRT1过表达时,乳腺癌细胞的增殖和集落形成显著增加(图2f-g)。此外,利用皮下异种移植模型验证了lncRNA-BCRT1在体内的生物学功能。与体外实验结果一致,与对照组相比,lncRNA BCRT1的过度表达显著增加了肿瘤的重量和体积(图2h-i)。免疫组织化学(IHC)检测证实lncRNA BCRT1过表达导致Ki67(细胞增殖中不可缺少的)表达增加(图2j),表明细胞增殖增强。结果表明,lncRNA-BCRT1在体内外均能促进乳腺癌细胞的增殖。

图2 LncRNA BCRT1基因敲除抑制乳腺癌细胞体外和体内增殖。a用RT-PCR法检测转染si-NC或si-BCRT1后,lncRNA-BCRT1在MDA-MB-231和MDA-MB-468细胞中的表达水平。b-c用MTT法(b)和菌落形成法(c)检测lncRNA-BCRT1基因敲除对MDA-MB-231和MDA-MB-468细胞增殖的影响。d采用EdU法检测lncRNA-BCRT1基因敲除后MDA-MB-231和MDA-MB-468细胞的增殖率。e流式细胞术lncRNA-BCRT1对细胞凋亡的影响。f用RT-PCR检测lncRNA-BCRT1过表达的转染效率。g MTT法检测lncRNA-BCRT1过表达后,MDA-MB-231和MDA-MB-468细胞增殖能力增强。h 用lncRNA-BCRT1过表达载体或对照载体稳定转染h-MDA-MB-231细胞后,皮下注射裸鼠。与对照组相比,lncRNA-BCRT1过表达促进肿瘤生长。i 在lncRNA-BCRT1过表达组中,肿瘤体积和重量明显增加。j 肿瘤的H&E和Ki67染色的代表性图像。免疫组化染色显示lncRNA-BCRT1过表达导致Ki67表达增加。(**P<0.01和**P<0.001)
3.LncRNA-BCRT1促进乳腺癌细胞迁移和肿瘤转移
接着,我们研究了lncRNA BCRT1在乳腺癌细胞运动中的作用。结果显示,lncRNA-BCRT1基因敲除显著损害了乳腺癌细胞的迁移和侵袭能力,而lncRNA-BCRT1基因过表达导致细胞迁移率增加(图3a-b)。此外,我们使用乳腺癌选择培养基刺激血管内皮细胞的血管生成,以评估体外血管生成活性。结果表明,与si-NC组相比,si-BCRT1组的相对血管长度明显缩短。另一方面,lncRNA BCRT1过表达导致血管长度显著增加(图3c)。鉴于上皮-间质转化(EMT)是肿瘤转移的主要机制之一,我们进一步评价了lncRNA-BCRT1对EMT相关标记物的影响。Western blot分析显示,lncRNA-BCRT1基因敲除可增加上皮标志物(E-cadherin)的表达,降低间充质标志物(如纤维连接蛋白、N-cadherin和Vimentin)的表达(图3d),提示lncRNA-BCRT1可调节EMT过程,从而来介导乳腺癌的进展。为了在体内证实这些发现,我们通过尾静脉注射乳腺癌细胞建立裸鼠肺转移模型。对照组注射乳腺癌细胞的5只中有2只(2/5)小鼠和lncRNA-BCRT1高表达组注射乳腺癌细胞的5只(5/5)小鼠在4周后出现肺转移灶(图3e)。然后,处死所有小鼠,并对其肺进行苏mu精和伊红(H&E)染色。结果显示,与对照组相比,lncRNA-BCRT1过表达显著增加了肺转移灶的体积和数量(图3f)。同样,lncRNA BCRT1过度表达组的血管密度增加(图3f)。综上所述,这些数据表明lncRNA BCRT1促进乳腺癌细胞的肿瘤转移。

图3 LncRNA-BCRT1基因敲除抑制乳腺癌细胞体内外的转移。a Transwell迁移和侵袭实验用来评估转染si-NC和si-BCRT1的MDA-MB-231和MDA-MB-468细胞的运动能力。b LncRNA-BCRT1过表达导致MDA-MB-231和MDA-MB-468细胞迁移和侵袭能力增加。c 转染si-BCRT1的MDA-MB-231细胞的选择培养基中能抑制HUVECs血管的形成,而过表达lncRNA-BCRT1能促进血管的形成。d western blot检测lncRNA-BCRT1基因敲除或过表达后MDA-MB-231和MDA-MB-468细胞的EMT相关蛋白表达。e 将lncRNA-BCRT1过表达后的MDA-MB-231细胞尾静脉注入裸鼠(n=5)。小鼠肺的代表性图像和肺的H&E染色。LncRNA BCRT1过表达导致肺转移数量增加。f 在异种移植中,代表性的CD31免疫组织化学染色及相应的统计图分析。(P<0.01和**P<0.001)
4.LncRNA BCRT1作用于miR-1303在乳腺癌细胞中发挥作用
最近,许多lncRNA被报道作为ceRNAs调节miRNAs的表达和生物学功能。由于lncRNA BCRT1主要分布在细胞浆中,我们推测lncRNA BCRT1可能作为miRNA海绵阻止miRNA与其靶mRNA结合。通过RegRNA数据库,我们确定miR-1303是lncRNA BCRT1的潜在靶点(图4a)。为了验证结合位点,我们进行了双荧光素酶报告分析。miR-1303的过表达显著降低了pmirGLO-BCRT1-wt载体的荧光素酶活性,但未能降低突变载体的荧光素酶活性(图4b)。AGO2免疫沉淀试验表明,AGO2抗体能够同时拉下内源性lncRNA BCRT1和miR-1303(图4c),进一步验证了它们的结合潜力。此外,lncRNA BCRT1基因敲除促进miR-1303的表达(图4d),而lncRNA BCRT1过表达抑制miR-1303的表达(图S3a)。这些结果表明:在乳腺癌中,miR-1303是lncRNA-BCRT1的抑制靶点。在异种移植瘤中也检测到lncRNA BCRT1和miR-1303之间的负相关(附图S3b)。
然后,检测了miR-1303在乳腺癌中的作用。根据LinkedDomics数据库显示,miR-1303的高表达与乳腺癌患者更好的总体生存率相关(附图 S3c),表明miR-1303在乳腺癌中起抑癌作用。RT-PCR测定miR-1303-mimics的转染效率(图4e和附图S3d),miR-1303过表达导致乳腺癌细胞增殖率降低和凋亡率增加(图4f-g和附图S3e)。此外,miR-1303过表达减少了细胞迁移和侵袭(图4h和附图S3f)。重要的是,挽救实验进一步验证了lncRNA BCRT1和miR-1303之间的功能关系(图3i-k)。此外,在乳腺癌细胞中miR-1303过度表达后,lncRNA-BCRT1表达降低(附图S3g),表明它们之间存在相互抑制作用。总之,我们选择miR-1303作为lncRNA-BCRT1的抑制靶点,以进一步研究乳腺癌。

图4 LncRNA-BCRT1在乳腺癌中充当miR-1303的海绵。a lncRNA BCRT1中miR-1303的预测结合位点和潜在miR-1303结合位点的突变序列的示意图。b与野生型或突变型lncRNA-BCRT1和miR-1303或NC共转染HEK293T细胞的双荧光素酶报告检测。c在HEK293T细胞中进行,anti-AGO2-RIP和RT-PCR检测与AGO2相关的lncRNA BCRT1或miR-1303的表达。d RT-PCR检测lncRNA-BCRT1基因敲除对乳腺癌细胞miR-1303表达的影响。e通过RT-PCR检测miR-1303在乳腺癌细胞中的过表达。f MTT法检测转染NC或miR-1303的乳腺癌细胞的增殖情况。g用miR-1303-mimics或NC转染MDA-MB-231和MDA-MB-468细胞,用流式细胞仪检测细胞凋亡率。h Transwell法检测miR-1303-mimics或NC转染的乳腺癌细胞的迁移。i用MTT法检测lncRNA-BCRT1和miR-1303共转染对细胞增殖的影响。j Transwell法检测lncRNA-BCRT1和miR-1303共转染乳腺癌细胞的迁移。k miR-1303过表达抑制了lncRNA-BCRT1过表达细胞选择培养基对HUVECs成管的影响。(*P<0.05,**P<0.01和**P<0.001).
5.LncRNA-BCRT1通过抑制miR-1303调节PTBP3的表达
使用miRDB、miRWalk、miRPathDB和TargetScan数据库,我们发现PTBP3是miR-1303的潜在靶标(图5a)。此外,我们发现,使用TCGA和GEO数据库发现,与正常组织相比,乳腺癌组织中PTBP3的表达升高(图5b),并且PTBP3的高表达与乳腺癌患者的不良预后相关(附图S4)。此外,我们发现在乳腺癌细胞中,PTBP3的表达与lncRNA BCRT1的表达呈正相关(图5c)。因此,我们选择PTBP3作为miR-1303的靶点进行进一步的观察。荧光素酶检测显示miR-1303的过表达降低了野生型PTBP3报告者的荧光素酶活性(图5d),表明PTBP3是miR-1303的直接靶点。此外,miR-1303过度表达(图5e)或lncRNA-BCRT1基因敲除(图5f)降低了PTBP3的mRNA和蛋白水平。在挽救实验中,miR-1303的过表达可以部分抵消lncRNA-BCRT1在乳腺癌细胞中过表达诱导的PTBP3表达的相应增加(图5g)。此外,lncRNA BCRT1的过表达也导致PTBP3在异种移植瘤中的表达增加(附图S5a-b)。图5h-j表明PTBP3基因敲除显著抑制细胞增殖,增加细胞凋亡。此外,Transwell分析显示PTBP3基因敲除缓解了乳腺癌细胞的迁移和侵袭能力(图5k)。这些结果表明, PTBP3在乳腺癌中起促进肿瘤的作用,并且lncRNA-BCRT1通过调节miR-1303在调节PTBP3表达中起重要作用。

图5 LncRNA-BCRT1通过保护PTBP3免受miR-1303诱导的降解而促进乳腺癌细胞的增殖和进展。a 由miRDB、miRWalk、miRPathDB和TargetScan预测的miR-1303重叠靶基因的示意图。b基于TCGA和GEO数据库,PTBP3在乳腺癌组织中的表达较正常组织增加。c RT-PCR显示乳腺癌细胞中lncRNA-BCRT1表达与PTBP3表达呈正相关。d上面表示荧光素酶报告质粒的构建。下面显示了miR-1303在PTBP3的3′UTR中的预测和突变结合位点。右边的统计图显示了miR-1303高表达和转染WT或MUT荧光素酶质粒的HEK293T细胞的荧光素酶活性。e RT-PCR和western blot检测显示miR-1303对PTBP3表达有影响。f RT-PCR和western blot检测表明,lncRNA-BCRT1基因敲除抑制了PTBP3的表达。g用RT-PCR和western blot方法检测pcDNA3.1-BCRT1和miR-1303-mimics共转染的MDA-MB-231细胞中PTBP3的表达水平。h RT-PCR检测PTBP3基因在乳腺癌细胞中的敲除效率。i MTT法检测PTBP3基因敲除后的增殖能力。j PTBP3基因敲除导致细胞凋亡增加。k Transwell显示PTBP3基因敲除抑制了乳腺癌细胞的迁移和侵袭能力。(*P<0.05,**P<0.01和**P<0.001)
6.外泌体lncRNA-BCRT1促进M2表型极化并促进巨噬细胞诱导的肿瘤进展
先前的研究报道,肿瘤相关巨噬细胞(TAM)被认为具有M2样表型,是肿瘤微环境(TME)中最丰富的免疫相关细胞,通过介导血管生成、转移和免疫逃逸参与肿瘤发展。为了探讨lncRNA-BCRT1是否参与M2极化,我们评估了在未极化巨噬细胞、LPS/INF-γ诱导的M1巨噬细胞和IL-4/IL-13诱导的M2巨噬细胞中lncRNA-BCRT1、 M1标记物和M2标记物的表达。图6a显示,M1相关基因(CD80、MCP-1、iNOS和IL-6)在M1巨噬细胞中的表达水平显著上调,而M2相关基因(包括CD206和MRC-2)在M2巨噬细胞中的表达水平显著上调,表明单核细胞成功极化。此外,与M1巨噬细胞相比,lncRNA BCRT1在M2巨噬细胞中的表达升高(图6b),表明lncRNA BCRT1在巨噬细胞极化中的潜在作用。PMA处理24小时后,用si-NC或si-BCRT1转染THP-1细胞,然后加入IL-4和IL-13诱导M2表型。结果表明,si-BCRT1组M1标记显著增加,M2标记显著减少(图6c)。相应地,lncRNA BCRT1过表达导致相反的结果(图6d)。此外,与对照组相比,lncRNA BCRT1过表达MDA-MB-231细胞的上清液中,M2标记物的表达升高(图6e)。
然后,我们试图探讨乳腺癌细胞与巨噬细胞间通讯的介导机制。研究报道lncRNAs可以通过外泌体转移来调节肿瘤微环境。为了研究lncRNA BCRT1是否能被包装到外泌体中,我们从培养的乳腺癌细胞上清液中提取外体,并用western blotting检测外泌体相关蛋白的表达,如CD63、HSP70和HSP90(图6f)。LncRNA-BCRT1在MDA-MB-231细胞中的过表达导致在分泌的外泌体中LncRNA-BCRT1水平的增加,而LncRNA-BCRT1基因敲除则产生相反的结果(图6g),表明外泌体中存在LncRNA-BCRT1。我们用PKH26标记MDA-MB-231细胞来源的外泌体,并与巨噬细胞孵育以检测外泌体的摄入情况,并确认标记的外泌体RNAs可被巨噬细胞内化(图6h)。然后,我们将未极化的巨噬细胞与从lncRNA BCRT1过表达或对照MDA-MB-231细胞中分离的外泌体共培养。lncRNA BCRT1和M2表型标记(CD206和MRC-2)在lncRNA BCRT1高表达组中的表达明显高于对照组(图6i),表明外泌体lncRNA BCRT1促进M2极化。然后,我们研究了lncRNA BCRT1在调节巨噬细胞中的作用。lncRNA BCRT1过表达细胞的上清液促进巨噬细胞的迁移能力,并显示出增强的趋化性(附图S6a-b)。此外,与对照组相比,lncRNA BCRT1过表达细胞的上清液或外泌体促进了TGF-β的表达和分泌(附图S6c-e)。为了进一步研究lncRNA-BCRT1培养的M2表型巨噬细胞是否具有促进肿瘤的特征性功能,我们用从lncRNA-BCRT1过表达细胞或对照细胞中分离的外泌体或上清液处理巨噬细胞。然后,收集巨噬细胞的条件培养基,用于治疗乳腺癌细胞或HUVECs。结果表明,用lncRNA BCRT1过表达组中分离的外泌体或上清液处理的巨噬细胞显著促进细胞迁移和血管生成(图6j-k)。此外,鸡胚绒毛尿囊膜(CAM)检测显示,用从lncRNA-BCRT1过表达组中分离的外泌体或上清液处理的巨噬细胞注射的鸡胚,新血管密度增加(图6l)。综上所述,这些结果提示lncRNA-BCRT1可以通过外泌体转移,从而促进M2表型极化,增强其促肿瘤作用。

图6 乳腺癌细胞可分泌LncRNA-BCRT1,促进M2极化。a 用RT-PCR方法检测LPS/INF-γ或IL-4/IL-13处理后M1和M2标记物的表达。b M2巨噬细胞中lncRNA-BCRT1表达升高。c 在lncRNA-BCRT1基因敲除组中M1标记(CD80、MCP-1、iNOS和IL-6)显著升高,M2标记(CD206和MRC-2)显著降低。d LncRNA-BCRT1过表达导致M1标记表达降低,M2标记表达增加。e 来自lncRNA BCRT1过表达细胞的培养基进一步增加了巨噬细胞中M2标记物和lncRNA BCRT1的表达。f 乳腺癌细胞外泌体CD63、Hsp70和Hsp90的Western印迹分析。g 采用琼脂糖凝胶电泳和RT-PCR方法检测外泌体中lncRNA-BCRT1的表达。h巨噬细胞摄取来自MDA-MB-231细胞的PKH26标记的外泌体(红色荧光染料)。i用外泌体培养后,检测巨噬细胞中M2标记物和lncRNA-BCRT1的表达。j用lncRNA BCRT1过表达的外泌体或培养基培养后,细胞迁移增加。k-l采用管形成或CAM法检测lncRNA-BCRT1过表达外泌体或条件培养液培养后血管生成能力。(*P<0.05,**P<0.01和**P<0.001)
7.缺氧条件下HIF-1α对LncRNA-BCRT1的转录调控
缺氧是许多肿瘤的主要瘤内特征之一,已有研究表明,肿瘤的缺氧微环境可能是某些lncRNAs异常表达的原因之一。为探讨lncRNA-BCRT1是否为缺氧敏感型lncRNA,对乳腺癌细胞缺氧或常氧48h。结果表明,随着HIF-1α表达的增加,lncRNA-BCRT1的表达明显升高(图7a-b)。HIF-1α基因敲除显著降低HIF-1α和lncRNA-BCRT1在正常和缺氧条件下的表达(图7c-e)。此外,HIF-1α的敲除大大减弱了缺氧诱导的lncRNA-BCRT1上调(图7c-e)。为了阐明缺氧诱导lncRNA-BCRT1上调的潜在机制,我们分析了JASPAR数据库,并鉴定了lncRNA-BCRT1启动子中两个假定的HIF-1α反应元件(HREs)(图7f-g)。为了确定HIF-1α是否通过这些HREs调控lncRNA-BCRT1的表达,我们构建了两个荧光素酶报告载体,其中包含全长lncRNA-BCRT1启动子(HRE1和HRE2)和一个截短片段(HRE2)。与对照细胞相比,缺氧处理显著提高了转染全长lncRNA-BCRT1启动子载体的细胞中的荧光素酶活性,而缺乏HRE1则损害了荧光素酶活性,这表明HRE1对lncRNA-BCRT1转录至关重要(图7h)。此外,HIF-1α基因敲除逆转了缺氧诱导的荧光素酶活性(图7h),表明缺氧通过HIF-1α与启动子区HRE1结合促进lncRNA-BCRT1转录。我们用HIF-1α抗体进行染色质免疫沉淀(ChIP)分析,进一步证实HIF-1α与lncRNA BCRT1启动子中两个预测的HREs结合(图7i),结果证实lncRNA BCRT1启动子中的HRE1是介导HIF-1α诱导转录调控的主要区域。使用ChIPBase数据库,我们发现PTBP3的表达与HIF-1α的表达呈正相关(图7j)。此外,缺氧处理导致PTBP3在mRNA和蛋白质水平上的表达升高(图7k),而HIF-1α的敲除减弱了这种作用(图7l)。这些结果提示缺氧通过HIF-1α与启动子上的HRE1直接结合调节lncRNA-BCRT1的表达。

图7缺氧时HIF-1α对LncRNA-BCRT1进行转录调控。a-b western blot和RT-PCR方法,检测培养48h后MDA-MB-231和MDA-MB-468细胞中HIF-1α蛋白(a)和lncRNA-BCRT1 mRNA(b)的表达水平。c-d RT-PCR和western blot检测HIF-1α基因敲除效率。e HIF-1α基因敲除抑制正常或缺氧条件下MDA-MB-231和MDA-MB-468细胞lncRNA-BCRT1的表达。f来自JASPAR数据库的HIF-1α识别基序。g lncRNA-BCRT1启动子近端区域和假定的缺氧反应元件(HREs)的示意图。h 用含pGL3报告载体的lncRNA-BCRT1启动子转染h-MDA-MB-231细胞,进一步用缺氧或缺氧联合siHIF-1α处理。48h后,用双荧光素酶报告系统测定荧光素酶活性。i 用抗HIF-1α抗体进行ChIP检测,以验证在常氧和缺氧条件下,HIF-1α与lncRNA-BCRT1启动子HREs的结合。j 用starBase数据库分析TCGA乳腺癌数据集中PTBP3和HIF-1α的表达。k缺氧条件下PTBP3的mRNA和蛋白表达升高。l HIF-1α基因敲除后,用RT-PCR和western blot检测正常或缺氧条件下MDA-MB-231和MDA-MB-468细胞PTBP3的表达。(*P<0.05,**P<0.01和**P<0.001)
8.LncRNA-BCRT1介导缺氧诱导的乳腺癌细胞恶性特性
缺氧是肿瘤微环境的一个标志,与各种实体瘤的增殖、转移和耐药性有关。因此,我们首先研究了lncRNA BCRT1是否参与缺氧诱导的细胞增殖。缺氧处理导致lncRNA BCRT1和PTBP3的表达增加,这与细胞增殖增强有关(图8a-c,附图S7a-c)。此外,HIF-1α或lncRNA-BCRT1基因敲除减弱了缺氧诱导的效应,而lncRNA-BCRT1过表达部分逆转了HIF-1α基因敲除的抑制效应(图8a-c,附图S7a-c)。以往的研究表明缺氧与EMT密切相关,因此进一步探讨了lncRNA-BCRT1在缺氧诱导EMT中的作用。缺氧处理后,MDA-MB-231细胞表现出更像成纤维细胞的形态和更高的迁移能力,HIF-1α或lncRNA-BCRT1的敲除显著逆转了这一点(图8d-f,附图S7d-e)。此外,缺氧条件下siHIF-1α抑制的EMT谱明显被lncRNA-BCRT1的过度表达所挽救(图8d-f,附图S7d-e)。这些结果表明lncRNA BCRT1可能参与了缺氧诱导乳腺癌细胞的生物学功能。

图8 LncRNA-BCRT1是HIF-1α介导的缺氧诱导的恶性肿瘤的关键。MDA-MB-231细胞经常氧、缺氧、siHIF-1α结合缺氧、si-BCRT1结合缺氧、或者缺氧与siHIF-1α和pcDNA3.1-BCRT1质粒共转染处理。a western blot检测HIF-1α和PTBP3的表达。b RT-PCR法检测lncRNA-BCRT1和PTBP3的表达。c集落形成法检测MDA-MB-231细胞增殖情况。d对MDA-MB-231细胞进行了单层形态学观察。e-f Transwell 和wound healing法分析MDA-MB-231细胞的迁移能力。
综上所述,我们认为缺氧反应性lncRNA BCRT1是乳腺癌的一个肿瘤促进因子,lncRNA BCRT1的高表达与肿瘤转移和预后不良有关。LncRNA BCRT1作为miR-1303的海绵,减弱其对PTBP3的抑制作用,并且通过外泌体介导的转移促进M2极化。






