研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
单核细胞膜融合间充质干细胞来源细胞外囊泡可增加其在心肌破裂模型中归巢
669 人阅读发布时间:2021-04-06 15:45
【关键词】间充质干细胞、细胞外囊泡/外泌体、单核细胞、心肌破裂、归巢

【摘要】
干细胞来源的细胞外囊泡EVs在心脏修复和再生中有疗效,但因为EVs的归巢性差而阻碍临床应用。本文作者利用单核细胞的趋化性高,将单核细胞膜与干细胞EVs进行融合,通过Mac1/LFA1-ICAM1途径增加干细胞来源EVs的归巢至心肌损伤处,促进血管新生,调节巨噬细胞极化,进而改善心功能。
文章创新点在于利用单核细胞归巢性,提取膜来改造干细胞的EVs
【前言】
外泌体是双层膜结构,已有大量文献报道了其介导细胞间交互,细胞保护、免疫调节、促血管新生功能,但因其向损伤处的归巢能力差,常被单核巨噬细胞系统吸收,难以到达损伤处发挥治疗作用。不仅如此,因为干细胞来源的外泌体有促进癌症发生作用,因此这种脱靶现象可能有不良影响。
白细胞在响应炎症信号后可募集至炎症处,其中主要的细胞类型是单核细胞,而单核细胞趋化性依赖于膜上的粘附分子(Mac1、PSGL1、VLA4、CCR2)等。因此本文作者利用白细胞膜结构上的粘附分子,将其与干细胞来源的EVs融合,提高干细胞EVs的靶向性。
【结果】
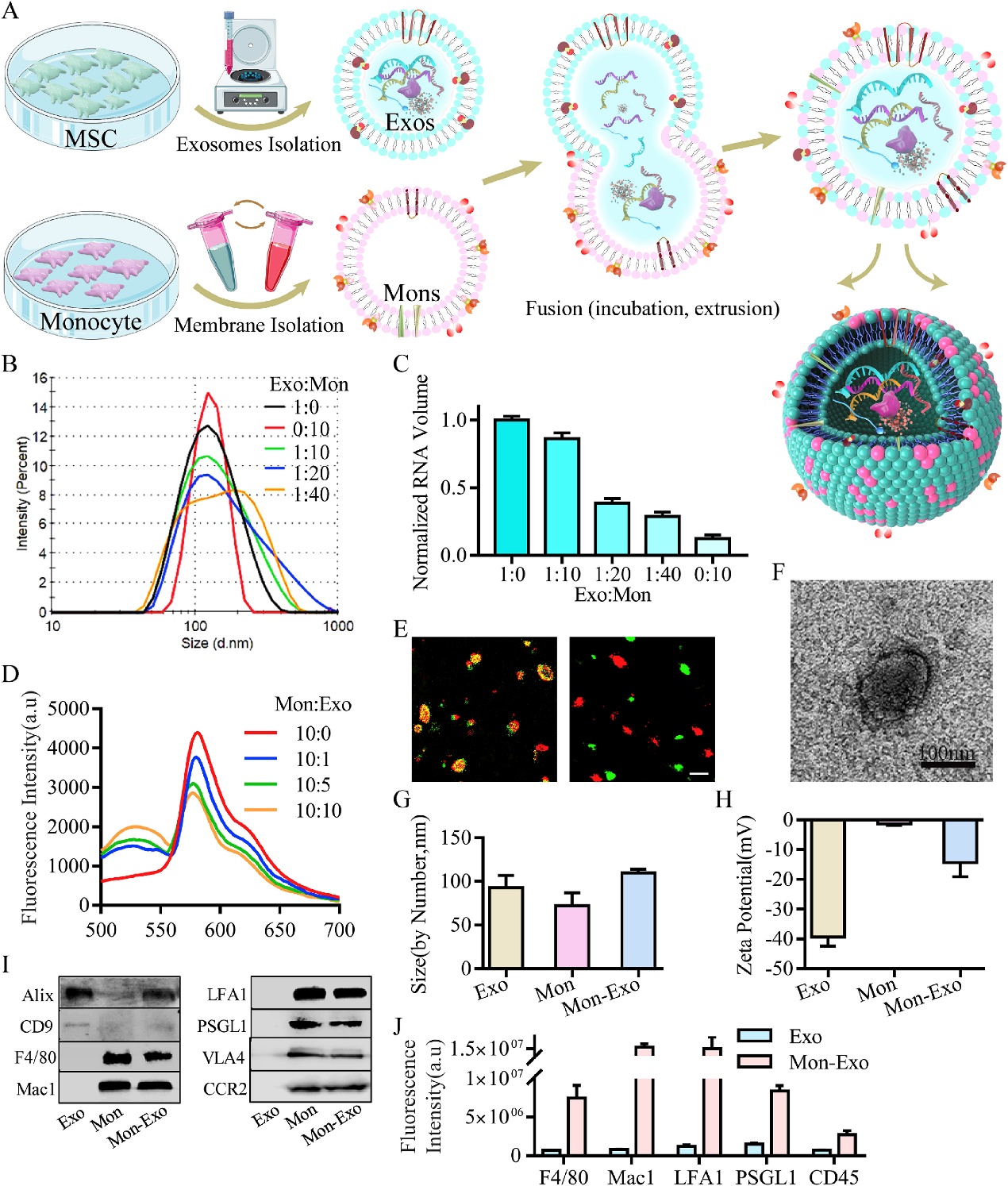
超速离心法提取BM-MSCs来源的EVs并进行表征,电镜和纳米追踪分析形态和大小,WB检测EVs相关蛋白(CD9、Alix)。提取单核细胞RAW264.7的膜,并检测与粘附相关的膜蛋白(Mac1、PSGL1、VLA4、CCR2)。将单核细胞的膜与干细胞来源EVs融合,并进行表征,荧光共聚焦验证膜的成功融合,WB验证融合的EVs可表达粘附相关蛋白。结果显示:融合后的Mon-EVs仍然具有外泌体相关特征,并且表达粘附相关蛋白。
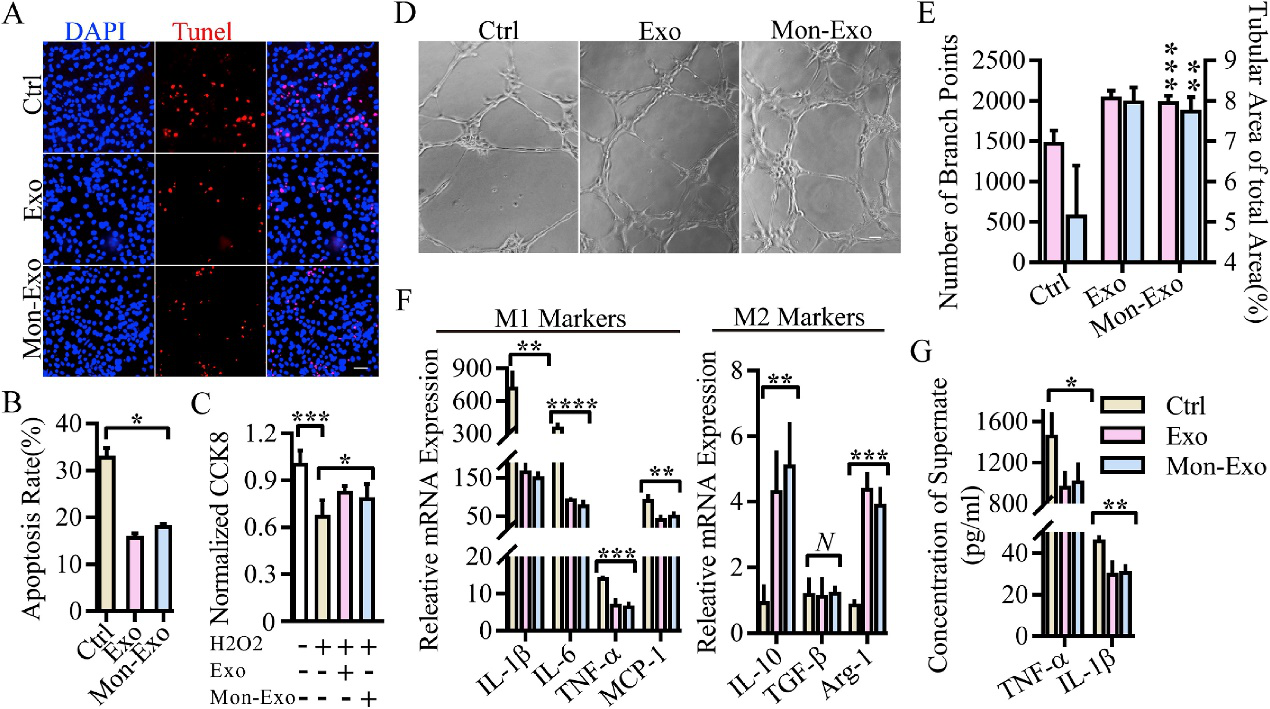
体外对Mon-EVs的生物功能进行验证。H2O2诱导细胞死亡后检测Mon-EVs对细胞存活影响,Tunel检测凋亡,Matrigel检测血管再生,检测M1/M2极化相关指标分别验证:Mon-EVs改造后不影响EVs的正常细胞保护、促血管再生、免疫调节功能。
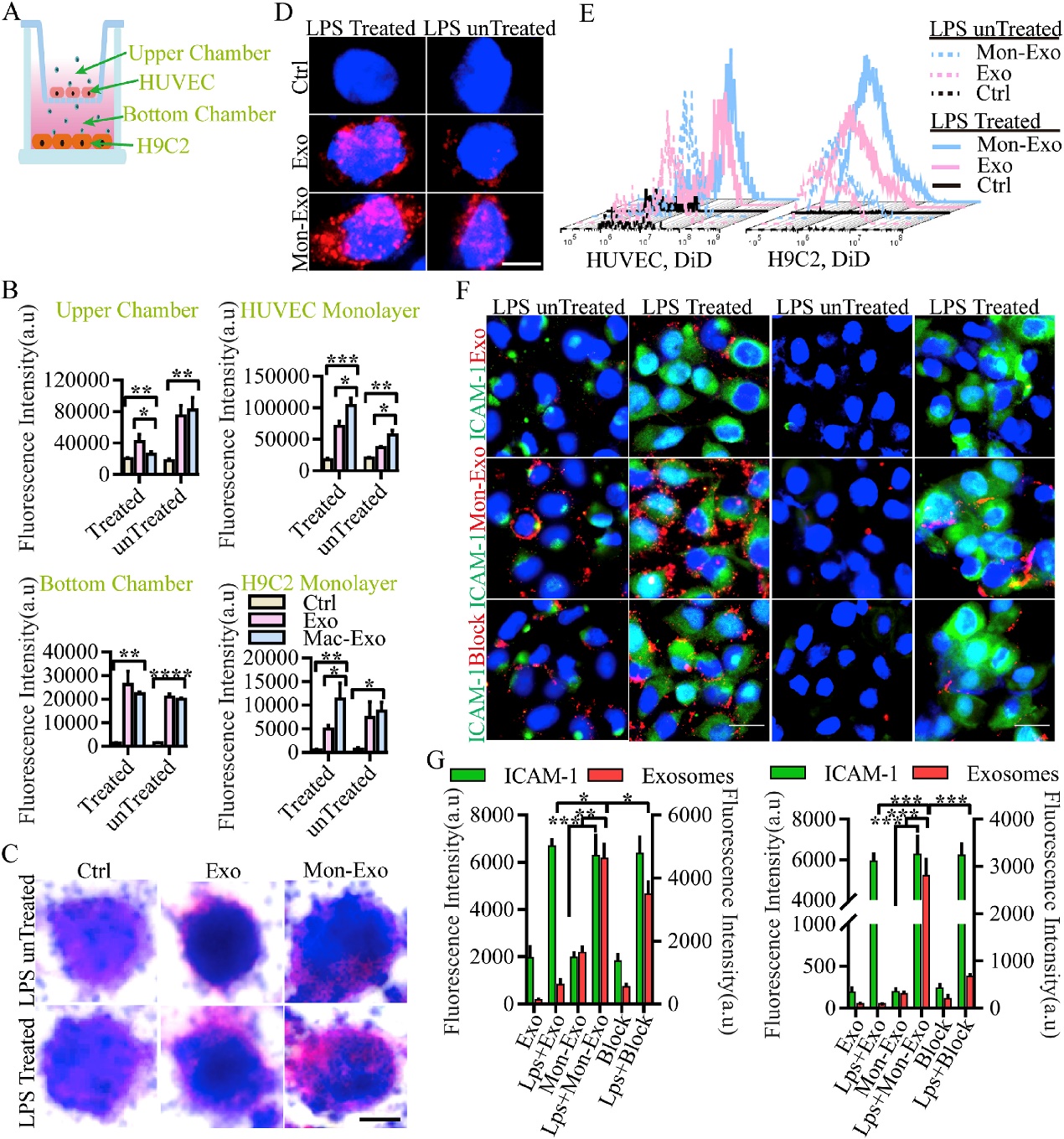
体外检测Mon-EVs的靶向炎症组织的能力。Dil标记Mon-EVs与LPS处理的内皮细胞共培养,利用荧光显微镜观察。荧光信号验证靶向性的提高是否与Mac1、PSGL1、VLA4、CCR2等相关。结果显示:Mon-EVs归巢能力增加,且通过Mac1-LFA1-ICAM1机制来增加靶向性。
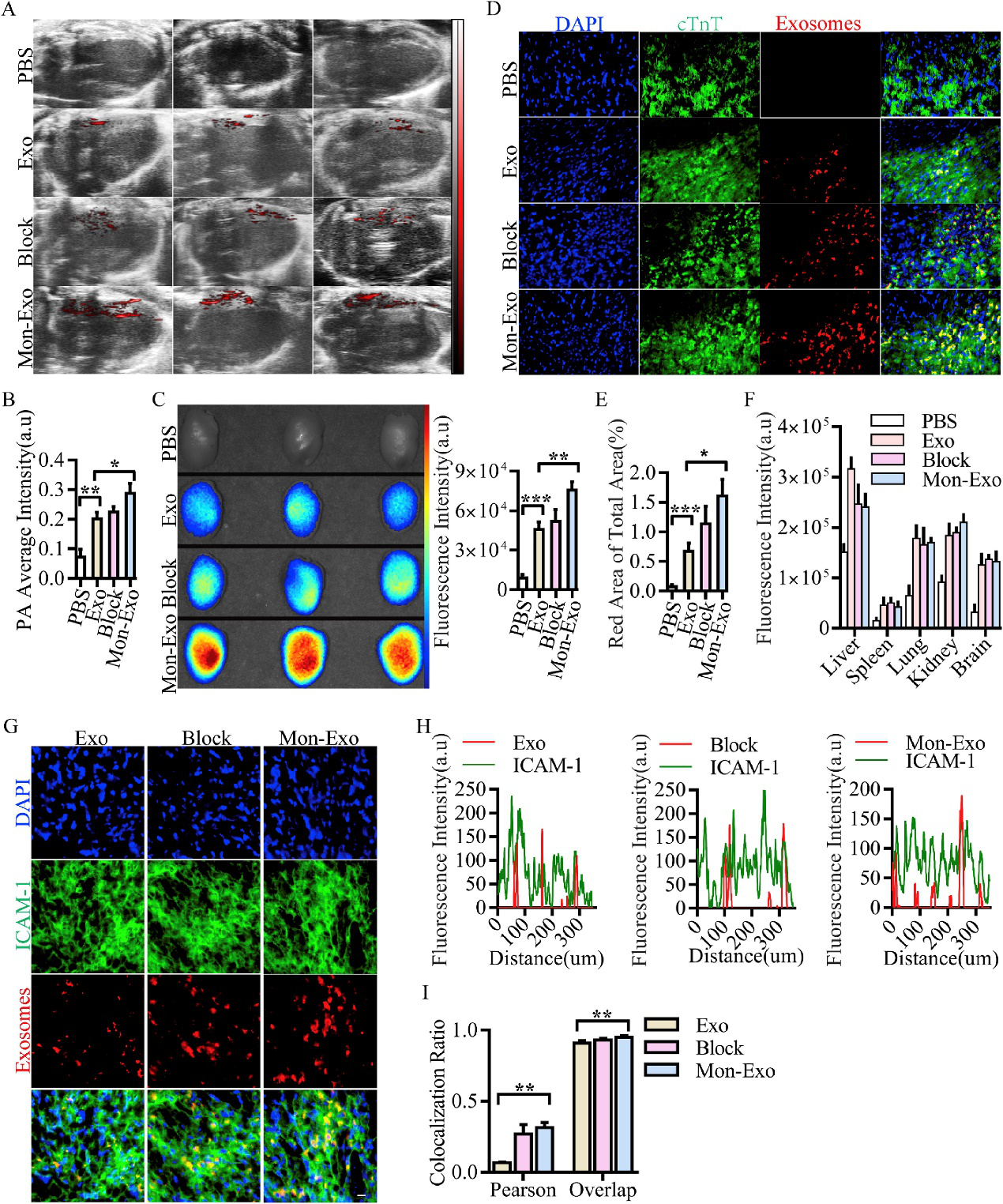
体内检测Mon-EVs归巢能力。Dil标记Mon-EVs后静脉输注至小鼠体内,检测其在循环中存在时间,利用体内成像检测Mon-EVs在心肌损伤小鼠中损伤处的归巢,心脏切片cTnT染色检测Mon-EVs的心脏浸润,下游ICAM1的信号。结果显示:Mon-EVs可在体内存在较长时间,利用ICAM1信号归巢至损伤局部。
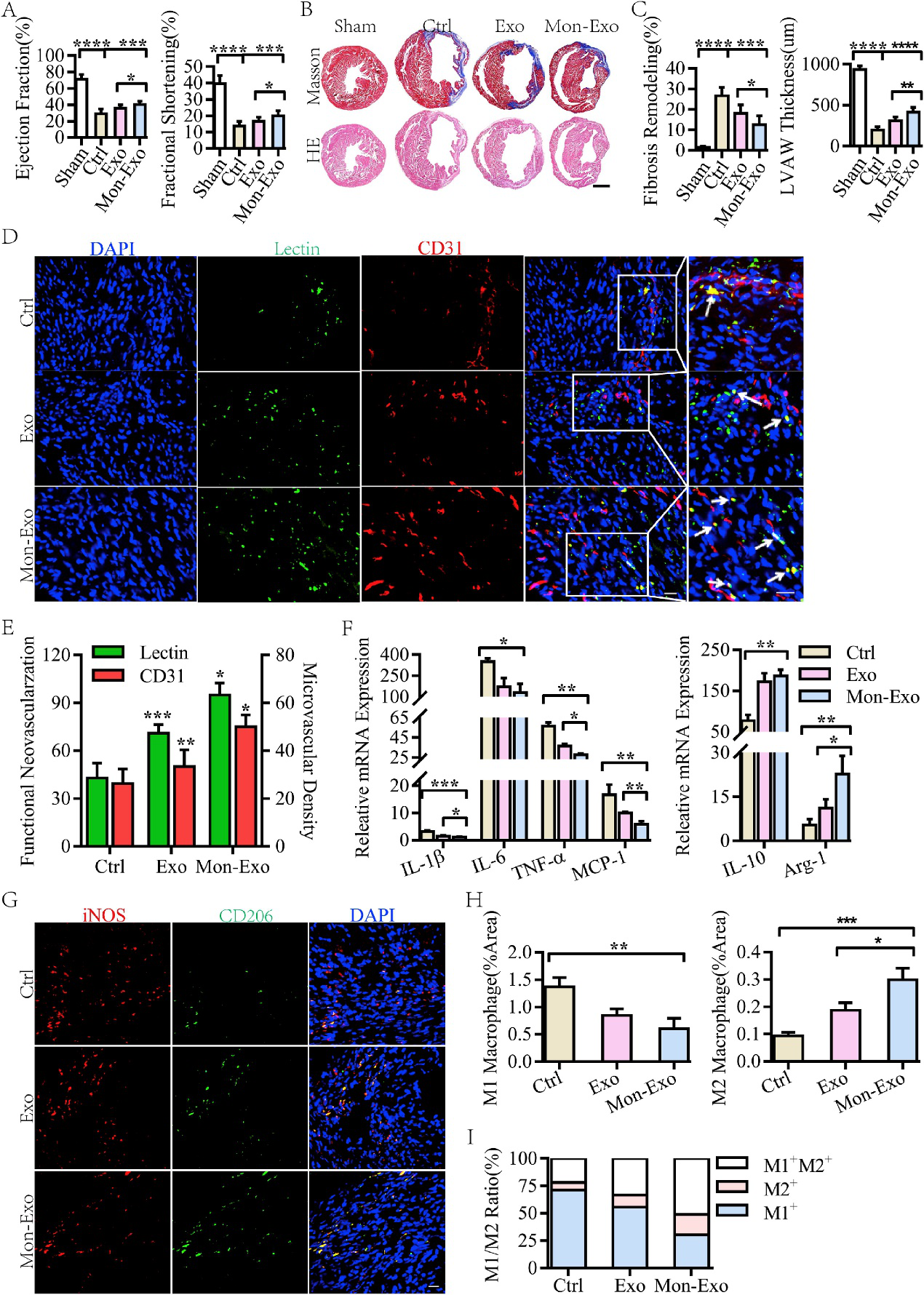
验证Mon-EVs对心脏功能改善。B超评估心功能、切片评估病理性重构、染色看微循环变化。结果显示:Mon-EVs可增强心功能,改善病理性重构及微循环。
体内评估Mon-EVs对免疫调节的影响。检测细胞因子谱和M1/M2极化,结果显示:Mon-EVs可减少炎症反应。
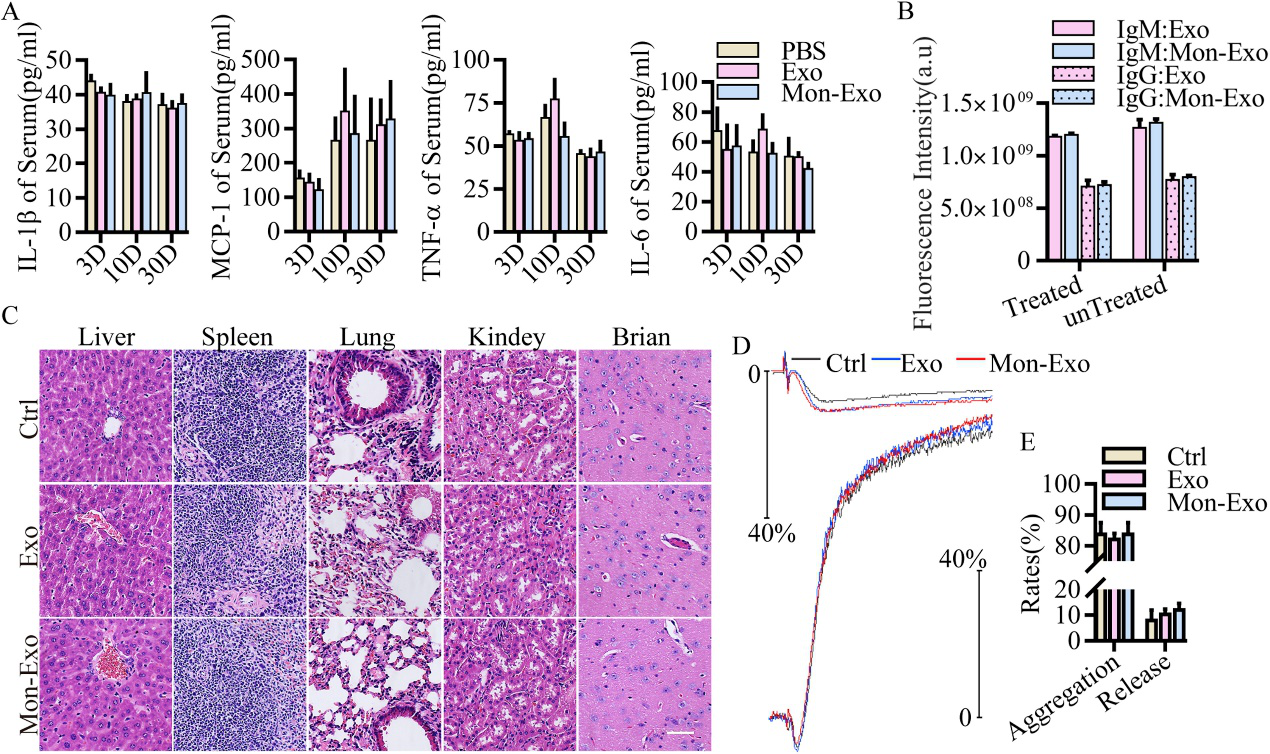
体内安全性评估:评估免疫反应、器官损伤、血栓风险。结果显示:Mon-EVs不会引起免疫反应,无器官毒性,不会增加血栓风险。

【摘要】
干细胞来源的细胞外囊泡EVs在心脏修复和再生中有疗效,但因为EVs的归巢性差而阻碍临床应用。本文作者利用单核细胞的趋化性高,将单核细胞膜与干细胞EVs进行融合,通过Mac1/LFA1-ICAM1途径增加干细胞来源EVs的归巢至心肌损伤处,促进血管新生,调节巨噬细胞极化,进而改善心功能。
文章创新点在于利用单核细胞归巢性,提取膜来改造干细胞的EVs

【前言】
外泌体是双层膜结构,已有大量文献报道了其介导细胞间交互,细胞保护、免疫调节、促血管新生功能,但因其向损伤处的归巢能力差,常被单核巨噬细胞系统吸收,难以到达损伤处发挥治疗作用。不仅如此,因为干细胞来源的外泌体有促进癌症发生作用,因此这种脱靶现象可能有不良影响。
白细胞在响应炎症信号后可募集至炎症处,其中主要的细胞类型是单核细胞,而单核细胞趋化性依赖于膜上的粘附分子(Mac1、PSGL1、VLA4、CCR2)等。因此本文作者利用白细胞膜结构上的粘附分子,将其与干细胞来源的EVs融合,提高干细胞EVs的靶向性。
【结果】
超速离心法提取BM-MSCs来源的EVs并进行表征,电镜和纳米追踪分析形态和大小,WB检测EVs相关蛋白(CD9、Alix)。提取单核细胞RAW264.7的膜,并检测与粘附相关的膜蛋白(Mac1、PSGL1、VLA4、CCR2)。将单核细胞的膜与干细胞来源EVs融合,并进行表征,荧光共聚焦验证膜的成功融合,WB验证融合的EVs可表达粘附相关蛋白。结果显示:融合后的Mon-EVs仍然具有外泌体相关特征,并且表达粘附相关蛋白。

体外对Mon-EVs的生物功能进行验证。H2O2诱导细胞死亡后检测Mon-EVs对细胞存活影响,Tunel检测凋亡,Matrigel检测血管再生,检测M1/M2极化相关指标分别验证:Mon-EVs改造后不影响EVs的正常细胞保护、促血管再生、免疫调节功能。

体外检测Mon-EVs的靶向炎症组织的能力。Dil标记Mon-EVs与LPS处理的内皮细胞共培养,利用荧光显微镜观察。荧光信号验证靶向性的提高是否与Mac1、PSGL1、VLA4、CCR2等相关。结果显示:Mon-EVs归巢能力增加,且通过Mac1-LFA1-ICAM1机制来增加靶向性。

体内检测Mon-EVs归巢能力。Dil标记Mon-EVs后静脉输注至小鼠体内,检测其在循环中存在时间,利用体内成像检测Mon-EVs在心肌损伤小鼠中损伤处的归巢,心脏切片cTnT染色检测Mon-EVs的心脏浸润,下游ICAM1的信号。结果显示:Mon-EVs可在体内存在较长时间,利用ICAM1信号归巢至损伤局部。

验证Mon-EVs对心脏功能改善。B超评估心功能、切片评估病理性重构、染色看微循环变化。结果显示:Mon-EVs可增强心功能,改善病理性重构及微循环。
体内评估Mon-EVs对免疫调节的影响。检测细胞因子谱和M1/M2极化,结果显示:Mon-EVs可减少炎症反应。

体内安全性评估:评估免疫反应、器官损伤、血栓风险。结果显示:Mon-EVs不会引起免疫反应,无器官毒性,不会增加血栓风险。







