研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
量化细胞外囊泡被细胞的摄取和内容物的递送
937 人阅读发布时间:2021-09-01 15:01
【关键词】细胞外囊泡、摄取
【前言】细胞外囊泡EVs,包括外泌体和微泌体,包含核酸、蛋白质、脂质等内容物,通过细胞间内容物的递送实现细胞间通讯,也可通过受体介导细胞间交流。EVs可被多种细胞内化,其内化的方式也是多样的,包括内体/溶酶体靶向递送。作者先前研究表明,EVs内容物的递送依赖于pH值,但是目前缺乏对受体细胞摄取EVs内容物的定量研究,同时对于EVs的摄取方式仍然存在争议。因此本文设计了一种定量研究EVs内容物递送的方法,量化了细胞摄取EVs内容物,阐明了了EVs内容物的释放需要内体酸化和膜融合。
【结果】
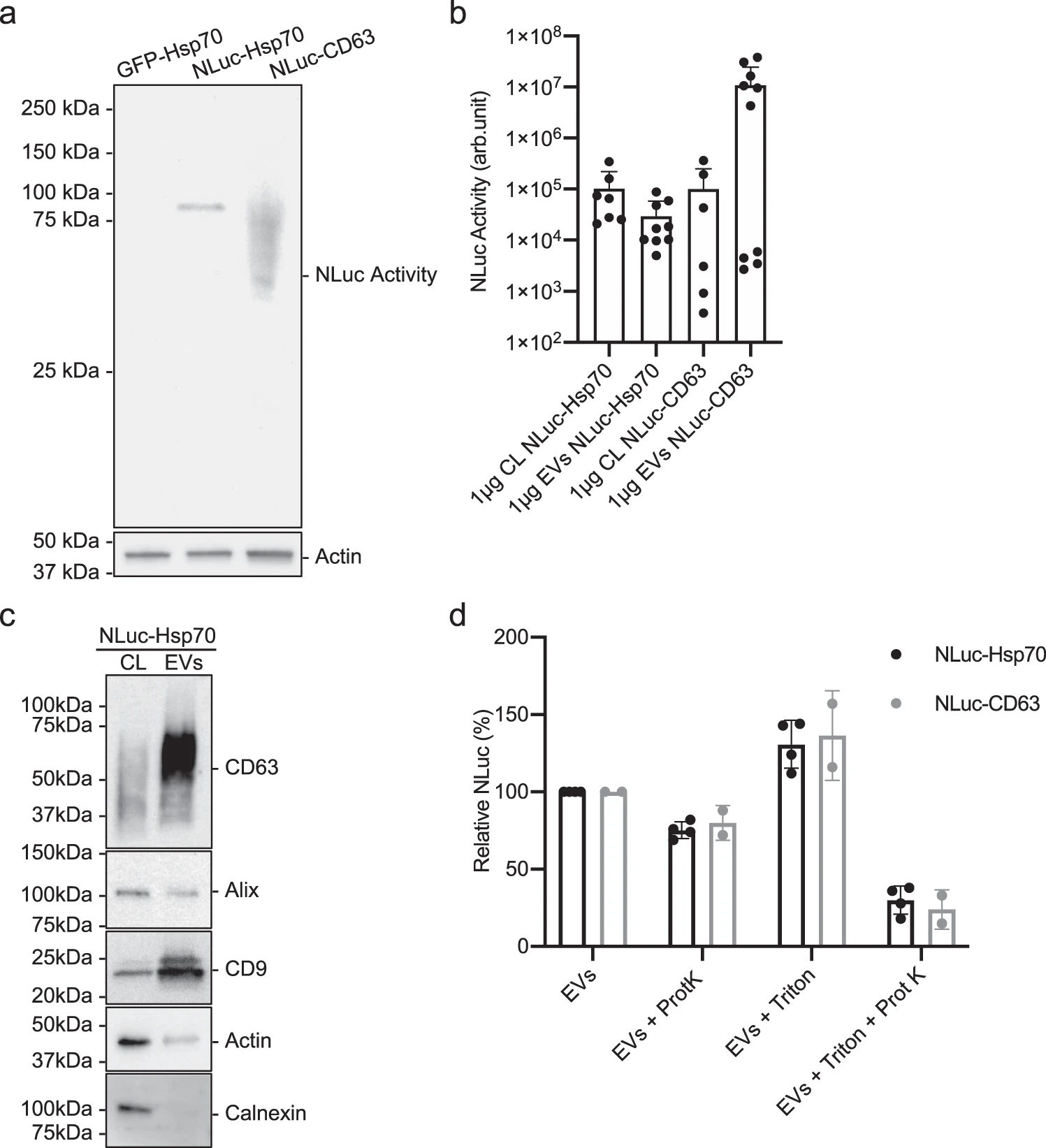
首先设计了稳定表达NanoLuc荧光素酶标记的Hsp70供体Hela细胞,从供体细胞分离EVs并进行WB和TEM表征,同时将NLuc-CD63蛋白作为对照,荧光素酶实验证实NLuc-CD63不会被显著降解,而NLuc-Hsp70可被降解。利用蛋白酶保护测定法证实NLuc-Hsp70确实在EVs内部,因此NLuc-Hsp70蛋白适合作为检测EVs摄取和量化内容物递送的一个指标。
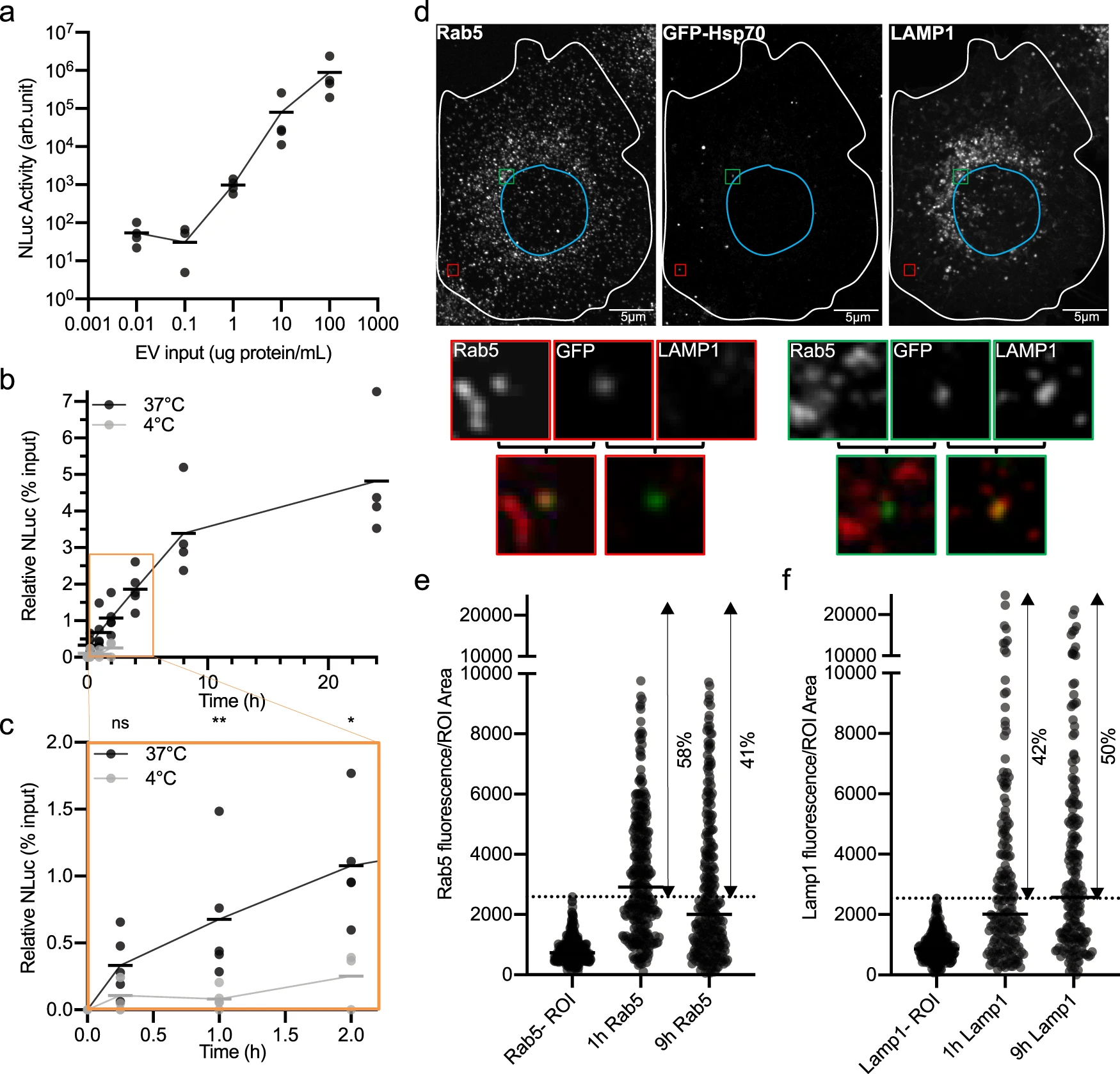
 将携带NLuc-Hsp70的EVs与未标记的细胞共培养评估细胞间交流的方式。受体细胞中荧光素酶活性与供体EVs的剂量呈正相关,动力学实验表明,受体细胞中荧光素酶活性随时间增加而增加。在低温环境下抑制能量依赖的内吞方式而不影响蛋白间相互作用,结果显示低温下EVs并未结合至受体细胞表面,通过共聚焦检测,Hsp70标记GFP后,与内体和溶酶体的标志共聚焦,表明EVs被内体/溶酶体内化至受体细胞中。
将携带NLuc-Hsp70的EVs与未标记的细胞共培养评估细胞间交流的方式。受体细胞中荧光素酶活性与供体EVs的剂量呈正相关,动力学实验表明,受体细胞中荧光素酶活性随时间增加而增加。在低温环境下抑制能量依赖的内吞方式而不影响蛋白间相互作用,结果显示低温下EVs并未结合至受体细胞表面,通过共聚焦检测,Hsp70标记GFP后,与内体和溶酶体的标志共聚焦,表明EVs被内体/溶酶体内化至受体细胞中。
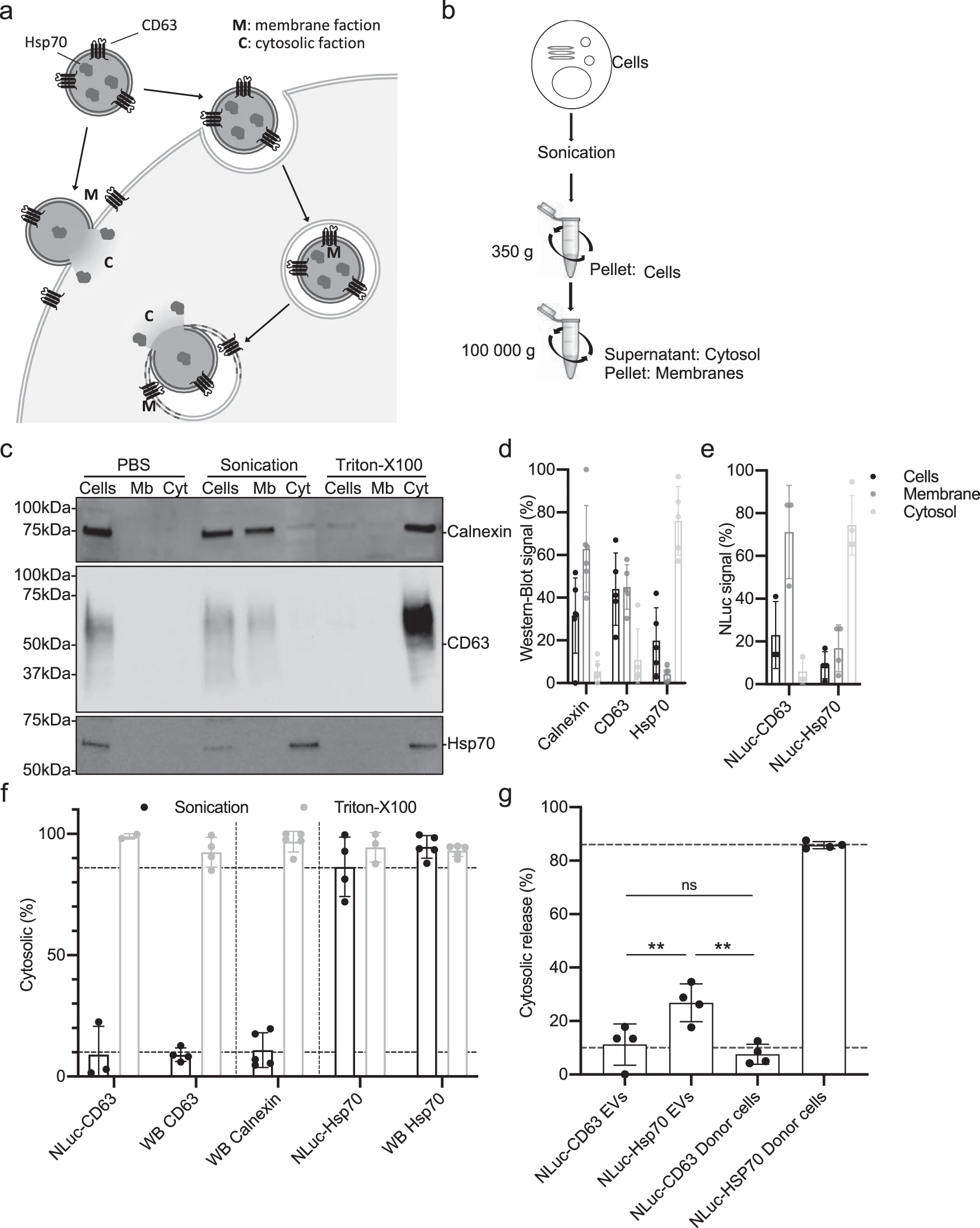
 当EVs内容物被释放至受体细胞中,NLuc-Hsp70可在胞质中被检测到,同时可检测到荧光素酶活性,因此从膜碎片中分离胞质并进行验证。Hsp70作为胞浆标记,CD63和Calnexin作为膜标记,在胞质中检测荧光素酶活性。再将NLuc-Hsp70和NLuc-CD63阳性的EVs与供体细胞培养检测胞质和细胞膜的荧光素酶活性。结果表明:仅有20%-30%被整合进受体细胞的EVs可释放内容物。
当EVs内容物被释放至受体细胞中,NLuc-Hsp70可在胞质中被检测到,同时可检测到荧光素酶活性,因此从膜碎片中分离胞质并进行验证。Hsp70作为胞浆标记,CD63和Calnexin作为膜标记,在胞质中检测荧光素酶活性。再将NLuc-Hsp70和NLuc-CD63阳性的EVs与供体细胞培养检测胞质和细胞膜的荧光素酶活性。结果表明:仅有20%-30%被整合进受体细胞的EVs可释放内容物。
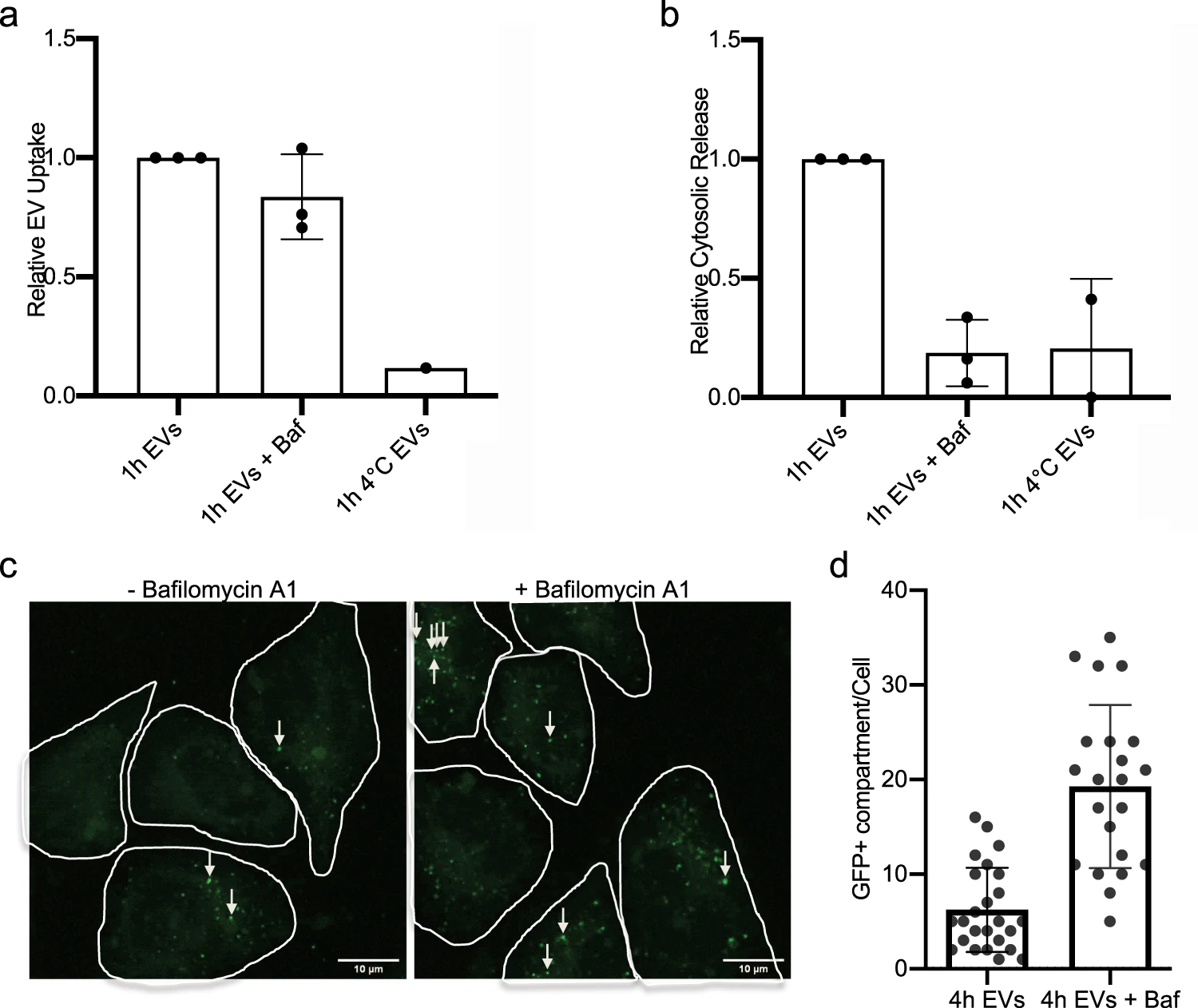
 用杆状霉素A1抑制内体酸化后,NLuc-Hsp70胞质释放减少但是EVs总体摄取量未改变。GFP标记Hsp70的EVs,共聚焦实验证实GFP荧光和内体共定位。推测整合至细胞内的EVs可破坏内体的膜而导致EVs内容物的释放,因此用galectin3修饰失去膜完整性的内体的腔表面,结果表面内体的逃逸并非是EV诱导的内体膜破坏而触发的。
用杆状霉素A1抑制内体酸化后,NLuc-Hsp70胞质释放减少但是EVs总体摄取量未改变。GFP标记Hsp70的EVs,共聚焦实验证实GFP荧光和内体共定位。推测整合至细胞内的EVs可破坏内体的膜而导致EVs内容物的释放,因此用galectin3修饰失去膜完整性的内体的腔表面,结果表面内体的逃逸并非是EV诱导的内体膜破坏而触发的。
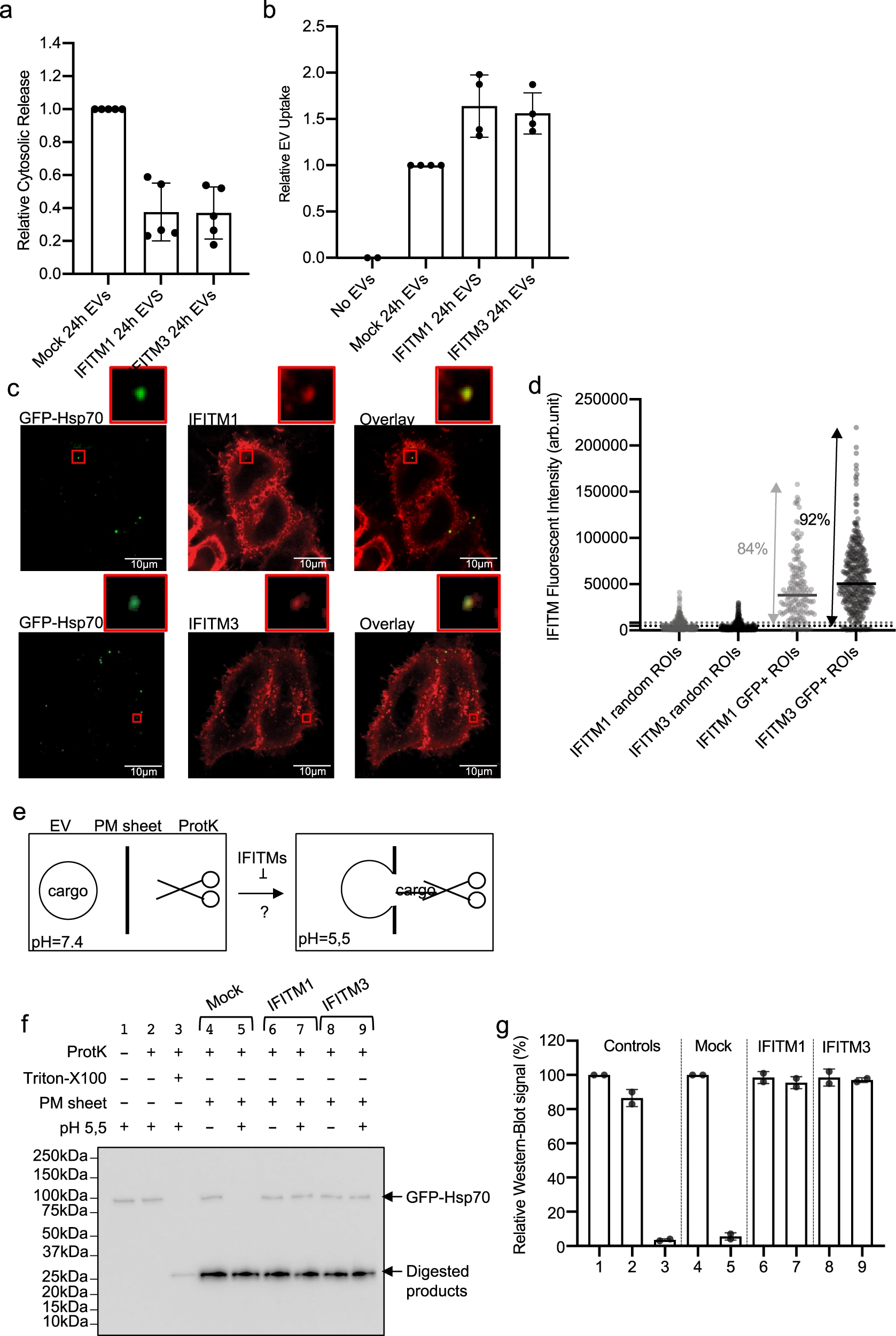
 IFITM蛋白之前研究表明广泛抑制病毒感染或合胞体形成过程中的融合反应,因此推测IFITM可能抑制EVs的传递。构建稳转过表达标签标记的IFITM1和IFITM3的293T细胞,IFITM1是定位于浆膜和内体/溶酶体中,而IFITM3则作为对照,检测293T细胞中荧光素酶的活性,通过共聚焦实验证实IFITM蛋白的定位,这表明IFITM影响EVs的融合和释放。进一步脱离细胞进行实验,将EVs于质膜和蛋白酶K共孵育,在不同pH的环境下检测EVs的释放。结果表明:IFITM蛋白通过阻断EV于靶细胞膜之间的膜融合来抑制EVs内容物的释放。
IFITM蛋白之前研究表明广泛抑制病毒感染或合胞体形成过程中的融合反应,因此推测IFITM可能抑制EVs的传递。构建稳转过表达标签标记的IFITM1和IFITM3的293T细胞,IFITM1是定位于浆膜和内体/溶酶体中,而IFITM3则作为对照,检测293T细胞中荧光素酶的活性,通过共聚焦实验证实IFITM蛋白的定位,这表明IFITM影响EVs的融合和释放。进一步脱离细胞进行实验,将EVs于质膜和蛋白酶K共孵育,在不同pH的环境下检测EVs的释放。结果表明:IFITM蛋白通过阻断EV于靶细胞膜之间的膜融合来抑制EVs内容物的释放。

【摘要】细胞外囊泡EVs包括外泌体,通过从供体转移内容物至受体细胞来介导细胞间的通讯,受体细胞中是否存在EVs的内容物仍然有待证明和量化。本文作者开发了基于细胞的分析方法,将包含荧光素酶或荧光蛋白标记的胞质货物的EVs装载到未标记的受体细胞上。剂量反应、动力学、温度阻断实验证实EVs的摄取是一个低产量过程,将细胞膜和细胞质分级后揭示EVs的内容物约有30%释放至受体细胞胞质中,这一释放过程可被杆状霉素A1和IFITM蛋白抑制。最终结果表明:EVs内容物的释放需要内体酸化和膜的融合。

【前言】细胞外囊泡EVs,包括外泌体和微泌体,包含核酸、蛋白质、脂质等内容物,通过细胞间内容物的递送实现细胞间通讯,也可通过受体介导细胞间交流。EVs可被多种细胞内化,其内化的方式也是多样的,包括内体/溶酶体靶向递送。作者先前研究表明,EVs内容物的递送依赖于pH值,但是目前缺乏对受体细胞摄取EVs内容物的定量研究,同时对于EVs的摄取方式仍然存在争议。因此本文设计了一种定量研究EVs内容物递送的方法,量化了细胞摄取EVs内容物,阐明了了EVs内容物的释放需要内体酸化和膜融合。
【结果】
首先设计了稳定表达NanoLuc荧光素酶标记的Hsp70供体Hela细胞,从供体细胞分离EVs并进行WB和TEM表征,同时将NLuc-CD63蛋白作为对照,荧光素酶实验证实NLuc-CD63不会被显著降解,而NLuc-Hsp70可被降解。利用蛋白酶保护测定法证实NLuc-Hsp70确实在EVs内部,因此NLuc-Hsp70蛋白适合作为检测EVs摄取和量化内容物递送的一个指标。











