研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
HIF1α通过上调自噬减缓压力诱导的髓核来源干细胞凋亡
731 人阅读发布时间:2021-10-08 11:26
【关键词】凋亡、自噬、内源性干细胞、HIF-1α、椎间盘退变、髓核、再生
 【摘要】椎间盘退变(IDD)是引起腰痛的主要病理机制,过载诱导的细胞死亡尤其是内源性干细胞的死亡是影响椎间盘退变修复和再生的主要因素。先前的研究单独分析了氧浓度和压力负荷在IDD中的作用,但是二者的协同作用对于内源性的修复尚不清楚。本研究团队构建体外和体内模型分析缺氧与过载对髓核干细胞(NPSCs)的影响,结果表明HIF1α通过调节BNIP3/ATG7轴,HMOX1、SLC2A1提高自噬过程保护受压的NPSCs。
【摘要】椎间盘退变(IDD)是引起腰痛的主要病理机制,过载诱导的细胞死亡尤其是内源性干细胞的死亡是影响椎间盘退变修复和再生的主要因素。先前的研究单独分析了氧浓度和压力负荷在IDD中的作用,但是二者的协同作用对于内源性的修复尚不清楚。本研究团队构建体外和体内模型分析缺氧与过载对髓核干细胞(NPSCs)的影响,结果表明HIF1α通过调节BNIP3/ATG7轴,HMOX1、SLC2A1提高自噬过程保护受压的NPSCs。
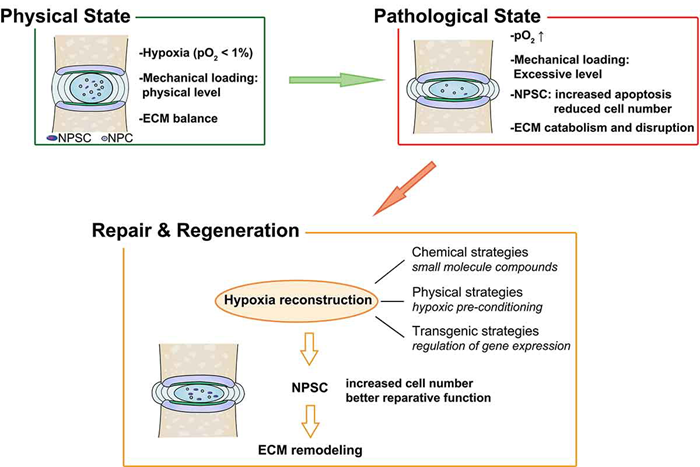 【前言】椎间盘退变(IDD)是导致腰痛的主要原因,除了手术和药物治疗以外,有研究团队表明干细胞也能够治疗IDD,其中有前景的细胞类型是髓核衍生的干细胞(NPSCs),但退化的椎间盘中恶劣的微环境影响NPSCs的存活进而导致细胞治疗失败。在椎间盘退变过程中,髓核(NP)过度受压从而影响内源性干细胞的存活,不仅如此,髓核内部缺乏血管导致局部缺氧的微环境,因而HIF1α参与调解髓核内的内源性干细胞的稳态。在椎间盘退变的晚期,髓核中会形成新生血管,导致椎间盘中氧浓度急剧增加,HIF1α随之降解,内源性修复变得更加艰难,因此缺氧环境和HIF1α通常被认为是内源性NPSCs维持稳态的必要因素。尽管缺氧和机械压力的因素已经研究众多,但是过载环境下HIF1α的变化以及对内源性NPSCs的影响未知,因此本研究者就此展开研究。
【前言】椎间盘退变(IDD)是导致腰痛的主要原因,除了手术和药物治疗以外,有研究团队表明干细胞也能够治疗IDD,其中有前景的细胞类型是髓核衍生的干细胞(NPSCs),但退化的椎间盘中恶劣的微环境影响NPSCs的存活进而导致细胞治疗失败。在椎间盘退变过程中,髓核(NP)过度受压从而影响内源性干细胞的存活,不仅如此,髓核内部缺乏血管导致局部缺氧的微环境,因而HIF1α参与调解髓核内的内源性干细胞的稳态。在椎间盘退变的晚期,髓核中会形成新生血管,导致椎间盘中氧浓度急剧增加,HIF1α随之降解,内源性修复变得更加艰难,因此缺氧环境和HIF1α通常被认为是内源性NPSCs维持稳态的必要因素。尽管缺氧和机械压力的因素已经研究众多,但是过载环境下HIF1α的变化以及对内源性NPSCs的影响未知,因此本研究者就此展开研究。
【结果】
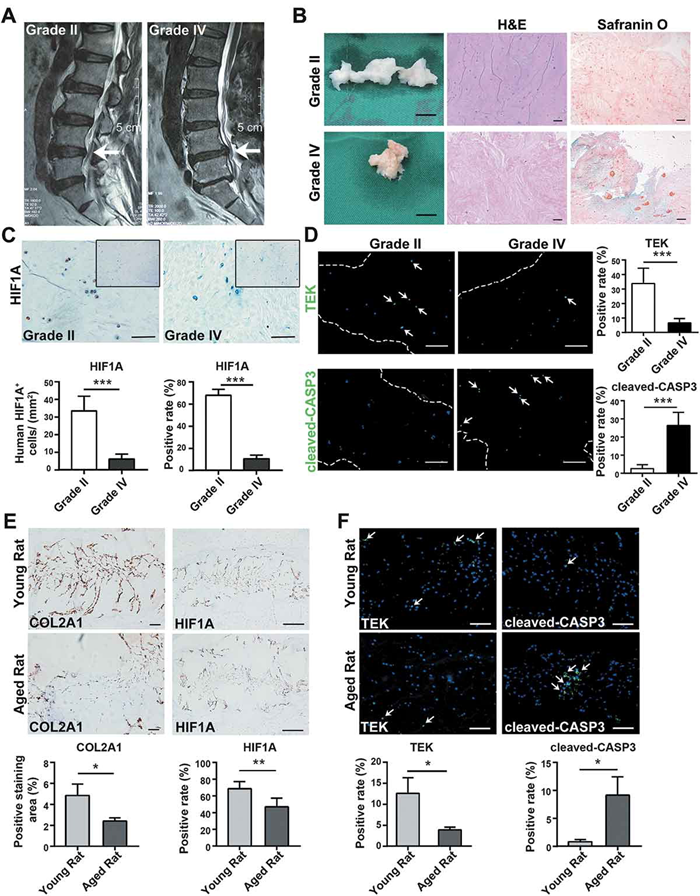
为了了解椎间盘退变过程中髓核缺氧环境的变化,临床收集患者的组织样本进行分析,结果表明随着椎间盘退变程度的不断增加,缺氧环境被破坏,髓核中祖细胞凋亡增加。
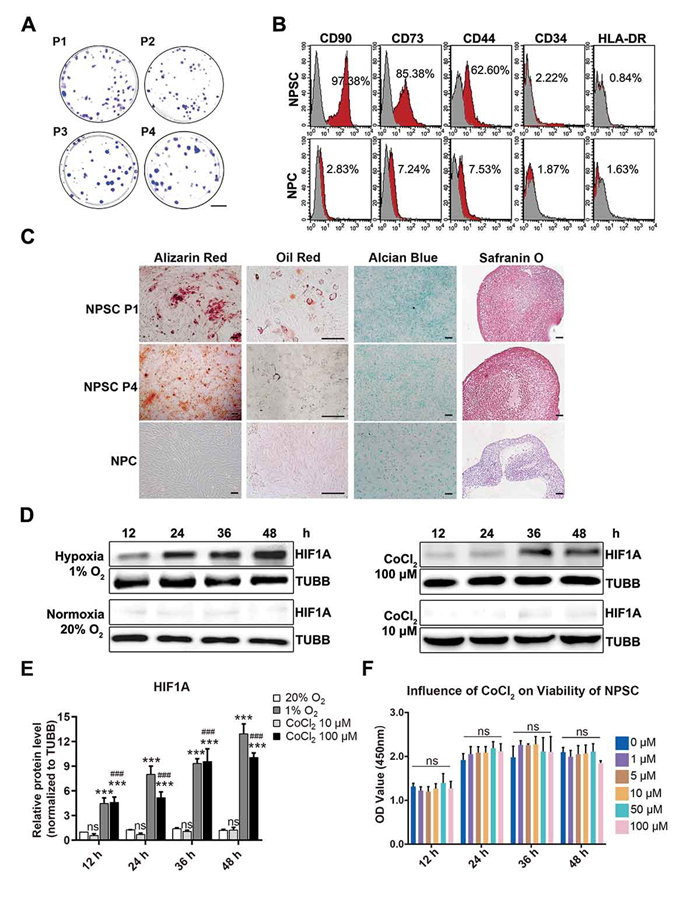
 从大鼠椎间盘中分离NPSCs,对其表面标志物进行表征和细胞分化潜能的分析以用于后续研究。利用CoCl2构建体外NPSCs细胞缺氧模型并验证模型的安全有效性。
从大鼠椎间盘中分离NPSCs,对其表面标志物进行表征和细胞分化潜能的分析以用于后续研究。利用CoCl2构建体外NPSCs细胞缺氧模型并验证模型的安全有效性。
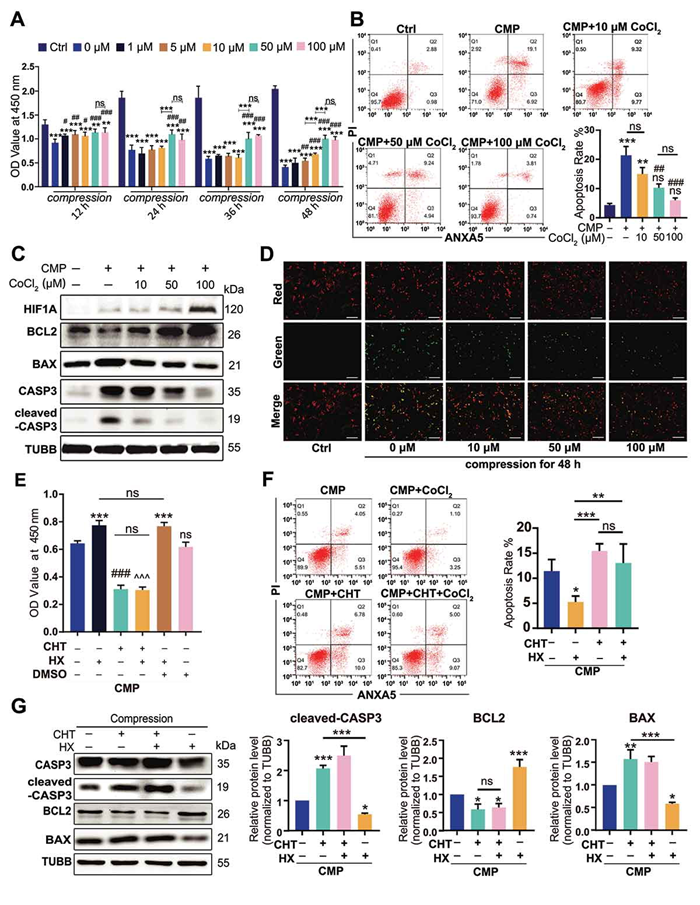
 将NPSCs置于压力环境下培养,并加入CoCl2诱导缺氧环境,检测缺氧对压力作用下NPSCs的保护作用,选择48h作为观察点(CoCl2的保护作用最明显),随后检测过载下HIF1α对NPSCs凋亡的影响。
将NPSCs置于压力环境下培养,并加入CoCl2诱导缺氧环境,检测缺氧对压力作用下NPSCs的保护作用,选择48h作为观察点(CoCl2的保护作用最明显),随后检测过载下HIF1α对NPSCs凋亡的影响。
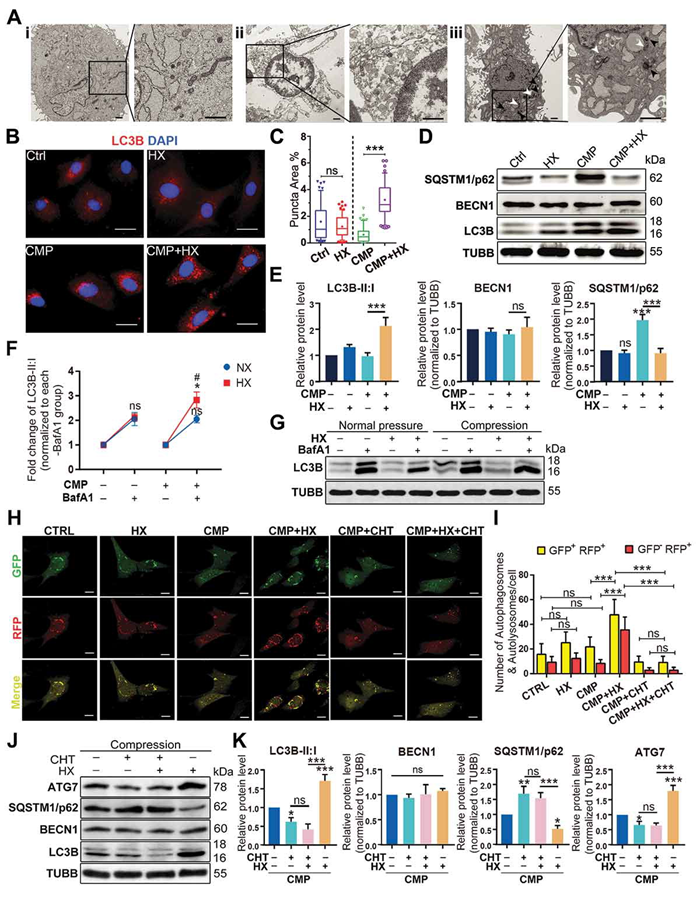
 为了阐述HIF1α保护NPSCs免受过载诱导的细胞凋亡的机制,电镜观察亚细胞结构变化,结果表明自噬小体数量增加。进一步检测自噬通量验证电镜观察到的自噬的变化。
为了阐述HIF1α保护NPSCs免受过载诱导的细胞凋亡的机制,电镜观察亚细胞结构变化,结果表明自噬小体数量增加。进一步检测自噬通量验证电镜观察到的自噬的变化。
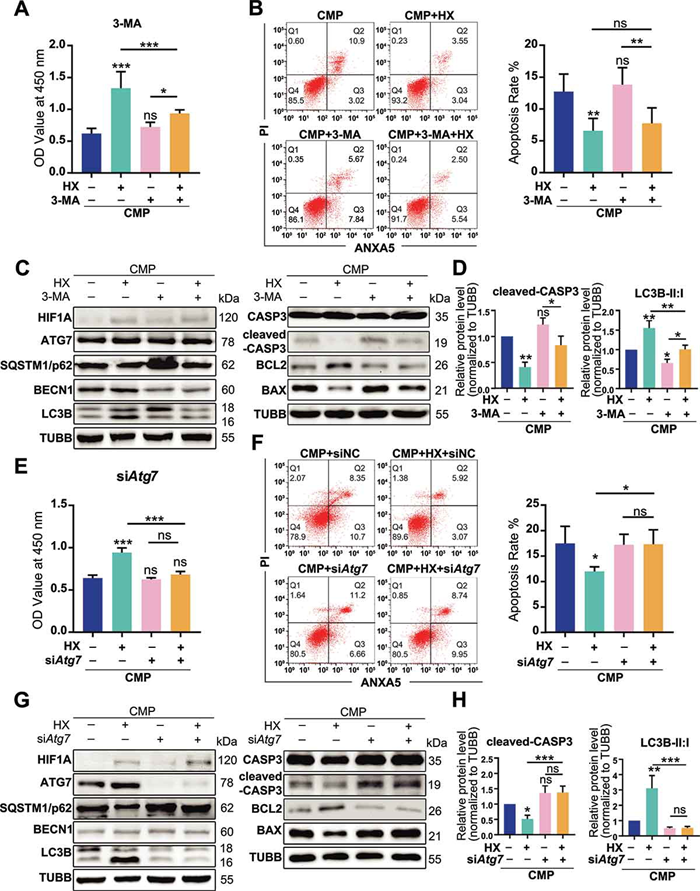
 为了阐述自噬是否与HIF-1α的抗凋亡作用相关,用不同方法调节自噬后观察NPSCs的变化。
为了阐述自噬是否与HIF-1α的抗凋亡作用相关,用不同方法调节自噬后观察NPSCs的变化。
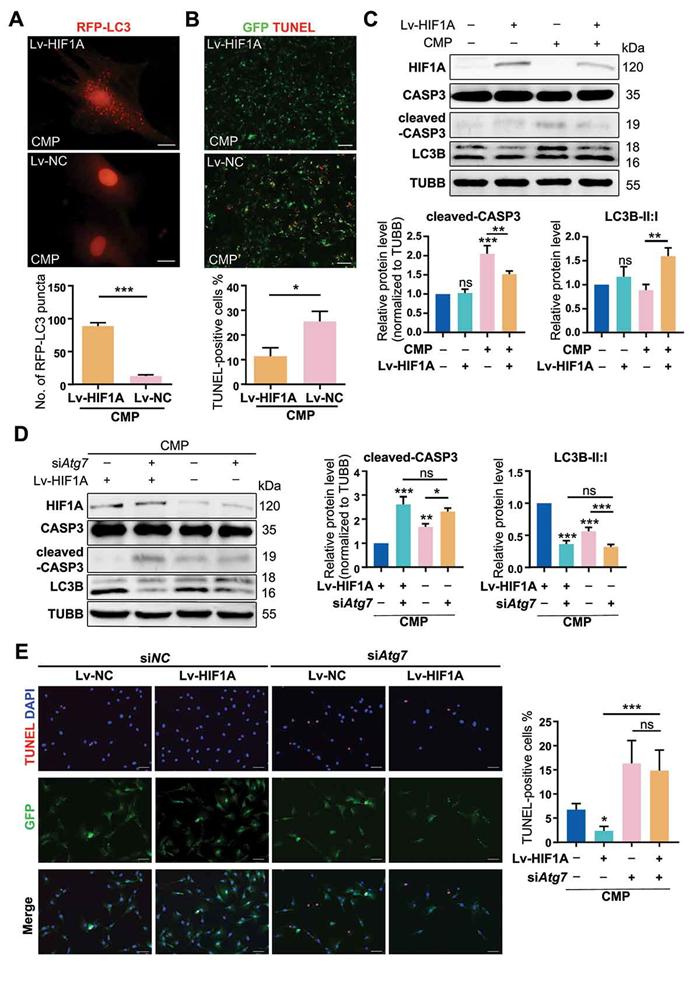
 利用外源性CoCl2模拟缺氧后,将NPSCs细胞过表达HIF-1α从而在遗传上模拟缺氧,进而重复之前实验的实验,观察HIF-1α对过载诱导的细胞凋亡的影响以及自噬在其中的变化。
利用外源性CoCl2模拟缺氧后,将NPSCs细胞过表达HIF-1α从而在遗传上模拟缺氧,进而重复之前实验的实验,观察HIF-1α对过载诱导的细胞凋亡的影响以及自噬在其中的变化。
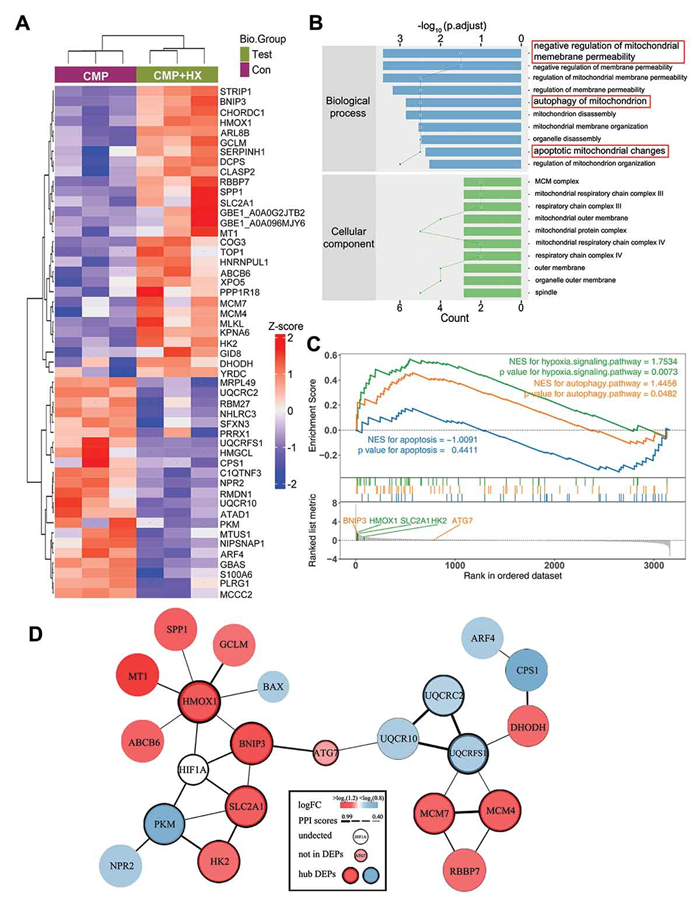
 为了深入了解HIF1α在背后的机制,对单纯加压组合加压联合缺氧组的NPSCs进行蛋白组学分析,结果显示这些差异蛋白富集在线粒体通透性、自噬和凋亡相关功能上,蛋白互作网络分析显示HIF-1α与ATG7、BNIP3、HMOX1、SLC2A1这些蛋白发生交互。
为了深入了解HIF1α在背后的机制,对单纯加压组合加压联合缺氧组的NPSCs进行蛋白组学分析,结果显示这些差异蛋白富集在线粒体通透性、自噬和凋亡相关功能上,蛋白互作网络分析显示HIF-1α与ATG7、BNIP3、HMOX1、SLC2A1这些蛋白发生交互。
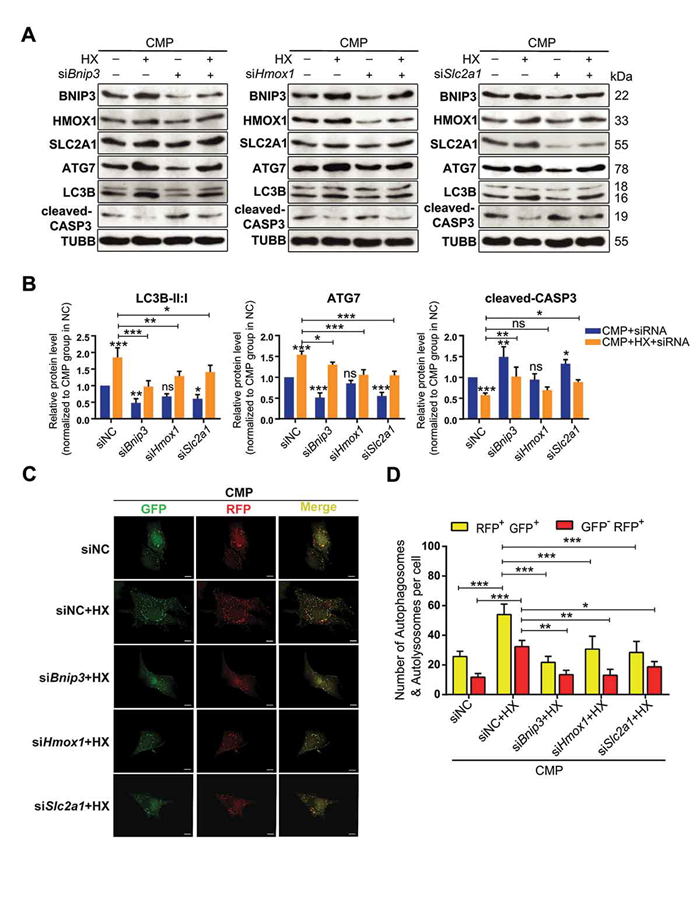
 为了验证HIF-1α/ATG7自噬轴相关的信号通路,分别对之前筛选出的三个蛋白的基因做干扰验证。
为了验证HIF-1α/ATG7自噬轴相关的信号通路,分别对之前筛选出的三个蛋白的基因做干扰验证。
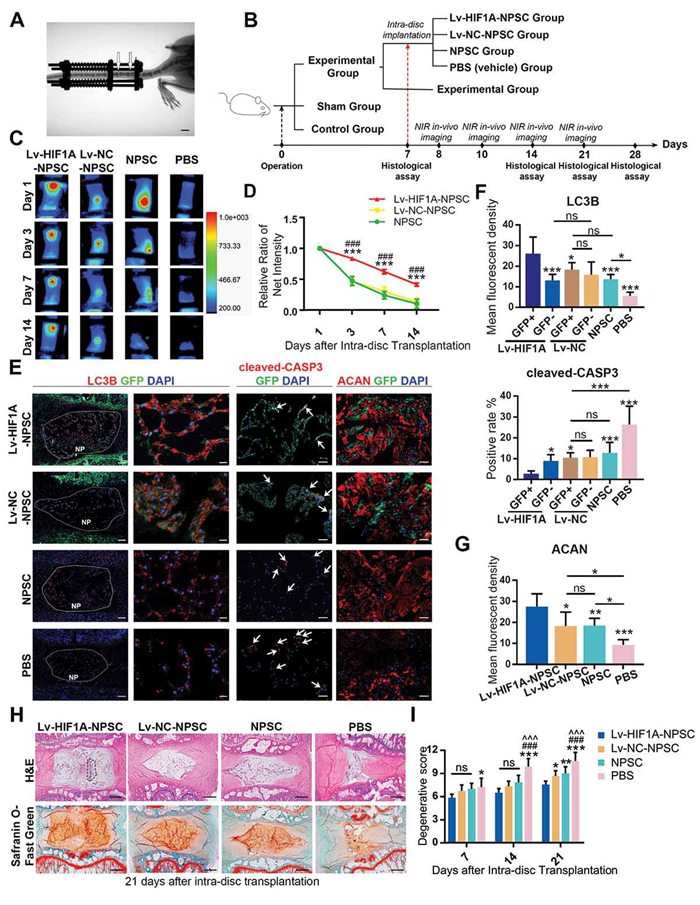
 利用轴向压缩外固定的方式构建大鼠尾椎间盘的压缩模型,研究过表达HIF-1α的NPSCs移植至过载的髓核中的存活情况,随后在体内验证HIF-1α能够通过上调自噬通量、减少细胞凋亡、促进NPSCs中ECM合成作用,进而延缓过度机械负荷诱导的椎间盘退变的进展。
利用轴向压缩外固定的方式构建大鼠尾椎间盘的压缩模型,研究过表达HIF-1α的NPSCs移植至过载的髓核中的存活情况,随后在体内验证HIF-1α能够通过上调自噬通量、减少细胞凋亡、促进NPSCs中ECM合成作用,进而延缓过度机械负荷诱导的椎间盘退变的进展。


【结果】
为了了解椎间盘退变过程中髓核缺氧环境的变化,临床收集患者的组织样本进行分析,结果表明随着椎间盘退变程度的不断增加,缺氧环境被破坏,髓核中祖细胞凋亡增加。















