研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Biomaterials】12分+,强势围观!一种靶向治疗胶质瘤的中性粒细胞外泌体载药系统
1245 人阅读发布时间:2022-06-06 16:15
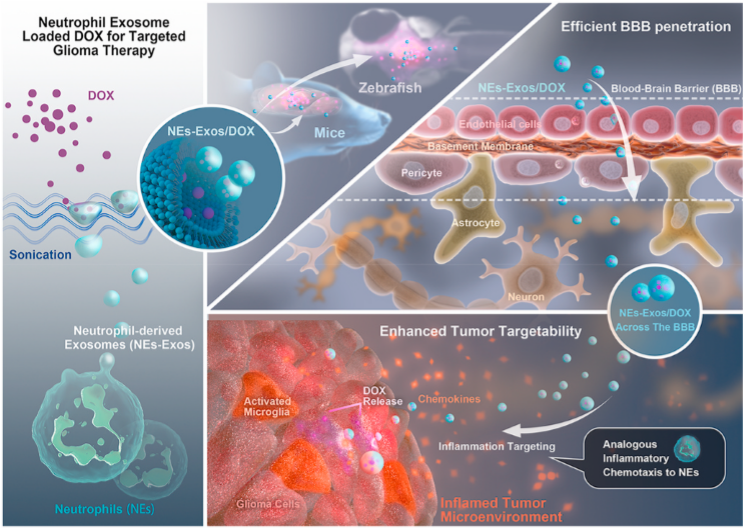
胶质瘤是中枢神经系统最具侵袭性、最常见的原发性恶性肿瘤,死亡率高,预后差,手术切除胶质瘤往往伴有明显的局部脑炎症。恶性胶质瘤的高浸润性生长和化疗耐药以及血脑屏障(BBB)的存在仍然是临床治疗的主要挑战。因此,迫切需要开发一种能够跨越血脑屏障、有效靶向肿瘤区域的给药系统。
重庆大学医学院王亚洲教授课题组受中性粒细胞固有的炎症趋化性和出色的血脑屏障交叉能力的启发,提出并研究了一种生物激发的中性粒细胞-外泌体(NEs-Exos)系统,该系统可负载的阿霉素(DOX)药物用于胶质瘤治疗,这为胶质瘤和其他实体肿瘤或脑部疾病的临床治疗提供了一种有前景的化疗方法。该研究发表在生物材料领域TOP期刊Biomaterials (IF:12.479)上,让我们一起瞅瞅吧~
文章链接:http://www.elsevier.com/locate/biomaterials
技术路线:
 研究结果:
研究结果:
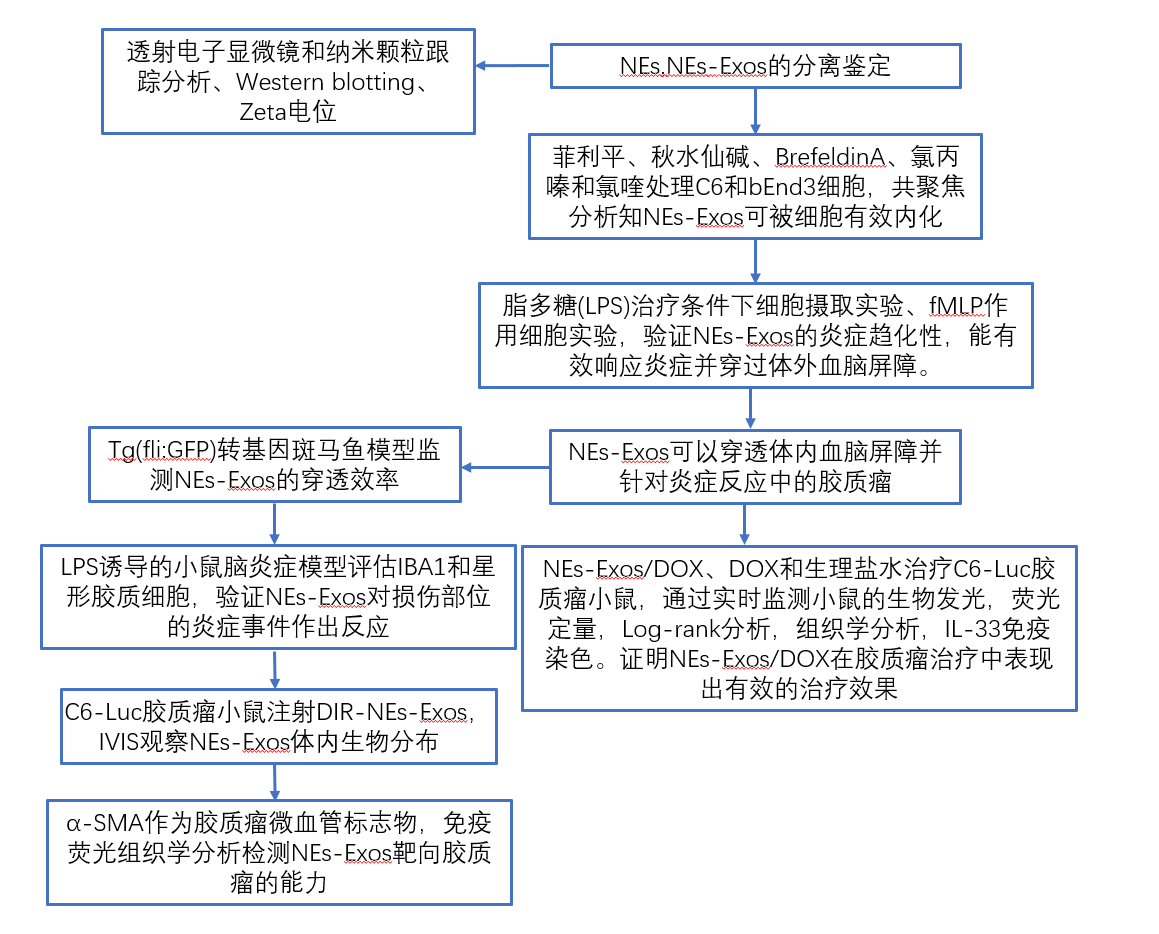
1. NEs-Exos的分离和鉴定
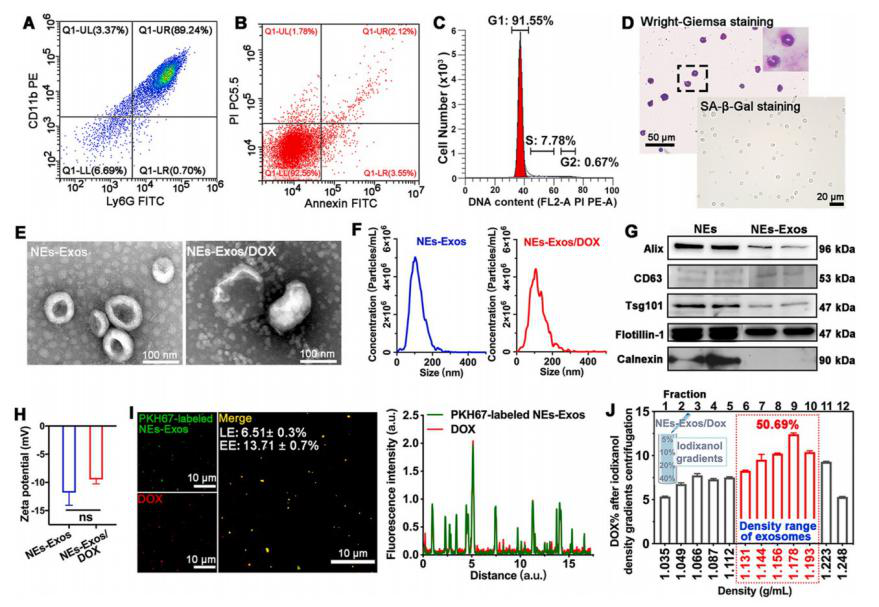
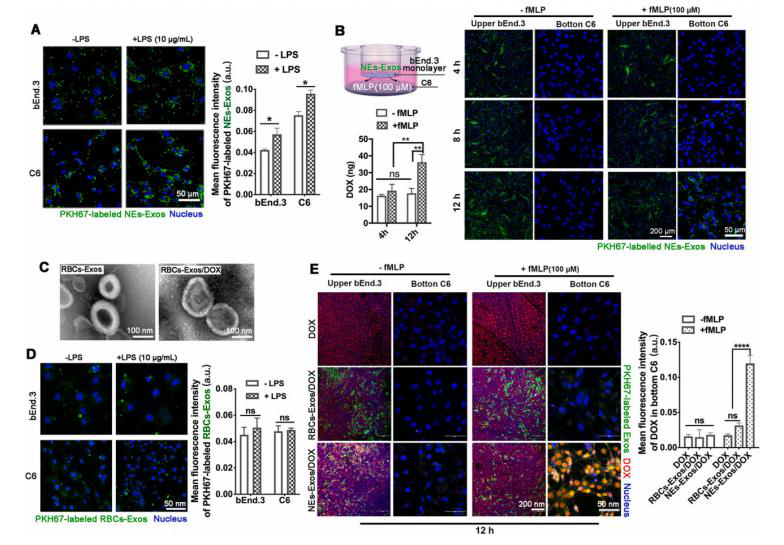
采用密度梯度离心法纯化从小鼠骨髓中提取的成熟NEs,连续超离心方法从NEs培养基中分离出NEs-Exos,透射电电镜、纳米颗粒跟踪及Western blot分析进行表征。NEs-Exos具有负电Zeta电位,对C6和bEnd3细胞均无毒。荧光图像显示DOX的荧光(红色)与PKH67标记的NEs-Exos的荧光(绿色)重叠,并通过半定量分析可知:NEs-Exos包裹了抗癌药物。通过荧光分光光度计测定,再次证实大多数DOX包裹在NEs-Exos中。载药后,NEs-Exos/DOX峰的粒径增加到112.5±12.6nm,粒径变得更加不均一,NEs-Exos/DOX电位未受显著影响。
 2. 神经胶质瘤相关细胞对NEs-Exos的摄取和内化
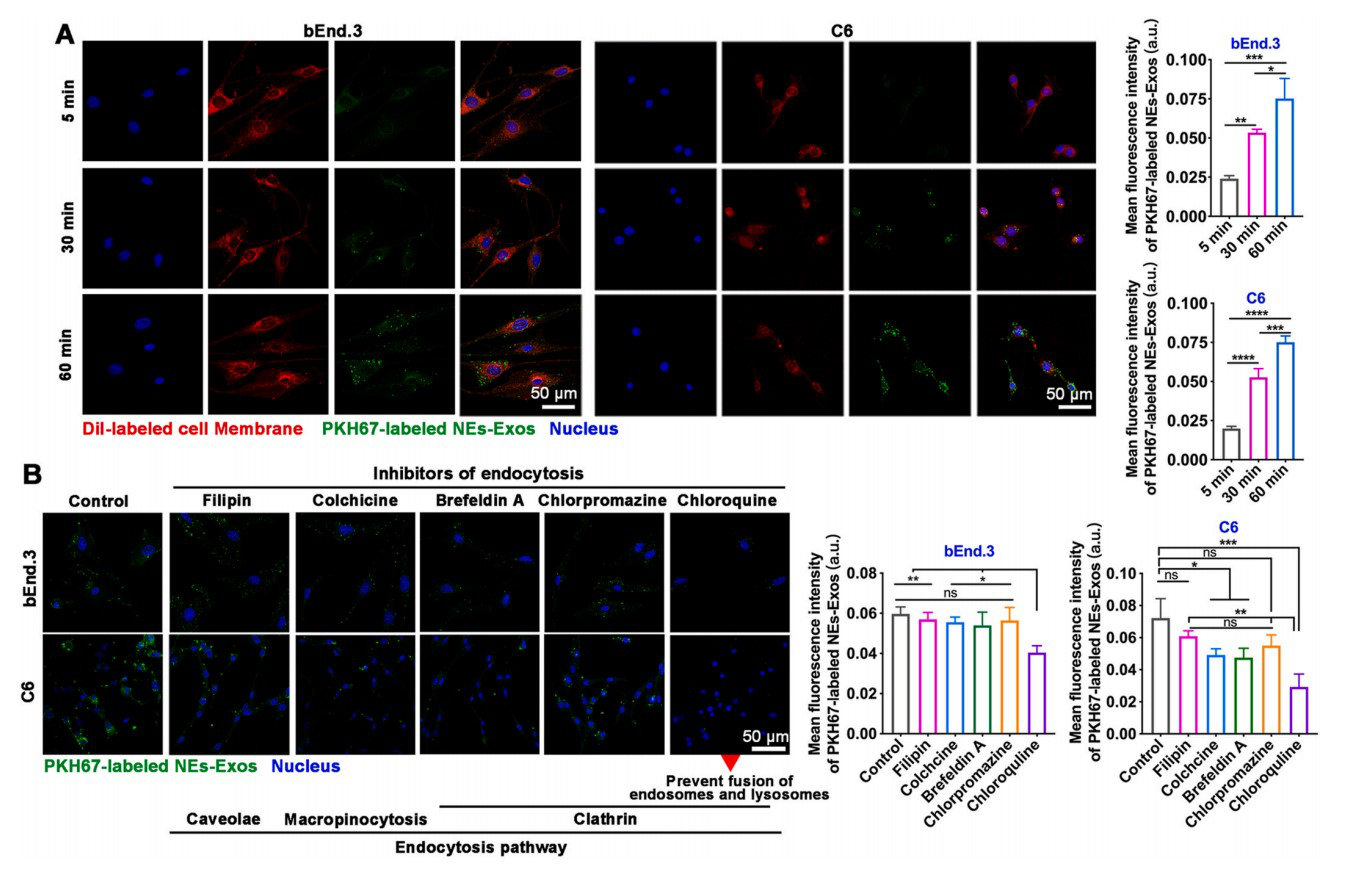
2. 神经胶质瘤相关细胞对NEs-Exos的摄取和内化
共聚焦分析结果显示,C6细胞和bEnd3都能轻易摄取NEs-Exos。为进一步研究NEs-Exos的内化行为,实验分别用各种内吞抑制剂处理细胞:菲利平、秋水仙碱、BrefeldinA、氯丙嗪和氯喹。结果显示,NEs-Exos可被细胞有效内化,网格蛋白内吞作用可能在调节NEs-Exos摄取中发挥最重要的作用。
 3. NEs-Exos可以穿过体外血脑屏障并对炎症刺激作出化学反应
3. NEs-Exos可以穿过体外血脑屏障并对炎症刺激作出化学反应
为了评估炎症是否会影响NEs-Exos/PKH67的摄取效率,在脂多糖(LPS)治疗条件下进行了细胞摄取实验,观察到bEnd3和C6细胞的胞腔内存在显著的NEs-Exos/PKH67定位。甲酰基甲硫酰亮基苯丙氨酸(fMLP)处理细胞来评估NEs-Exos对炎症细胞因子的趋化能力。fMLP作用下C6细胞的荧光强度逐渐增强,表明NEs-Exos具有NEs的趋化能力,能有效响应炎症并在体外穿透BBB。fMLP作用下bEnd3细胞NEs-Exos/PKH67荧光强度连续下降,表明NEs-Exos/PKH67从bEnd3排出向炎症部位迁移。为了检测非中性粒细胞来源的外泌体是否能对炎症做出反应,我们还制备了红细胞来源的外泌体(RBC-Exos),通过TEM、NTA、LPS条件下细胞摄取实验、fMLP作用细胞。结果表明NEs-Exos具有出色的炎症趋化性,能够有效地响应炎症并穿过体外血脑屏障。
 4. NEs-Exos可以穿透体内血脑屏障并针对炎症反应中的胶质瘤
4. NEs-Exos可以穿透体内血脑屏障并针对炎症反应中的胶质瘤
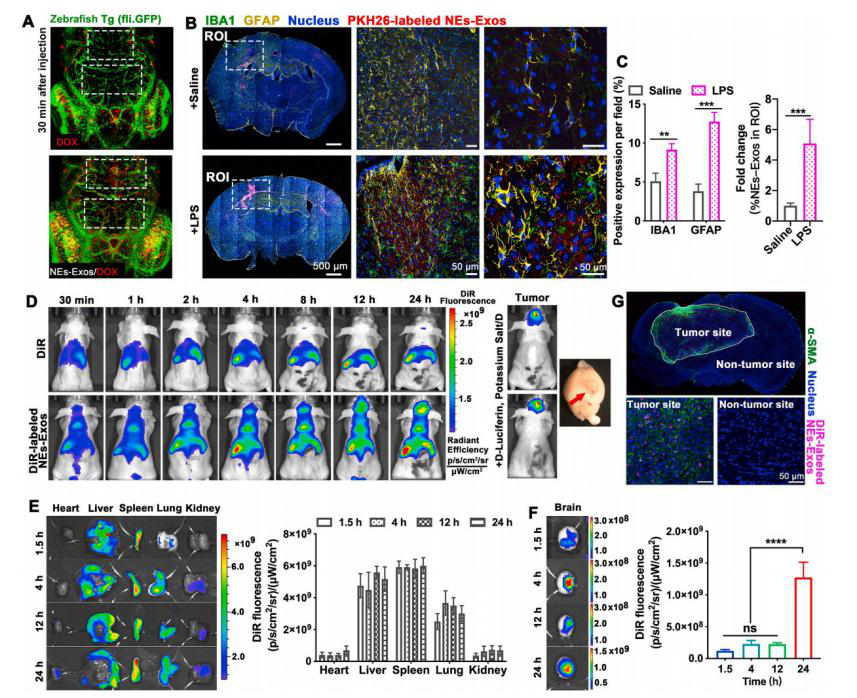
为了评估NEs-Exos是否能在体内穿过血脑屏障,实验采用Tg(fli:GFP)转基因斑马鱼模型监测NEs-Exos的穿透效率,结果表明NEs-Exos装载抗癌药物进入大脑是可行的。
为了评估胶质瘤的病理特征并验证NEs-Exos对胶质瘤中炎性化学物质的反应,实验重建了LPS诱导的小鼠脑炎症模型,对脑肿瘤进行了组织学分析。LPS处理小鼠脑组织的免疫组化结果,以及荧光成像中小胶质细胞和星形胶质细胞的异常激活状态,提示LPS处理小鼠大脑处于炎症病理状态。在这种炎症病理情况下,观察到更多的NEs-Exos/PKH26在炎症部位积聚,强调与中性粒细胞类似,NEs-Exos对损伤部位的炎症作出反应。
为了解NEs-Exos体内的生物分布,给C6-Luc胶质瘤小鼠静脉注射DiR标记的NEs-Exos,并通过IVIS成像观察,观察到注射NEs-Exos/DiR的小鼠脑瘤部位荧光明显增强,脑区荧光强度随时间增加而逐渐增加。接下来,使用α-SMA作为胶质瘤微血管标志物,通过免疫荧光组织学分析检测NEs-Exos靶向胶质瘤的能力。结果显示,肿瘤部位α-SMA染色较强,特别是在胶质瘤区域周围。在大脑肿瘤区域中发现了显著更高的DiR标记NEs-Exos的积累,进一步表明NEs-Exos在体内具有更好的胶质瘤靶向肿瘤能力。
5. NEs-Exos/DOX在胶质瘤治疗中表现出有效的治疗效果
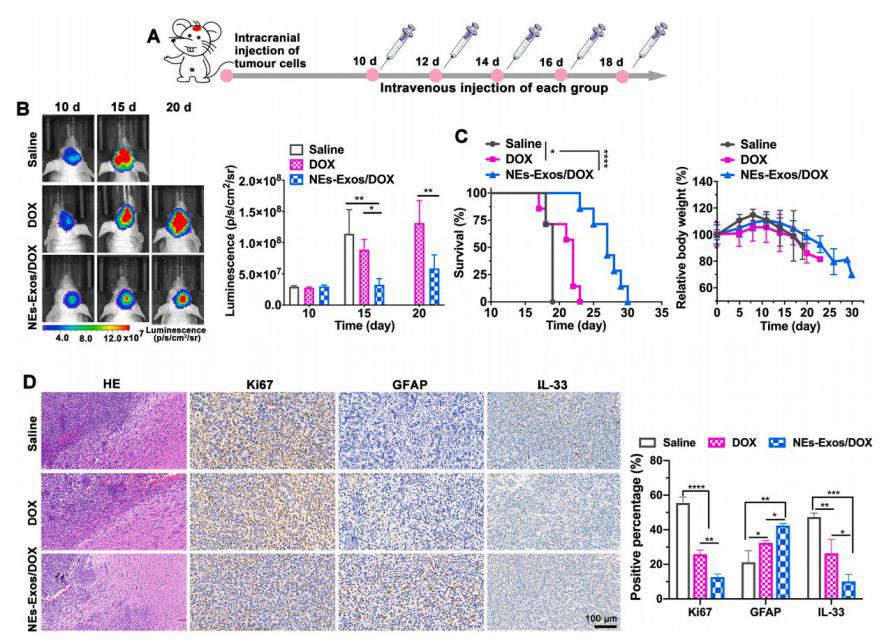
为探索NEs-Exos/DOX在体内的治疗效果,实验监测并量化了NEs-Exos/DOX、DOX和生理盐水治疗后C6-Luc胶质瘤小鼠的生物发光。通过荧光定量和Log-rank分析得知:盐水组:胶质瘤生长快,强荧光,小鼠体重显著下降。DOX组:胶质瘤随时间增殖,小鼠体重显著下降。NEs-Exos/DOX组:荧光弱,胶质瘤生长受抑制,小鼠存活时间更长,小鼠体重下降率相对低。
接下来对以上三组进行组织学分析,结果显示与其他两组相比,NEs-Exos/DOX处理的小鼠,H&E染色的胶质瘤细胞密度和免疫荧光染色的Ki67表达显著降低,说明NEs-Exos/DOX能有效抑制肿瘤的增殖。且经过NEs-Exos/DOX治疗后脑肿瘤GFAP表达相对较高,表明NEs-Exos/DOX抑制胶质瘤恶性进展。实验还对IL-33进行免疫染色,IL-33在NEs-Exos/DOX组的表达明显低于其他组,再次证实NEs-Exos为抗肿瘤药物进入肿瘤提供了一种高度可行的策略,在胶质瘤治疗中表现出了有效的治疗效果。
总结:
本研究开发了一种基于中性粒细胞来源的外泌体的炎症刺激反应性肿瘤靶向纳米载体,用于抗胶质瘤治疗。作为一种天然的细胞外囊泡,NEs- Exos载药作用已被证明,并主要通过网格蛋白内吞作用有效地内化到细胞中。此外,研究证实了NEs-Exos具有诱人的血脑屏障穿透能力,在体内静脉注射NEs-Exos/DOX能更好地将DOX抗癌药物传递到脑实质。更重要的是,NEs-Exos在体外和体内都能够对炎症刺激做出反应。因此,NEs-Exos/DOX可以方便地进入大脑,靶向胶质瘤,显著提高抗胶质瘤治疗效果。
重庆大学医学院王亚洲教授课题组受中性粒细胞固有的炎症趋化性和出色的血脑屏障交叉能力的启发,提出并研究了一种生物激发的中性粒细胞-外泌体(NEs-Exos)系统,该系统可负载的阿霉素(DOX)药物用于胶质瘤治疗,这为胶质瘤和其他实体肿瘤或脑部疾病的临床治疗提供了一种有前景的化疗方法。该研究发表在生物材料领域TOP期刊Biomaterials (IF:12.479)上,让我们一起瞅瞅吧~

文章链接:http://www.elsevier.com/locate/biomaterials


技术路线:

1. NEs-Exos的分离和鉴定
采用密度梯度离心法纯化从小鼠骨髓中提取的成熟NEs,连续超离心方法从NEs培养基中分离出NEs-Exos,透射电电镜、纳米颗粒跟踪及Western blot分析进行表征。NEs-Exos具有负电Zeta电位,对C6和bEnd3细胞均无毒。荧光图像显示DOX的荧光(红色)与PKH67标记的NEs-Exos的荧光(绿色)重叠,并通过半定量分析可知:NEs-Exos包裹了抗癌药物。通过荧光分光光度计测定,再次证实大多数DOX包裹在NEs-Exos中。载药后,NEs-Exos/DOX峰的粒径增加到112.5±12.6nm,粒径变得更加不均一,NEs-Exos/DOX电位未受显著影响。

共聚焦分析结果显示,C6细胞和bEnd3都能轻易摄取NEs-Exos。为进一步研究NEs-Exos的内化行为,实验分别用各种内吞抑制剂处理细胞:菲利平、秋水仙碱、BrefeldinA、氯丙嗪和氯喹。结果显示,NEs-Exos可被细胞有效内化,网格蛋白内吞作用可能在调节NEs-Exos摄取中发挥最重要的作用。

为了评估炎症是否会影响NEs-Exos/PKH67的摄取效率,在脂多糖(LPS)治疗条件下进行了细胞摄取实验,观察到bEnd3和C6细胞的胞腔内存在显著的NEs-Exos/PKH67定位。甲酰基甲硫酰亮基苯丙氨酸(fMLP)处理细胞来评估NEs-Exos对炎症细胞因子的趋化能力。fMLP作用下C6细胞的荧光强度逐渐增强,表明NEs-Exos具有NEs的趋化能力,能有效响应炎症并在体外穿透BBB。fMLP作用下bEnd3细胞NEs-Exos/PKH67荧光强度连续下降,表明NEs-Exos/PKH67从bEnd3排出向炎症部位迁移。为了检测非中性粒细胞来源的外泌体是否能对炎症做出反应,我们还制备了红细胞来源的外泌体(RBC-Exos),通过TEM、NTA、LPS条件下细胞摄取实验、fMLP作用细胞。结果表明NEs-Exos具有出色的炎症趋化性,能够有效地响应炎症并穿过体外血脑屏障。

为了评估NEs-Exos是否能在体内穿过血脑屏障,实验采用Tg(fli:GFP)转基因斑马鱼模型监测NEs-Exos的穿透效率,结果表明NEs-Exos装载抗癌药物进入大脑是可行的。
为了评估胶质瘤的病理特征并验证NEs-Exos对胶质瘤中炎性化学物质的反应,实验重建了LPS诱导的小鼠脑炎症模型,对脑肿瘤进行了组织学分析。LPS处理小鼠脑组织的免疫组化结果,以及荧光成像中小胶质细胞和星形胶质细胞的异常激活状态,提示LPS处理小鼠大脑处于炎症病理状态。在这种炎症病理情况下,观察到更多的NEs-Exos/PKH26在炎症部位积聚,强调与中性粒细胞类似,NEs-Exos对损伤部位的炎症作出反应。
为了解NEs-Exos体内的生物分布,给C6-Luc胶质瘤小鼠静脉注射DiR标记的NEs-Exos,并通过IVIS成像观察,观察到注射NEs-Exos/DiR的小鼠脑瘤部位荧光明显增强,脑区荧光强度随时间增加而逐渐增加。接下来,使用α-SMA作为胶质瘤微血管标志物,通过免疫荧光组织学分析检测NEs-Exos靶向胶质瘤的能力。结果显示,肿瘤部位α-SMA染色较强,特别是在胶质瘤区域周围。在大脑肿瘤区域中发现了显著更高的DiR标记NEs-Exos的积累,进一步表明NEs-Exos在体内具有更好的胶质瘤靶向肿瘤能力。

5. NEs-Exos/DOX在胶质瘤治疗中表现出有效的治疗效果
为探索NEs-Exos/DOX在体内的治疗效果,实验监测并量化了NEs-Exos/DOX、DOX和生理盐水治疗后C6-Luc胶质瘤小鼠的生物发光。通过荧光定量和Log-rank分析得知:盐水组:胶质瘤生长快,强荧光,小鼠体重显著下降。DOX组:胶质瘤随时间增殖,小鼠体重显著下降。NEs-Exos/DOX组:荧光弱,胶质瘤生长受抑制,小鼠存活时间更长,小鼠体重下降率相对低。
接下来对以上三组进行组织学分析,结果显示与其他两组相比,NEs-Exos/DOX处理的小鼠,H&E染色的胶质瘤细胞密度和免疫荧光染色的Ki67表达显著降低,说明NEs-Exos/DOX能有效抑制肿瘤的增殖。且经过NEs-Exos/DOX治疗后脑肿瘤GFAP表达相对较高,表明NEs-Exos/DOX抑制胶质瘤恶性进展。实验还对IL-33进行免疫染色,IL-33在NEs-Exos/DOX组的表达明显低于其他组,再次证实NEs-Exos为抗肿瘤药物进入肿瘤提供了一种高度可行的策略,在胶质瘤治疗中表现出了有效的治疗效果。

总结:
本研究开发了一种基于中性粒细胞来源的外泌体的炎症刺激反应性肿瘤靶向纳米载体,用于抗胶质瘤治疗。作为一种天然的细胞外囊泡,NEs- Exos载药作用已被证明,并主要通过网格蛋白内吞作用有效地内化到细胞中。此外,研究证实了NEs-Exos具有诱人的血脑屏障穿透能力,在体内静脉注射NEs-Exos/DOX能更好地将DOX抗癌药物传递到脑实质。更重要的是,NEs-Exos在体外和体内都能够对炎症刺激做出反应。因此,NEs-Exos/DOX可以方便地进入大脑,靶向胶质瘤,显著提高抗胶质瘤治疗效果。






