研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【CDD】8分+,经典套路解锁骨髓间充质干细胞外泌体缓解血管钙化的机制研究
613 人阅读发布时间:2022-06-17 13:43
血管钙化(VC)是慢性肾脏疾病(CKD)的重要并发症。凋亡小体导致钙和磷酸盐的沉积,并发展成为钙化的核心,在VC的发展中发挥关键作用。近年来,骨髓间充质干细胞来源的外泌体(BMSC-Exo)的治疗作用越来越受到关注,之前的研究中发现BMSC-Exo可以缓解VC,但其机制尚不清楚。
本研究旨在探讨BMSC-Exo在CKD-VC中的抗凋亡和抗钙化作用,阐明其机制,不仅有助于更好地理解BMSC-Exo的保护作用,而且为CKD-VC的治疗提供一种潜在的策略。相关研究成果发表在Cell death & disease上,IF:8.469。

技术路线:
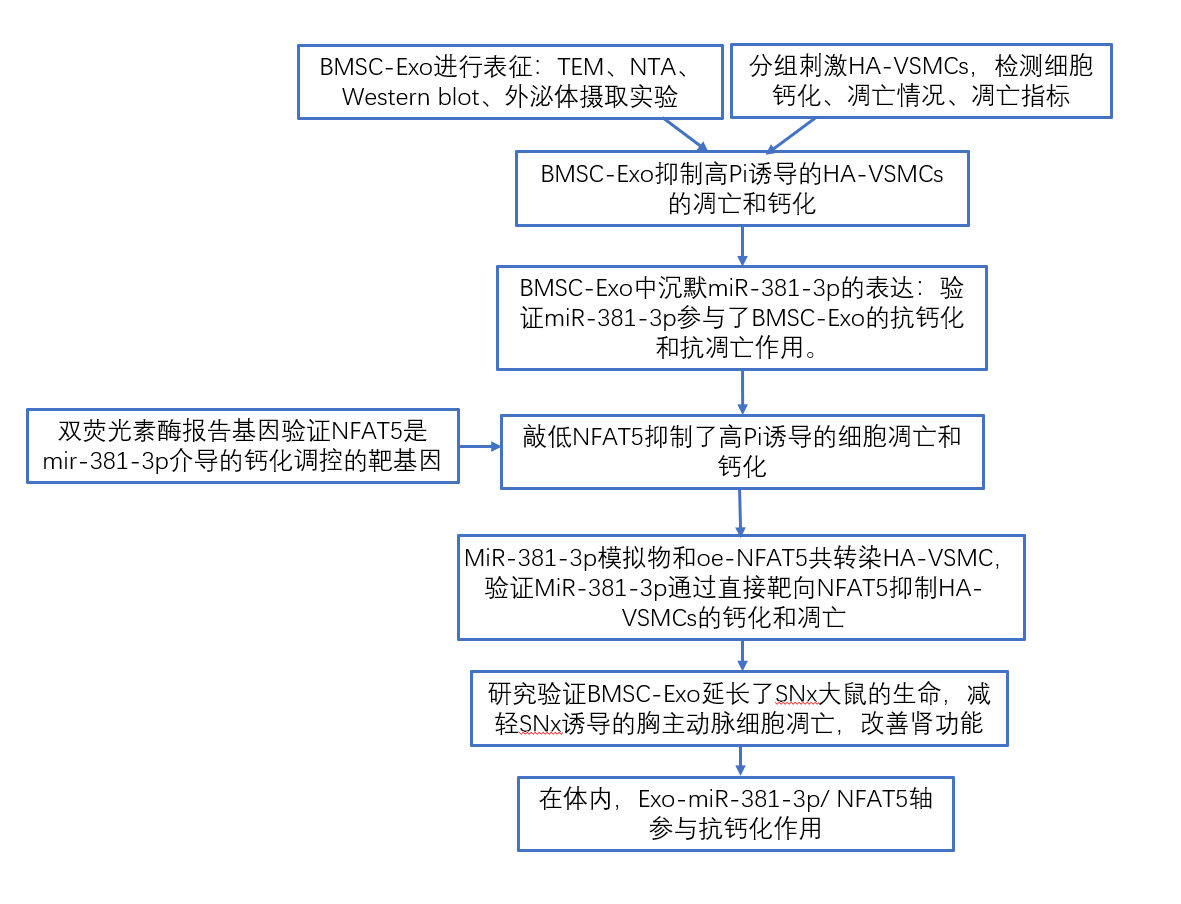 研究结果:
研究结果:
1. BMSC-Exo抑制高Pi诱导的HA-VSMCs的凋亡和钙化
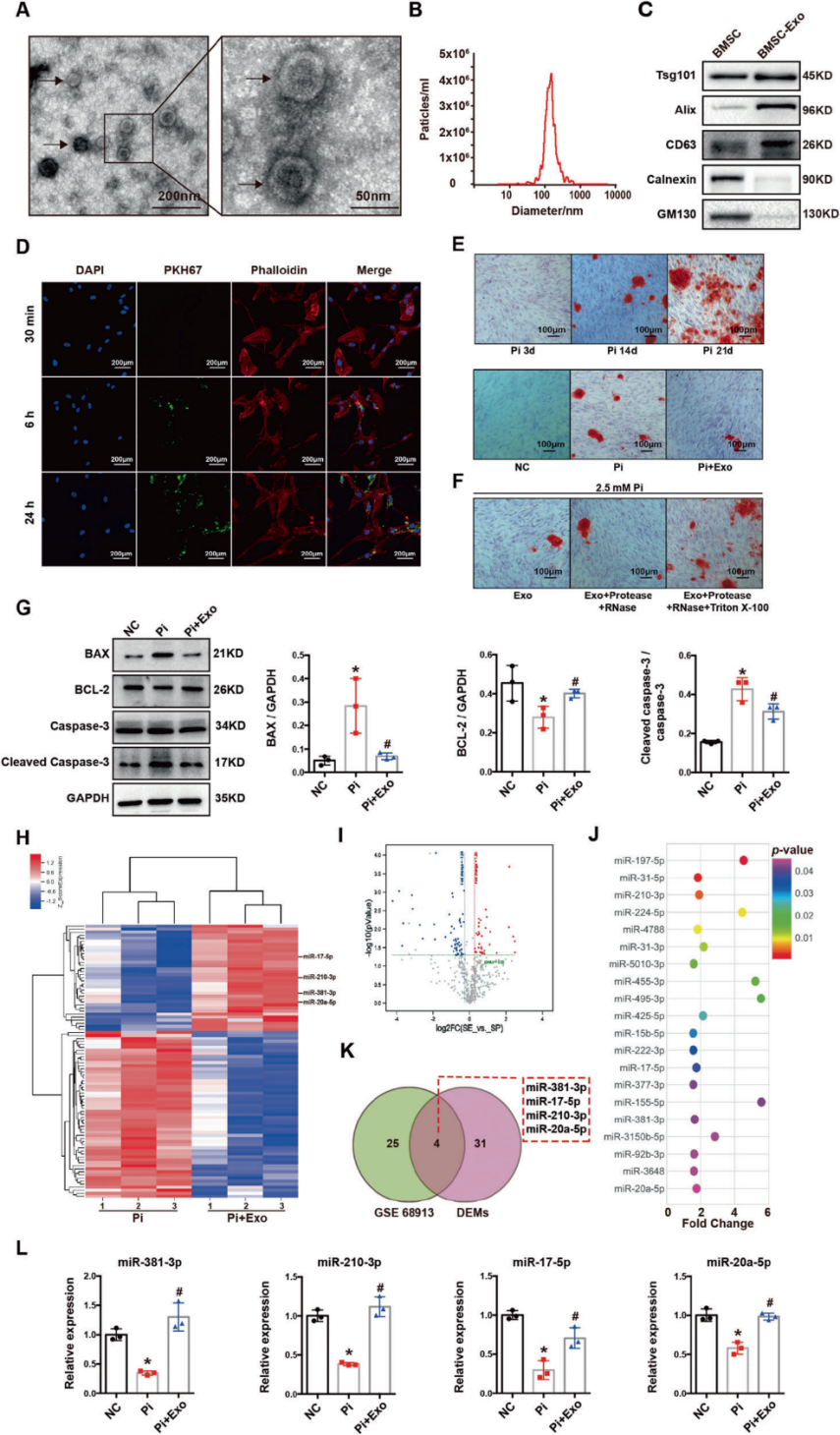
通过透射电子显微镜(TEM)、纳米粒子跟踪分析(NTA)、Western blot对BMSC-Exo进行表征检测。外泌体摄取实验采用高磷酸盐刺激的人主动脉平滑肌细胞(HAVSMCs),证明了HA-VSMCs内化了BMSC-Exo。
实验用2.5mM Pi刺激HA-VSMCs 3、14、21天,14天后细胞出现明显钙化。2.5mM Pi,2.5mM Pi+Exo,NC分组刺激HA-VSMCs14天,观察细胞钙化情况,并检测细胞中凋亡指标的表达水平进行Western blot分析,结果说明BMSC-Exo改善Pi诱导的HA-VSMCs的凋亡和VC。此外,实验还证明了BMSC-Exo的钙化保护作用是由外泌体封闭的物质而不是其他来源的RNA/蛋白所引起的。
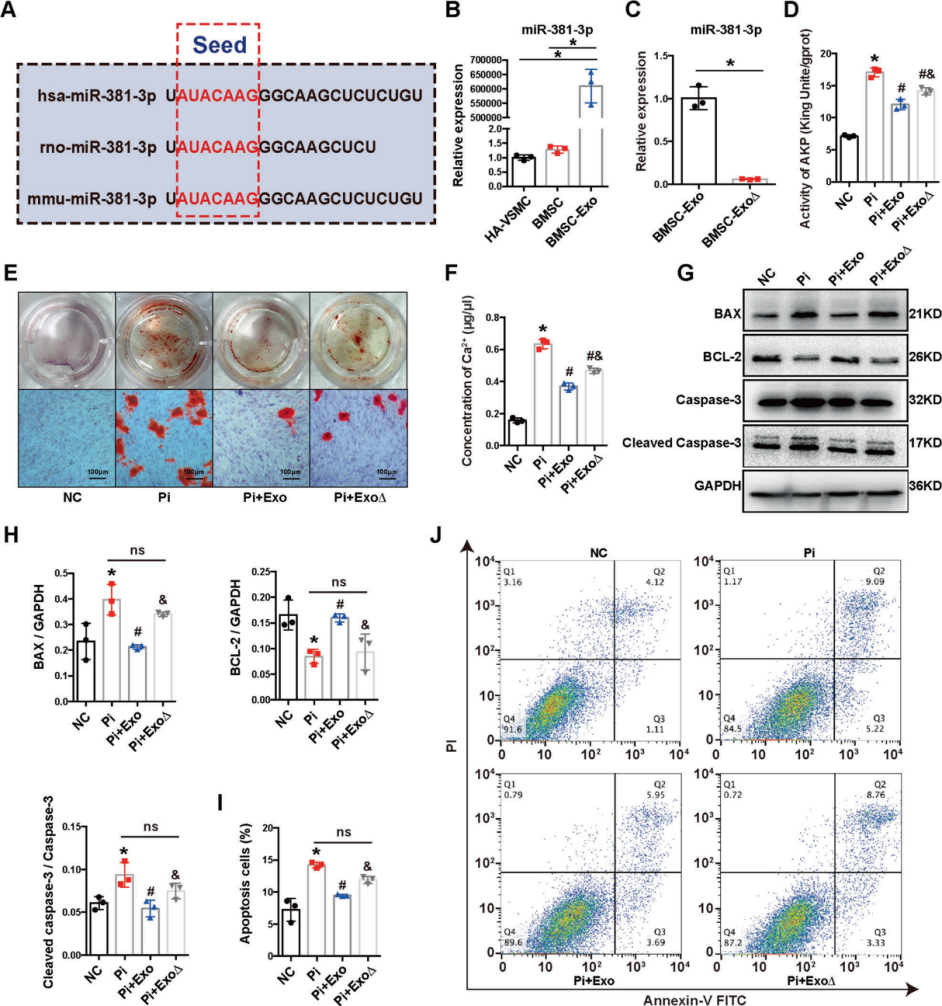
2. BMSC-Exo对钙化的抑制作用部分依赖于miR-381-3p
MiRNA微阵列分析来识别HA-VSMCs中Pi和Pi+Exo组之间差异表达的miRNA (DEM),对选中的4个上调miRNA进行RT-qPCR检测,最终选择miR-381-3p作为进一步研究的靶点。实验分为两组:BMSC-ExoΔ组(沉默miR-381-3p的表达)与BMSC-Exo组。茜素红S染色、Ca2+含量测定和AKP活性分析显示,BMSC-ExoΔ对钙化的抑制作用明显弱于BMSC-Exo。对凋亡指标的评估,发现BMSC-ExoΔ组,对BAX、裂解的caspase3的抑制和BCL-2的增强均被消除。流式细胞仪分析得知BMSC-Exo显著抑制细胞凋亡,BMSC-ExoΔ对细胞凋亡无明显抑制作用。结果表明,miR-381-3p参与了BMSC-Exo的抗钙化和抗凋亡作用。
3. MiR-381-3p通过直接靶向NFAT5抑制HA-VSMCs的钙化和凋亡
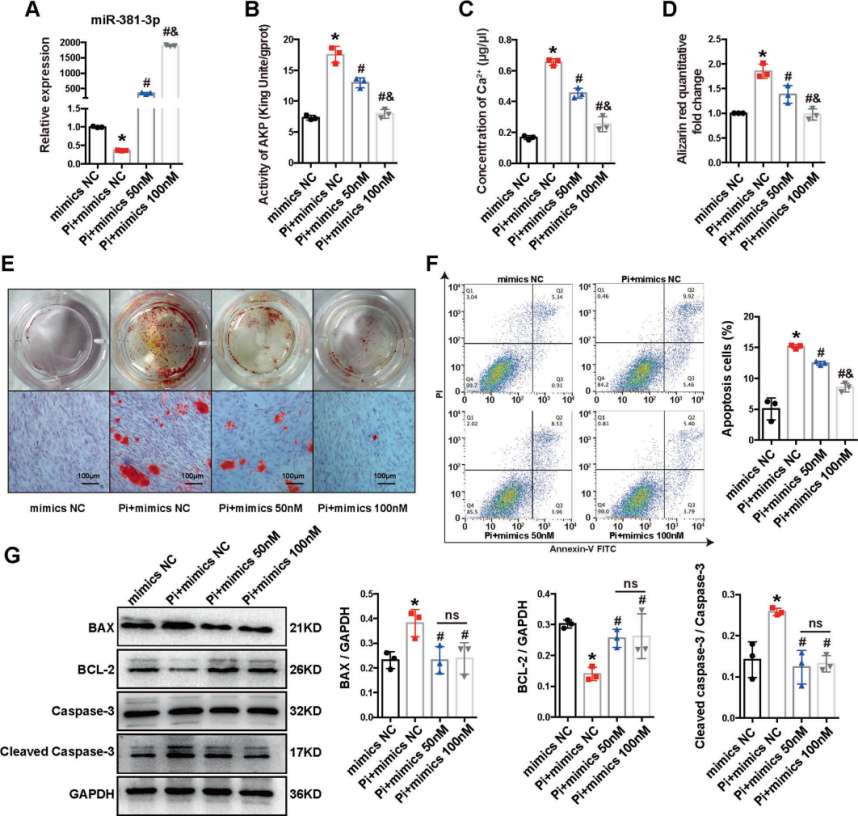
通过微阵列分析,并推测NFAT5可能是mir-381-3p介导的钙化调控的靶基因。双荧光素酶报告基因实验进行了验证,得知miR-381-3p可以直接与NFAT5 mRNA的3'UTR序列结合。对转染了miR-381-3p模拟物的HA-VSMCs中NFAT5蛋白和mRNA表达水平进行了评估,模拟物下调NFAT5的蛋白和mRNA水平。在HA-VSMCs中应用BMSC-Exo后,NFAT5 mRNA和蛋白表达水平也是下调。表明,miR-381-3p通过直接靶向NFAT5 mRNA 3'UTR序列调控其表达。
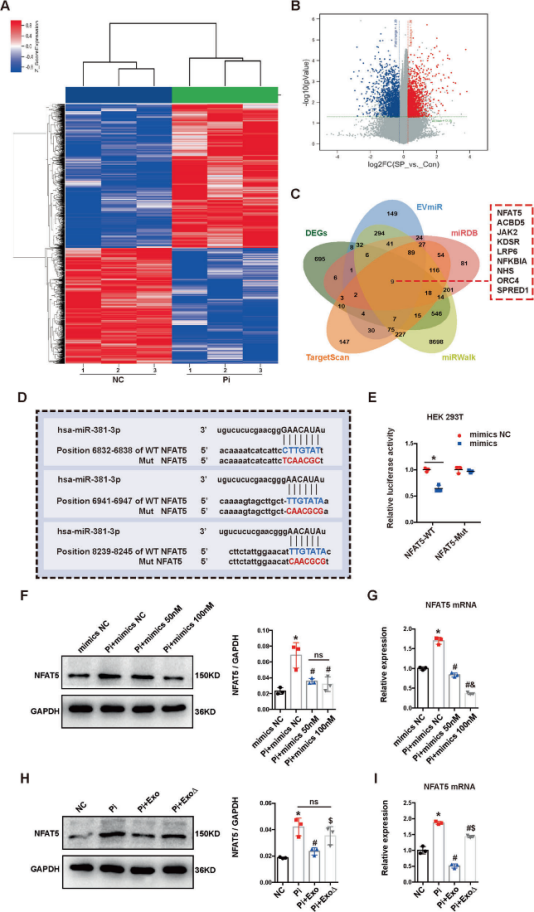
Si-NFAT5转染HA-VSMCs后,NFAT5的mRNA和蛋白表达显著降低,miR-381-3p的表达未受影响。钙沉积和凋亡相关指标检测,结果表明,NFAT5的下调抑制了高Pi诱导的细胞凋亡和钙化。MiR-381-3p模拟物(100nM)和人NFAT5过表达质粒(oe-NFAT5)共转染HA-VSMCs,检测共转染后凋亡和钙化情况,相关凋亡指标。oe-NFAT5显著加剧了细胞的凋亡和钙化,而oe-NFAT5大大减弱了miR-381-3p模拟物的抑制作用,表明NFAT5对于外泌体miR-381-3p的抗钙化和抗凋亡作用至关重要。
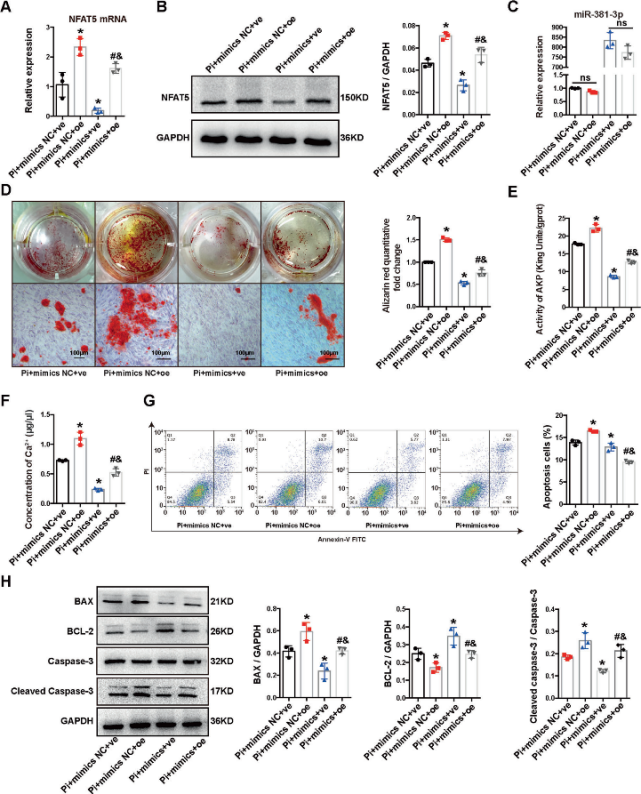
Figure 5 MiR-381-3p通过靶向NFAT5抑制凋亡和VC
4. BMSC-Exo对SNx大鼠细胞凋亡及VC的治疗作用
实验用5/6SNx大鼠建立稳定的VC模型。术后16周SNx组大鼠较SNx+Exo组和SHAM组大鼠明显变瘦。较SHAM组,SNx组Scr和BUN水平升高,BMSC-Exo处理后Scr和BUN水平降低。因此,BMSC-Exo延长了SNx大鼠的生命,并改善了肾功能。
SNx大鼠16周后,主动脉的茜素红S和Von Kossa (V-K)染色均呈阳性,SHAM组钙沉积少。定量了Ca2+含量和AKP活性,SNx后胸主动脉Ca2+含量和AKP活性明显升高,BMSC-Exo治疗可缓解上述变化。TUNEL检测胸主动脉细胞凋亡,SHAM组凋亡细胞较少,而SNx组大量凋亡细胞随血管介质分布,与钙沉积分布相似,BMSC-Exo处理后TUNEL阳性减少。RT-qPCR和Western blot显示BMSC-Exo降低了SNx引起的BAX和裂解的caspase3表达,增加了SNx引起的BCL-2的mRNA和蛋白水平,提示BMSC-Exo减轻了SNx诱导的胸主动脉细胞凋亡。
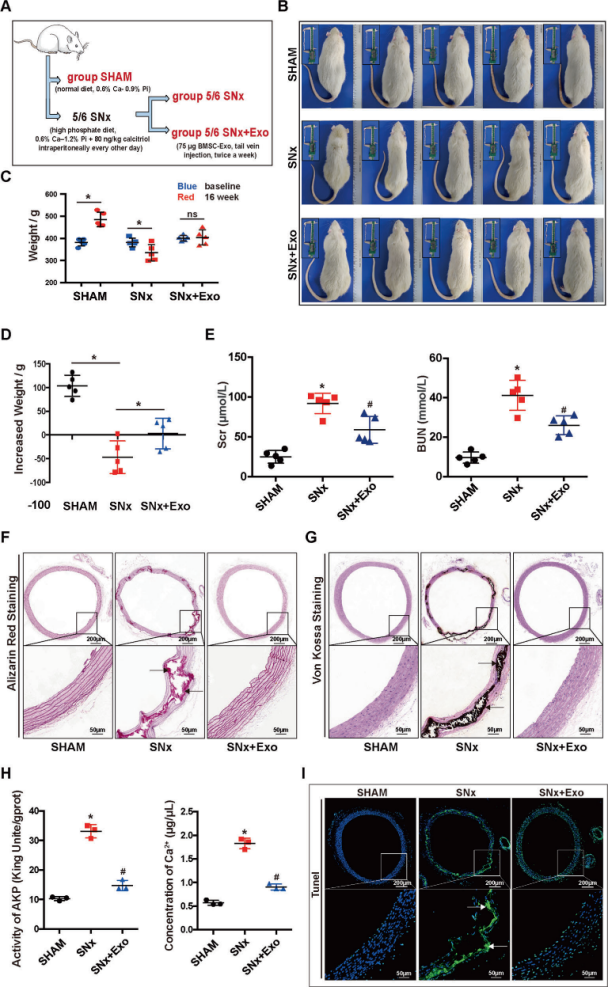
Figure 6 BMSC-Exo对5/6 SNx大鼠生存、肾功能、细胞凋亡及VC的治疗作用
5. 在体内,Exo-miR-381-3p/ NFAT5轴参与抗钙化作用
BMSC-Exo处理SNx大鼠,上调miR-381-3p,下调NFAT5的表达。验证Exo-miR-381-3p/NFAT5轴在透析患者中的作用,将其分为VC组和非VC组。TUNEL检测显示VC组血管介质中有大量凋亡细胞分布,RT-qPCR结果证实,nVC组血管组织中miR-381-3p的表达明显高于VC组,miR-381-3p可能对透析患者VC有保护作用。免疫组化显示VC组NFAT5阳性染色明显增加,NFAT5在VC中发挥了潜在的恶化作用。
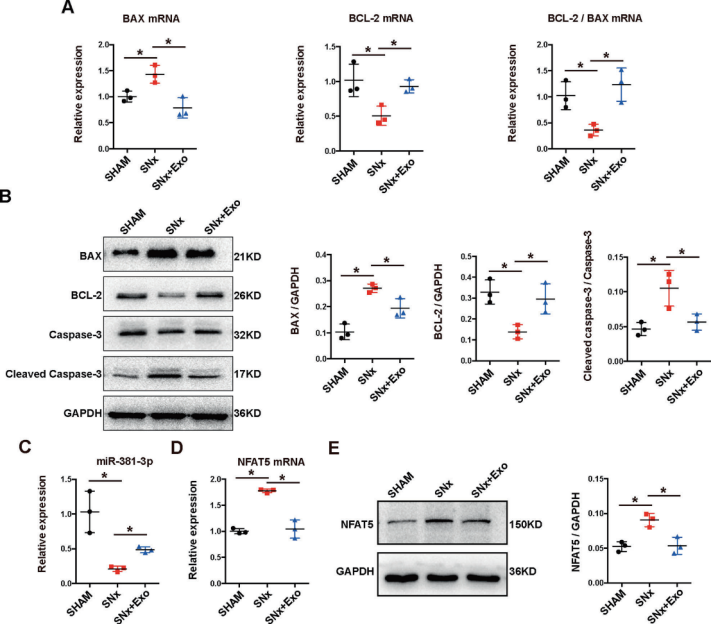
Figure 7 BMSC-Exo通过调节miR-381-3p/NFAT5轴抑制5/6SNx大鼠胸主动脉的凋亡
总结:
研究发现BMSC-Exo通过传递miR-381-3p并抑制其靶基因NFAT5,进而抑制VSMCs的凋亡,从而发挥其抑制血管钙化的作用。不仅揭示了miR-381-3p/NFAT5在调控细胞凋亡/ VC中的重要作用,也拓展了对BMSC-Exo在CKD-VC等复杂机制疾病中的调控作用的认识。
本研究旨在探讨BMSC-Exo在CKD-VC中的抗凋亡和抗钙化作用,阐明其机制,不仅有助于更好地理解BMSC-Exo的保护作用,而且为CKD-VC的治疗提供一种潜在的策略。相关研究成果发表在Cell death & disease上,IF:8.469。

技术路线:

1. BMSC-Exo抑制高Pi诱导的HA-VSMCs的凋亡和钙化
通过透射电子显微镜(TEM)、纳米粒子跟踪分析(NTA)、Western blot对BMSC-Exo进行表征检测。外泌体摄取实验采用高磷酸盐刺激的人主动脉平滑肌细胞(HAVSMCs),证明了HA-VSMCs内化了BMSC-Exo。
实验用2.5mM Pi刺激HA-VSMCs 3、14、21天,14天后细胞出现明显钙化。2.5mM Pi,2.5mM Pi+Exo,NC分组刺激HA-VSMCs14天,观察细胞钙化情况,并检测细胞中凋亡指标的表达水平进行Western blot分析,结果说明BMSC-Exo改善Pi诱导的HA-VSMCs的凋亡和VC。此外,实验还证明了BMSC-Exo的钙化保护作用是由外泌体封闭的物质而不是其他来源的RNA/蛋白所引起的。

Figure 1 BMSC-Exo抑制HA-VSMC的凋亡和VC
2. BMSC-Exo对钙化的抑制作用部分依赖于miR-381-3p
MiRNA微阵列分析来识别HA-VSMCs中Pi和Pi+Exo组之间差异表达的miRNA (DEM),对选中的4个上调miRNA进行RT-qPCR检测,最终选择miR-381-3p作为进一步研究的靶点。实验分为两组:BMSC-ExoΔ组(沉默miR-381-3p的表达)与BMSC-Exo组。茜素红S染色、Ca2+含量测定和AKP活性分析显示,BMSC-ExoΔ对钙化的抑制作用明显弱于BMSC-Exo。对凋亡指标的评估,发现BMSC-ExoΔ组,对BAX、裂解的caspase3的抑制和BCL-2的增强均被消除。流式细胞仪分析得知BMSC-Exo显著抑制细胞凋亡,BMSC-ExoΔ对细胞凋亡无明显抑制作用。结果表明,miR-381-3p参与了BMSC-Exo的抗钙化和抗凋亡作用。

Figure 2 BMSC-Exo抑制钙化的作用依赖于miR-381-3p
3. MiR-381-3p通过直接靶向NFAT5抑制HA-VSMCs的钙化和凋亡

Figure 3 miR-381-3p对HA-VSMCs VC和凋亡的影响
通过微阵列分析,并推测NFAT5可能是mir-381-3p介导的钙化调控的靶基因。双荧光素酶报告基因实验进行了验证,得知miR-381-3p可以直接与NFAT5 mRNA的3'UTR序列结合。对转染了miR-381-3p模拟物的HA-VSMCs中NFAT5蛋白和mRNA表达水平进行了评估,模拟物下调NFAT5的蛋白和mRNA水平。在HA-VSMCs中应用BMSC-Exo后,NFAT5 mRNA和蛋白表达水平也是下调。表明,miR-381-3p通过直接靶向NFAT5 mRNA 3'UTR序列调控其表达。

Figure 4 MiR-381-3p通过直接靶向NFAT5的3'UTR抑制NFAT5
Si-NFAT5转染HA-VSMCs后,NFAT5的mRNA和蛋白表达显著降低,miR-381-3p的表达未受影响。钙沉积和凋亡相关指标检测,结果表明,NFAT5的下调抑制了高Pi诱导的细胞凋亡和钙化。MiR-381-3p模拟物(100nM)和人NFAT5过表达质粒(oe-NFAT5)共转染HA-VSMCs,检测共转染后凋亡和钙化情况,相关凋亡指标。oe-NFAT5显著加剧了细胞的凋亡和钙化,而oe-NFAT5大大减弱了miR-381-3p模拟物的抑制作用,表明NFAT5对于外泌体miR-381-3p的抗钙化和抗凋亡作用至关重要。

Figure 5 MiR-381-3p通过靶向NFAT5抑制凋亡和VC
4. BMSC-Exo对SNx大鼠细胞凋亡及VC的治疗作用
实验用5/6SNx大鼠建立稳定的VC模型。术后16周SNx组大鼠较SNx+Exo组和SHAM组大鼠明显变瘦。较SHAM组,SNx组Scr和BUN水平升高,BMSC-Exo处理后Scr和BUN水平降低。因此,BMSC-Exo延长了SNx大鼠的生命,并改善了肾功能。
SNx大鼠16周后,主动脉的茜素红S和Von Kossa (V-K)染色均呈阳性,SHAM组钙沉积少。定量了Ca2+含量和AKP活性,SNx后胸主动脉Ca2+含量和AKP活性明显升高,BMSC-Exo治疗可缓解上述变化。TUNEL检测胸主动脉细胞凋亡,SHAM组凋亡细胞较少,而SNx组大量凋亡细胞随血管介质分布,与钙沉积分布相似,BMSC-Exo处理后TUNEL阳性减少。RT-qPCR和Western blot显示BMSC-Exo降低了SNx引起的BAX和裂解的caspase3表达,增加了SNx引起的BCL-2的mRNA和蛋白水平,提示BMSC-Exo减轻了SNx诱导的胸主动脉细胞凋亡。

Figure 6 BMSC-Exo对5/6 SNx大鼠生存、肾功能、细胞凋亡及VC的治疗作用
5. 在体内,Exo-miR-381-3p/ NFAT5轴参与抗钙化作用
BMSC-Exo处理SNx大鼠,上调miR-381-3p,下调NFAT5的表达。验证Exo-miR-381-3p/NFAT5轴在透析患者中的作用,将其分为VC组和非VC组。TUNEL检测显示VC组血管介质中有大量凋亡细胞分布,RT-qPCR结果证实,nVC组血管组织中miR-381-3p的表达明显高于VC组,miR-381-3p可能对透析患者VC有保护作用。免疫组化显示VC组NFAT5阳性染色明显增加,NFAT5在VC中发挥了潜在的恶化作用。

Figure 7 BMSC-Exo通过调节miR-381-3p/NFAT5轴抑制5/6SNx大鼠胸主动脉的凋亡
总结:
研究发现BMSC-Exo通过传递miR-381-3p并抑制其靶基因NFAT5,进而抑制VSMCs的凋亡,从而发挥其抑制血管钙化的作用。不仅揭示了miR-381-3p/NFAT5在调控细胞凋亡/ VC中的重要作用,也拓展了对BMSC-Exo在CKD-VC等复杂机制疾病中的调控作用的认识。






