研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
茶花外泌体能抑制转移性乳腺癌?!这样14分+文章你也能发!
743 人阅读发布时间:2022-07-05 11:49
当前有几种人工纳米疗法已被用于转移性乳腺癌的治疗,但低治疗效果、不良反应和高成本限制了它们的临床应用。虽对食用植物衍生的纳米囊泡研究历史很短,但它们对结肠癌、头颈癌等其他癌症的治疗效果已在临床试验中得到证实。
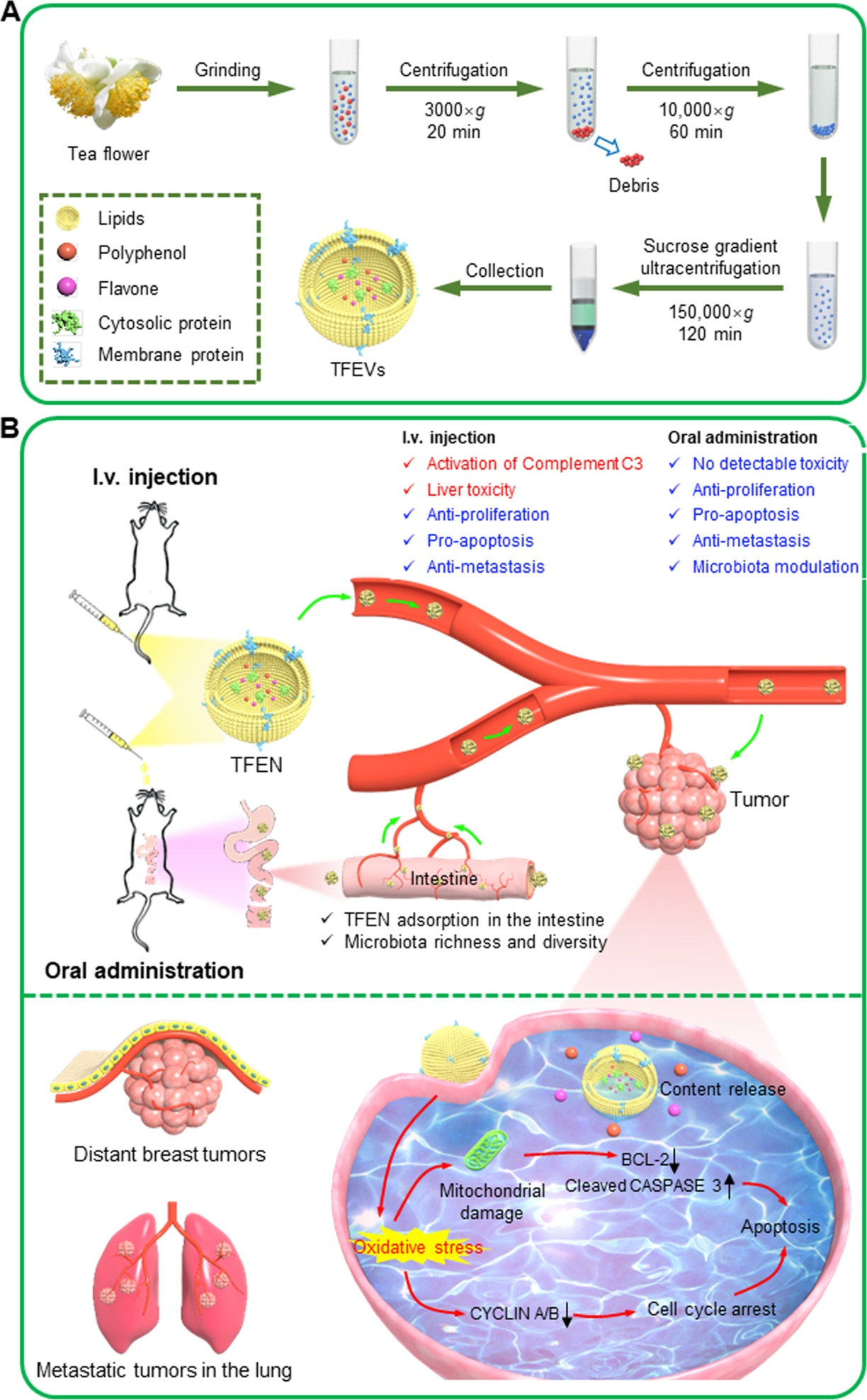
今天为大家分享一篇由西南大学的肖波和重庆大学的王晨辉合作发表在Acta Pharm Sin B.(IF=14.9)的文章,首次分离出茶花外泌体样纳米囊泡TFENs,如下图所示,TFENs通过携带多酚、类黄酮、功能性蛋白和脂质,在体内外抑制转移性乳腺癌的发展。
 文章链接:https://www.sciencedirect.com/science/article/pii/S2211383521003063?via%3Dihub
文章链接:https://www.sciencedirect.com/science/article/pii/S2211383521003063?via%3Dihub
技术路线:
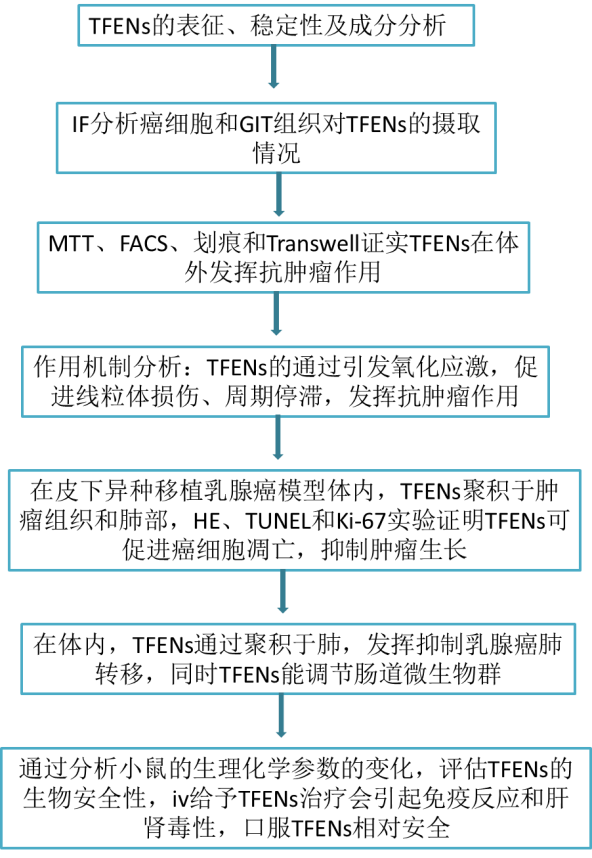
 结果:
结果:
1. TFENs的物化特性
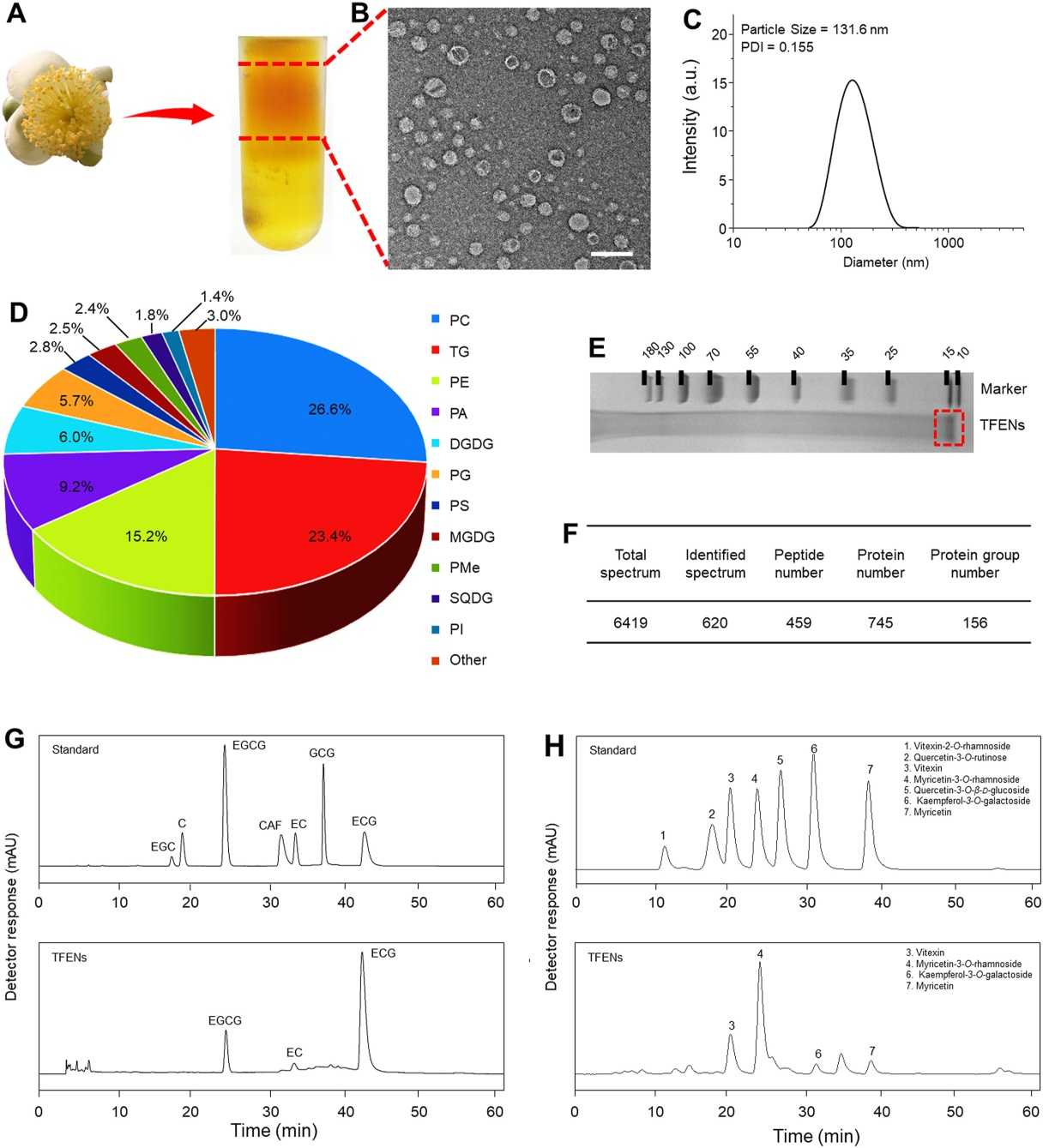
差速离心法结合蔗糖密度梯度超速离心从茶花中分离纯化得到具有负电荷的TFENs,粒径约为130nm。在胃、小肠、结肠模拟液和DMEM中均能稳定存在,意味着静脉注射iv和口服后TFENs在胃肠道GIT和血液中能稳定存在。
脂质组学、蛋白质组学和HPLC/MS分析发现,PC、TG和PE是TFENs的主要脂质成分;其蛋白质成分主要与细胞代谢和增殖有关,其中16种蛋白质具有氧化相关功能;还含有抗癌多酚和类黄酮。这些天然活性物质的存在暗示了TFENs具有治疗癌症的潜能。
 2. 癌细胞和GIT组织对TFENs的摄取情况
2. 癌细胞和GIT组织对TFENs的摄取情况
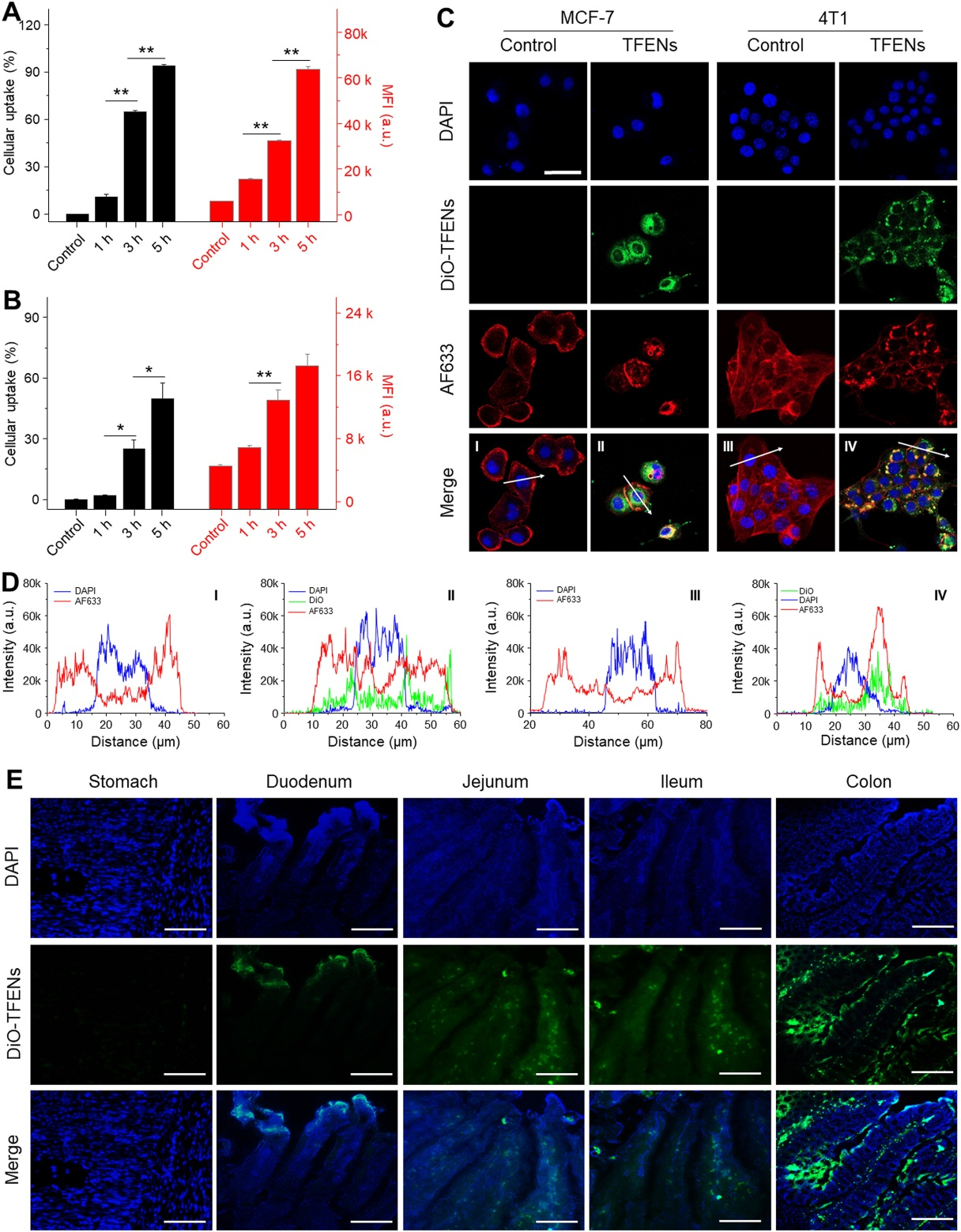
MCF7和4T1细胞对Dio-TFENs的摄取量随时间的延长而增加,且被摄取的TFENs主要分布在细胞核周围。进一步体内实验表明,口服Dio-TFENs后,在空肠、回肠和结肠的粘膜中均可以观察到TFENs的存在,说明TFENs可以有效穿透肠上皮层,从而进入血液循环系统。
3. TFENs的体外抗增殖、促凋亡和抑制迁移侵袭作用
MTT结果显示TFENs以剂量和时间依赖的方式抑制MCF7、4T1、A549和Hela细胞增殖,且对MCF7和4T1作用更显著,而对正常细胞表现出相对良好的生物相容性。FACS分析结果显示TFENs具有促细胞凋亡作用,同时划痕和Transwell呈现出TFENs具有很强的抑制乳腺癌细胞转移能力。
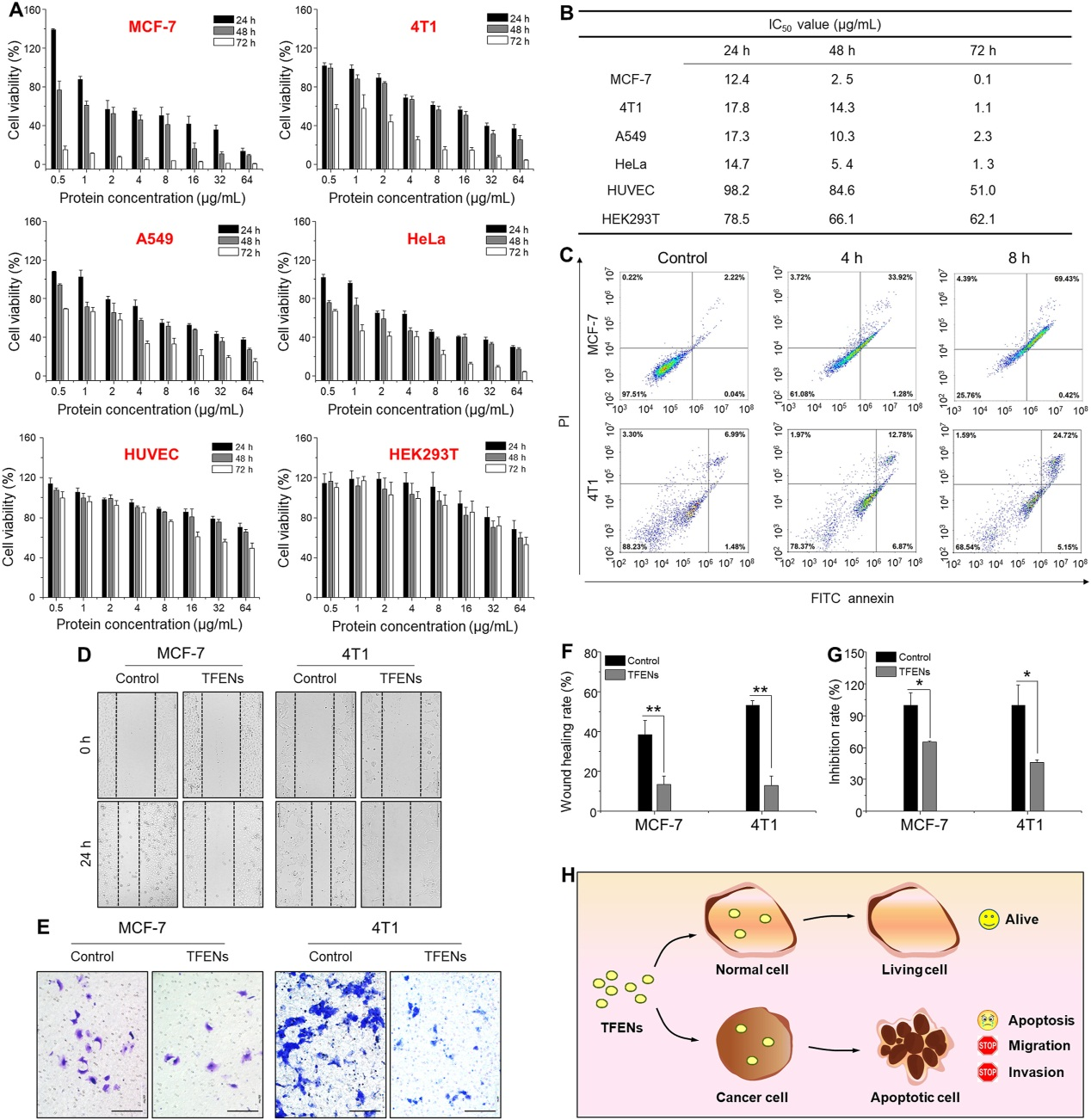
4. TFENs的抗癌机制
鉴于TFENs含有16种与细胞内氧化相关的蛋白质,同时含多酚和类黄酮,故对TFENs处理的细胞内氧化元素进行了评估。如下图结果,TFENs提高了细胞内总ROS、SA和NO的含量,说明TFENs会刺激乳腺癌细胞发生氧化应激,而氧化应激可引起线粒体损伤和周期停滞,接着作者评估了TFENs对这两个方面的影响。
TFENs处理的MCF7和4T1细胞中能检测到绿色荧光信号的J-单体,说明发生了线粒体损伤,同时cleaved caspase-3的表达水平明显升高,Bcl-2水平降低,说明TFENs促凋亡作用是基于caspase依赖性途径。周期分析显示,TFENs的处理将MCF7细胞阻滞在G2/M期,阻断4T1细胞中DNA复制过程,在分子水平体现在cyclin A和cyclin B水平的降低。
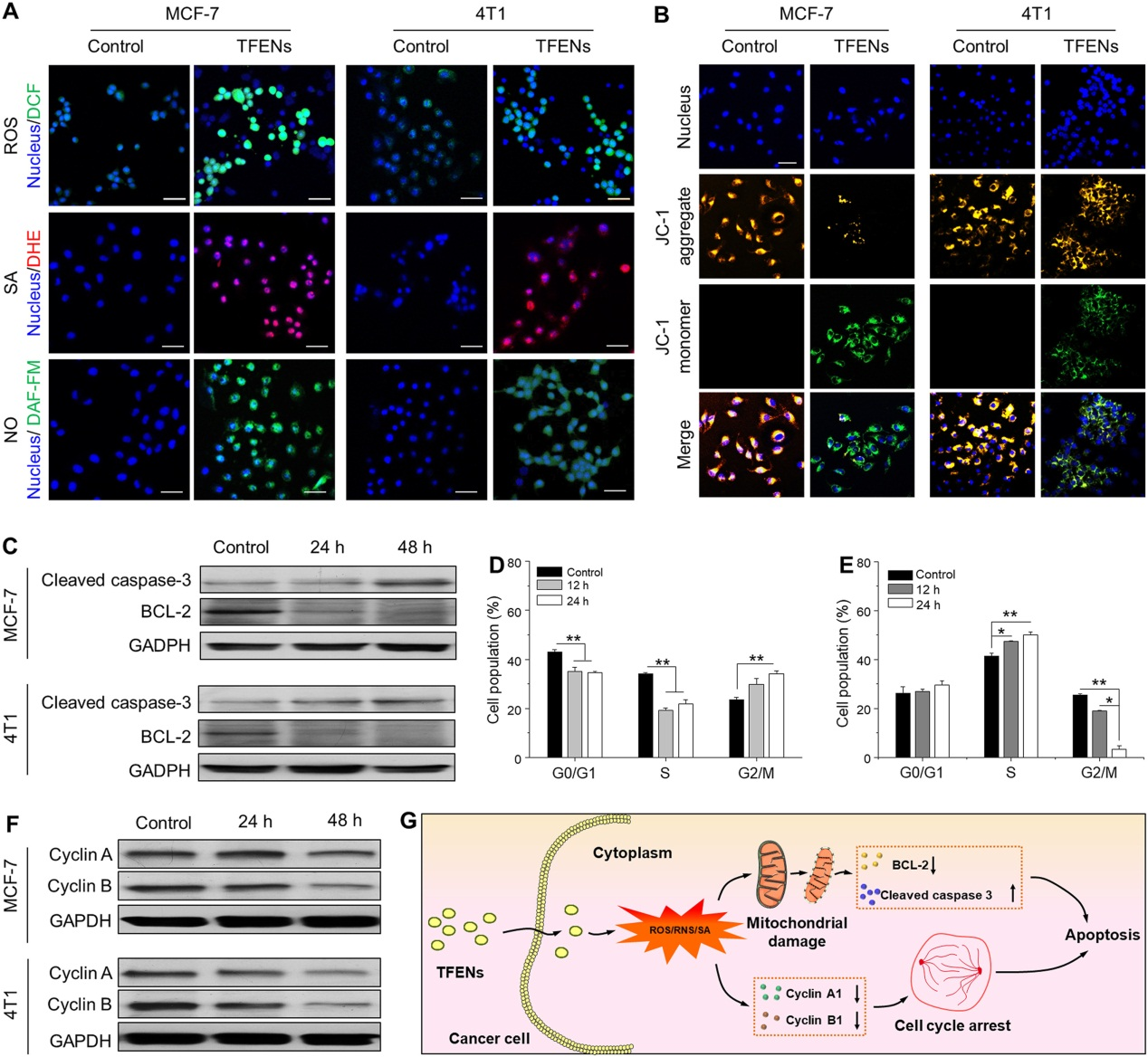 5. TFENs的体内抗癌作用
5. TFENs的体内抗癌作用
在异种移植瘤鼠模型的肿瘤组织中,DiR-TFENs在iv给药24h和口服48h达到最大蓄积量,但iv给药的蓄积量要明显多于口服。5大脏器中,肝肺是TFENs的主要积累部位,肺作为第二个优先积累部位,是转移性乳腺癌最常见的转移部位之一,暗示TFENs可能具有抑制乳腺癌肺转移到能力。相对于其他处理组,iv注射高浓度TFENs组荷瘤小鼠体重明显下降,说明高剂量TFENs治疗会导致严重的毒性,但TFENs的治疗能显著抑制肿瘤生长,两种给药方式的治疗效果无显著差异。HE显示TFENs明显减少了肿瘤细胞数量,细胞出现固缩和凋亡小体,TUNEL染色和Ki67阳性肿瘤细胞数量证明了高剂量TFENs的强肿瘤抑制能力。
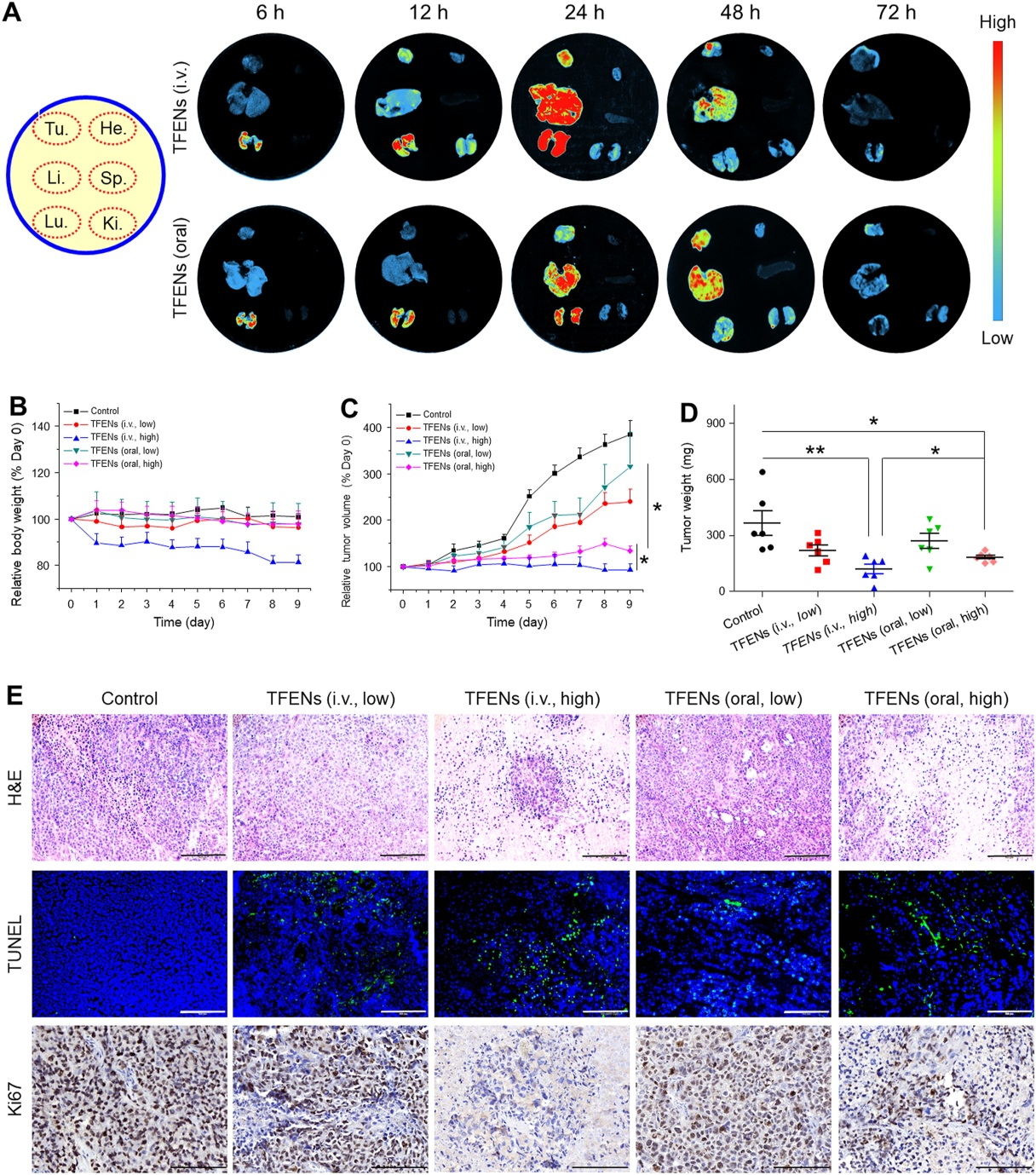
6. TFENs在体内抑制肺转移
对建立的肺转移小鼠模型进行iv给药12h和口服24h后,肺部TFENs能达到最大蓄积量,TFENs在肺部的积累为治疗转移性乳腺癌提供了先决条件。为研究TFENs的抗肺转移作用,静脉注射4T1细胞后,给予,所有治疗组肺部肿瘤结节数量均有所减少,且HE染色表明TFENs治疗组仅发现散发性病变。
口服TFENs后,分类操作单元OTU的辛普森指数明显增加,说明增加胃肠道微生物群的丰度和多样性增加了。通过PcoA分析发现,口服TFENs后能维持有益菌的丰度,减少有害菌的丰度;同时TFENs提高了肺转移鼠的存活率。
这些结果归因于TFENs可直接促进癌细胞增殖、凋亡和迁移,同时调节肠道菌群,降低微生物环境的不平衡导致癌症转移的风险。

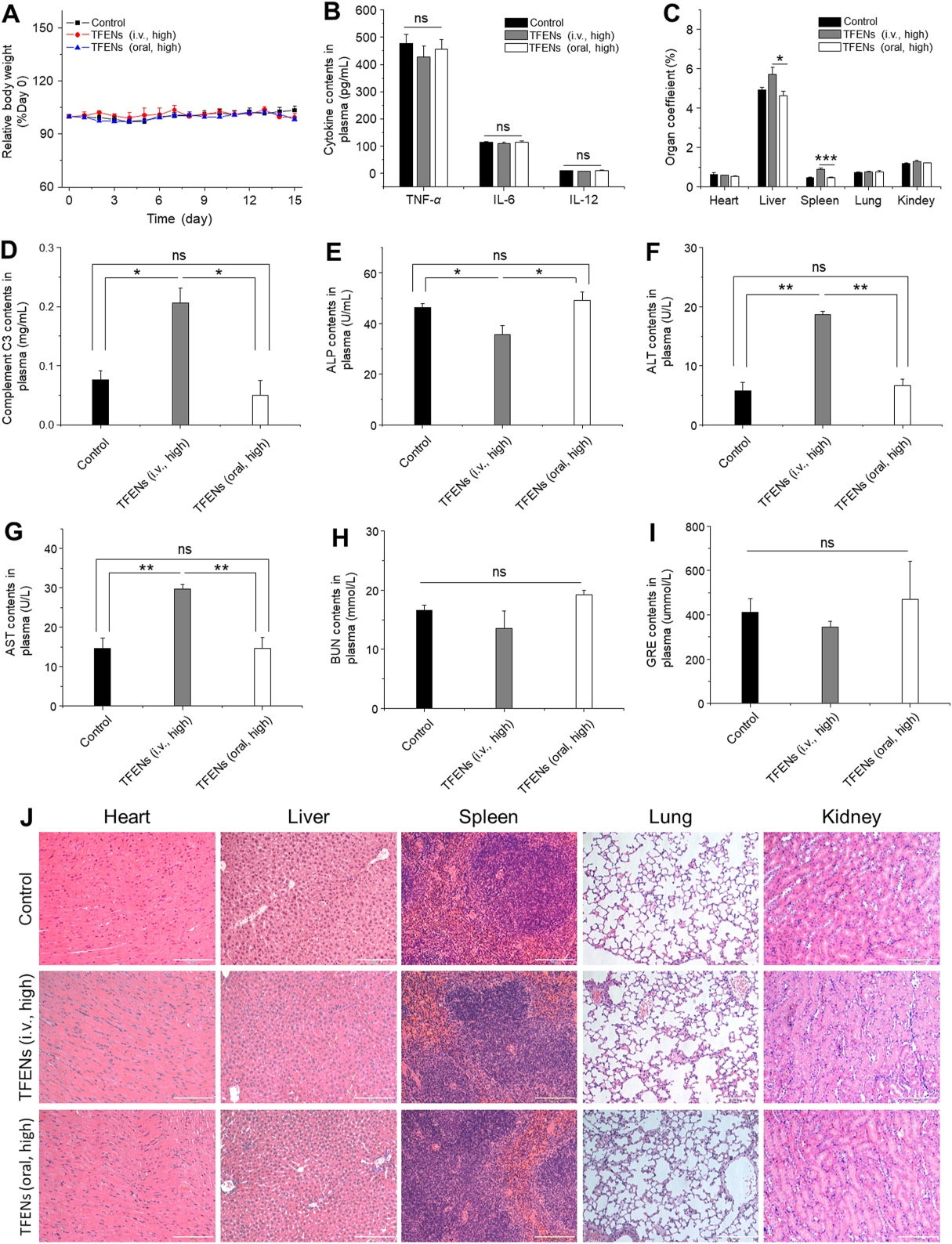
7. 生物安全性评估
从下图可知,TFENs处理后的小鼠体重和促炎因子无明显变化,但iv治疗组小鼠肝脾重量增加,C3水平升高,说明iv注射TFENs后激活了补体系统,这可能是TFENs表面成分被免疫系统视为抗原引起免疫反应,口服后可能在GIT中降解了。Iv注射TFENs不会引起溶血现象,但增加了血液中ALT和AST的水平,揭示了iv注射后TFENs具有肝毒性。而口服TFENs后小鼠未引起免疫反应、诱导肝肾毒性和改变血象,说明口服TFENs对生物体相对更安全。
总结:
本研究表明TFENs含有多酚、功能蛋白和脂质,这些生物活性成分的综合作用在癌细胞中诱导产生ROS,导致线粒体损伤、周期停滞和细胞凋亡;在体内TFENs优先在乳腺癌组织和肺转移部位积累,抑制肿瘤生长及肺转移,同时调节小鼠胃肠道菌群结构;但iv给药会刺激免疫系统,诱发肝肾毒性,口服相对安全。该研究有助于开发一种具有较大临床转化潜力的“绿色”纳米疗法,用于治疗转移性乳腺癌。
今天为大家分享一篇由西南大学的肖波和重庆大学的王晨辉合作发表在Acta Pharm Sin B.(IF=14.9)的文章,首次分离出茶花外泌体样纳米囊泡TFENs,如下图所示,TFENs通过携带多酚、类黄酮、功能性蛋白和脂质,在体内外抑制转移性乳腺癌的发展。
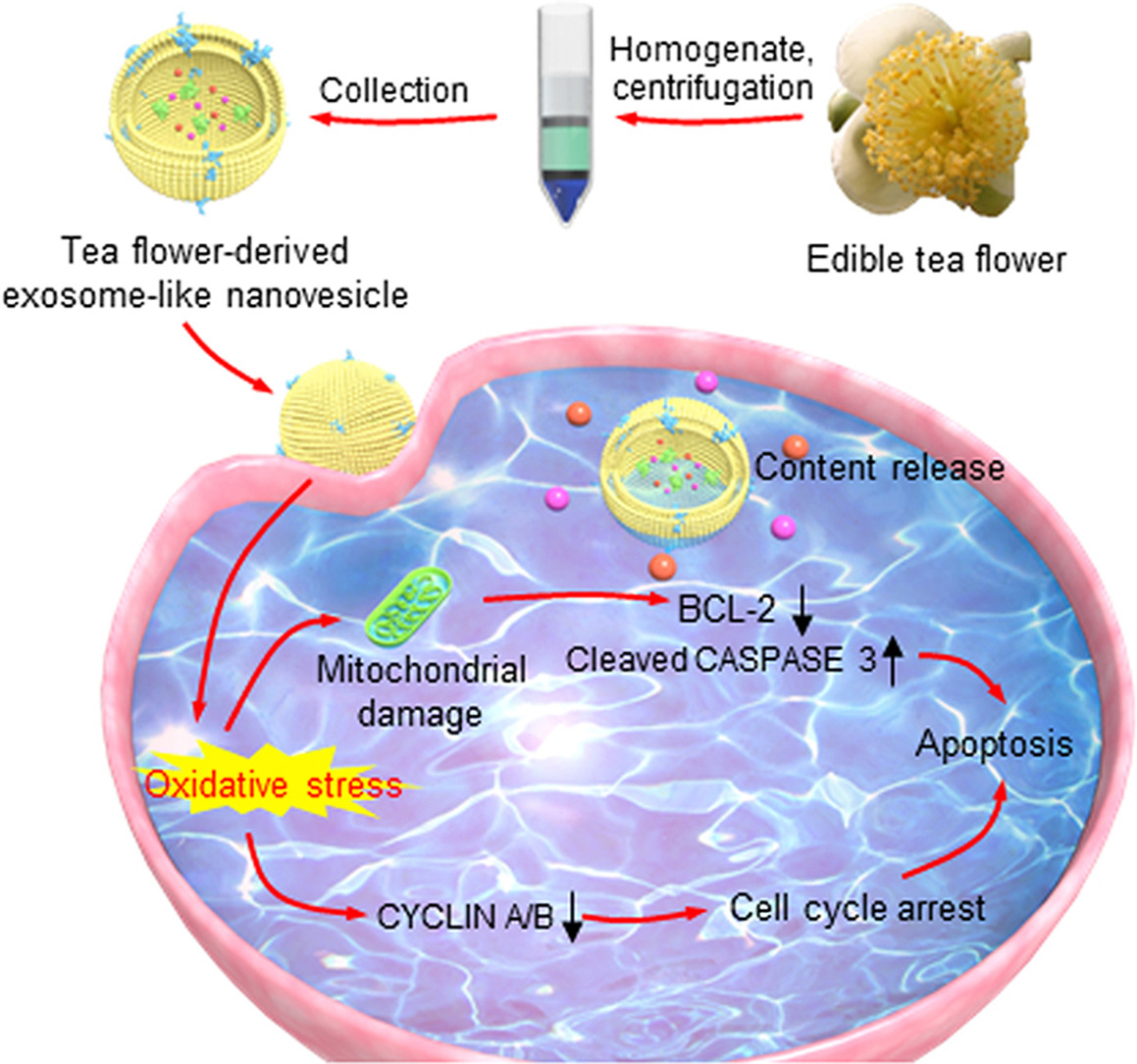


技术路线:


1. TFENs的物化特性
差速离心法结合蔗糖密度梯度超速离心从茶花中分离纯化得到具有负电荷的TFENs,粒径约为130nm。在胃、小肠、结肠模拟液和DMEM中均能稳定存在,意味着静脉注射iv和口服后TFENs在胃肠道GIT和血液中能稳定存在。
脂质组学、蛋白质组学和HPLC/MS分析发现,PC、TG和PE是TFENs的主要脂质成分;其蛋白质成分主要与细胞代谢和增殖有关,其中16种蛋白质具有氧化相关功能;还含有抗癌多酚和类黄酮。这些天然活性物质的存在暗示了TFENs具有治疗癌症的潜能。

MCF7和4T1细胞对Dio-TFENs的摄取量随时间的延长而增加,且被摄取的TFENs主要分布在细胞核周围。进一步体内实验表明,口服Dio-TFENs后,在空肠、回肠和结肠的粘膜中均可以观察到TFENs的存在,说明TFENs可以有效穿透肠上皮层,从而进入血液循环系统。

3. TFENs的体外抗增殖、促凋亡和抑制迁移侵袭作用
MTT结果显示TFENs以剂量和时间依赖的方式抑制MCF7、4T1、A549和Hela细胞增殖,且对MCF7和4T1作用更显著,而对正常细胞表现出相对良好的生物相容性。FACS分析结果显示TFENs具有促细胞凋亡作用,同时划痕和Transwell呈现出TFENs具有很强的抑制乳腺癌细胞转移能力。

4. TFENs的抗癌机制
鉴于TFENs含有16种与细胞内氧化相关的蛋白质,同时含多酚和类黄酮,故对TFENs处理的细胞内氧化元素进行了评估。如下图结果,TFENs提高了细胞内总ROS、SA和NO的含量,说明TFENs会刺激乳腺癌细胞发生氧化应激,而氧化应激可引起线粒体损伤和周期停滞,接着作者评估了TFENs对这两个方面的影响。
TFENs处理的MCF7和4T1细胞中能检测到绿色荧光信号的J-单体,说明发生了线粒体损伤,同时cleaved caspase-3的表达水平明显升高,Bcl-2水平降低,说明TFENs促凋亡作用是基于caspase依赖性途径。周期分析显示,TFENs的处理将MCF7细胞阻滞在G2/M期,阻断4T1细胞中DNA复制过程,在分子水平体现在cyclin A和cyclin B水平的降低。

在异种移植瘤鼠模型的肿瘤组织中,DiR-TFENs在iv给药24h和口服48h达到最大蓄积量,但iv给药的蓄积量要明显多于口服。5大脏器中,肝肺是TFENs的主要积累部位,肺作为第二个优先积累部位,是转移性乳腺癌最常见的转移部位之一,暗示TFENs可能具有抑制乳腺癌肺转移到能力。相对于其他处理组,iv注射高浓度TFENs组荷瘤小鼠体重明显下降,说明高剂量TFENs治疗会导致严重的毒性,但TFENs的治疗能显著抑制肿瘤生长,两种给药方式的治疗效果无显著差异。HE显示TFENs明显减少了肿瘤细胞数量,细胞出现固缩和凋亡小体,TUNEL染色和Ki67阳性肿瘤细胞数量证明了高剂量TFENs的强肿瘤抑制能力。

6. TFENs在体内抑制肺转移
对建立的肺转移小鼠模型进行iv给药12h和口服24h后,肺部TFENs能达到最大蓄积量,TFENs在肺部的积累为治疗转移性乳腺癌提供了先决条件。为研究TFENs的抗肺转移作用,静脉注射4T1细胞后,给予,所有治疗组肺部肿瘤结节数量均有所减少,且HE染色表明TFENs治疗组仅发现散发性病变。
口服TFENs后,分类操作单元OTU的辛普森指数明显增加,说明增加胃肠道微生物群的丰度和多样性增加了。通过PcoA分析发现,口服TFENs后能维持有益菌的丰度,减少有害菌的丰度;同时TFENs提高了肺转移鼠的存活率。
这些结果归因于TFENs可直接促进癌细胞增殖、凋亡和迁移,同时调节肠道菌群,降低微生物环境的不平衡导致癌症转移的风险。

7. 生物安全性评估
从下图可知,TFENs处理后的小鼠体重和促炎因子无明显变化,但iv治疗组小鼠肝脾重量增加,C3水平升高,说明iv注射TFENs后激活了补体系统,这可能是TFENs表面成分被免疫系统视为抗原引起免疫反应,口服后可能在GIT中降解了。Iv注射TFENs不会引起溶血现象,但增加了血液中ALT和AST的水平,揭示了iv注射后TFENs具有肝毒性。而口服TFENs后小鼠未引起免疫反应、诱导肝肾毒性和改变血象,说明口服TFENs对生物体相对更安全。

总结:
本研究表明TFENs含有多酚、功能蛋白和脂质,这些生物活性成分的综合作用在癌细胞中诱导产生ROS,导致线粒体损伤、周期停滞和细胞凋亡;在体内TFENs优先在乳腺癌组织和肺转移部位积累,抑制肿瘤生长及肺转移,同时调节小鼠胃肠道菌群结构;但iv给药会刺激免疫系统,诱发肝肾毒性,口服相对安全。该研究有助于开发一种具有较大临床转化潜力的“绿色”纳米疗法,用于治疗转移性乳腺癌。






