研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
缺氧+自噬+外泌体+肿瘤细胞侵袭=1区高分文章,这个思路你值得拥有!
3932 人阅读发布时间:2022-08-15 11:32
癌症相关成纤维细胞 CAF,是肿瘤微环境(TME)中最丰富的基质细胞,参与肿瘤的发生、发展和转移。缺氧是实体瘤 TME的标志性特征,有助于肿瘤侵袭,但很少有报道研究缺氧 CAF 对肿瘤进展的影响。共济失调毛细血管扩张症突变基因 ATM 的核功能是协调细胞周期检查点的激活,以维持基因组完整性和稳定性。细胞质内氧化 ATM 可通过充当氧化还原传感器参与调节氧化应激和细胞代谢,迄今为止,氧化 ATM 在肿瘤中的作用及分子机制尚不清晰。
重庆医科大学柳满然教授团队在 Journal of Extracellular Vesicles(IF:17.337) 杂志上发表一篇文章,从多角度揭示了缺氧条件下 CAF 通过激活氧化型 ATM,调控细胞自噬与外泌体 EV 释放,促进肿瘤侵袭。

文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8452512 /
技术路线:
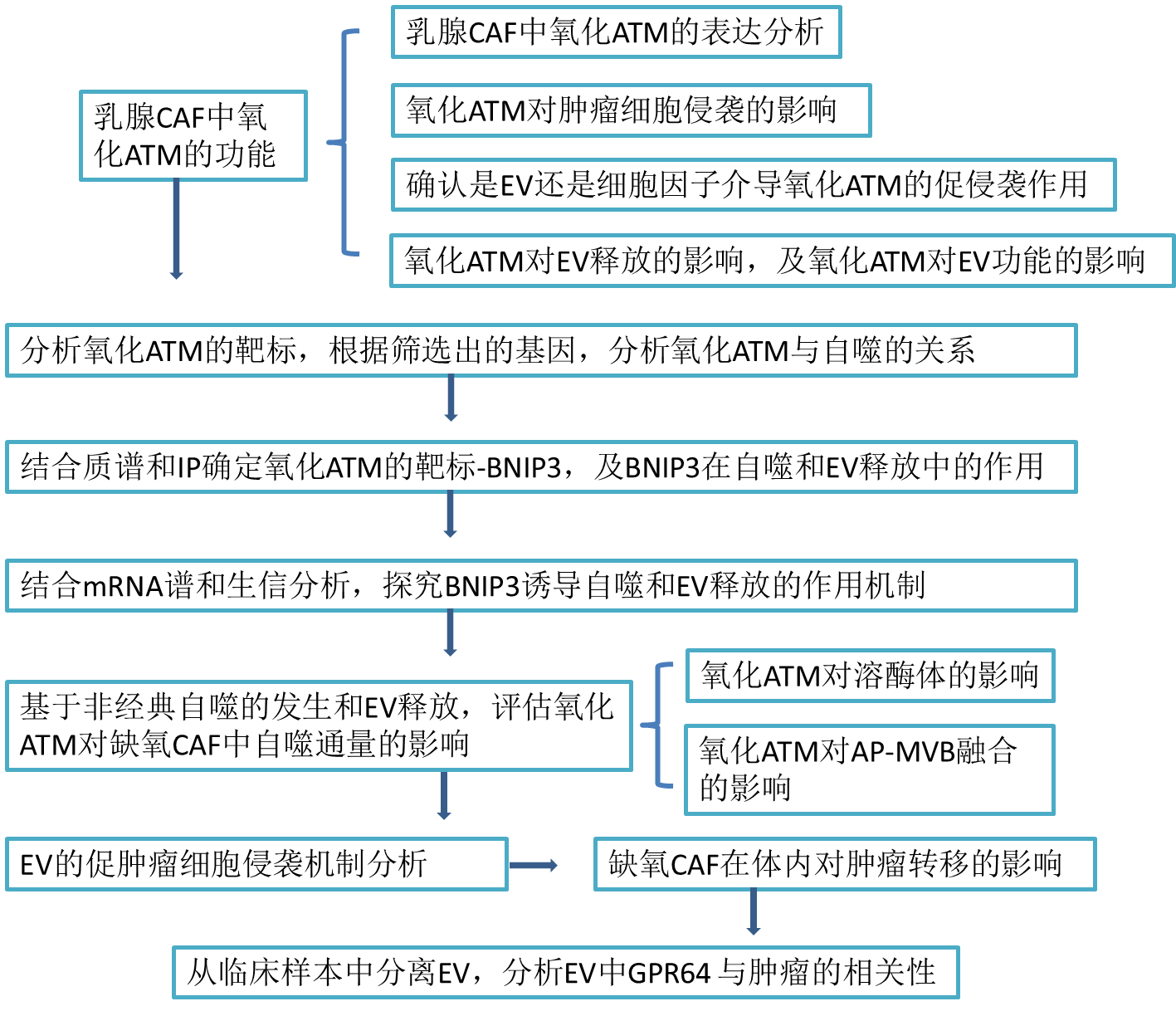
实验结果:
1. 乳腺 CAF 中氧化 ATM 通过增强 EV 释放促进乳腺癌细胞侵袭
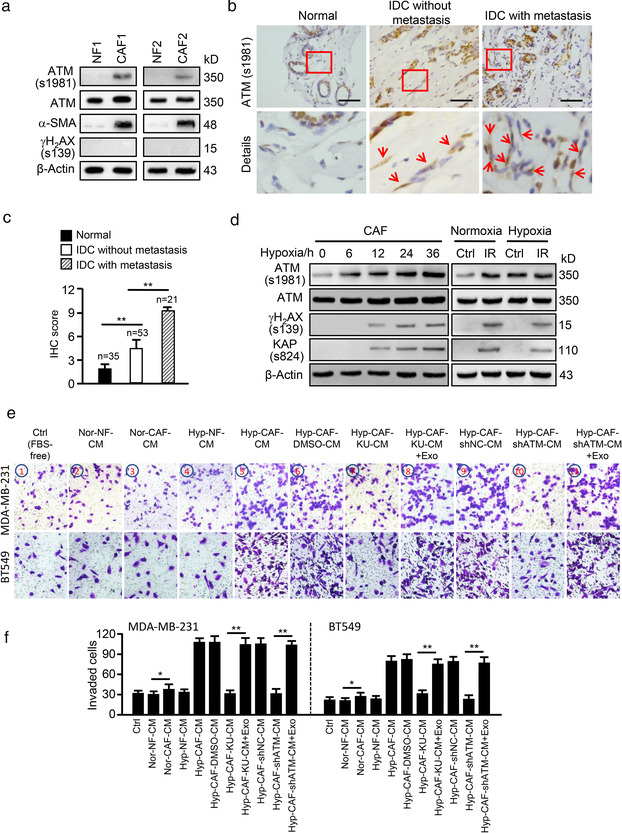
从未经化疗治疗的乳腺癌患者中分离 NF 和 CAF,WB 及 IHC 结果显示 CAF 中 ATM 的表达及其活化形式 (s1981 位磷酸化) 均高于 NF,且在转移性乳腺癌中表达高于非转移性乳腺癌。CAF 缺氧处理后可以时间依赖性方式增加氧化 ATM 水平,且在缺氧 6 hr 后即可产生,而 DNA 双链断裂标志物 rH2AX 和 KAP 的磷酸化在缺氧 12 - 36 hr 会增加,以离子辐照为对照,进一步证实缺氧诱导激活 CAF 中不依赖 DNA 损伤的氧化 ATM。
利用共培养系统分析,发现与其他组相比,缺氧 CAF 的培养液 CM 能显著增加乳腺癌细胞侵袭,但可被 ATM 特异性抑制剂 KU60019 或 ATM shRNA 减弱。意味着氧化 ATM 是 CAF-CM 促进肿瘤细胞侵袭所必需的。
分离 CAF-EV 和无 EV 的 CM,分别与处理肿瘤细胞,发现由缺氧 CAF-EV 诱导细胞侵袭能力强于其他组 EV,且效果比可溶性因子更突出。若用 GW4869 预处理细胞,则显著降低缺氧 CAF 的 CM 对细胞侵袭的促进作用。用 KU60019或ATM shRNA证明氧化 ATM 可通过 EV 释放促进肿瘤细胞侵袭。
基于 KU60019或ATM shRNA减少了 EV 的释放量,利用拯救实验,将缺氧 CAF-EV 加入到共培养系统中,能逆转用KU60019或ATM shRNA处理的CAF-CM 所抑制的细胞侵袭。表明氧化 ATM 促进了缺氧 CAF 释放 EV,从而增强乳腺癌细胞的侵袭。
2. 氧化 ATM 促进缺氧 CAF 中的自噬
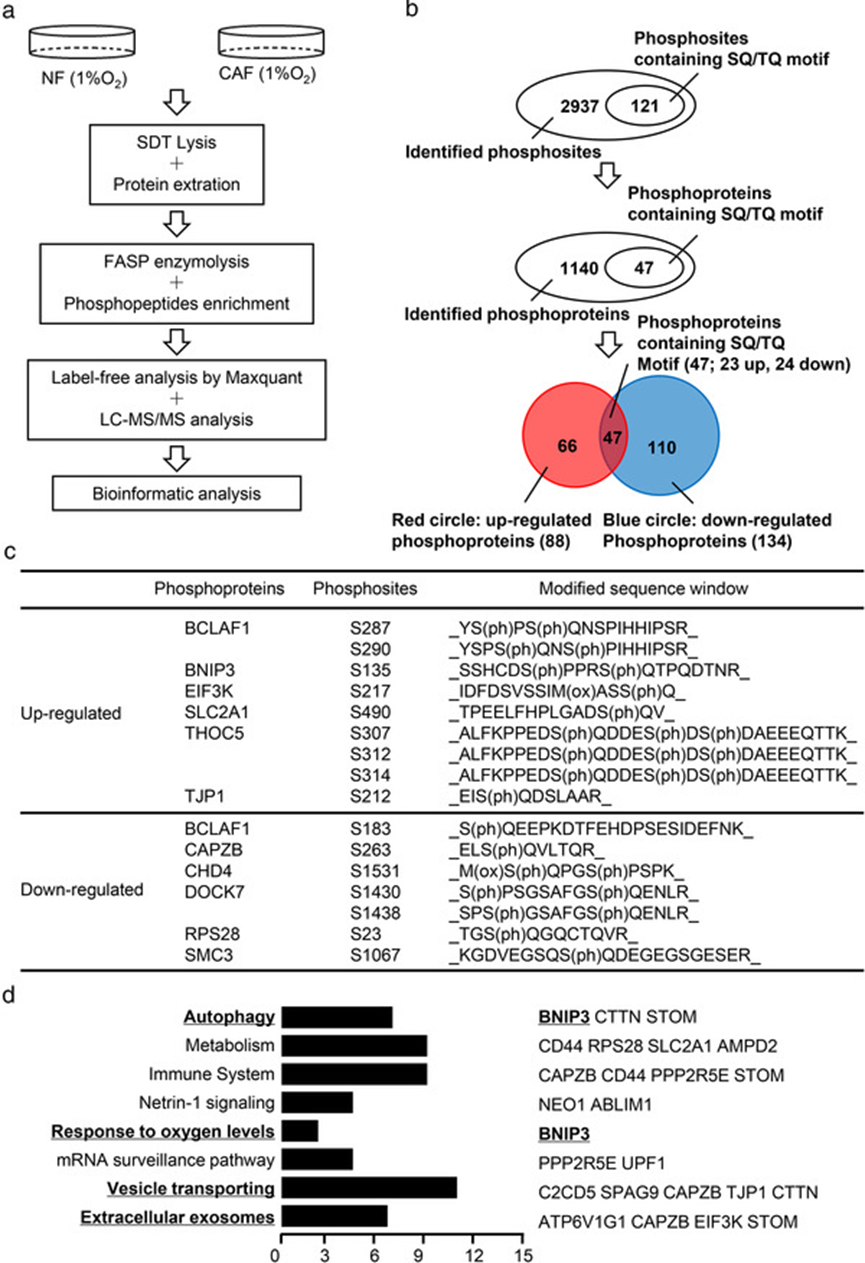
LC-MS/MS 对缺氧 NF 和 CAF 进行磷酸化蛋白质组学分析,结合生物信息学分析,发现低氧 CAF 中磷酸化蛋白涉及到多种生物过程,如自噬、对氧气水平反应、囊泡运输和 EV。
为确定氧化 ATM 与自噬的关系,通过 WB 分析,发现与常氧 CAF 相比,LC3BII 在缺氧 CAF 中高表达,而 p62 水平适度下降,但用KU60019或ATM shRNA处理后,LC3BII 水平降低,p62 适度增加,表明缺氧 CAF 中存在非典型自噬,有部分自噬体未与溶酶体融合。同样在缺氧 CAF 中观察到更多的自噬体,但受 KU60019 的下调。表明氧化 ATM 促进了 CAF 中自噬体积累。
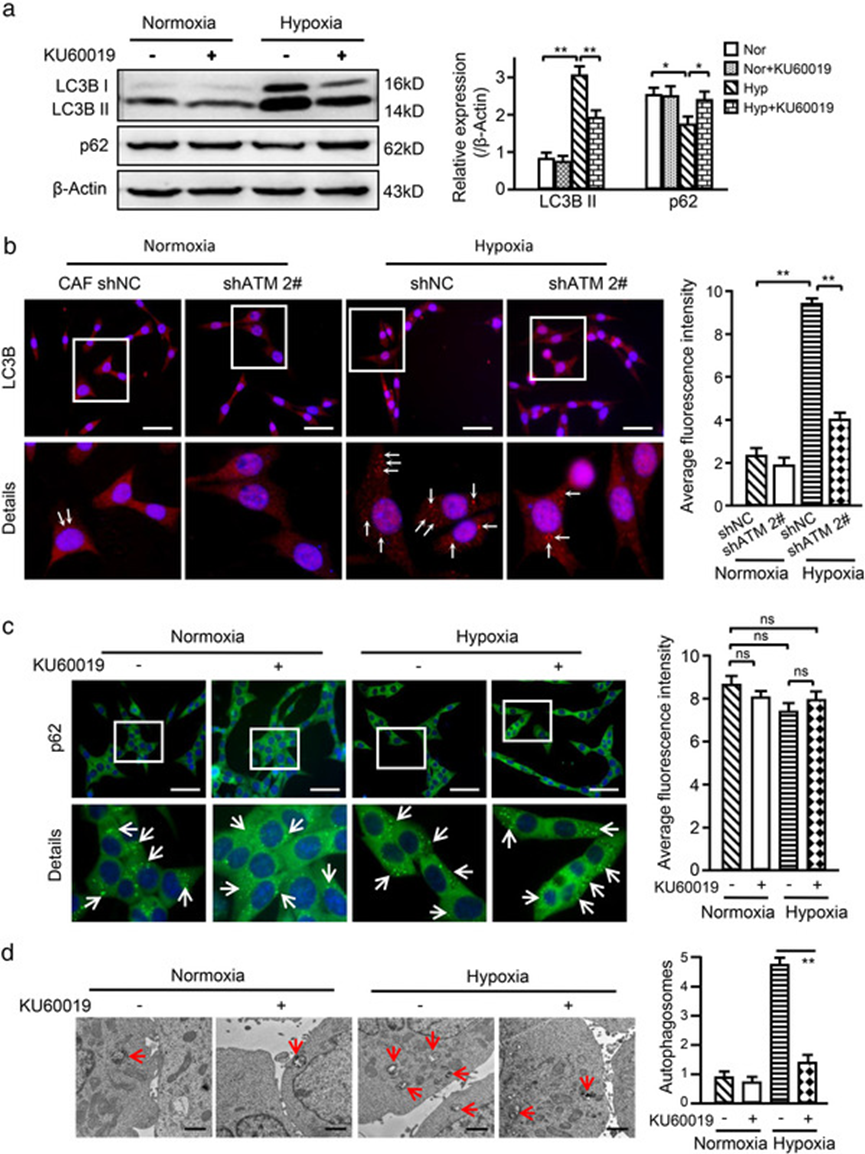
3. 氧化 ATM 在丝氨酸 135 位磷酸化 BNIP3 以诱导 CAF 的自噬和 EV 释放
通过蛋白质组学筛选出 BNIP3 参与自噬信号传导并对氧水平反应,缺氧能提高CAF中p-BNIP3的水平,经质谱和 COIP 证实 BNIP3 的 s135 位可被 ATM 磷酸化,抑制 ATM 后 p-BNIP3 会减少。构建低磷酸化 BNIP3 突变体和高磷酸化 BNIP3 突变体质粒,转染 HEK293T 细胞,利用 ATP 消耗和 ADP 形成的体外激酶活性测定分析,支持氧化 ATM 在缺氧 CAF 中诱导 BNIP3 s135 位磷酸化。
低氧 CAF 中敲低 BNIP3 会降低 LC3BII 水平,略增加 p62。高磷酸化或低磷酸化 BNIP3 突变体质粒转染 BNIP3 沉默的 CAF 进一步证明 s135 位点磷酸化的 BNIP3 可诱导自噬。内源性 BNIP3 敲低或低磷酸化 BNIP3 突变体转染到 BNIP3 敲低的缺氧 CAF 中显著减少 EV 的量,而转染高磷酸化 BNIP3 突变体能挽救 CAF 释放 EV 的能力。敲低 BNIP3 或将低磷酸化 BNIP3 突变体转染到 BNIP3 沉默的缺氧 CAF 中,消除了缺氧 CAF-EV 对乳腺癌细胞的促侵袭能力。表明氧化 ATM 在 s135 位磷酸化 BNIP3 可诱导缺氧 CAF 自噬和 EV 释放。
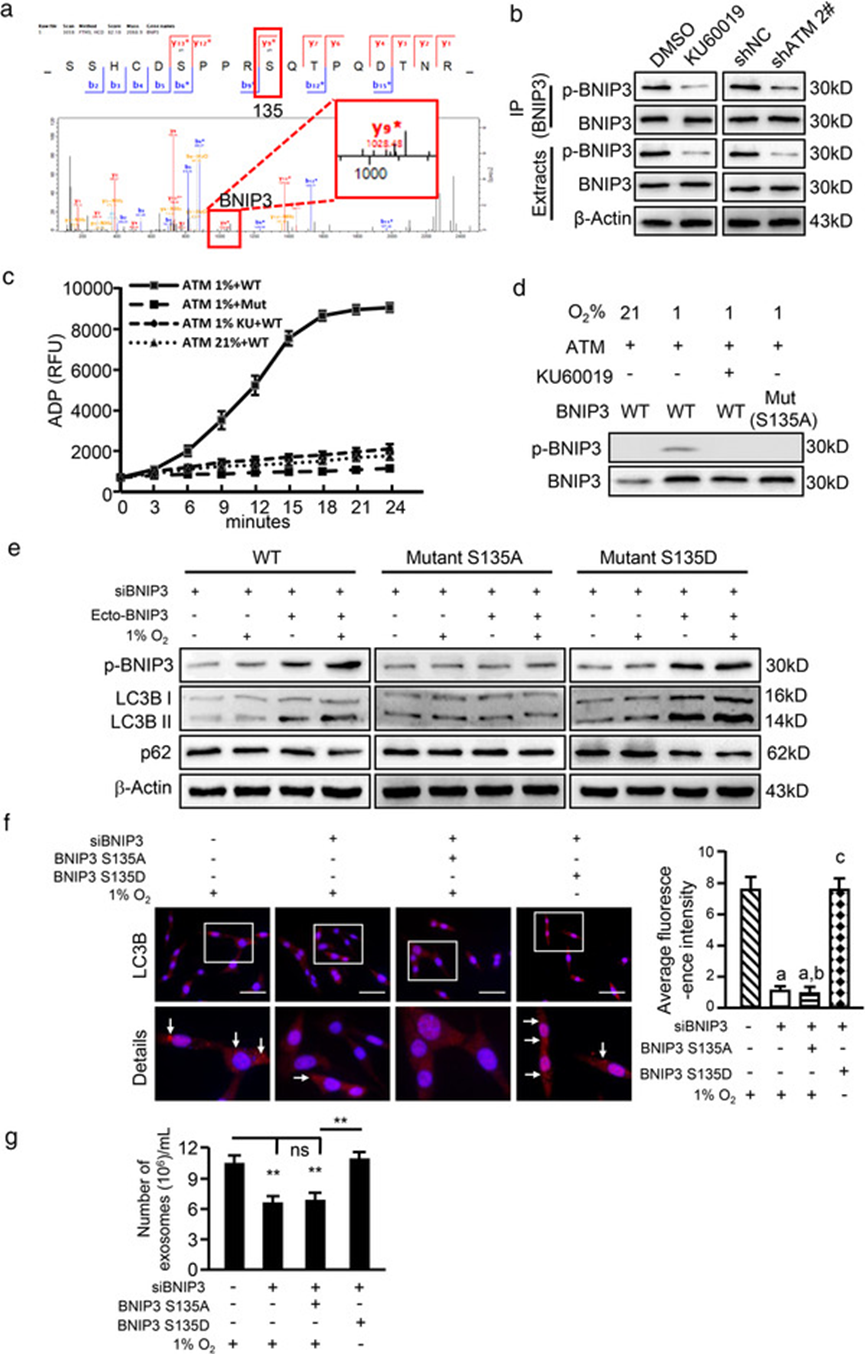
4. 磷酸化 BNIP3 上调 Atg5 和 Atg16L 以上调自噬和 EV 释放
原发性 CAF 和 NF 的 mRNA 数据分析,发现一组与自噬和 EV 形成相关的基因 Atg5、Atg7 和 Atg16L 在缺氧 CAF 中上调。QPCR 验证 Atg5和Atg16L在缺氧 CAF 中上调,敲低 ATM 可下调缺氧条件下 Atg5和Atg16L的表达。转染 BNIP3 或高磷酸化 BNIP3 突变体,可防止缺氧 CAF 中内源性 BNIP3 敲低引起的 Atg5和Atg16L减少。表明氧化 ATM 通过 p-BNIP3 在缺氧 CAF 中增强 Atg5和Atg16L表达。
生信分析结合双荧光素酶报告系统检测,发现 FOXO3 是 Atg5和Atg16L表达的潜在转录因子。在缺氧 CAF 中敲低 Atg5和Atg16L后并不影响 LC3BII 和 p62 的水平,但是会抑制 EV 释放和癌细胞侵袭,说明磷酸化 BNIP3 正向调节 Atg5和Atg16L的表达,参与 CAF 的自噬和 EV 释放,从而促进乳腺癌细胞的侵袭。
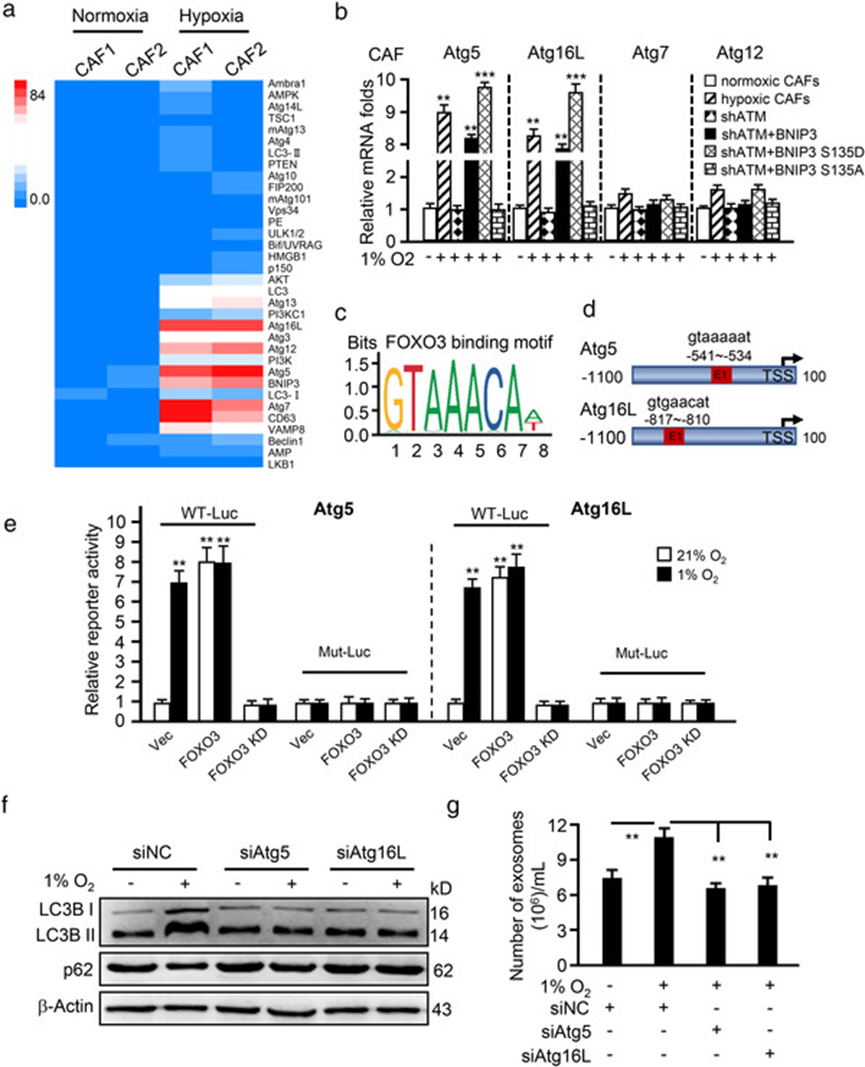
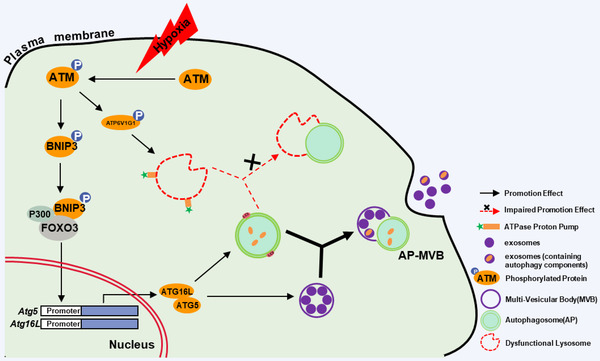
5. 氧化 ATM 损坏溶酶体酸性
鉴于氧化 ATM 促进了 CAF 中非典型自噬和 EV 释放,作者接着评估自噬通量的变化是否促进了自噬体的积累。用巴弗洛霉素 A1 (BafA1) 处理缺氧 CAF 可以增加 LC3BII,而 KU60019 减弱了 BafA1 诱导的 LC3BII 增加。在 BafA1 或 BafA1 和 KU60019联合处理下p62保持不变,表明缺氧CAF中存在由氧化ATM引起的功能失调的溶酶体。经检测发现缺氧CAF的溶酶体pH值有所增加,LAMP1和ACP2水平较低,KU60019的存在会抑制pH水平升高,并增强LAMP1和ACP2的表达。
ATP6V1 G1负责维持溶酶体酸化,且是ATM的靶蛋白,在本研究中通过IP证明ATP6V1 G1的磷酸化水平可被KU60019降低,相应地溶酶体pH值升高。说明氧化ATM通过磷酸化ATP6V1 G1 破坏溶酶体酸化,损坏其功能。
6. 氧化 ATM 促进缺氧 CAF 中自噬体 AP 和多泡体 MVB 融合
为验证EV释放时由氧化ATM诱导的溶酶体功能障碍引起的,作者通过TEM观察,发现缺氧CAF中观察到更多自噬囊泡和含有蛋白质的MVB或腔内囊泡。在细胞膜附近AP和MVB发生融合。
WB在缺氧CAF-EV中检测到高水平的LC3B, KU60019的处理会减降低LC3B水平,而BafA1进一步增加CAF-EV的LC3B水平,但均不影响EV的粒径,说明缺氧CAF-EV与AP和MVB的融合密切相关,有助于EV从缺氧CAF中释放。
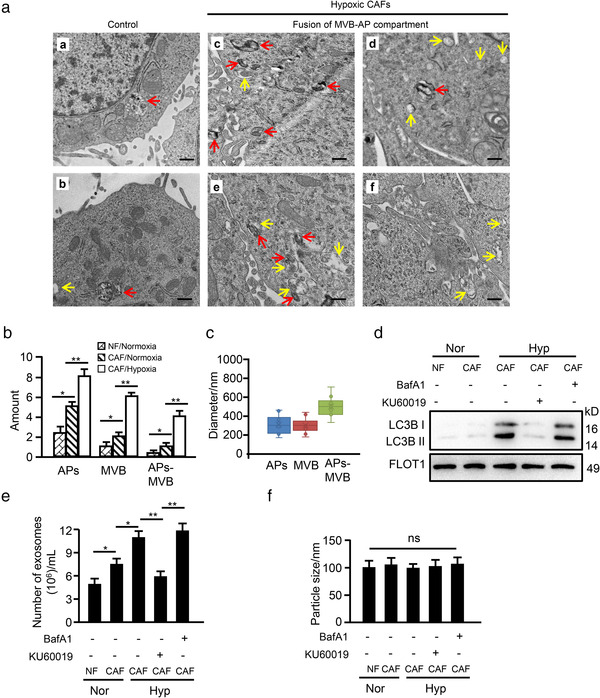
7. 来自缺氧 CAF 的 EV-GPR64刺激肿瘤细胞中非经典NF‐κB信号传导以促进细胞侵袭
ExoCarta和GEO数据库与CAF mRNA谱合并分析,筛选出12个与肿瘤侵袭转移有关的基因,结合QPCR,发现粘附G蛋白耦联受体G2(GPR64)在缺氧 CAF 中表达最高,且在其EV表达更高。将CAF中的GPR64敲低对EV的释放和粒径没有影响,但显著减轻了缺氧CAF的EV对乳腺癌细胞侵袭的促进作用;同时KU60019的使用或Atg5 -siRNA的存在下调了缺氧CAF-EV中GPR64水平,ATM敲低的CAF中转染高磷酸化水平BNIP3突变质粒能恢复EV中GPR64的水平。表明缺氧CAF中氧化ATM诱导的自噬丰富了EV中的GPR64,有助于乳腺癌细胞的侵袭。
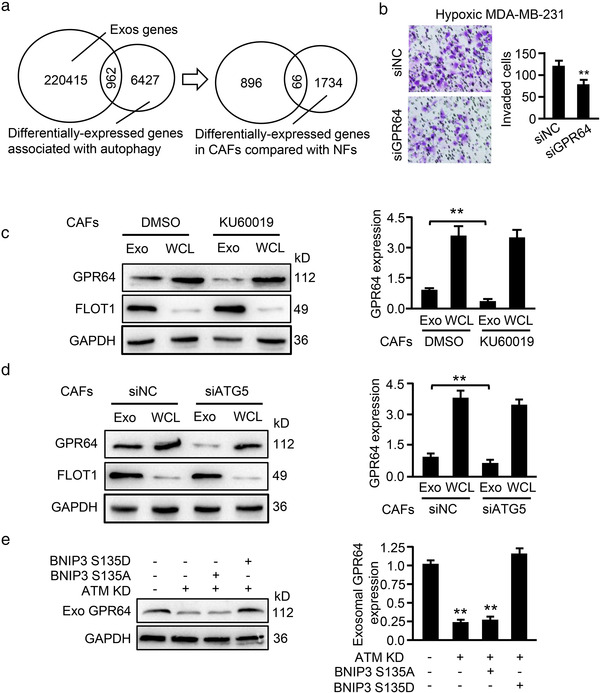
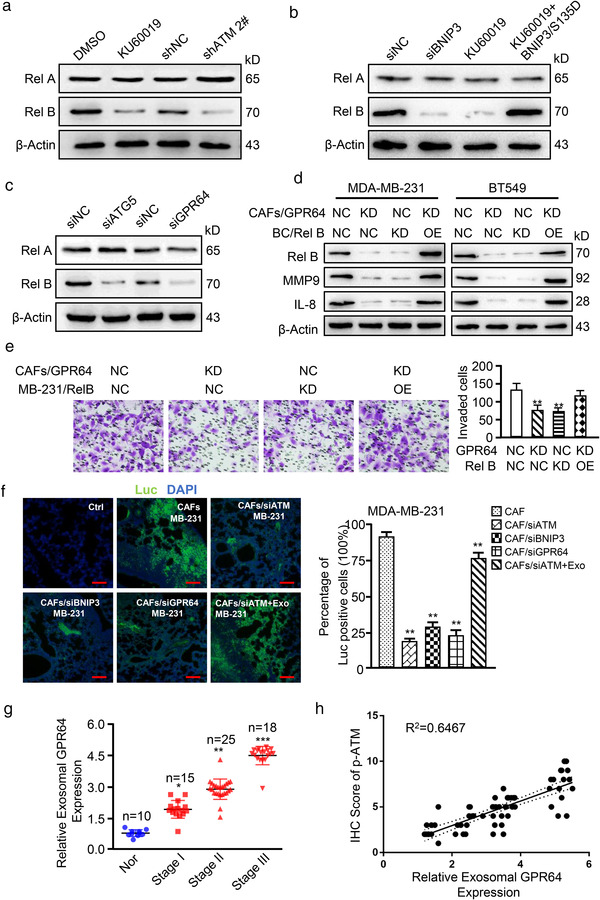
鉴于NF‐κB信号通路为GPR64的下游,作者通过WB分析发现KU60019处理或敲低ATM的缺氧CAF-EV,均会导致癌细胞中与非经典NF‐κB信号通路相关的RelB水平显著下降,来源于KU60019处理或BNIP3敲低的缺氧CAF-EV 降低癌细胞中RelB水平,高磷酸化BNIP3突变体的存在能挽救KU60019导致的RelB的降低。低氧CAF中敲低Atg5或GPR64均能下调癌细胞中RelB的表达。敲低CAF中GPR64或癌细胞中RelB,显著减低了癌细胞中非经典NF‐κB信号传导调节的分泌因子MMP9和IL- 8的水平,进而导致细胞侵袭能力降低。
将亲本CAF和工程化CAF(si-ATM、si-BNIP3或si-GPR64)与MDA-MB- 231混合注射到裸鼠体内,发现工程化CAF组小鼠肺转移较少。同时向工程化CAF组小鼠体内给予含GPR64的缺氧CAF-EV能部分挽救肿瘤转移。
通过对临床血浆样本来源的EV进行分析,发现乳腺癌患者的EV中GPR64含量更高,与肿瘤进展、分级和TNM相关。表明乳腺癌中的EV- GPR64与不良预后 有关。
讨论:
本研究揭示了缺氧诱导CAF中不依赖DSB的ATM激活,氧化ATM通过磷酸化BNIP3来促进AP积累,磷酸化ATP6V1 G1来诱导溶酶体功能障碍,促进AP和MVB融合,从而促进富含GPR64的EV释放,激活癌细胞中非经典NF‐κB信号通路以增强其侵袭和转移。但氧化ATM诱导的自噬如何促进GPR64在EV中富集需进一步探究。总体而言,该研究为乳腺癌细胞侵袭和转移提供了一种新的TME相关调控机制。






