研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Theranostics】11分+,脂肪MSC外泌体治疗急性肺损伤的机制研究
1002 人阅读发布时间:2022-08-17 15:51
急性肺损伤(ALI)是由多种致病因素引起的临床综合征,巨噬细胞异常激活和线粒体解离与其发病机制相关,LPS等感染因子已被证实可诱发ALI。MSC-EV因具有低免疫原性、无致瘤性、安全性高和伦理问题少的优势,使其成为治疗炎症性疾病的一种无细胞疗法,但在治疗ALI中的作用及其机制尚待明确。
南京中医药大学的史丽云课题组探究了AdMSC-EV的线粒体捐献是否改善巨噬细胞线粒体功能,保护内毒素诱导的小鼠ALI。将研究成果发表在Theranostics(IF:11.600)杂志上。

文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8965475/

实验结果:
实验结果:
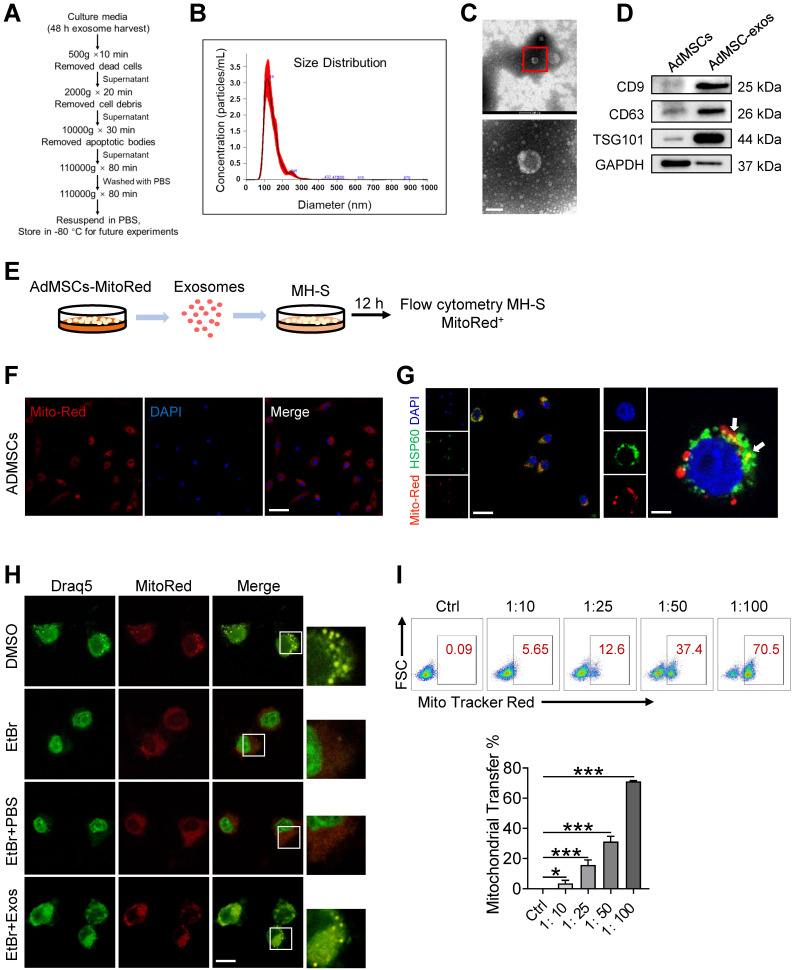
1. AdMSC-EV的分离、纯化和表征
对从人脂肪组织中分离得到的AdMSC细胞进行鉴定,传代培养3-8代后,通过梯度离心从其培养上清液中分离EV。经鉴定,获得的EV具有典型的双凹形态,粒径范围为50-150nm,CD9、CD63和TSG101呈阳性。
2. AdMSC-EV将线粒体成分转移到巨噬细胞
从线粒体探针Mito Tracker Red标记的AdMSC细胞中分离EV,再与鼠肺泡巨噬细胞MH-S共孵育,在MH-S细胞线粒体中可见Mito-Red。为排除是残留染料导致的,先用EtBr耗尽MH-S细胞中mDNA,再与AdMSC-EV共孵育,仍可检测到mDNA的存在。用氯丙嗪或木黄酮抑制内吞作用后,则抑制了AdMSC-EV的内化。表明AdMSC-EV携带mDNA通过内吞作用被靶细胞摄取。
根据AdMSC-EV的蛋白质浓度与颗粒数,按1x107个EV的蛋白质浓度为10ug/ml,将MH-S:EV以1:10、1:25、1:50和1:100的比例进行共孵育,FACS分析发现MH-S细胞中Mito-Red阳性率随EV量的增加而增加。表明AdMSC-EV可将线粒体成分转移到肺泡巨噬细胞中,且与细胞内线粒体共定位。
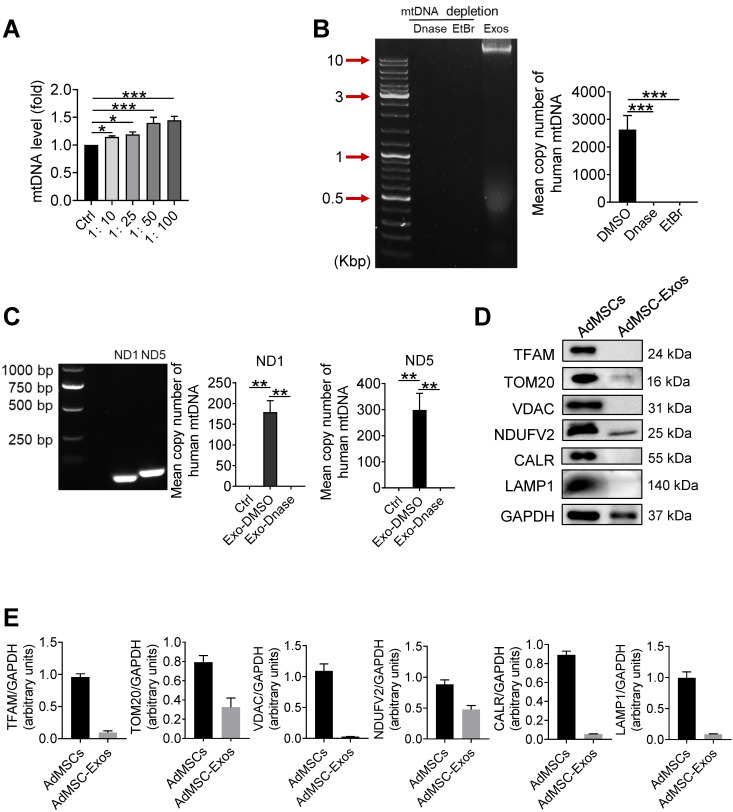
3. 人线粒体DNA(mDNA)通过AdMSC-EV转移并改善巨噬细胞线粒体适应性
为确认哪些线粒体成分被AdMSC-EV转移,首先检测了MH-S细胞的mDNA,发现在AdMSC-EV处理后,mDNA水平增加。同时,通过琼脂糖电泳在AdMSC-EV中检测到mDNA(16.5kb);若用EtBr去除AdMSC中的mDNA,则在AdMSC-EV中检测不到mDNA。使用人类特异性mDNA引物,可在AdMSC-EV中检测到线粒体基因ND1和ND5的表达,MH-S与AdMSC-EV共孵育后ND1和ND5基因表达增加。
mDNA作为一种损伤相关分子模式,能识别巨噬细胞中的AIM或cGAS受体,但与AdMSC-EV-mDNA相比,游离的mDNA不影响LPS诱导的细胞炎症反应。由于mDNA通常与相关蛋白质共存,通过WB检测,发现线粒体内TOM20和NDUFV2蛋白质存在于AdMSC-EV中,可能参与维持mDNA结构。表明AdMSC-EV通过转移mDNA恢复了受体巨噬细胞中mDNA的水平。
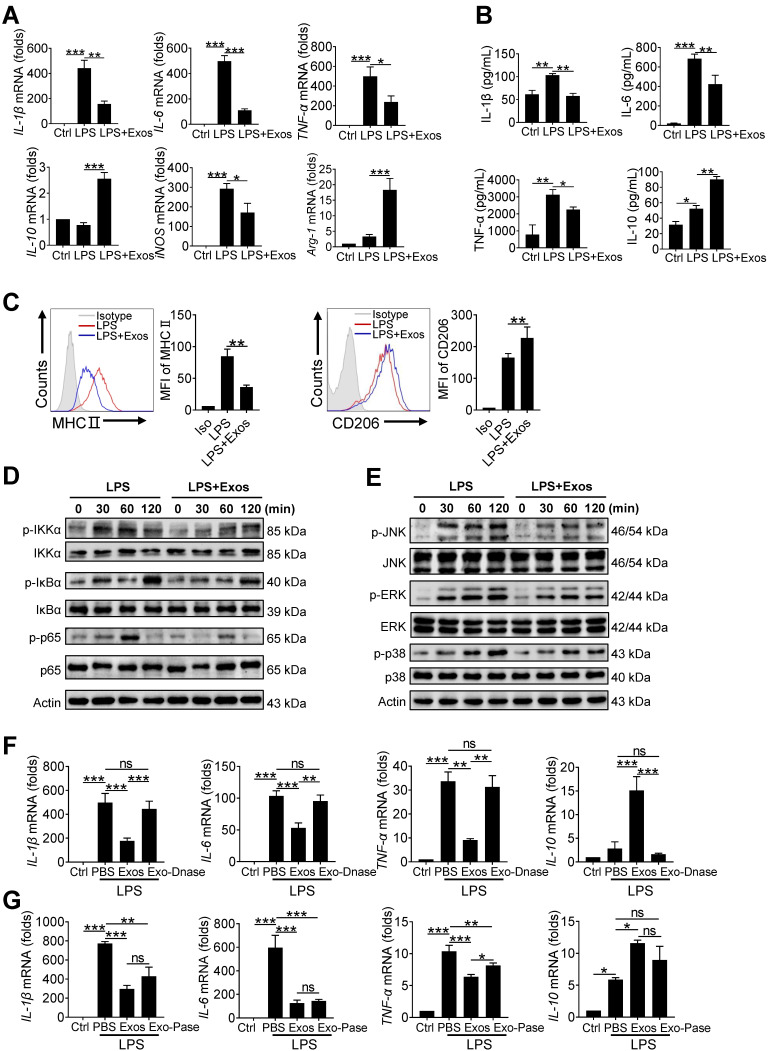
4. AdMSC-EV转移的线粒体成分可改善巨噬细胞线粒体功能
为了解AdMSC是否通过提供mDNA缓解巨噬细胞中的线粒体应激,用LPS刺激MH-S细胞,诱导线粒体数量减少、嵴杂乱无章、腔内出现空泡等;但在AdMSC-EV的预处理下则能抑制LPS诱导的线粒体损伤和细胞凋亡,细胞内mDNA和ATP的量亦有所增加,表明AdMSC-EV通过传递mDNA,增加了受损巨噬细胞的mDNA水平和产能能力。
通过Seahorse XF分析仪分析发现AdMSC-EV的预处理能抑制LPS诱导的线粒体耗氧率降低,此外AdMSC-EV减轻了ROS应激,细胞中代表呼吸链复合物I、II、III、IV和V的线粒体基因网络表达增加,恢复了泛醌氧化还原酶核心亚基V2(NDUFV2)的表达,从而缓解LPS刺激的线粒体病理学。若敲低MH-S细胞中的NDUFV2,AdMSC-EV亦能有效增加细胞中NDUFV2的表达。在AdMSC细胞中敲低NDUFV2后,则EV 抑制LPS诱导的炎性细胞因子表达的能力减弱,且不能恢复线粒体功能。以上数据进一步证明了AdMSC-EV携带的线粒体成分对其功能至关重要。
5. AdMSC-EV转移的线粒体成分促进内毒素刺激的巨噬细胞向抗炎表型转变
AdMSC-EV抑制了LPS诱导的促炎因子(IL-6、TNF-a和IL-1B)和M1标志基因iNOS的表达;同时,巨噬细胞中M2标志基因IL-10和Arg-1的表达在AdMSC-EV处理后显著增加。FASC分析显示,在LPS刺激的MH-S细胞中,AdMSC-EV能下调MHCII的水平,增加CD206的表达。表明AdMSC-EV诱使LPS刺激的巨噬细胞从M1型转变为M2型。
LPS刺激巨噬细胞线粒体氧化应激后产生的ROS可促进NF-kB和MAPKs信号通路活化,而AdMSC-EV的处理阻止了p65/NF-kB及其上游信号分子的激活,JNK、ERK和p38激酶磷酸化亦被抑制。DNase I的预处理大大消除了AdMSC-EV的抗炎作用,蛋白酶处理的AdMSC-EV仍具抗炎作用。表明AdMSC-EV抑制了调节促炎因子表达的关键信号通路,诱导LPS刺激的巨噬细胞促炎表型逆转。
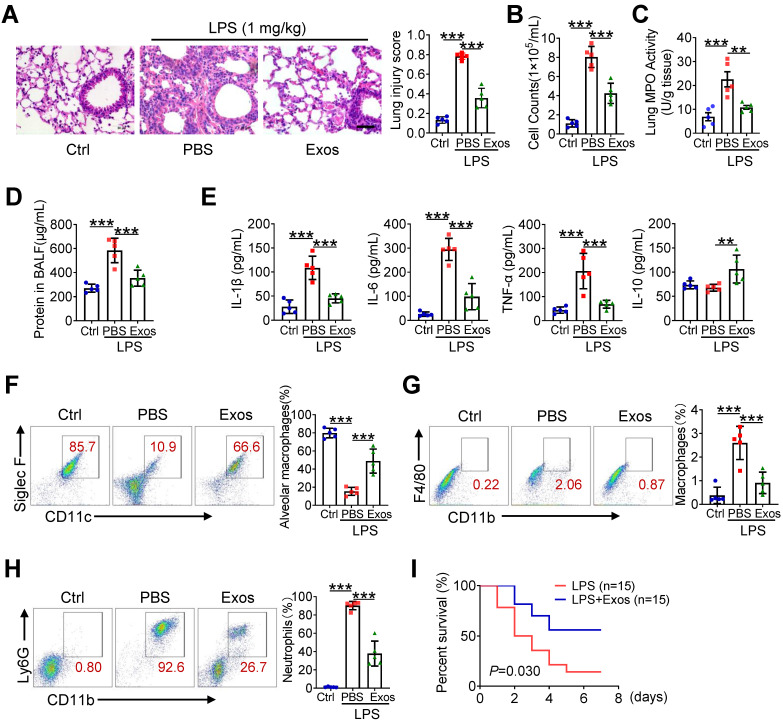
6. AdMSC-EV可减轻小鼠的肺部炎症和损伤
尾静脉给予AdMSC-EV治疗,可减轻LPS诱导的小鼠肺损伤,降低炎性细胞浸润,诱导肺泡壁变薄。在体内,AdMSC-EV可被ACE-I和ACE-II细胞内化,诱导肺泡灌洗液(BALF)中的细胞量、蛋白质及MPO的活性降低,M1型细胞因子的产生减少,IL-10表达增加。FACS显示,AdMSC-EV的使用增加了肺泡巨噬细胞的含量,促炎性中性粒细胞和单核细胞来源的巨噬细胞数量降低,提高致死剂量内毒素下小鼠的存活率。若将无mDNA的AdMSC-EV处理ALI小鼠,则降低了AdMSC-EV在肺炎中的抗炎和组织保护作用。
7. AdMSC-EV治疗可改善体内巨噬细胞的线粒体功能
与体外结果一致,在体内AdMSC-EV可被肺巨噬细胞摄取,增加mDNA和ATP水平,减少功能失调的线粒体和ROS释放,改善了内毒素破坏的线粒体完整性和功能。与线粒体合成及稳态相关的基因(PGC-1a、TFAM和Sirt1),和与呼吸链相关的基因(COX15、NDUFV2、ATP5d和ATP5h),在AdMSC-EV治疗后表达水平显著增加。表明AdMSC-EV改善了LPS刺激的小鼠肺巨噬细胞的线粒体功能和免疫稳态。
8. AdMSC-EV对ALI的治疗作用在很大程度上取决于肺泡巨噬细胞
接着研究肺巨噬细胞在AdMSC-EV治疗ALI中的作用。小鼠气管内滴注氯膦suan盐脂质体(CL2MBP)以清除肺中的巨噬细胞,但此时AdMSC-EV的抗炎和组织保护作用在很大程度上被减弱,且不能抑制LPS诱导中性粒细胞和单核巨噬细胞的肺浸润。清除肺巨噬细胞后,BALF中中性粒细胞的百分比未增加,这与IL-6的水平有关,可能有其他细胞参与诱导中性粒细胞和IL-6的表达,此外肺巨噬细胞的清除会破坏肺炎中凋亡中性粒细胞的清除,从而影响中性粒细胞的存在及IL-6的表达。表明肺巨噬细胞是负责AdMSC-EV对抗ALI的主要效应物。
讨论:
本研究表明人AdMSC来源的EV通过转移mDNA,改善肺巨噬细胞中线粒体的完整性和氧化磷酸化水平,促进肺巨噬细胞代谢和免疫稳态,进而减轻ALI的严重程度。由于对治疗COVID-19等严重肺部疾病有迫切需要,因此使用EV制剂治疗急性肺损伤具有重要意义。
南京中医药大学的史丽云课题组探究了AdMSC-EV的线粒体捐献是否改善巨噬细胞线粒体功能,保护内毒素诱导的小鼠ALI。将研究成果发表在Theranostics(IF:11.600)杂志上。

文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8965475/
技术路线:

1. AdMSC-EV的分离、纯化和表征
对从人脂肪组织中分离得到的AdMSC细胞进行鉴定,传代培养3-8代后,通过梯度离心从其培养上清液中分离EV。经鉴定,获得的EV具有典型的双凹形态,粒径范围为50-150nm,CD9、CD63和TSG101呈阳性。
2. AdMSC-EV将线粒体成分转移到巨噬细胞
从线粒体探针Mito Tracker Red标记的AdMSC细胞中分离EV,再与鼠肺泡巨噬细胞MH-S共孵育,在MH-S细胞线粒体中可见Mito-Red。为排除是残留染料导致的,先用EtBr耗尽MH-S细胞中mDNA,再与AdMSC-EV共孵育,仍可检测到mDNA的存在。用氯丙嗪或木黄酮抑制内吞作用后,则抑制了AdMSC-EV的内化。表明AdMSC-EV携带mDNA通过内吞作用被靶细胞摄取。
根据AdMSC-EV的蛋白质浓度与颗粒数,按1x107个EV的蛋白质浓度为10ug/ml,将MH-S:EV以1:10、1:25、1:50和1:100的比例进行共孵育,FACS分析发现MH-S细胞中Mito-Red阳性率随EV量的增加而增加。表明AdMSC-EV可将线粒体成分转移到肺泡巨噬细胞中,且与细胞内线粒体共定位。

3. 人线粒体DNA(mDNA)通过AdMSC-EV转移并改善巨噬细胞线粒体适应性
为确认哪些线粒体成分被AdMSC-EV转移,首先检测了MH-S细胞的mDNA,发现在AdMSC-EV处理后,mDNA水平增加。同时,通过琼脂糖电泳在AdMSC-EV中检测到mDNA(16.5kb);若用EtBr去除AdMSC中的mDNA,则在AdMSC-EV中检测不到mDNA。使用人类特异性mDNA引物,可在AdMSC-EV中检测到线粒体基因ND1和ND5的表达,MH-S与AdMSC-EV共孵育后ND1和ND5基因表达增加。
mDNA作为一种损伤相关分子模式,能识别巨噬细胞中的AIM或cGAS受体,但与AdMSC-EV-mDNA相比,游离的mDNA不影响LPS诱导的细胞炎症反应。由于mDNA通常与相关蛋白质共存,通过WB检测,发现线粒体内TOM20和NDUFV2蛋白质存在于AdMSC-EV中,可能参与维持mDNA结构。表明AdMSC-EV通过转移mDNA恢复了受体巨噬细胞中mDNA的水平。

4. AdMSC-EV转移的线粒体成分可改善巨噬细胞线粒体功能
为了解AdMSC是否通过提供mDNA缓解巨噬细胞中的线粒体应激,用LPS刺激MH-S细胞,诱导线粒体数量减少、嵴杂乱无章、腔内出现空泡等;但在AdMSC-EV的预处理下则能抑制LPS诱导的线粒体损伤和细胞凋亡,细胞内mDNA和ATP的量亦有所增加,表明AdMSC-EV通过传递mDNA,增加了受损巨噬细胞的mDNA水平和产能能力。
通过Seahorse XF分析仪分析发现AdMSC-EV的预处理能抑制LPS诱导的线粒体耗氧率降低,此外AdMSC-EV减轻了ROS应激,细胞中代表呼吸链复合物I、II、III、IV和V的线粒体基因网络表达增加,恢复了泛醌氧化还原酶核心亚基V2(NDUFV2)的表达,从而缓解LPS刺激的线粒体病理学。若敲低MH-S细胞中的NDUFV2,AdMSC-EV亦能有效增加细胞中NDUFV2的表达。在AdMSC细胞中敲低NDUFV2后,则EV 抑制LPS诱导的炎性细胞因子表达的能力减弱,且不能恢复线粒体功能。以上数据进一步证明了AdMSC-EV携带的线粒体成分对其功能至关重要。

5. AdMSC-EV转移的线粒体成分促进内毒素刺激的巨噬细胞向抗炎表型转变
AdMSC-EV抑制了LPS诱导的促炎因子(IL-6、TNF-a和IL-1B)和M1标志基因iNOS的表达;同时,巨噬细胞中M2标志基因IL-10和Arg-1的表达在AdMSC-EV处理后显著增加。FASC分析显示,在LPS刺激的MH-S细胞中,AdMSC-EV能下调MHCII的水平,增加CD206的表达。表明AdMSC-EV诱使LPS刺激的巨噬细胞从M1型转变为M2型。
LPS刺激巨噬细胞线粒体氧化应激后产生的ROS可促进NF-kB和MAPKs信号通路活化,而AdMSC-EV的处理阻止了p65/NF-kB及其上游信号分子的激活,JNK、ERK和p38激酶磷酸化亦被抑制。DNase I的预处理大大消除了AdMSC-EV的抗炎作用,蛋白酶处理的AdMSC-EV仍具抗炎作用。表明AdMSC-EV抑制了调节促炎因子表达的关键信号通路,诱导LPS刺激的巨噬细胞促炎表型逆转。

6. AdMSC-EV可减轻小鼠的肺部炎症和损伤
尾静脉给予AdMSC-EV治疗,可减轻LPS诱导的小鼠肺损伤,降低炎性细胞浸润,诱导肺泡壁变薄。在体内,AdMSC-EV可被ACE-I和ACE-II细胞内化,诱导肺泡灌洗液(BALF)中的细胞量、蛋白质及MPO的活性降低,M1型细胞因子的产生减少,IL-10表达增加。FACS显示,AdMSC-EV的使用增加了肺泡巨噬细胞的含量,促炎性中性粒细胞和单核细胞来源的巨噬细胞数量降低,提高致死剂量内毒素下小鼠的存活率。若将无mDNA的AdMSC-EV处理ALI小鼠,则降低了AdMSC-EV在肺炎中的抗炎和组织保护作用。

7. AdMSC-EV治疗可改善体内巨噬细胞的线粒体功能
与体外结果一致,在体内AdMSC-EV可被肺巨噬细胞摄取,增加mDNA和ATP水平,减少功能失调的线粒体和ROS释放,改善了内毒素破坏的线粒体完整性和功能。与线粒体合成及稳态相关的基因(PGC-1a、TFAM和Sirt1),和与呼吸链相关的基因(COX15、NDUFV2、ATP5d和ATP5h),在AdMSC-EV治疗后表达水平显著增加。表明AdMSC-EV改善了LPS刺激的小鼠肺巨噬细胞的线粒体功能和免疫稳态。

8. AdMSC-EV对ALI的治疗作用在很大程度上取决于肺泡巨噬细胞
接着研究肺巨噬细胞在AdMSC-EV治疗ALI中的作用。小鼠气管内滴注氯膦suan盐脂质体(CL2MBP)以清除肺中的巨噬细胞,但此时AdMSC-EV的抗炎和组织保护作用在很大程度上被减弱,且不能抑制LPS诱导中性粒细胞和单核巨噬细胞的肺浸润。清除肺巨噬细胞后,BALF中中性粒细胞的百分比未增加,这与IL-6的水平有关,可能有其他细胞参与诱导中性粒细胞和IL-6的表达,此外肺巨噬细胞的清除会破坏肺炎中凋亡中性粒细胞的清除,从而影响中性粒细胞的存在及IL-6的表达。表明肺巨噬细胞是负责AdMSC-EV对抗ALI的主要效应物。

讨论:
本研究表明人AdMSC来源的EV通过转移mDNA,改善肺巨噬细胞中线粒体的完整性和氧化磷酸化水平,促进肺巨噬细胞代谢和免疫稳态,进而减轻ALI的严重程度。由于对治疗COVID-19等严重肺部疾病有迫切需要,因此使用EV制剂治疗急性肺损伤具有重要意义。






