研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
1区17分+,一种分离肺组织高质量外泌体的有效方法,赶紧学起来!
1605 人阅读发布时间:2022-08-24 13:45
细胞外囊泡EV被认为是疾病的生物标志物和体内远程细胞间通讯的载体,可介导细胞间和器官间的通信,以维持多细胞生物体的体内平衡。然而当前研究EV主要是通过细胞培养系统进行探索,缺乏在生理微环境中共存的其他细胞的影响,加上从完整组织中分离EV的技术并不理想,所以尚不清楚生理EV如何在体内发挥稳态或病理功能。
北京大学尹玉新团队在Journal of Extracellular Vesicles(IF=17.337)杂志上发表了一种从人和鼠的肺组织中分离高质量EV的有效方法,阐明了肺EV通过传递dsDNA促进了骨髓中中性粒细胞的驱化性,及其作用机制。
技术路线:

实验结果:
1. 肺EV的分离和表征
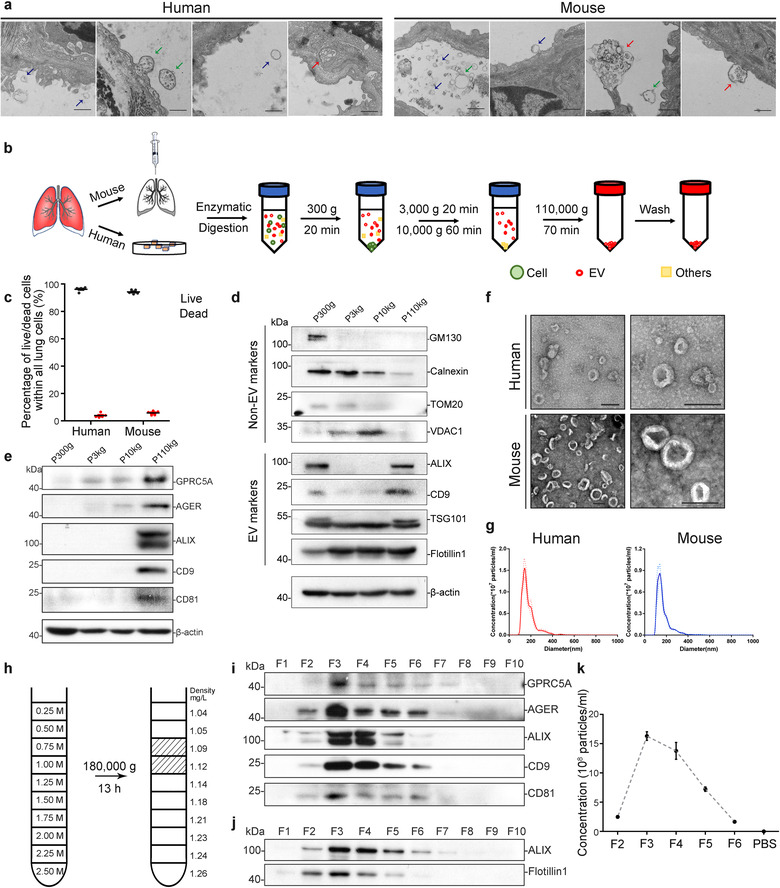
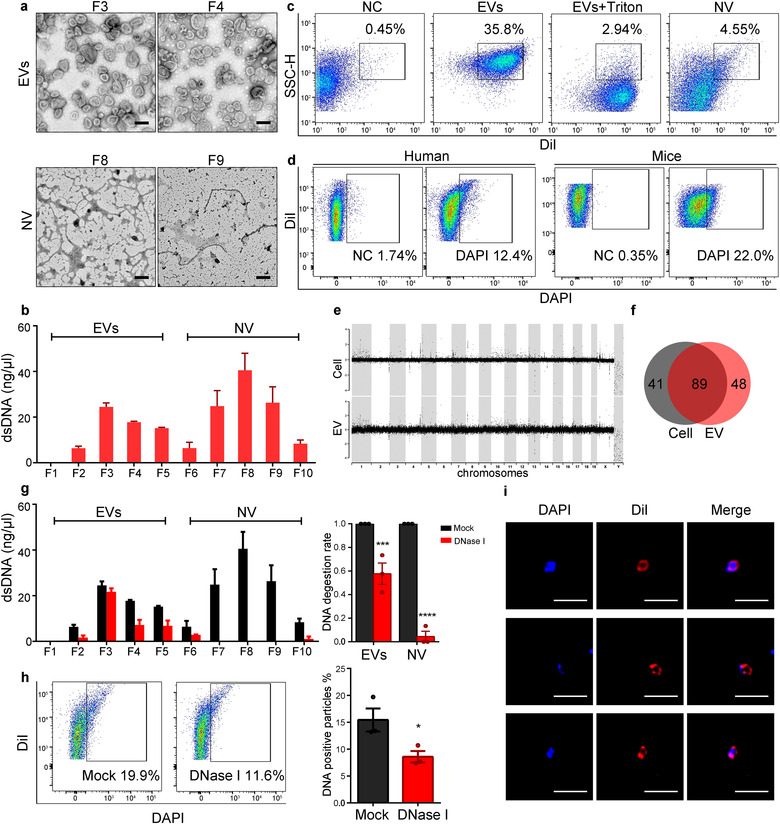
为从肺组织中分离高质量的EV,作者优化了一种基于差速离心的温和消化组织方法,无需均质化、过滤或剪切,通过蛋白酶和DNA酶将组织处理成悬浊液,再与培养液混合振荡20min,收集上清液,进行后续差速离心和密度梯度超速离心。消化后的活细胞分别占人和鼠样本总细胞的96.2%和94.2%。通过WB、TEM、NTA和CT分析不同离心速度的沉淀,发现EV主要存在于p110kg级分中。接着用0.25M-2.5M不连续十层蔗糖垫对EV进行纯化,经分析EV的密度为1.05-1.14g/ml。人和鼠样本的平均产量分别为0.78ug/mg和0.7ug/mg。表明通过作者改进的分离方法,可以有效地从人和鼠的肺组织中收集到高质量的EV。
2. 人和小鼠肺EV的蛋白质组学分析
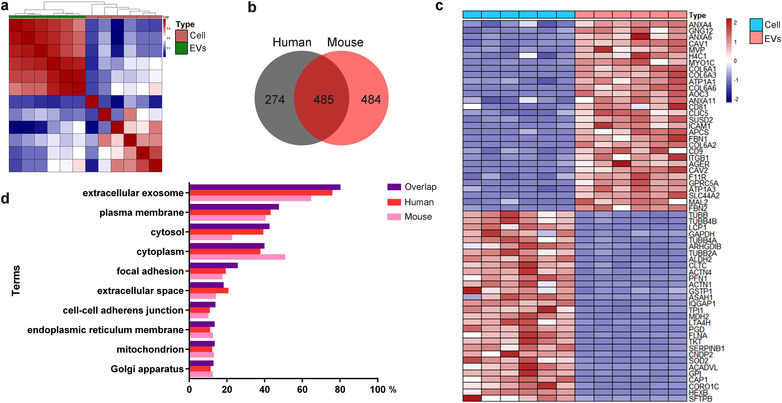
LC-MS/MS对6个人和3个鼠的肺EV进行分析,从细胞与EV、人与鼠的角度进行比对,发现EV中除了含有其经典标志物外,还有肺特异性表达的GPRC5A和AGER蛋白,人和鼠的肺EV中有一半以上的蛋白质是共享的,主要是EV、质膜和胞质相关蛋白质,表明作者优化的分离方法富集了细胞污染较少的EV。
3. 鉴定GPRC5A和AGER为肺EV的标志物
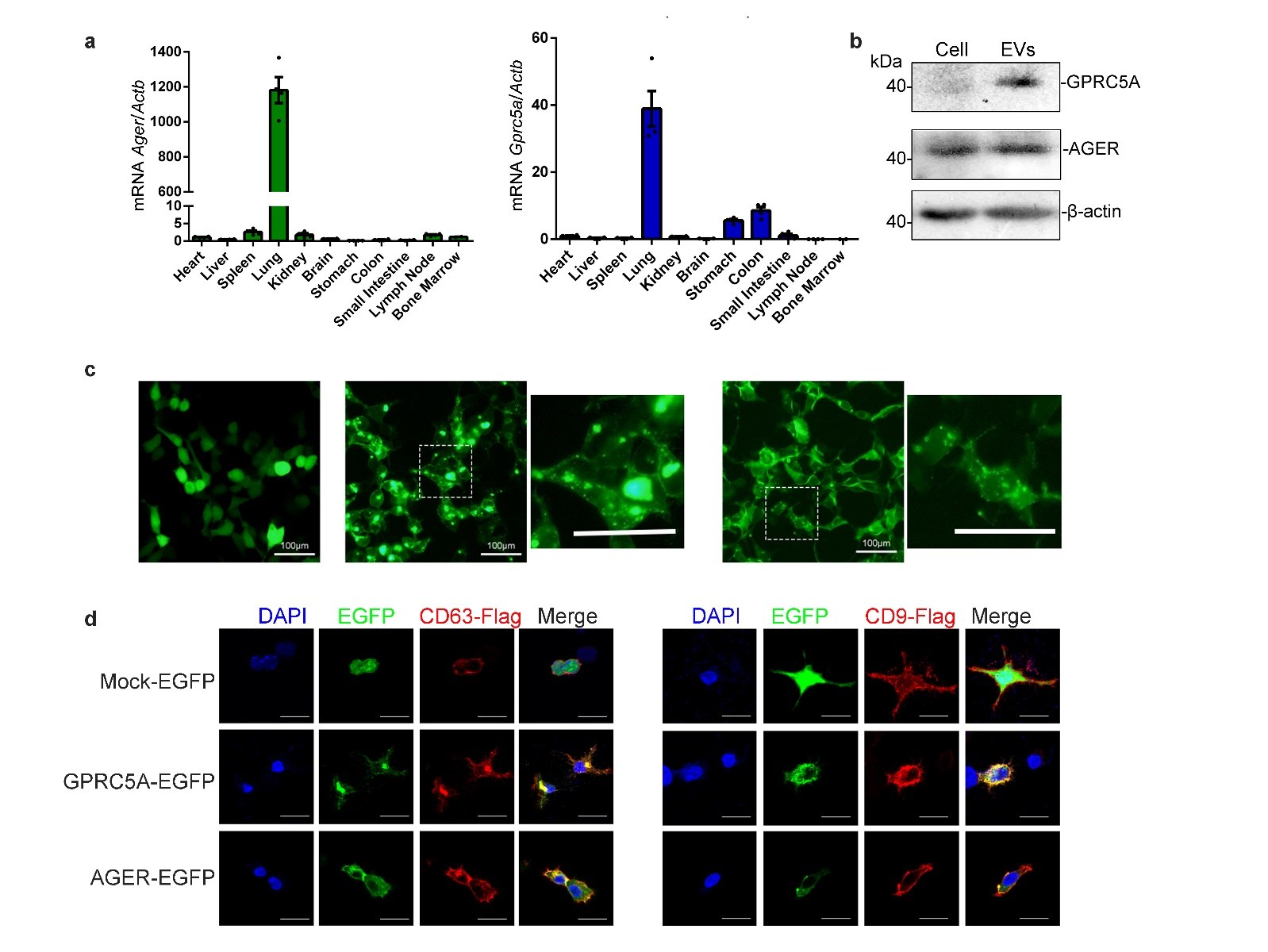
基于GPRC5A和AGER在肺组织中特异性表达,同时WB实验在EV中检测到GPRC5A和AGER的表达,因此作者通过EGFP对GPRC5A和AGER进行标记,发现两种蛋白质定位在质膜和细胞内囊泡上,且在细胞质中与CD63和CD9共定位,因此确认GPRC5A和AGER为肺EV标志物。
4. ATII是肺EV的主要来源
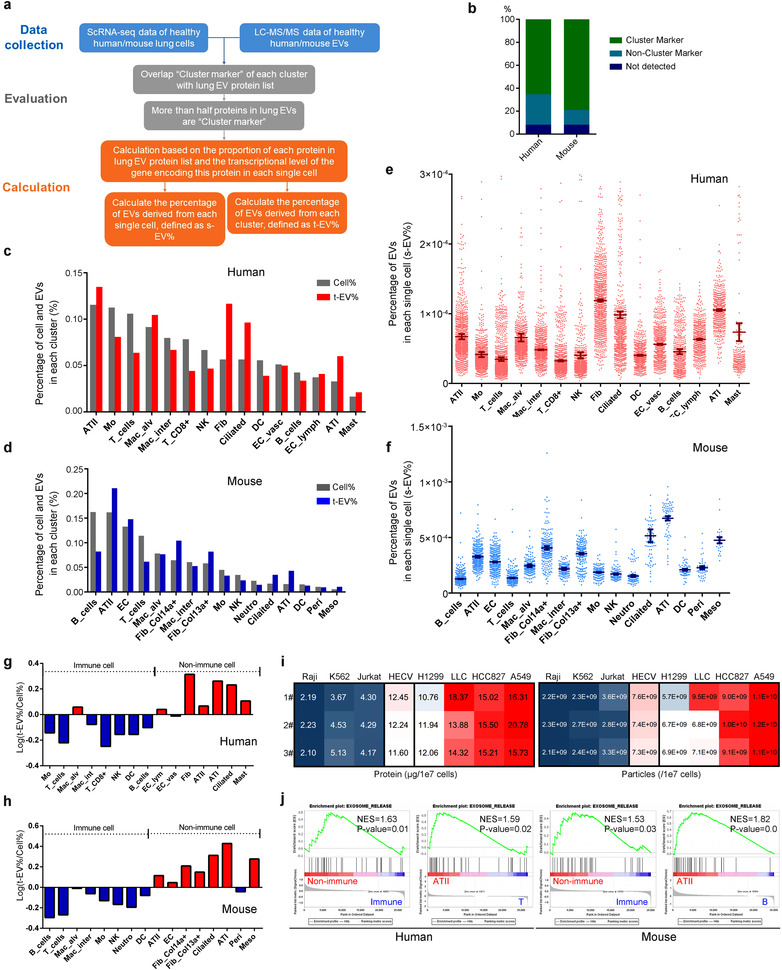
EV中有一半以上的蛋白质在特定细胞类型中表达,因此根据LC-MS/MS(丰度)和scRNA-seq数据(表达水平)联合分析来自每个细胞簇分泌的EV比例,及单细胞释放EV的能力,结合生物信息学分析,发现人和鼠的肺组织中ATII细胞是EV的主要来源,人肺组织中单个成纤维细胞释放的EV最多,小鼠组织中ATI细胞释放最多,且单个非免疫细胞的EV释放量要多于免疫细胞。
5. 肺EV含有dsDNA
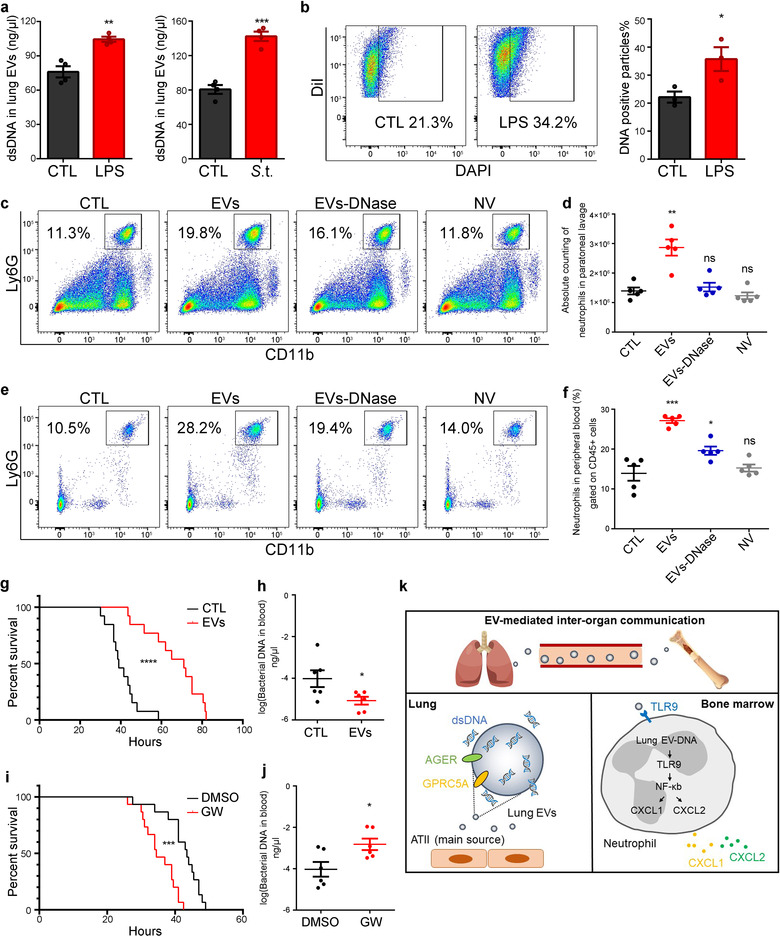
为分析肺组织EV中是否有dsDNA,作者对不同蔗糖梯度中的DNA进行量化,结果显示dsDNA主要存在于EV(1.05-1/14g/ml)和高密度非囊泡(1.18-1/24g/ml)中,使用DNaseI和RNase进一步证实了DNA的存在。
通过FACS可检测到Dil标记的EV,用0.5%Triton X-100处理EV后则检测不到EV,而非囊泡成分检测不到荧光信号。用DAPI染色EV后,有10-20%的EV呈阳性。接着对肺细胞和EV的DNA进行了全基因组测序,发现EV包含了各种长度跨越染色体的dsDNA,未检测到线粒体DNA,CNV与细胞DNA相似,说明肺EV中dsDNA来源于基因组DNA。
6. dsDNA存在于肺EV的内部和外部
用DNaseI处理EV会导致EV中总DNA降低40%,FACS显示DNaseI处理后DAPI阳性颗粒也相应减少,而DNaseI处理后的非囊泡成分几乎检测不到dsDNA。DAPI和Dil同时标记EV后通过Confocal可以看到DNA与囊泡膜结构共定位,表明DNA存在于肺EV的表面和内部。
7. 肺EV在骨髓中性粒细胞中积累
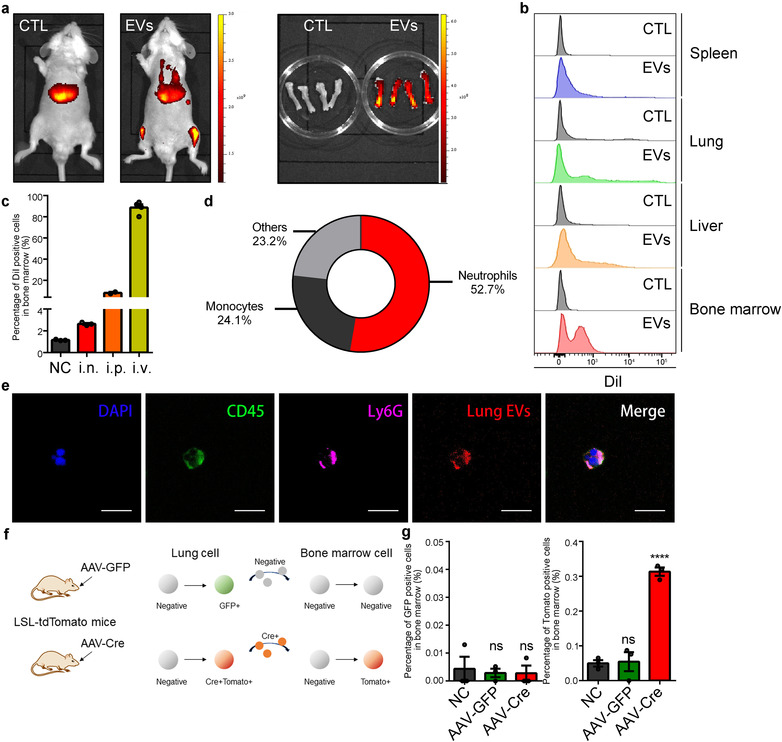
将DiR标记的EV通过i.v.注射到小鼠体内以分析EV在体内的分布,IVIS显示下肢有EV富集,FACS进一步证实骨髓中存在带红色荧光的EV。i.n.、i.p.和i.v.给予EV均不影响EV在骨髓中积累,且i.v.给药能检测更多的EV,说明EV通过血液转移。骨髓中带有红色荧光的细胞主要是中性粒细胞(52.7%)和单核细胞(24.1%),confocal观察到EV与CD45+LY6G+中性粒细胞共定位。
同时利用EV介导转移功能性Cre-mRNA进入靶细胞的系统来分析EV的体内转移,发现来自Cre阳性肺细胞的EV处理ROSA26-CAG-LSL-tdTOMAT鼠,可转移到靶细胞中,诱导TOMATO表达,而对照组检测不到荧光,进一步证明了EV可经血管转移并聚积在骨髓中性粒细胞中。
8. 肺EV-DNA增强中性粒细胞的驱化性
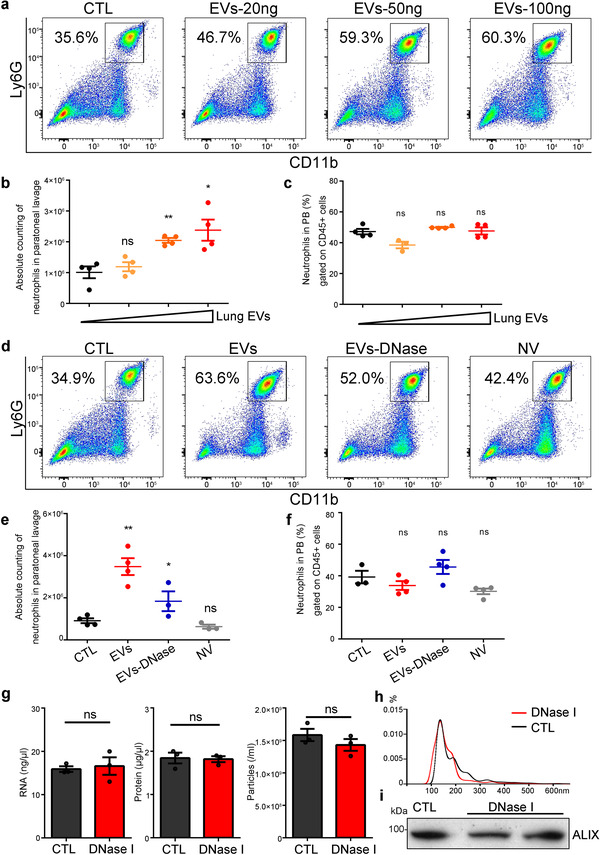
肺EV对骨髓中各细胞的相对比例并无影响,但若在体内给予EV处理,3天后再用巯基yi酸诱导急性腹膜炎,则在小鼠腹膜部位可检测到中性粒细胞,且其数量呈EV剂量依赖性增加。用GW4869预处理小鼠,则能抑制中性粒细胞向腹腔募集。表明EV影响中性粒细胞的驱化性。
DNaseI处理EV后不影响其蛋白质、RNA、数量或粒径,但会降低DNA含量,用DNaseI处理的EV注射到小鼠体内,会降低EV促进炎症状态下中性粒细胞驱化性的能力。而相同DNA含量的非囊泡成分对中性粒细胞并无影响,说明EV-DNA增强了中性粒细胞的驱化性。
9. 肺EV-DNA诱导中性粒细胞中CXCL1和CXCL2的表达
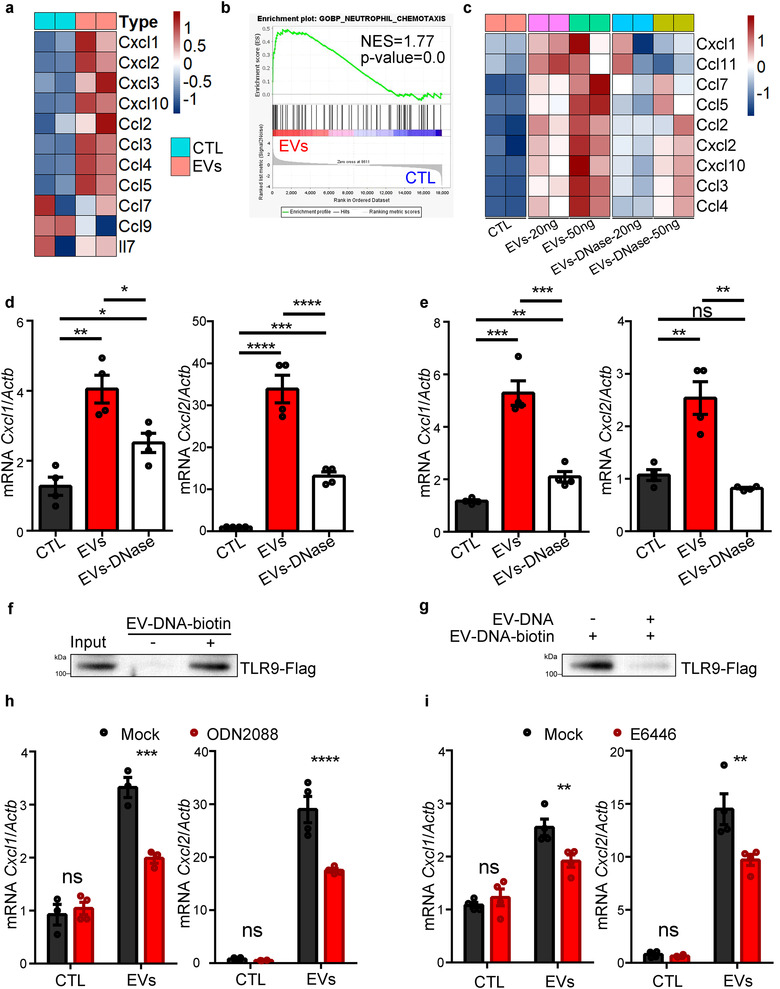
小鼠肺EV处理鼠骨髓中获得的中性粒细胞后进行mRNA测序分析,发现促炎趋化因子的表达显著上调。与未处理的中性粒细胞和用DNaseI处理过的EV刺激的中性粒细胞相比,肺EV以剂量依赖性方式增加中性粒细胞释放趋化因子;且能有效刺激CXCL1和CXCL2的产生,在体内进一步证实EV促进CXCL1和CXCL2的产生。同样,人肺EV与外周血中分离出的白细胞共培养,也能显著增加白细胞中CXCL1和CXCL2的表达水平,但若用DNaseI预处理EV,则无影响。表明EV-DNA在体内外均可诱导骨髓中性粒细胞释放CXCL1和CXCL2。
10. TLR9感知中性粒细胞中的肺EV-DNA
TLR9定位于质膜和内体,能识别未甲基化CpG基序的DNA,诱导激活NF-kB和下游炎症通路。因此作者通过体外DNA结合pulldown实验验证了肺EV-DNA可结合TLR9,confocal也观察到Dil-EV与内源性TLR9在中性粒细胞中共定位。用ODN2088和E6446抑制TLR9后,抑制了肺EV诱导的CXCL1和CXCL2 mRNA水平增加。同时BAY11-7082抑制NF-kB后也消除了肺EV的作用。表明肺EV-DNA可被TLR9识别结合,促进中性粒细胞中促炎趋化因子的表达,而此过程对急性炎症发作期间从骨髓中动员中性粒细胞至关重要。
11. 肺EV可增强沙门氏菌感染中中性粒细胞的募集
基于上述结果,作者进一步评估肺EV在临床传染病中的作用,从LPS诱导急性炎症小鼠模型和感染鼠伤寒沙门氏jun的小鼠肺组织中分离EV,发现与对照组相比,炎症组EV中DNA含量更高。沙门氏菌感染的小鼠用肺EV处理,能在腹膜中检测到更多的中性粒细胞,且小鼠存活率更高,肝和脾组织中活CFU相对较低,但GW4869的处理则抑制了这一效果。表明肺EV可以有效增强中性粒细胞的募集,抑制肺EV的分泌会导致中性粒细胞趋化性受损,从而降低宿主的免疫防御。
讨论:
本研究中作者首次建立了一种从肺组织中富集高质量EV的方法,消除了血液EV和细胞内囊泡的污染。开发了一种高通量检测方法的联合,确定了肺EV主要来自ATII细胞。发现肺EV可在骨髓中积累并在炎症条件下增强中性粒细胞募集,通过EV-DNA-TLR9信号传导刺激CXCL1和CXCL2表达,从而提高宿主对细菌感染的免疫防御。该方法可能还存在一定的局限,但为后续从其他组织中分离高质量EV提供参考,且将有利于完善组织EV来源推定的技术路线和策略。
北京大学尹玉新团队在Journal of Extracellular Vesicles(IF=17.337)杂志上发表了一种从人和鼠的肺组织中分离高质量EV的有效方法,阐明了肺EV通过传递dsDNA促进了骨髓中中性粒细胞的驱化性,及其作用机制。
技术路线:

实验结果:
1. 肺EV的分离和表征
为从肺组织中分离高质量的EV,作者优化了一种基于差速离心的温和消化组织方法,无需均质化、过滤或剪切,通过蛋白酶和DNA酶将组织处理成悬浊液,再与培养液混合振荡20min,收集上清液,进行后续差速离心和密度梯度超速离心。消化后的活细胞分别占人和鼠样本总细胞的96.2%和94.2%。通过WB、TEM、NTA和CT分析不同离心速度的沉淀,发现EV主要存在于p110kg级分中。接着用0.25M-2.5M不连续十层蔗糖垫对EV进行纯化,经分析EV的密度为1.05-1.14g/ml。人和鼠样本的平均产量分别为0.78ug/mg和0.7ug/mg。表明通过作者改进的分离方法,可以有效地从人和鼠的肺组织中收集到高质量的EV。

2. 人和小鼠肺EV的蛋白质组学分析
LC-MS/MS对6个人和3个鼠的肺EV进行分析,从细胞与EV、人与鼠的角度进行比对,发现EV中除了含有其经典标志物外,还有肺特异性表达的GPRC5A和AGER蛋白,人和鼠的肺EV中有一半以上的蛋白质是共享的,主要是EV、质膜和胞质相关蛋白质,表明作者优化的分离方法富集了细胞污染较少的EV。

3. 鉴定GPRC5A和AGER为肺EV的标志物
基于GPRC5A和AGER在肺组织中特异性表达,同时WB实验在EV中检测到GPRC5A和AGER的表达,因此作者通过EGFP对GPRC5A和AGER进行标记,发现两种蛋白质定位在质膜和细胞内囊泡上,且在细胞质中与CD63和CD9共定位,因此确认GPRC5A和AGER为肺EV标志物。

4. ATII是肺EV的主要来源
EV中有一半以上的蛋白质在特定细胞类型中表达,因此根据LC-MS/MS(丰度)和scRNA-seq数据(表达水平)联合分析来自每个细胞簇分泌的EV比例,及单细胞释放EV的能力,结合生物信息学分析,发现人和鼠的肺组织中ATII细胞是EV的主要来源,人肺组织中单个成纤维细胞释放的EV最多,小鼠组织中ATI细胞释放最多,且单个非免疫细胞的EV释放量要多于免疫细胞。

5. 肺EV含有dsDNA
为分析肺组织EV中是否有dsDNA,作者对不同蔗糖梯度中的DNA进行量化,结果显示dsDNA主要存在于EV(1.05-1/14g/ml)和高密度非囊泡(1.18-1/24g/ml)中,使用DNaseI和RNase进一步证实了DNA的存在。
通过FACS可检测到Dil标记的EV,用0.5%Triton X-100处理EV后则检测不到EV,而非囊泡成分检测不到荧光信号。用DAPI染色EV后,有10-20%的EV呈阳性。接着对肺细胞和EV的DNA进行了全基因组测序,发现EV包含了各种长度跨越染色体的dsDNA,未检测到线粒体DNA,CNV与细胞DNA相似,说明肺EV中dsDNA来源于基因组DNA。
6. dsDNA存在于肺EV的内部和外部
用DNaseI处理EV会导致EV中总DNA降低40%,FACS显示DNaseI处理后DAPI阳性颗粒也相应减少,而DNaseI处理后的非囊泡成分几乎检测不到dsDNA。DAPI和Dil同时标记EV后通过Confocal可以看到DNA与囊泡膜结构共定位,表明DNA存在于肺EV的表面和内部。

7. 肺EV在骨髓中性粒细胞中积累
将DiR标记的EV通过i.v.注射到小鼠体内以分析EV在体内的分布,IVIS显示下肢有EV富集,FACS进一步证实骨髓中存在带红色荧光的EV。i.n.、i.p.和i.v.给予EV均不影响EV在骨髓中积累,且i.v.给药能检测更多的EV,说明EV通过血液转移。骨髓中带有红色荧光的细胞主要是中性粒细胞(52.7%)和单核细胞(24.1%),confocal观察到EV与CD45+LY6G+中性粒细胞共定位。
同时利用EV介导转移功能性Cre-mRNA进入靶细胞的系统来分析EV的体内转移,发现来自Cre阳性肺细胞的EV处理ROSA26-CAG-LSL-tdTOMAT鼠,可转移到靶细胞中,诱导TOMATO表达,而对照组检测不到荧光,进一步证明了EV可经血管转移并聚积在骨髓中性粒细胞中。

8. 肺EV-DNA增强中性粒细胞的驱化性
肺EV对骨髓中各细胞的相对比例并无影响,但若在体内给予EV处理,3天后再用巯基yi酸诱导急性腹膜炎,则在小鼠腹膜部位可检测到中性粒细胞,且其数量呈EV剂量依赖性增加。用GW4869预处理小鼠,则能抑制中性粒细胞向腹腔募集。表明EV影响中性粒细胞的驱化性。
DNaseI处理EV后不影响其蛋白质、RNA、数量或粒径,但会降低DNA含量,用DNaseI处理的EV注射到小鼠体内,会降低EV促进炎症状态下中性粒细胞驱化性的能力。而相同DNA含量的非囊泡成分对中性粒细胞并无影响,说明EV-DNA增强了中性粒细胞的驱化性。

9. 肺EV-DNA诱导中性粒细胞中CXCL1和CXCL2的表达
小鼠肺EV处理鼠骨髓中获得的中性粒细胞后进行mRNA测序分析,发现促炎趋化因子的表达显著上调。与未处理的中性粒细胞和用DNaseI处理过的EV刺激的中性粒细胞相比,肺EV以剂量依赖性方式增加中性粒细胞释放趋化因子;且能有效刺激CXCL1和CXCL2的产生,在体内进一步证实EV促进CXCL1和CXCL2的产生。同样,人肺EV与外周血中分离出的白细胞共培养,也能显著增加白细胞中CXCL1和CXCL2的表达水平,但若用DNaseI预处理EV,则无影响。表明EV-DNA在体内外均可诱导骨髓中性粒细胞释放CXCL1和CXCL2。
10. TLR9感知中性粒细胞中的肺EV-DNA
TLR9定位于质膜和内体,能识别未甲基化CpG基序的DNA,诱导激活NF-kB和下游炎症通路。因此作者通过体外DNA结合pulldown实验验证了肺EV-DNA可结合TLR9,confocal也观察到Dil-EV与内源性TLR9在中性粒细胞中共定位。用ODN2088和E6446抑制TLR9后,抑制了肺EV诱导的CXCL1和CXCL2 mRNA水平增加。同时BAY11-7082抑制NF-kB后也消除了肺EV的作用。表明肺EV-DNA可被TLR9识别结合,促进中性粒细胞中促炎趋化因子的表达,而此过程对急性炎症发作期间从骨髓中动员中性粒细胞至关重要。

11. 肺EV可增强沙门氏菌感染中中性粒细胞的募集
基于上述结果,作者进一步评估肺EV在临床传染病中的作用,从LPS诱导急性炎症小鼠模型和感染鼠伤寒沙门氏jun的小鼠肺组织中分离EV,发现与对照组相比,炎症组EV中DNA含量更高。沙门氏菌感染的小鼠用肺EV处理,能在腹膜中检测到更多的中性粒细胞,且小鼠存活率更高,肝和脾组织中活CFU相对较低,但GW4869的处理则抑制了这一效果。表明肺EV可以有效增强中性粒细胞的募集,抑制肺EV的分泌会导致中性粒细胞趋化性受损,从而降低宿主的免疫防御。

讨论:
本研究中作者首次建立了一种从肺组织中富集高质量EV的方法,消除了血液EV和细胞内囊泡的污染。开发了一种高通量检测方法的联合,确定了肺EV主要来自ATII细胞。发现肺EV可在骨髓中积累并在炎症条件下增强中性粒细胞募集,通过EV-DNA-TLR9信号传导刺激CXCL1和CXCL2表达,从而提高宿主对细菌感染的免疫防御。该方法可能还存在一定的局限,但为后续从其他组织中分离高质量EV提供参考,且将有利于完善组织EV来源推定的技术路线和策略。







