研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Molecular Therapy】12分+,细胞凋亡释放凋亡小泡对血管生成和组织再生的影响
1502 人阅读发布时间:2022-09-21 16:49
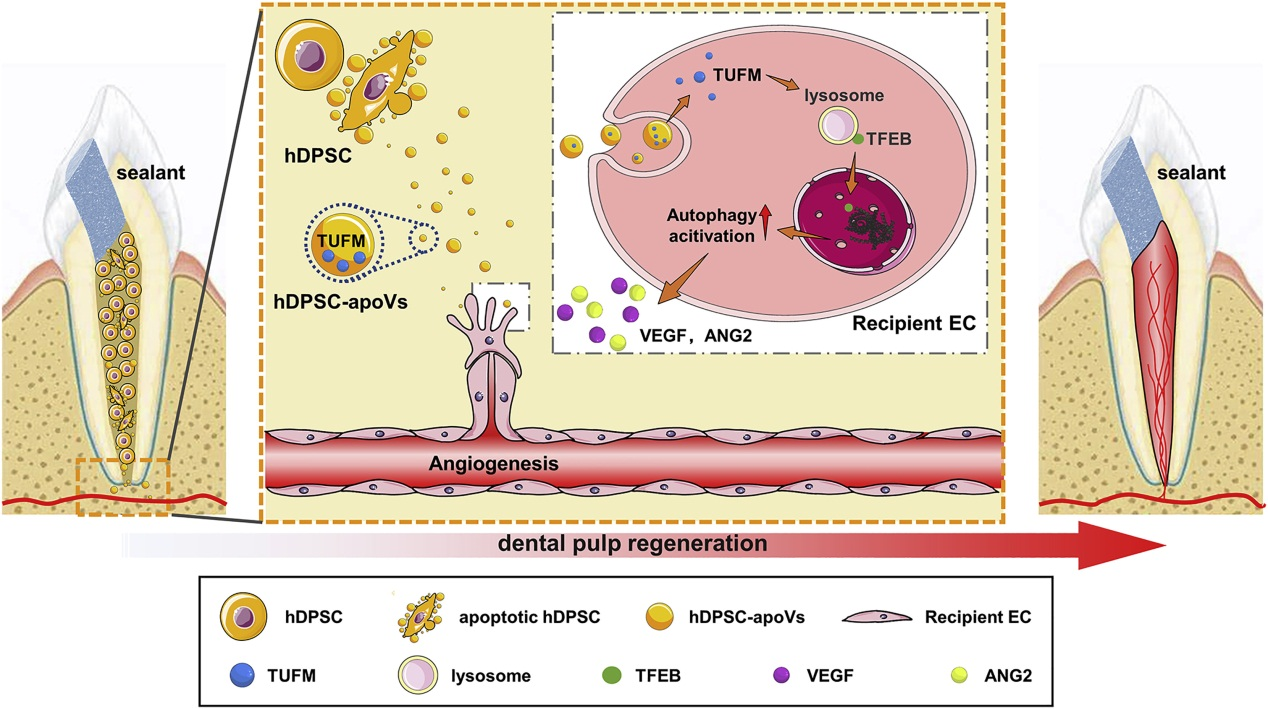
当前各种组织的再生医学具有显著的效果,但组织的血运重建无法满足医疗需求。缺氧缺血激活MSC的血管生成潜力,包括释放血管生成因子、分泌细胞外囊泡和影响内皮细胞的功能,但缺氧缺血环境通常会导致供体细胞凋亡。细胞外囊泡分为外泌体、微泡和apoV,研究表明apoV不仅调节正常生理过程,还参与组织修复和再生,但MSC细胞凋亡释放的apoV是否影响血管生成和组织再生及其机制尚不清楚。
空军军医大学轩昆团队在Molecular Therapy(IF:12.91)发表的研究成果,探讨了人类乳牙牙髓干细胞(hDPSC)来源的凋亡小泡(apoV)对牙髓再生过程的影响,证明了apoV可以激活受体细胞的自噬,从而在缺氧缺血环境中诱导宿主血管生成。

文章链接:https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(22)00304-5?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1525001622003045%3Fshowall%3Dtrue
技术路线:

实验结果:
1. 聚集的hDPSC发生细胞凋亡,导致牙髓再生
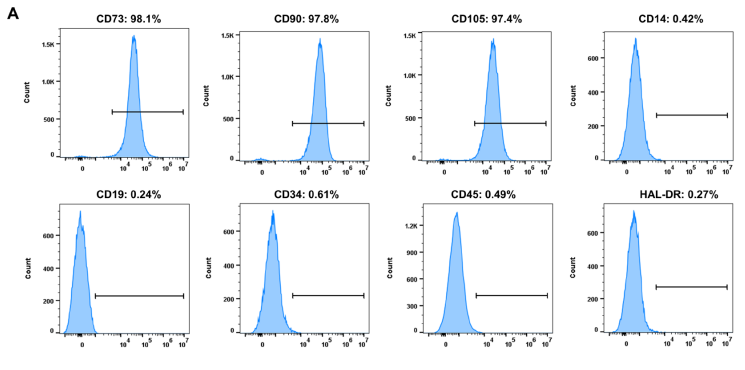
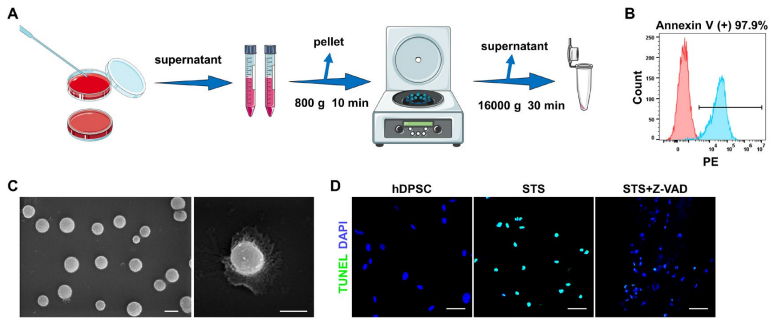
胶原酶消化法从人乳牙牙髓中分离出hDPSC,按先前报道的方法如FACS、诱导成骨成脂及单克隆成簇实验进行细胞鉴定。
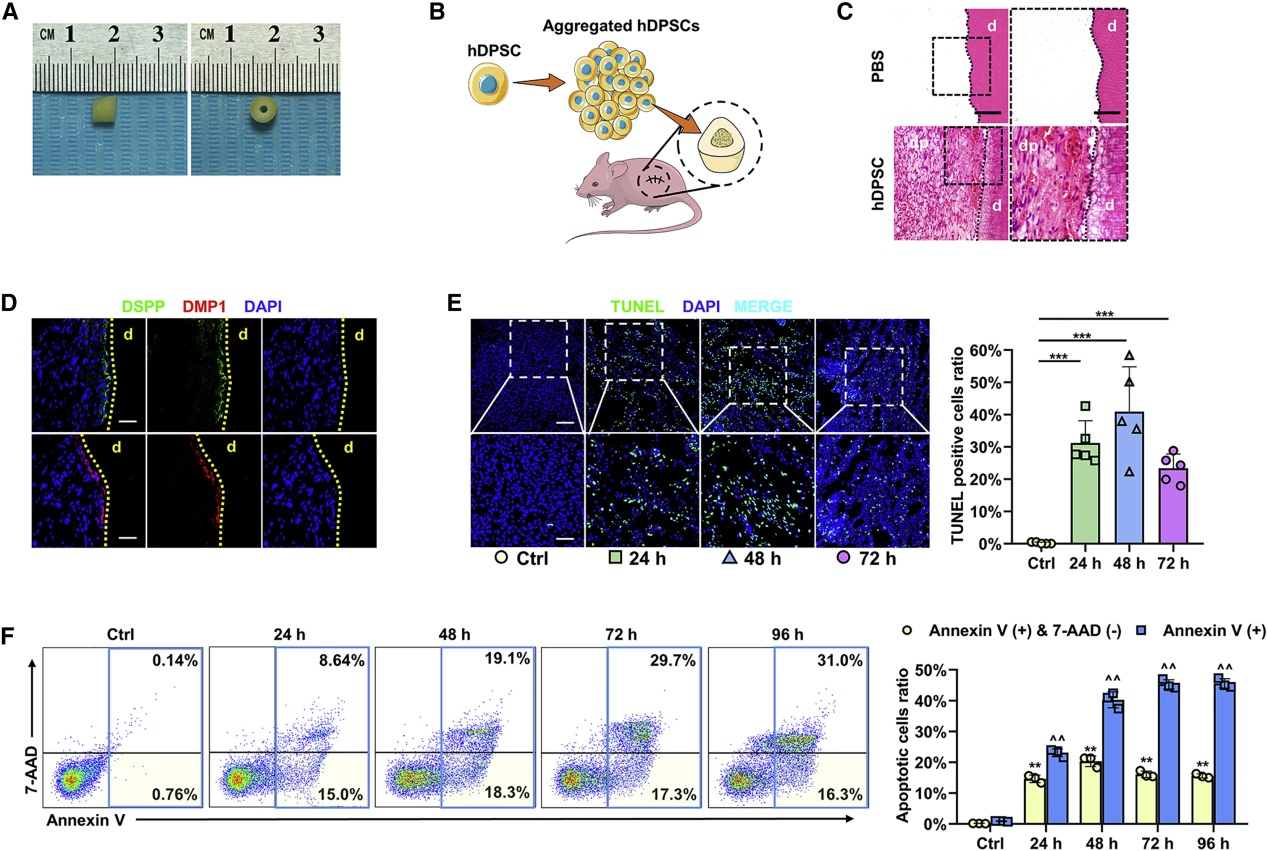
将聚焦的hDPSC和PBS凝胶载入牙支架中,植入裸鼠背部,2个月后,HE显示hDPSC组形成牙髓样组织,IF证明有牙本质涎磷蛋白(DSPP)和牙本质基质蛋白1(DMP1)阳性的成牙本质细胞层存在。TUNEL和FACS显示缺氧缺血环境中植入hDPSC后会发生细胞凋亡。
2. hDPSC的凋亡是导致牙髓再生所必需的
为探究细胞凋亡在牙髓再生中的作用,事先用凋亡抑制剂Z-VAD预处理hDPSC,再载入牙齿支架,植入鼠皮下,HE结果显示hDPSC组能形成良好的牙髓样组织,但Z-VAD组未出现牙髓再生。
为进一步探究凋亡细胞释放的apoV在牙髓再生过程中的作用,从蛋白激酶C抑制剂STS诱导的hPDSC中分离apoV,经SEM、TEM和DSL进行表征,同时IF、FACS和WB证明了apoV标志物PtdSer和cleaved caspase-3的存在,表明成功分离apoV。
将Z-VAD、hDPSC和apoV按不同处理组合方式载入牙齿支架,植入裸鼠背部,2个月后,HE染色显示,与Z-AVD组相比,Z-AVD+apoV组牙支架开口附近坏死面积和血管生成减少。与hDPSC组相比,apoV可诱导新形成的牙髓样组织中生成血管。表明hDPSC细胞凋亡在牙髓再生中起积极作用,apoV促进血管的形成。
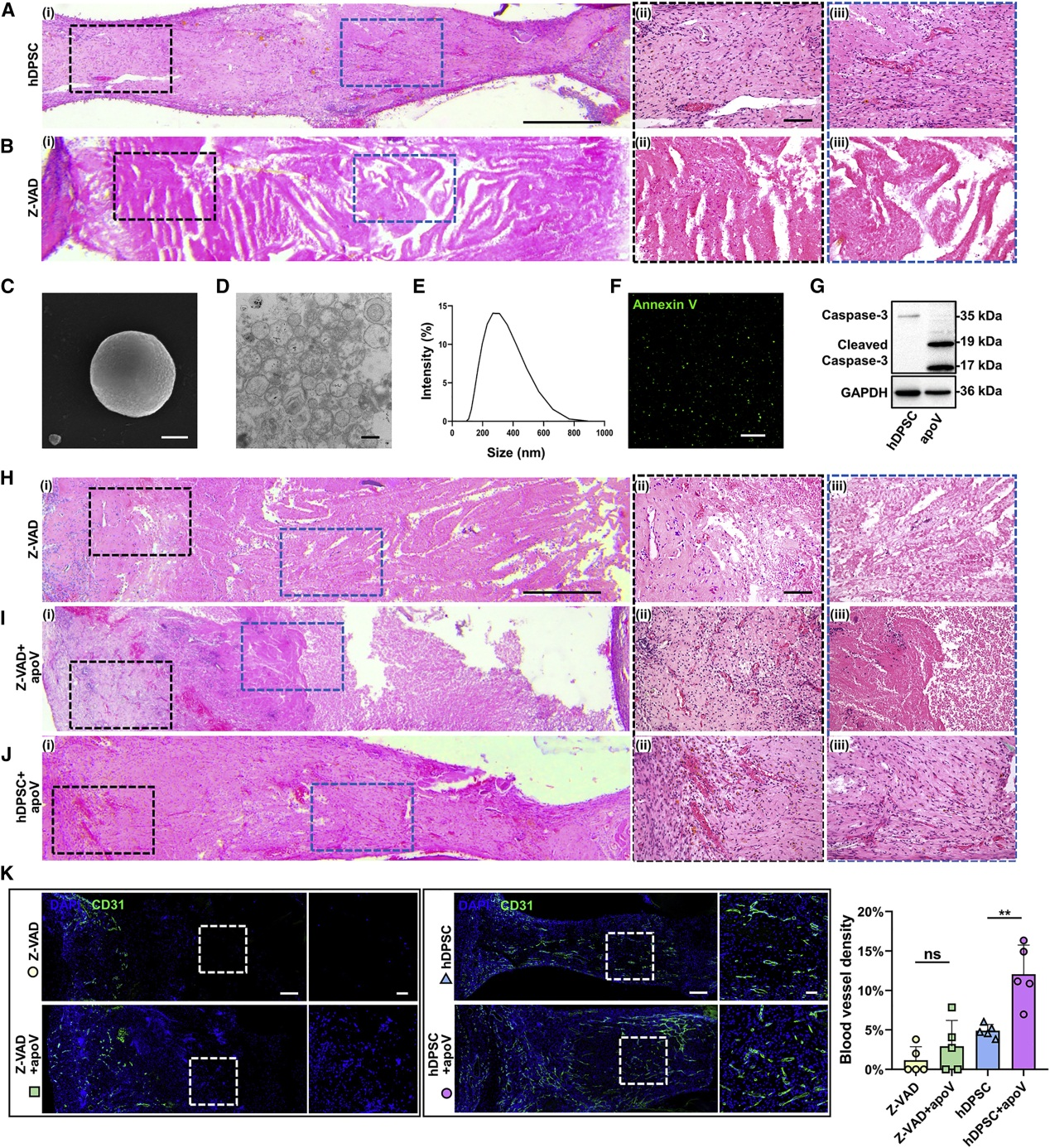
3. hDPSC-apoV促进组织再生
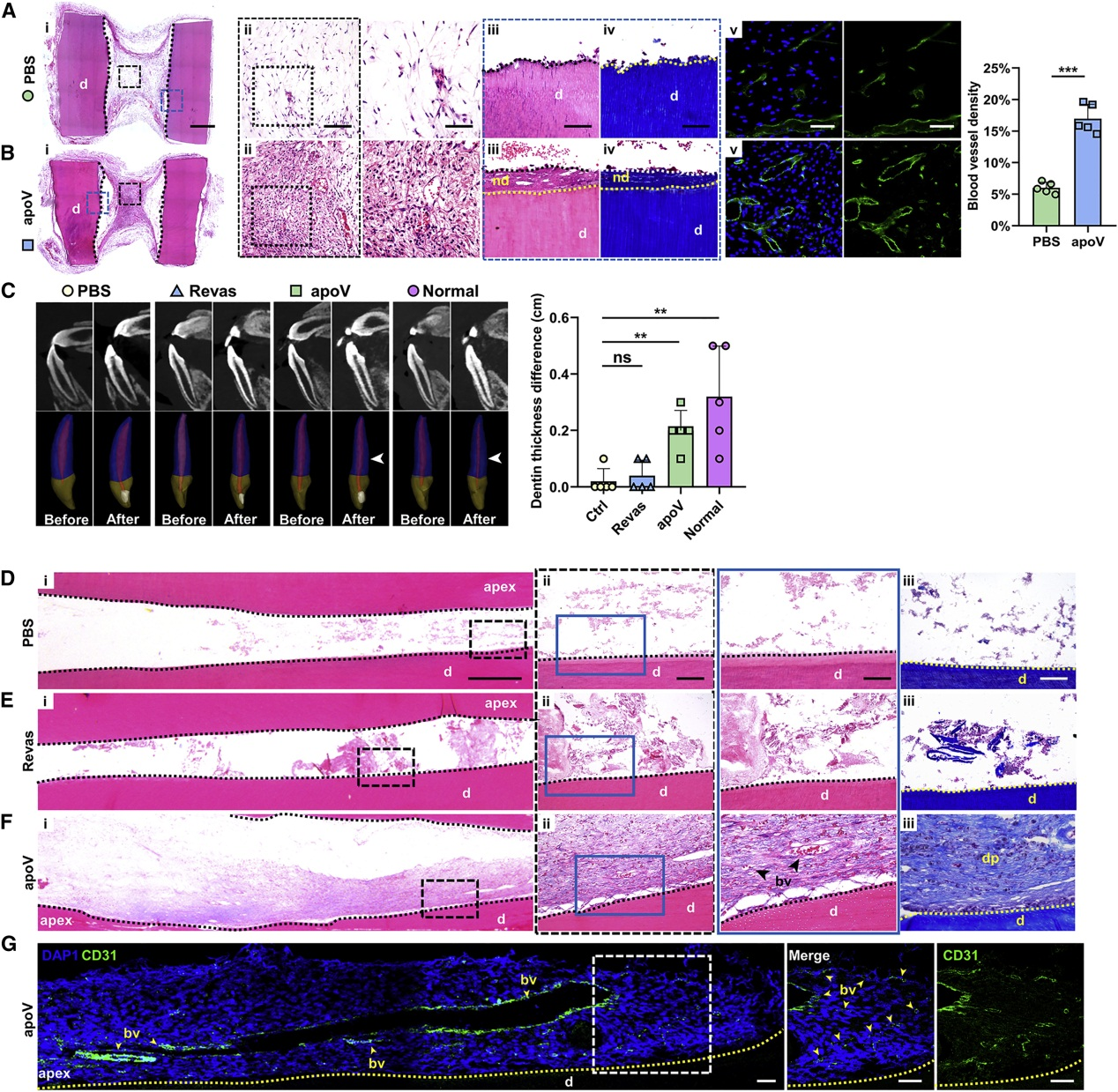
为进一步探讨apoV的血管生成作用,将载有PBS凝胶和hDPSC-apoV凝胶的支架植入裸鼠皮下,2个月后,HE、Masson和IF染色,结果显示apoV组有牙髓样组织形成、新生牙本质样组织增加,且具更高的血管密度。表明apoV促进体内血管再生。
去除牙髓建立的狗原位模型,分为PBS、apoV、Revas(血运重建)治疗组和正常组,3个月后,HE结果显示PBS组未形成纤维结缔组织,CBCT显示apoV组牙本质厚度平均增加0.2cm,有新的血管形成,而Revas组的治疗效果不明显。表明hDPSC-apoV通过刺激血管生成来促进牙髓再生。
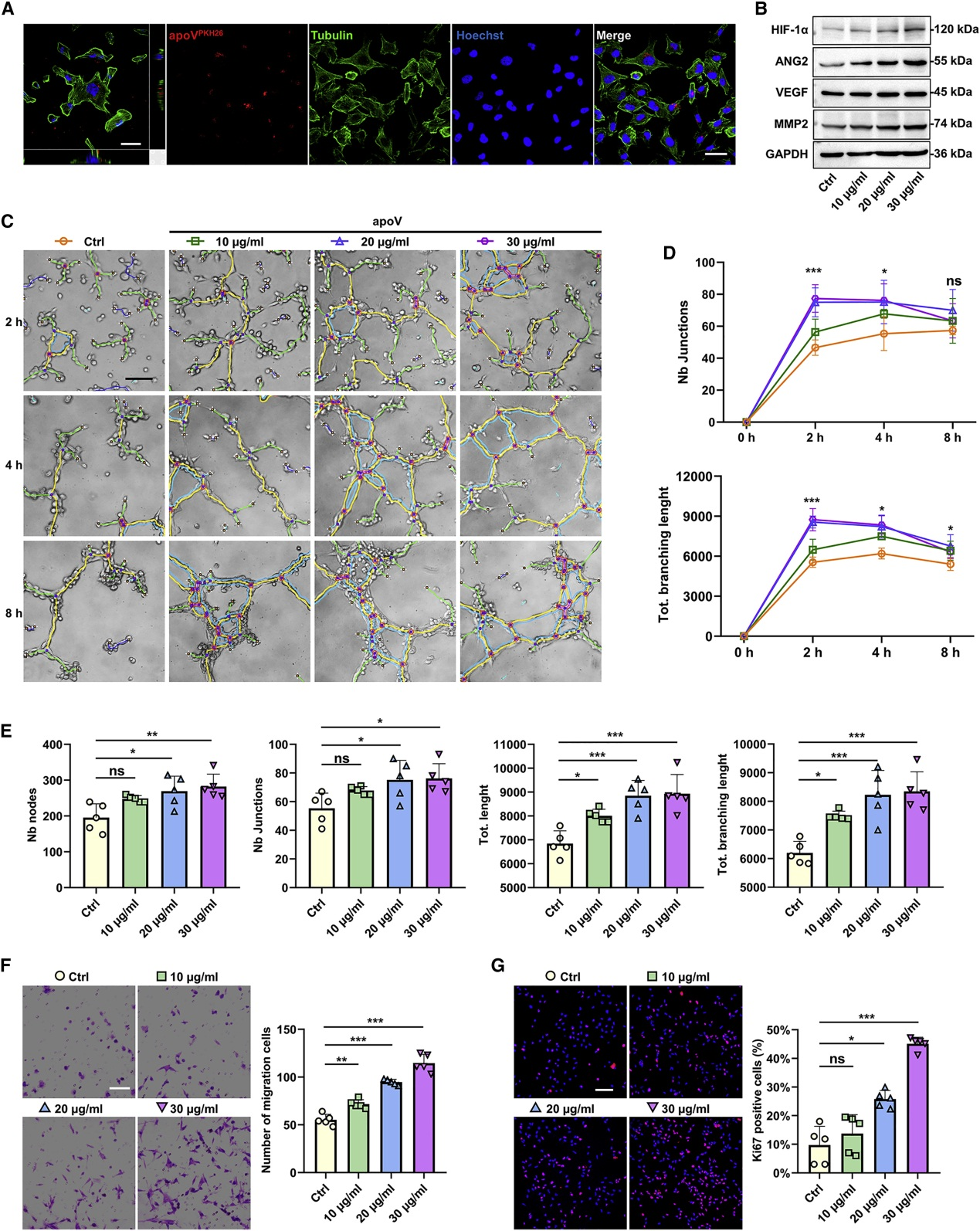
4. hDPSC-apoV被ECs内化并增强其血管生成能力
为探究hDPSC-apoV是如何促进血管生成的,将PKH26-apoV与HUVEC共孵育,发现apoV可被HUVEC摄取。同时apoV处理的HUVEC中血管生成和细胞迁移相关蛋白(HIF-1a、VEGF、ANG2和MMP2)的表达显著上调,Matrigel和Transwell分析显示apoV处理的HUVEC管形成和迁移能力增加。同时Ki67阳性细胞量增加,表明apoV的内化增强了体外EC的血管生成能力。
5. hDPSC-apoV通过诱导自噬调节EC功能
对hDPSC和apoV进行质谱分析发现有129种蛋白质在apoV中高表达,借助KEGG进行分析发现这些蛋白质富集于自噬相关通路,可能与apoV调节EC有关。
WB分析显示apoV处理EC后,自噬相关蛋白(ATG7、Beclin-1和LC3)表达上调。用表达mRFP-GFP-LC3的腺病毒感染EC细胞,在apoV处理后,可见黄色的自噬体和红色自溶酶体的存在。自噬体和溶酶体融合抑制剂氯喹CQ处理后,随apoV作用时间的增加,自噬体增多,同时LC3II表达增加。自噬抑制剂3-MA的存在逆转了apoV诱导的EC细胞血管生成、迁移和增殖能力增加。表明apoV通过调节自噬增强了EC血管生成。
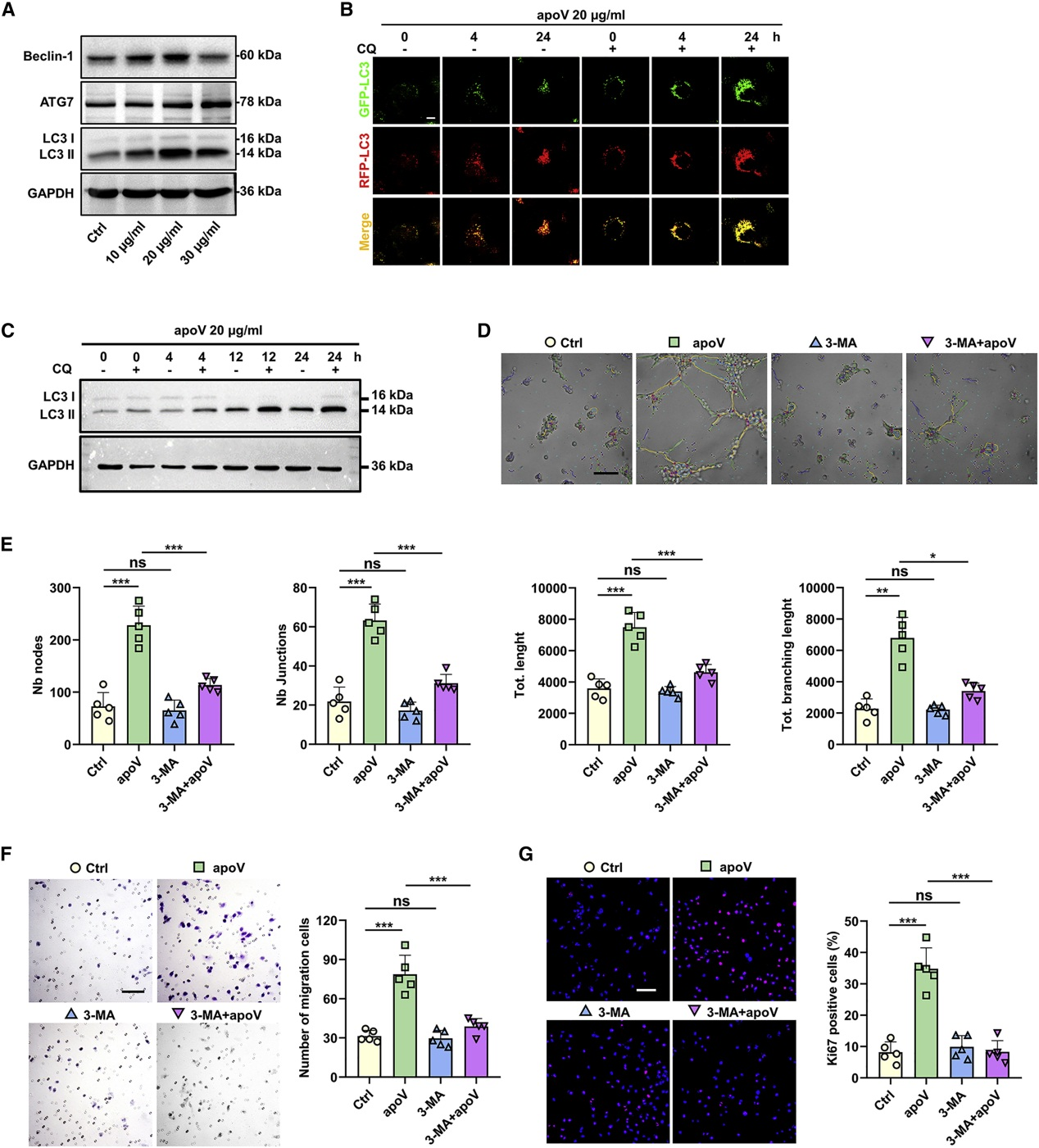
6. TUFM通过TFEB核转位激活EC自噬
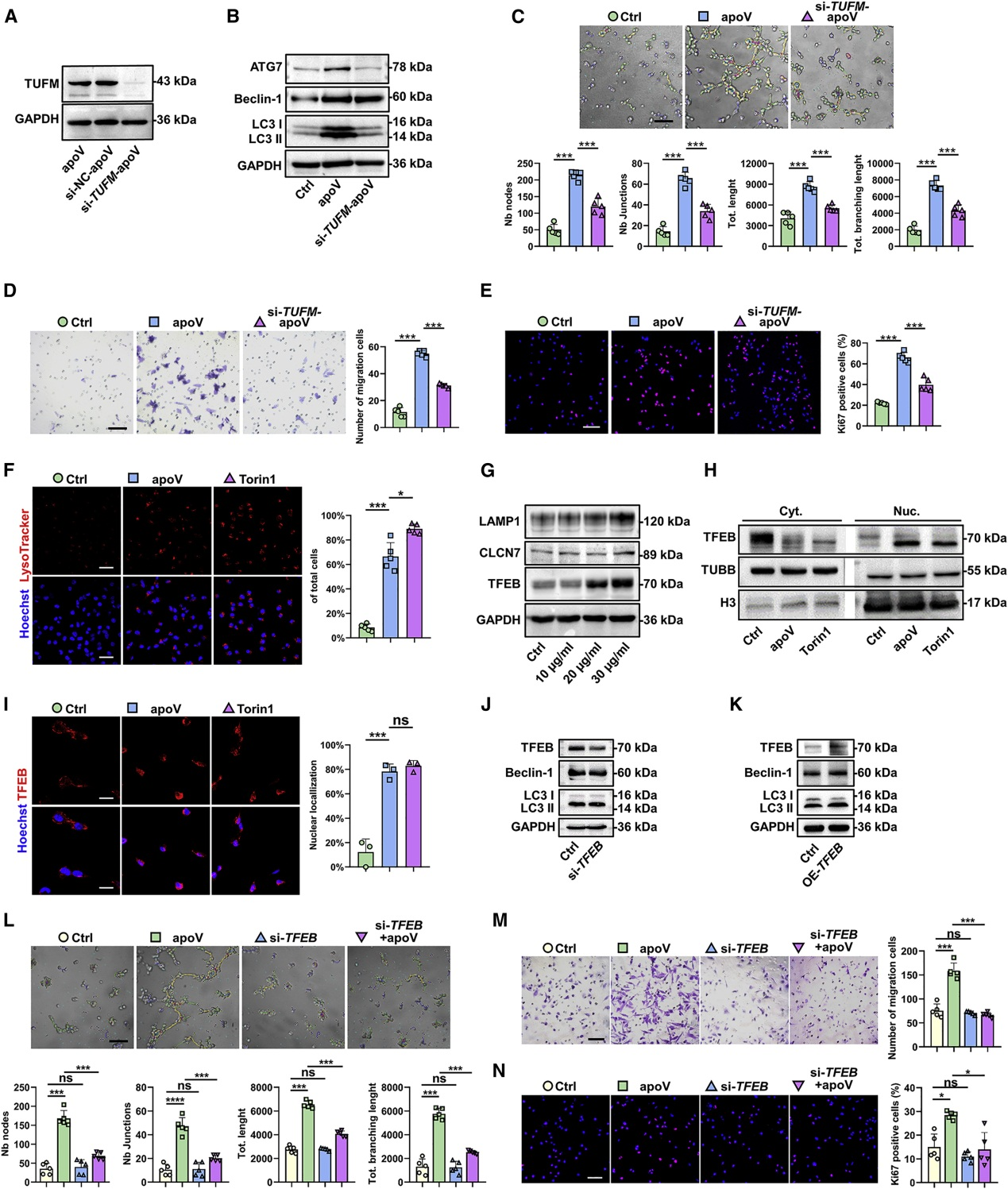
线粒体Tu翻译延伸因子(TUFM)是自噬效应器,富含于apoV中。在hDPSC中敲低TUFM后,apoV中TUFM含量相应降低。与对照组相比,用si-TUFM-apoV处理EC,显著降低自噬相关基因表达,减弱EC管形成、迁移和增殖。
由于TUFM可调节转录因子EB(TFEB)诱导自噬-溶酶体途径,作者用LysoTracker标记溶酶体,发现apoV处理后溶酶体数量增加,LAMP1、CLCN7和TFEB的表达增加。基于TFEB转移到细胞核中可调节自噬相关基因表达,作者通过WB和IF证实apoV的处理促进了TFEB的入核。此外敲低TFEB后,apoV诱导的EC管形成、迁移和增殖能力减弱。表明apoV- TUFM通过TFEB诱导的自噬-溶酶体途径激活EC自噬并促进血管生成。
7. hDPSC细胞凋亡通过体内自噬改善血运重建
为证实自噬对apoV介导的体内EC血管生成是必需的,通过3-MA注射到裸鼠体内,检测LC3II的表达,确定抑制效率后,将填充有3-MA+apoV组的牙齿支架植入裸鼠皮下,与apoV组相比,自噬抑制后不能诱导血管形成。说明自噬是apoV介导体内血管生成所必需的。
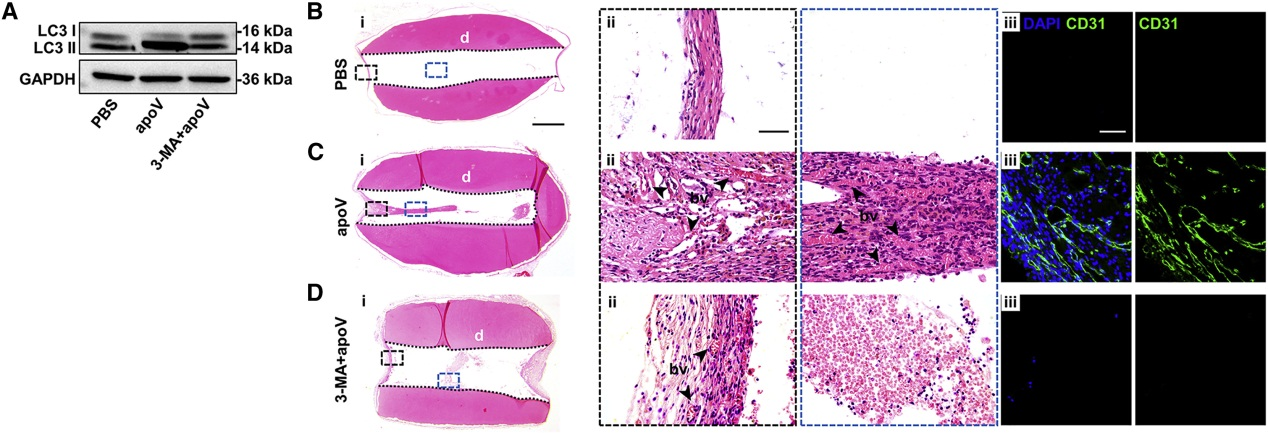
讨论:
外源聚集的hPDSC在植入根管后部分发生细胞凋亡,释放含TUFM的apoV,被内源性EC摄取后,通过诱导TFEB核转位,激活自噬信号通路诱导血管生成,加速血运重建,促进牙髓的有效再生。该研究深入了解了缺氧缺血微环境中细胞凋亡对牙髓血运重建和组织再生的意义,阐明了hPDSC-apoV调节EC血管生成的机制,为基于hPDSC-apoV改善早期血运重建恢复丢失的牙髓组织提供了一种有前景的方法。
空军军医大学轩昆团队在Molecular Therapy(IF:12.91)发表的研究成果,探讨了人类乳牙牙髓干细胞(hDPSC)来源的凋亡小泡(apoV)对牙髓再生过程的影响,证明了apoV可以激活受体细胞的自噬,从而在缺氧缺血环境中诱导宿主血管生成。


文章链接:https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(22)00304-5?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1525001622003045%3Fshowall%3Dtrue
技术路线:

实验结果:
1. 聚集的hDPSC发生细胞凋亡,导致牙髓再生
胶原酶消化法从人乳牙牙髓中分离出hDPSC,按先前报道的方法如FACS、诱导成骨成脂及单克隆成簇实验进行细胞鉴定。


将聚焦的hDPSC和PBS凝胶载入牙支架中,植入裸鼠背部,2个月后,HE显示hDPSC组形成牙髓样组织,IF证明有牙本质涎磷蛋白(DSPP)和牙本质基质蛋白1(DMP1)阳性的成牙本质细胞层存在。TUNEL和FACS显示缺氧缺血环境中植入hDPSC后会发生细胞凋亡。

2. hDPSC的凋亡是导致牙髓再生所必需的
为探究细胞凋亡在牙髓再生中的作用,事先用凋亡抑制剂Z-VAD预处理hDPSC,再载入牙齿支架,植入鼠皮下,HE结果显示hDPSC组能形成良好的牙髓样组织,但Z-VAD组未出现牙髓再生。
为进一步探究凋亡细胞释放的apoV在牙髓再生过程中的作用,从蛋白激酶C抑制剂STS诱导的hPDSC中分离apoV,经SEM、TEM和DSL进行表征,同时IF、FACS和WB证明了apoV标志物PtdSer和cleaved caspase-3的存在,表明成功分离apoV。

将Z-VAD、hDPSC和apoV按不同处理组合方式载入牙齿支架,植入裸鼠背部,2个月后,HE染色显示,与Z-AVD组相比,Z-AVD+apoV组牙支架开口附近坏死面积和血管生成减少。与hDPSC组相比,apoV可诱导新形成的牙髓样组织中生成血管。表明hDPSC细胞凋亡在牙髓再生中起积极作用,apoV促进血管的形成。

3. hDPSC-apoV促进组织再生
为进一步探讨apoV的血管生成作用,将载有PBS凝胶和hDPSC-apoV凝胶的支架植入裸鼠皮下,2个月后,HE、Masson和IF染色,结果显示apoV组有牙髓样组织形成、新生牙本质样组织增加,且具更高的血管密度。表明apoV促进体内血管再生。
去除牙髓建立的狗原位模型,分为PBS、apoV、Revas(血运重建)治疗组和正常组,3个月后,HE结果显示PBS组未形成纤维结缔组织,CBCT显示apoV组牙本质厚度平均增加0.2cm,有新的血管形成,而Revas组的治疗效果不明显。表明hDPSC-apoV通过刺激血管生成来促进牙髓再生。

4. hDPSC-apoV被ECs内化并增强其血管生成能力
为探究hDPSC-apoV是如何促进血管生成的,将PKH26-apoV与HUVEC共孵育,发现apoV可被HUVEC摄取。同时apoV处理的HUVEC中血管生成和细胞迁移相关蛋白(HIF-1a、VEGF、ANG2和MMP2)的表达显著上调,Matrigel和Transwell分析显示apoV处理的HUVEC管形成和迁移能力增加。同时Ki67阳性细胞量增加,表明apoV的内化增强了体外EC的血管生成能力。

5. hDPSC-apoV通过诱导自噬调节EC功能
对hDPSC和apoV进行质谱分析发现有129种蛋白质在apoV中高表达,借助KEGG进行分析发现这些蛋白质富集于自噬相关通路,可能与apoV调节EC有关。
WB分析显示apoV处理EC后,自噬相关蛋白(ATG7、Beclin-1和LC3)表达上调。用表达mRFP-GFP-LC3的腺病毒感染EC细胞,在apoV处理后,可见黄色的自噬体和红色自溶酶体的存在。自噬体和溶酶体融合抑制剂氯喹CQ处理后,随apoV作用时间的增加,自噬体增多,同时LC3II表达增加。自噬抑制剂3-MA的存在逆转了apoV诱导的EC细胞血管生成、迁移和增殖能力增加。表明apoV通过调节自噬增强了EC血管生成。

6. TUFM通过TFEB核转位激活EC自噬
线粒体Tu翻译延伸因子(TUFM)是自噬效应器,富含于apoV中。在hDPSC中敲低TUFM后,apoV中TUFM含量相应降低。与对照组相比,用si-TUFM-apoV处理EC,显著降低自噬相关基因表达,减弱EC管形成、迁移和增殖。
由于TUFM可调节转录因子EB(TFEB)诱导自噬-溶酶体途径,作者用LysoTracker标记溶酶体,发现apoV处理后溶酶体数量增加,LAMP1、CLCN7和TFEB的表达增加。基于TFEB转移到细胞核中可调节自噬相关基因表达,作者通过WB和IF证实apoV的处理促进了TFEB的入核。此外敲低TFEB后,apoV诱导的EC管形成、迁移和增殖能力减弱。表明apoV- TUFM通过TFEB诱导的自噬-溶酶体途径激活EC自噬并促进血管生成。

7. hDPSC细胞凋亡通过体内自噬改善血运重建
为证实自噬对apoV介导的体内EC血管生成是必需的,通过3-MA注射到裸鼠体内,检测LC3II的表达,确定抑制效率后,将填充有3-MA+apoV组的牙齿支架植入裸鼠皮下,与apoV组相比,自噬抑制后不能诱导血管形成。说明自噬是apoV介导体内血管生成所必需的。

讨论:
外源聚集的hPDSC在植入根管后部分发生细胞凋亡,释放含TUFM的apoV,被内源性EC摄取后,通过诱导TFEB核转位,激活自噬信号通路诱导血管生成,加速血运重建,促进牙髓的有效再生。该研究深入了解了缺氧缺血微环境中细胞凋亡对牙髓血运重建和组织再生的意义,阐明了hPDSC-apoV调节EC血管生成的机制,为基于hPDSC-apoV改善早期血运重建恢复丢失的牙髓组织提供了一种有前景的方法。






