研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【J Hematol Onco】23分+,hUC-EVs-ATO降低急性GVHD严重程度的研究
764 人阅读发布时间:2022-09-27 16:22
同种异基因造血干细胞移植(allo-HSCT)用于诊治各种造血系统恶性**,但急性移植物抗宿主病(aGVHD)是移植后的并发症,虽皮质类固醇和替代疗法已在临床上用于诊治aGVHD,但效果不佳。研究表明se2o3(ATO)可改善aGVHD,但其生物利用度低,具全身毒性,无法到达靶部位,而MSC-EV具有与MSC相当的诊治效果,且无致瘤性和栓塞问题,因此北京大学张晓军和黄晓辉课题组将ATO装载到hUC-EVs中,以研究hUC-EVs-ATO在HSCT后aGVHD小鼠模型中的诊治效果和潜在机制,并将成果发表在J Hematol Oncol (IF:23.169)杂志上。

文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9306027/
技术路线:
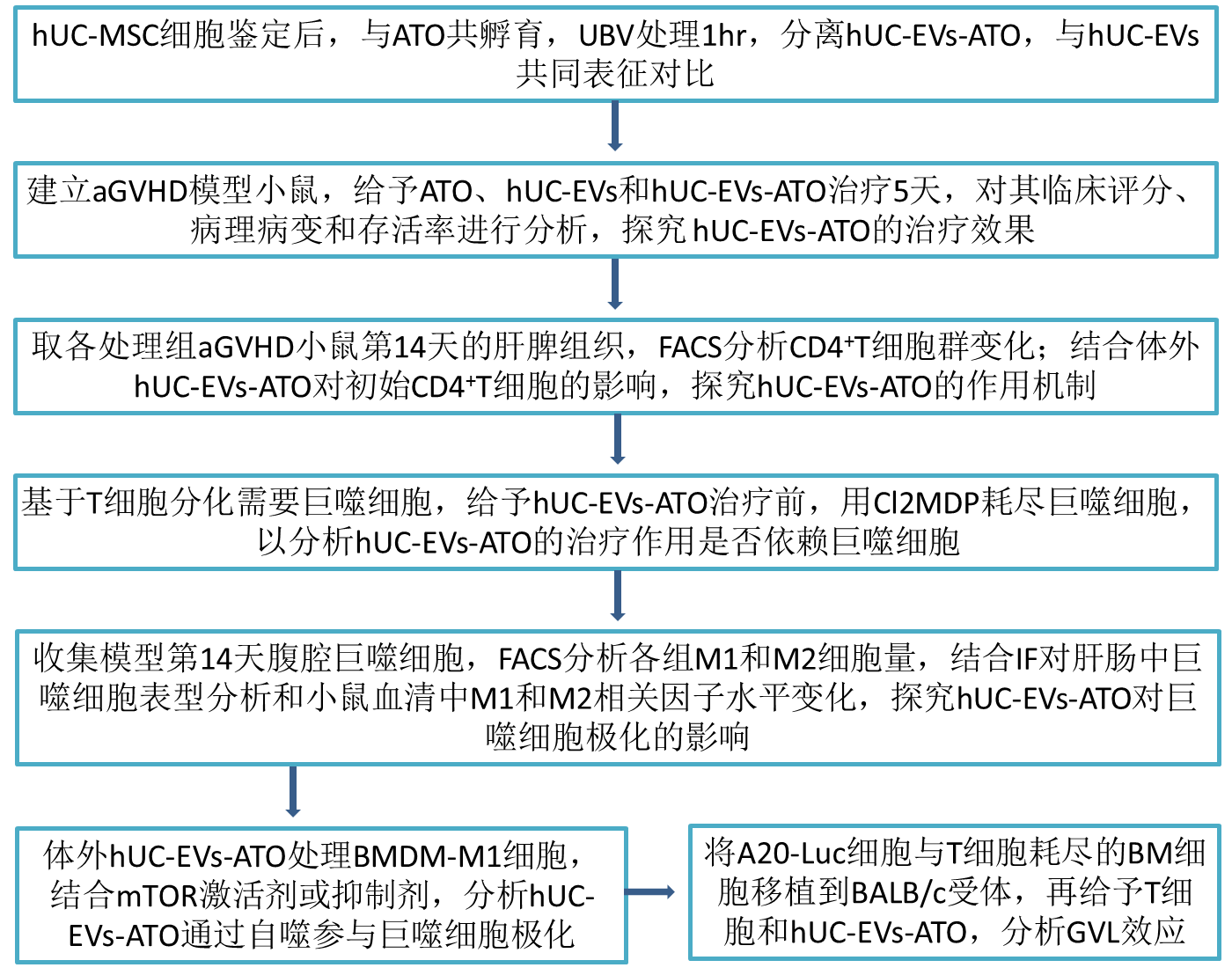
实验结果:
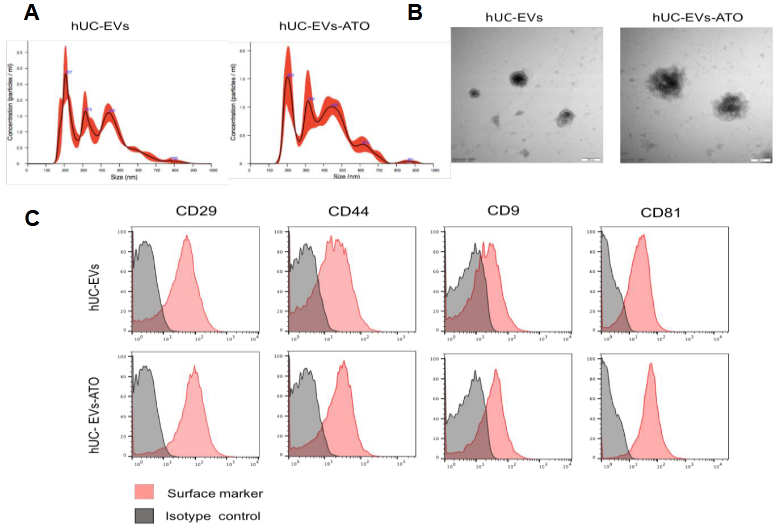
1. hUC-EVs-ATO的表征
对hUC-MSC细胞进行鉴定(诱导分化成骨、成脂和软骨形成,FACS检测表面标志物)后,与ATO共孵育,UBV处理1hr,收集培养上清液,分离EV,质谱法测定EV中ATO的浓度。下图是hUC-EVs和hUC-EVs-ATO表征结果,两者在大小、形态和标志蛋白方面没有差异。
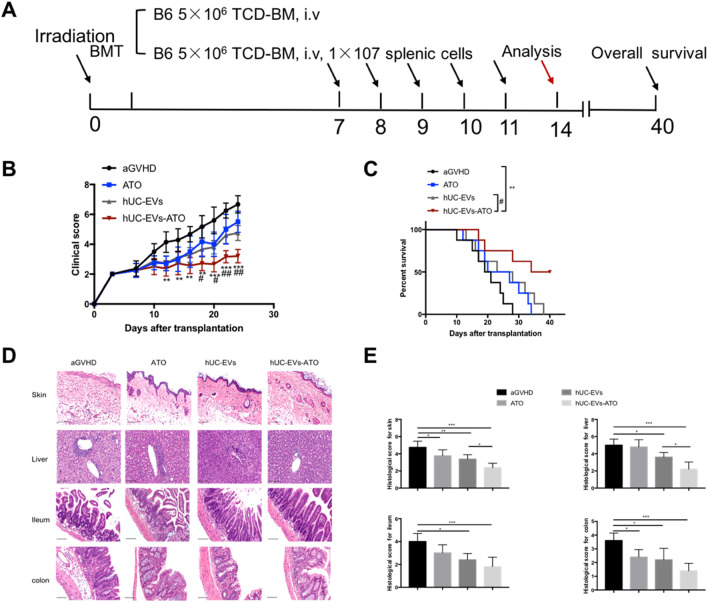
2. hUC-EVs-ATO减轻了小鼠模型中的aGVHD
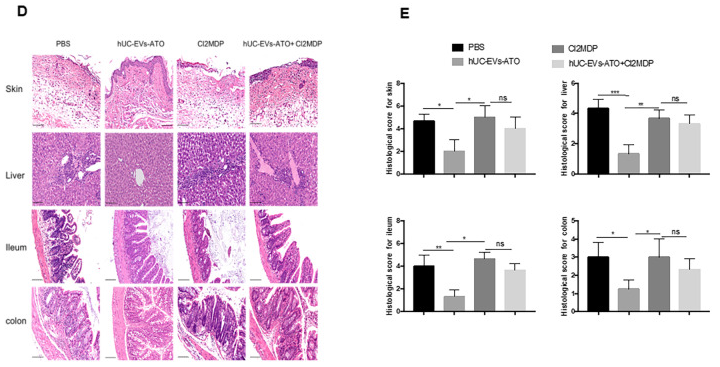
诱导BALB/c小鼠为aGVHD模型后,第7天开始连续5次腹腔注射PBS、ATO(1mg/kg)、hUC-EVs(1x106/mouse)和hUC-EVs-ATO(1x106/mouse,含4nmol ATO),第14天取组织进行IHC分析,发现ATO和hUC-EVs诊治效果相似,但hUC-EVs-ATO效果**,表现在临床评分**、病理病变极小和存活率的增加。表明hUC-EVs-ATO给药减轻了同种异体HSCT中aGVHD的严重程度。
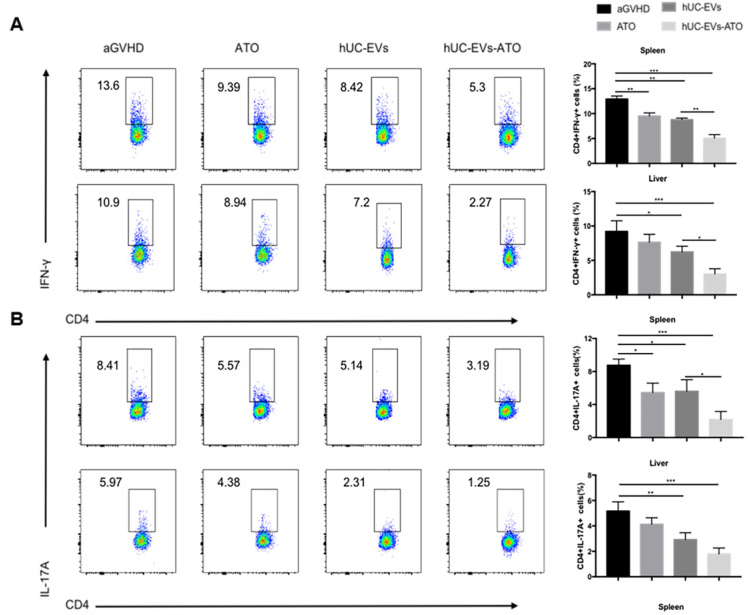
3. hUC-EVs-ATO在aGVHD小鼠中调节T细胞群,但在体外没有
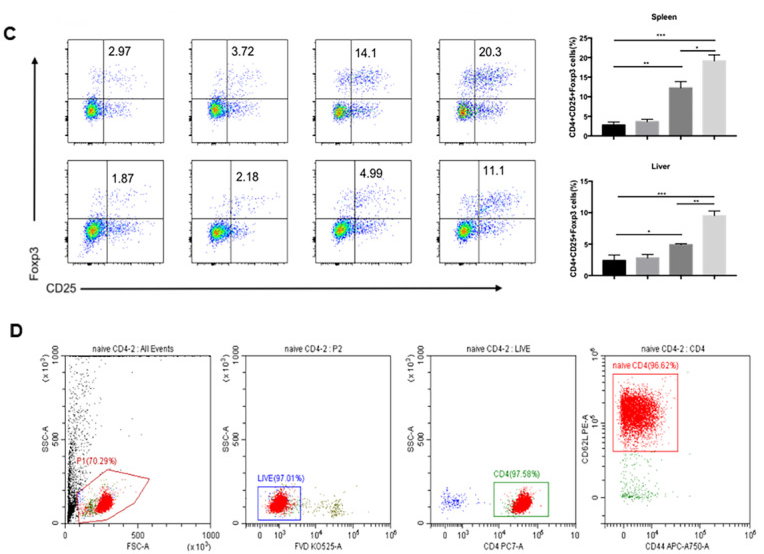
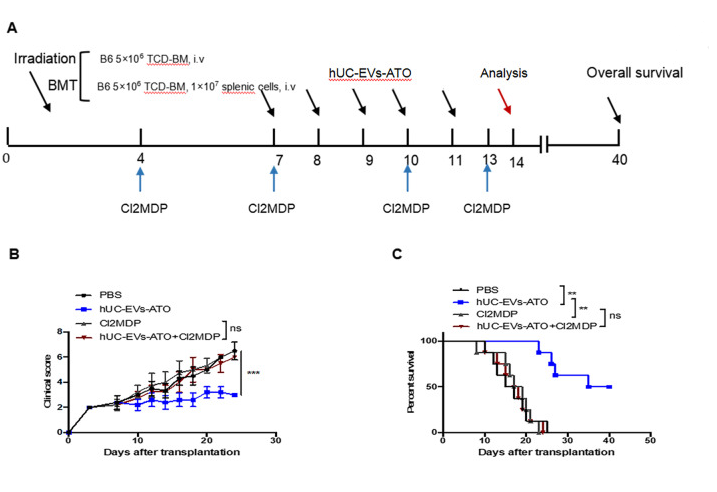
为了探究hUC-EVs-ATO的作用机制,取第14天的肝脾组织,FACS分析CD4+T细胞群时发现hUC-EVs-ATO诊治组的小鼠肝脾中CD4+CD25+FoxP3+ Tregs比例增加,IFN-γ+CD4+T和IL-17+CD4+ T 细胞比例降低。极化条件下,hUC-EVs-ATO处理C57BL/6小鼠脾中分离的初始CD4+T细胞后,既未减少Th1和Th17细胞,也未增加Treg细胞。表明hUC-EVs-ATO在aGVHD体内对同种异体T细胞的影响较大,但在体外对T细胞无影响。
4. hUC-EVs-ATO的诊治效果依赖于巨噬细胞
上述结果表明hUC-EVs-ATO可能调节T细胞分化,而T细胞分化需要巨噬细胞,在给予hUC-EVs-ATO诊治小鼠前,先用Cl2MDP耗尽巨噬细胞,发现hUC-EVs-ATO不能减轻aGVHD的严重程度,临床评分、组织病理评分和生存率与对照组无差异。表明巨噬细胞的缺失明显抑制了hUC-EVs-ATO的诊治效果。
5. hUC-EVs-ATO上调aGVHD小鼠中的M2巨噬细胞
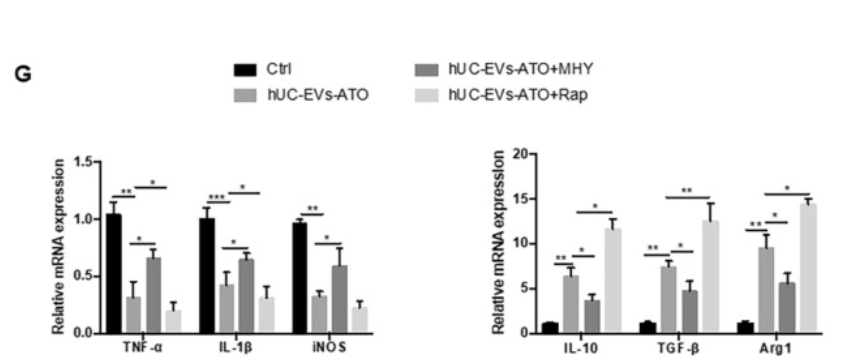
接着探究hUC-EVs-ATO是否影响aGVHD小鼠中巨噬细胞的极化,收集第14天小鼠腹腔巨噬细胞,FACS分析显示hUC-EVs明显降低M1(CD11b+F4/80+CD86+)巨噬细胞量,而hUC-EVs-ATO进一步降低该细胞。相反M2 (CD11b+F4/80+CD206+)巨噬细胞量在hUC-EVs-ATO处理后大幅度增加,这一结果与IF对肝肠中巨噬细胞表型的分析结果一致。同时,通过评估小鼠血清中M1和M2相关因子表达水平变化时,发现TNF-α, IL-6和 IL-1β水平明显降低,IL-10 和TGF-β水平升高。表明hUC-EVs-ATO促进了aGVHD小鼠的M2极化。
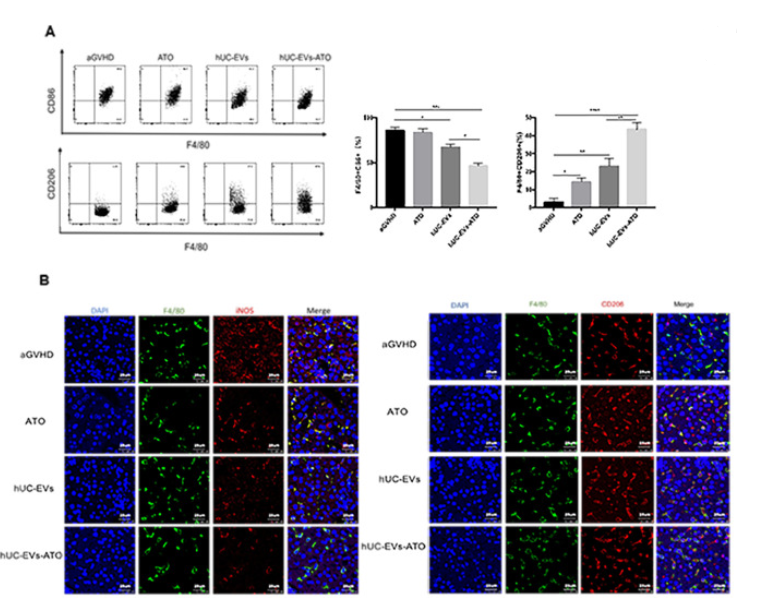
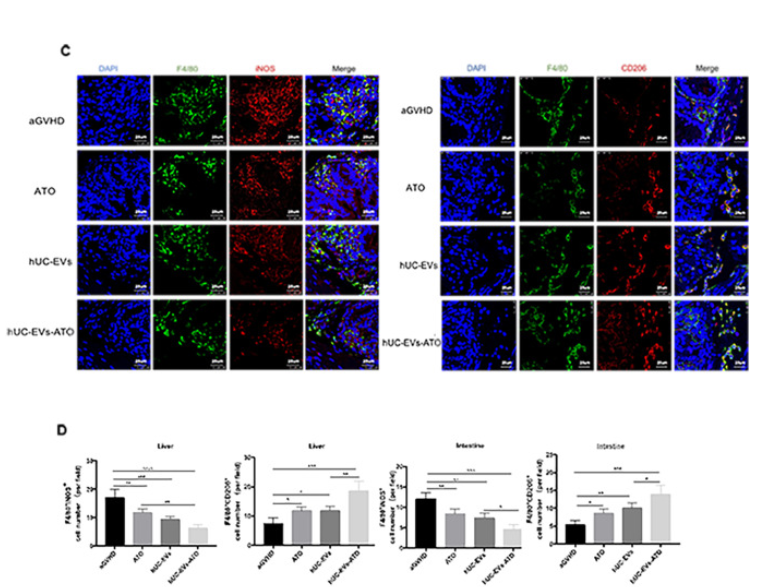
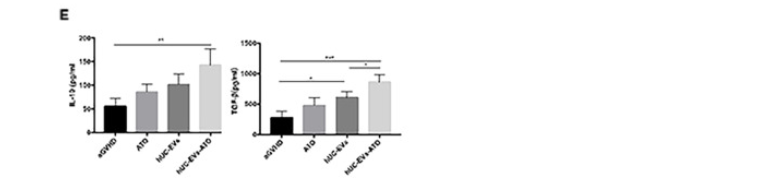
6. hUC-EVs-ATO在体外更有效地将M1巨噬细胞极化为M2巨噬细胞
为进一步验证hUC-EVs-ATO是否可以促进巨噬细胞从M1型向M2型极化,用hUC-EVs, ATO或 hUC-EVs-ATO在体外处理BMDM-M1巨噬细胞,结果显示hUC-EVs-ATO组的CD86+M1巨噬细胞数量降低,CD206+M2巨噬细胞增多。QPCR结果表明hUC-EVs-ATO组明显降低M1相关基因表达,上调M2相关基因表达。同时hUC-EVs-ATO可被RAW264.7细胞摄取,并诱导其由M1向M2极化。说明hUC-EVs-ATO可通过将M1细胞极化成M2细胞。
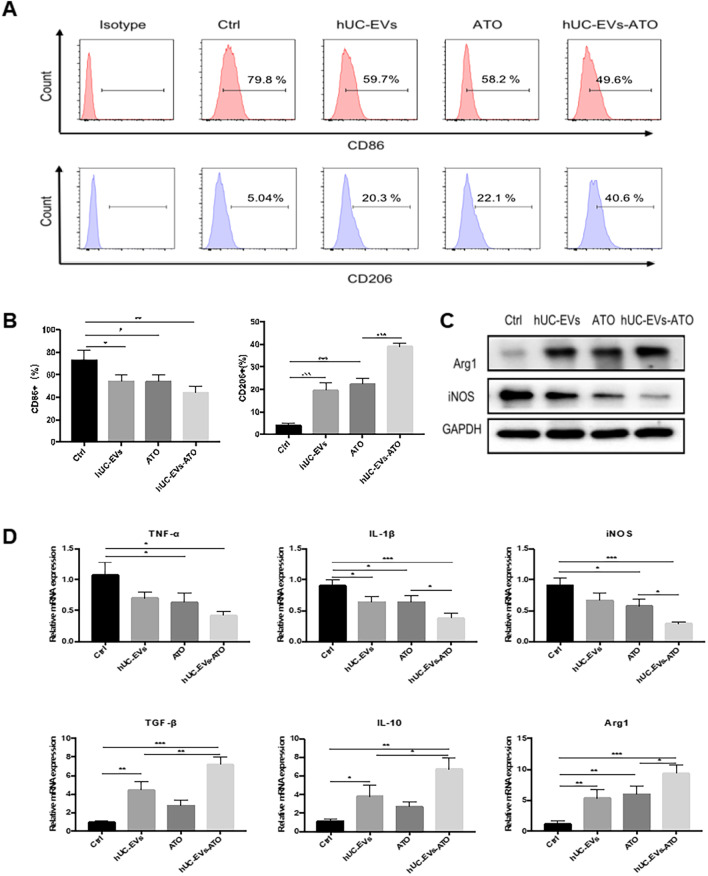
7. hUC-EVs-ATO通过以mTOR方式诱导自噬促进M2巨噬细胞极化
研究表明自噬参与巨噬细胞极化,因此作者将关注点转移到hUC-EVs-ATO对巨噬细胞自噬的影响。TEM和WB显示用hUC-EVs, ATO或 hUC-EVs-ATO在体外处理BMDM-M1巨噬细胞,均能增加自噬体的量、促进LC3II积累和p62的降解,且hUC-EVs-ATO作用效果极明显。p-mTOR的水平在hUC-EVs-ATO处理下明显降低,利用mTOR**剂MHY1485预处理BMDM-M1后,hUC-EVs-ATO介导的LC3II表达增加和p-mTOR、p62的降低被明显抑制,抑制了hUC-EVs-ATO对M1细胞向M2细胞极化;而mTOR抑制剂雷帕霉素刺激BMDM-M1后,hUC-EVs-ATO对M2巨噬细胞极化的促进作用得到加强。表明hUC-EVs-ATO通过以mTOR方式诱导自噬促进M2巨噬细胞极化。
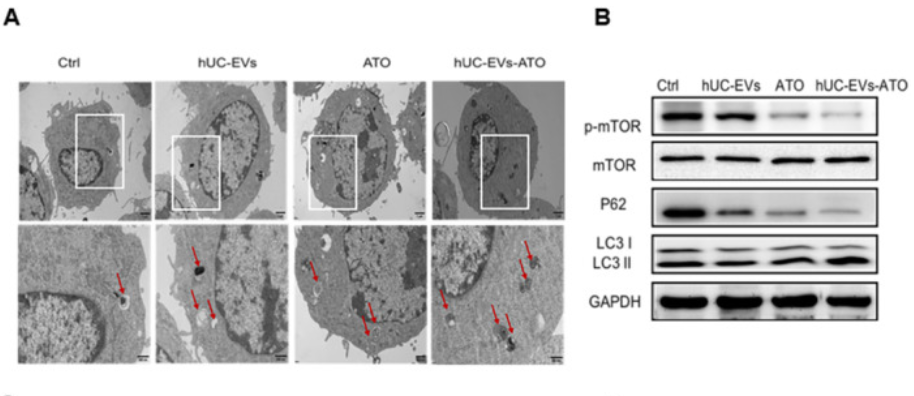
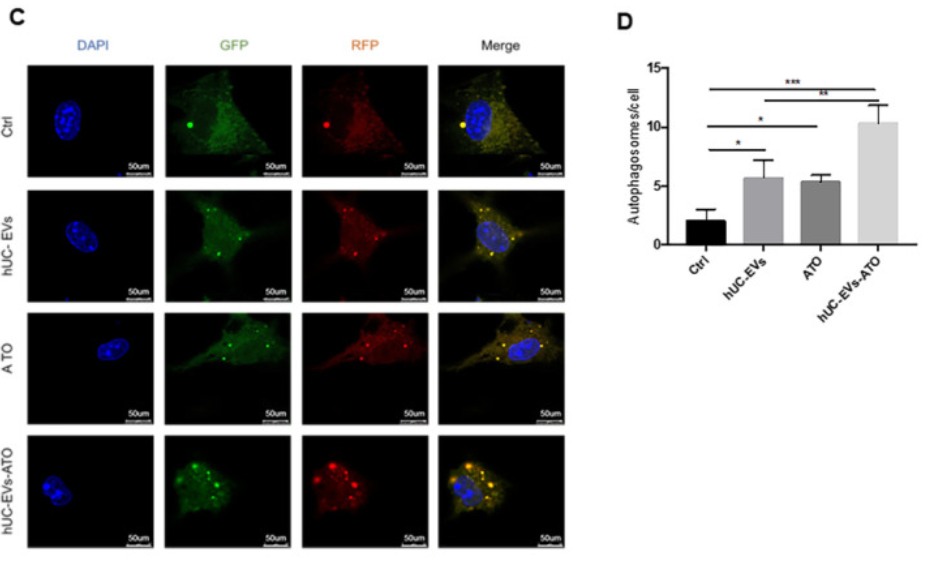
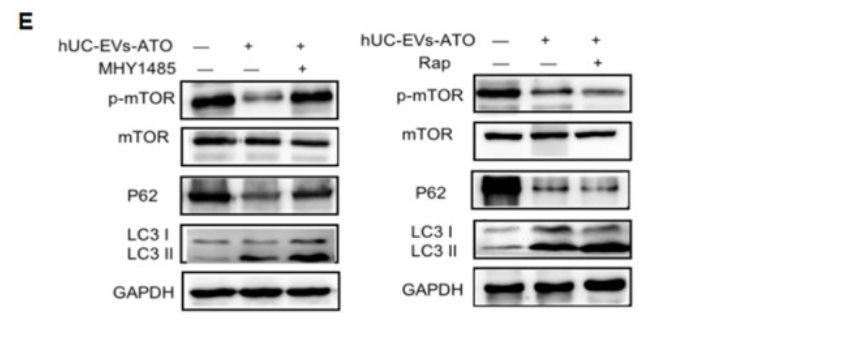
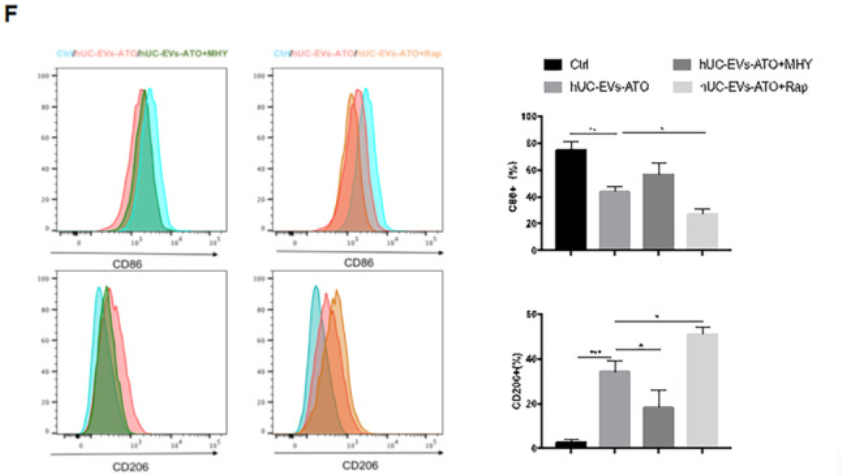
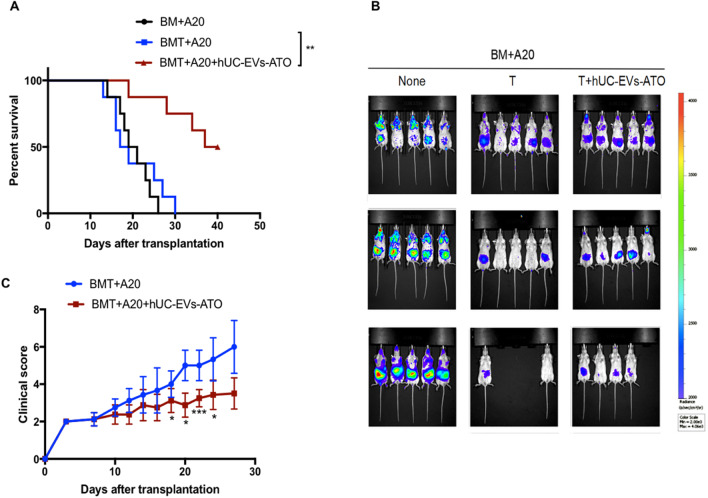
8. BMT后hUC-EVs-ATO保留了GVL效应
保持移植物抗淋巴瘤(GVL)效应是预防血液恶性**复发的关键,为探究hUC-EVs-ATO对GVL效应的影响,将A20-Luc细胞与T细胞耗尽的BM细胞或T细胞耗尽的BM细胞和脾细胞结合移植到BALB/c受体中,接受T细胞的小鼠体内**信号均降低,但没有hUC-EVs-ATO的存在小鼠极终死于aGVHD;接受hUC-EVs-ATO和T细胞的小鼠,存活率明显提高,表明hUC-EVs-ATO减轻了aGVHD,且不损害GVL活性。
讨论:
本研究中作者发现hUC-EVs-ATO可在不影响GVL活性的情况下降低allo-HSCT后的aGVHD。hUC-EVs-ATO通过提高体内外mTOR介导的自噬水平来促进M1巨噬细胞向M2巨噬细胞极化。但hUC-EVs-ATO对mTOR上游通路和自噬代谢通路的影响,及保留GVL效应的具体机制需进一步探究。该研究成果提供了一种降低aGVHD严重程度的新方法,同时保留有益的GVL效应。

文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9306027/
技术路线:

实验结果:
1. hUC-EVs-ATO的表征
对hUC-MSC细胞进行鉴定(诱导分化成骨、成脂和软骨形成,FACS检测表面标志物)后,与ATO共孵育,UBV处理1hr,收集培养上清液,分离EV,质谱法测定EV中ATO的浓度。下图是hUC-EVs和hUC-EVs-ATO表征结果,两者在大小、形态和标志蛋白方面没有差异。

2. hUC-EVs-ATO减轻了小鼠模型中的aGVHD
诱导BALB/c小鼠为aGVHD模型后,第7天开始连续5次腹腔注射PBS、ATO(1mg/kg)、hUC-EVs(1x106/mouse)和hUC-EVs-ATO(1x106/mouse,含4nmol ATO),第14天取组织进行IHC分析,发现ATO和hUC-EVs诊治效果相似,但hUC-EVs-ATO效果**,表现在临床评分**、病理病变极小和存活率的增加。表明hUC-EVs-ATO给药减轻了同种异体HSCT中aGVHD的严重程度。

3. hUC-EVs-ATO在aGVHD小鼠中调节T细胞群,但在体外没有
为了探究hUC-EVs-ATO的作用机制,取第14天的肝脾组织,FACS分析CD4+T细胞群时发现hUC-EVs-ATO诊治组的小鼠肝脾中CD4+CD25+FoxP3+ Tregs比例增加,IFN-γ+CD4+T和IL-17+CD4+ T 细胞比例降低。极化条件下,hUC-EVs-ATO处理C57BL/6小鼠脾中分离的初始CD4+T细胞后,既未减少Th1和Th17细胞,也未增加Treg细胞。表明hUC-EVs-ATO在aGVHD体内对同种异体T细胞的影响较大,但在体外对T细胞无影响。



4. hUC-EVs-ATO的诊治效果依赖于巨噬细胞
上述结果表明hUC-EVs-ATO可能调节T细胞分化,而T细胞分化需要巨噬细胞,在给予hUC-EVs-ATO诊治小鼠前,先用Cl2MDP耗尽巨噬细胞,发现hUC-EVs-ATO不能减轻aGVHD的严重程度,临床评分、组织病理评分和生存率与对照组无差异。表明巨噬细胞的缺失明显抑制了hUC-EVs-ATO的诊治效果。


5. hUC-EVs-ATO上调aGVHD小鼠中的M2巨噬细胞
接着探究hUC-EVs-ATO是否影响aGVHD小鼠中巨噬细胞的极化,收集第14天小鼠腹腔巨噬细胞,FACS分析显示hUC-EVs明显降低M1(CD11b+F4/80+CD86+)巨噬细胞量,而hUC-EVs-ATO进一步降低该细胞。相反M2 (CD11b+F4/80+CD206+)巨噬细胞量在hUC-EVs-ATO处理后大幅度增加,这一结果与IF对肝肠中巨噬细胞表型的分析结果一致。同时,通过评估小鼠血清中M1和M2相关因子表达水平变化时,发现TNF-α, IL-6和 IL-1β水平明显降低,IL-10 和TGF-β水平升高。表明hUC-EVs-ATO促进了aGVHD小鼠的M2极化。



6. hUC-EVs-ATO在体外更有效地将M1巨噬细胞极化为M2巨噬细胞
为进一步验证hUC-EVs-ATO是否可以促进巨噬细胞从M1型向M2型极化,用hUC-EVs, ATO或 hUC-EVs-ATO在体外处理BMDM-M1巨噬细胞,结果显示hUC-EVs-ATO组的CD86+M1巨噬细胞数量降低,CD206+M2巨噬细胞增多。QPCR结果表明hUC-EVs-ATO组明显降低M1相关基因表达,上调M2相关基因表达。同时hUC-EVs-ATO可被RAW264.7细胞摄取,并诱导其由M1向M2极化。说明hUC-EVs-ATO可通过将M1细胞极化成M2细胞。

7. hUC-EVs-ATO通过以mTOR方式诱导自噬促进M2巨噬细胞极化
研究表明自噬参与巨噬细胞极化,因此作者将关注点转移到hUC-EVs-ATO对巨噬细胞自噬的影响。TEM和WB显示用hUC-EVs, ATO或 hUC-EVs-ATO在体外处理BMDM-M1巨噬细胞,均能增加自噬体的量、促进LC3II积累和p62的降解,且hUC-EVs-ATO作用效果极明显。p-mTOR的水平在hUC-EVs-ATO处理下明显降低,利用mTOR**剂MHY1485预处理BMDM-M1后,hUC-EVs-ATO介导的LC3II表达增加和p-mTOR、p62的降低被明显抑制,抑制了hUC-EVs-ATO对M1细胞向M2细胞极化;而mTOR抑制剂雷帕霉素刺激BMDM-M1后,hUC-EVs-ATO对M2巨噬细胞极化的促进作用得到加强。表明hUC-EVs-ATO通过以mTOR方式诱导自噬促进M2巨噬细胞极化。





8. BMT后hUC-EVs-ATO保留了GVL效应
保持移植物抗淋巴瘤(GVL)效应是预防血液恶性**复发的关键,为探究hUC-EVs-ATO对GVL效应的影响,将A20-Luc细胞与T细胞耗尽的BM细胞或T细胞耗尽的BM细胞和脾细胞结合移植到BALB/c受体中,接受T细胞的小鼠体内**信号均降低,但没有hUC-EVs-ATO的存在小鼠极终死于aGVHD;接受hUC-EVs-ATO和T细胞的小鼠,存活率明显提高,表明hUC-EVs-ATO减轻了aGVHD,且不损害GVL活性。

讨论:
本研究中作者发现hUC-EVs-ATO可在不影响GVL活性的情况下降低allo-HSCT后的aGVHD。hUC-EVs-ATO通过提高体内外mTOR介导的自噬水平来促进M1巨噬细胞向M2巨噬细胞极化。但hUC-EVs-ATO对mTOR上游通路和自噬代谢通路的影响,及保留GVL效应的具体机制需进一步探究。该研究成果提供了一种降低aGVHD严重程度的新方法,同时保留有益的GVL效应。






