研载生物科技(上海)有限公司
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【J Extracell Vesicles】17分+,富含HAX1的细胞外囊泡通过调节ITGB6翻译促进血管生成
616 人阅读发布时间:2022-10-10 14:20
鼻咽cancer(NPC)是起源于鼻咽粘膜内层的上皮cancer,具有高度的侵袭性和转移性。HS1相关蛋白X-1(HAX1)可与各种蛋白质和mRNA的3’-UTR相互作用发挥复杂的生物学作用,其过表达与tumour患者的不良预后有关。
越来越多的证据表明,EV通过多种机制参与各种人类疾病的进展,南通大学附属医院尤易文课题组前期研究发现富含HAX1的EV与NPC的转移有关,但其促进NPC血管生成的分子机制尚未阐明,今年5月他们通过动物和细胞模型深入探讨了其中的分子机制,并在J Extracell Vesicles(IF:17.338)上发表了该成果
 文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9077140/
文章链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9077140/
技术路线:

实验结果:
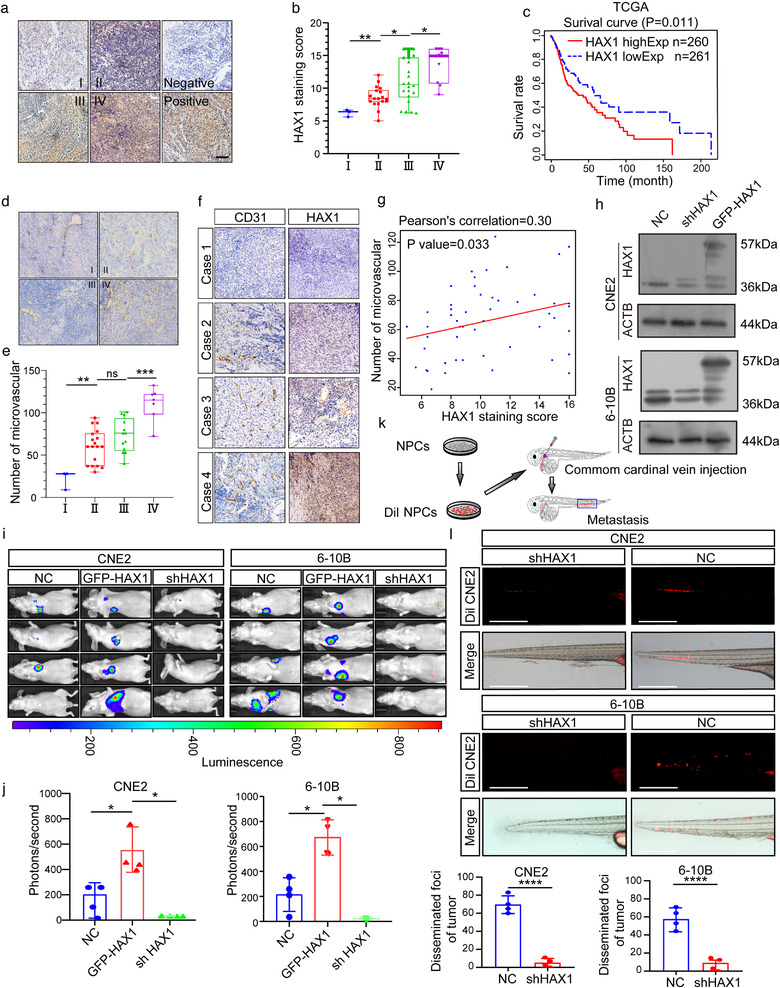
1. HAX1上调促进NPC转移和血管生成
为验证HAX1在NPC进展中的作用,作者利用IHC、TCGA和CD31 IHC计算NPC中MVD,结果显示HAX1的高表达与晚期NPC、患者不良预后及高MVD正相关。从多种NPC细胞中筛选出高表达和中低表达HAX1的CNE2和6-10B细胞用于后续研究。两细胞中通过慢病毒转导shHAX1和GFP-HAX1,建立BALB/c小鼠模型,发现shHAX1明显抑制了CNE2和6-10B细胞的转移能力。将DiL-CNE2细胞注射到斑马鱼的主静脉中,3天后,shHAX1组斑马鱼尾部转移性tumour细胞数量低于NC组。表明NPC中HAX1表达影响NPC进展和血管生成。
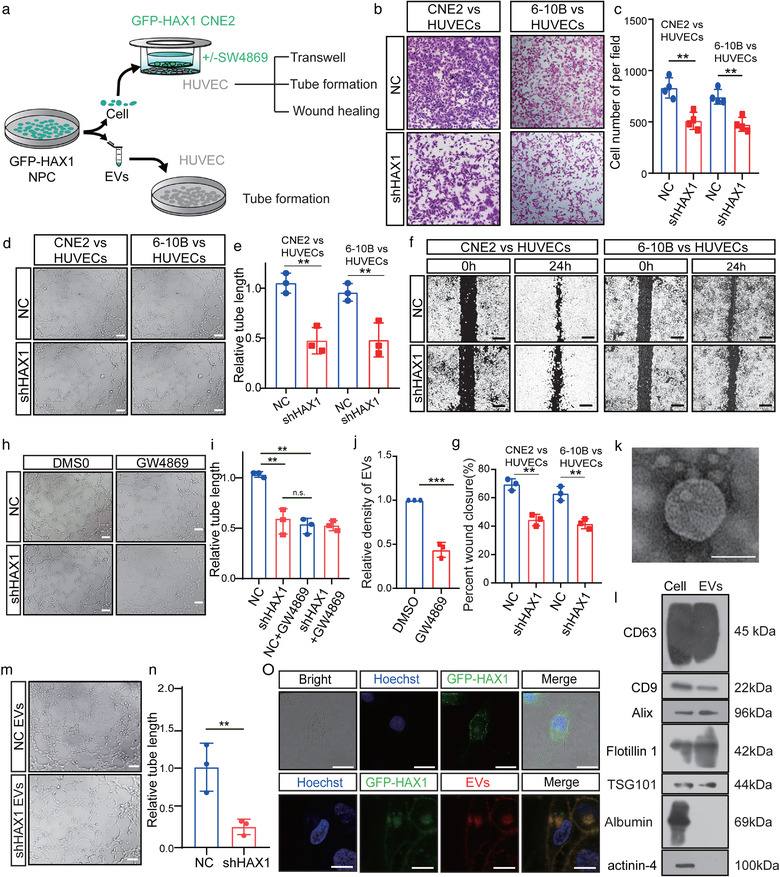
2. 富含HAX1的EV促进NPC的血管生成
如下图所示,建立NPC和HUVEC共培养系统,来研究HAX1在血管生成中的作用,发现与NC组相比,CNE2-shHAX1组共培养的HUVEC血管生成和迁移能力明显降低。GW4869的处理,能明显抑制CNE2-NC促进血管生成。从转染GFP-HAX1的CNE2细胞中分离EV,与HUVEC共孵育,在HUVEC中可观察到绿色信号,说明HUVEC摄取了富含HAX1的EV。
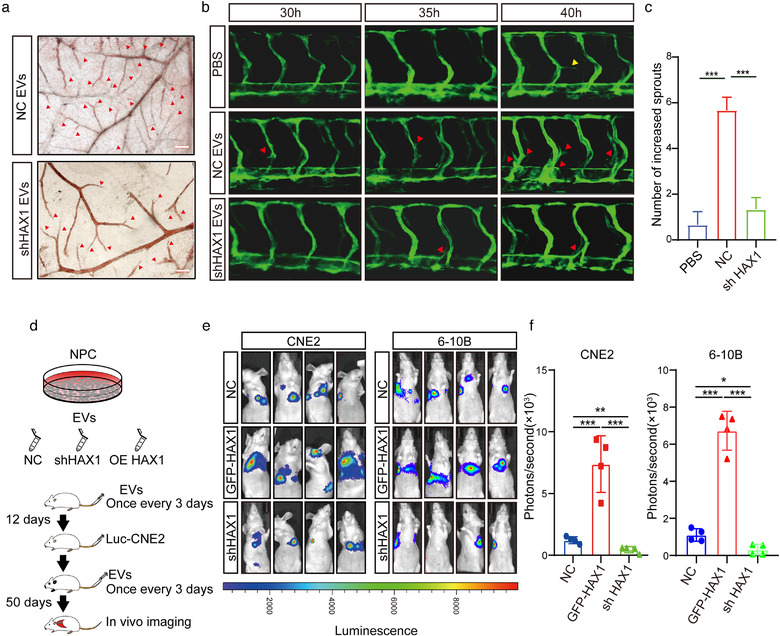
提取CNE2-NC和CNE2-shHAX1细胞EV,注入斑马鱼胚胎或鸡胚绒毛尿囊膜(CAM)中,发现EV-shHAX1明显抑制了CAM和斑马鱼胚胎的血管生成。将带Luc信号的CNE2和6-10B细胞注入裸鼠尾静脉中,再给予EV-NC、EV-shHAX1和EV-GFP-HAX1,来探究EV-HAX1是否促进转移,结果显示,EV-shHAX1组的远端转移灶较少,EV-GFP-HAX1组的远端转移灶较多。经患者血清EV丰度的分析,发现EV的密度与疾病进展和患者预后没有明显统计学相关性,说明EV的功能并不取决于其数量或其中HAX1的含量。
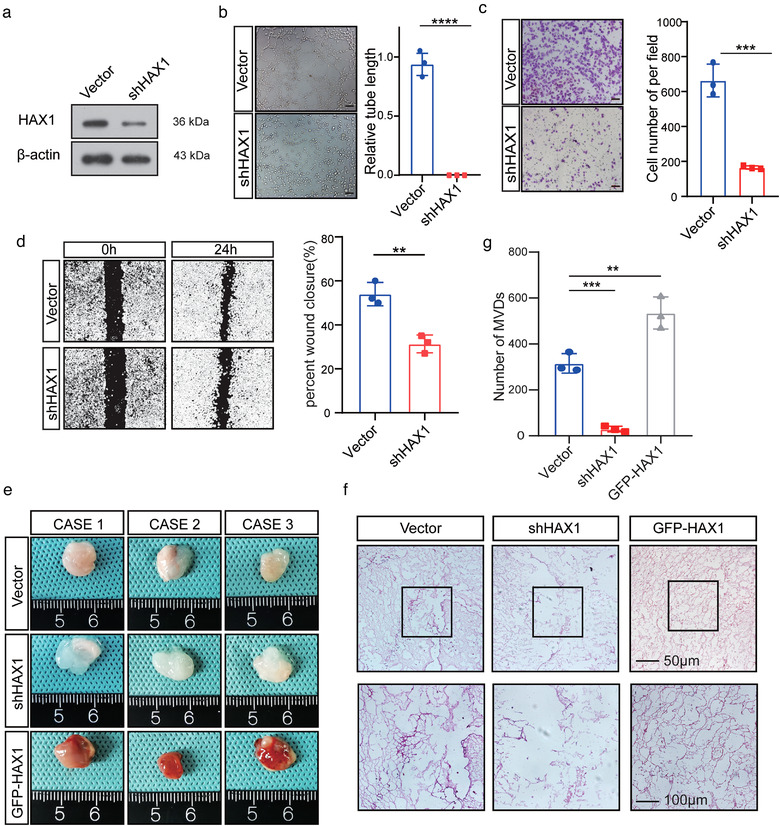
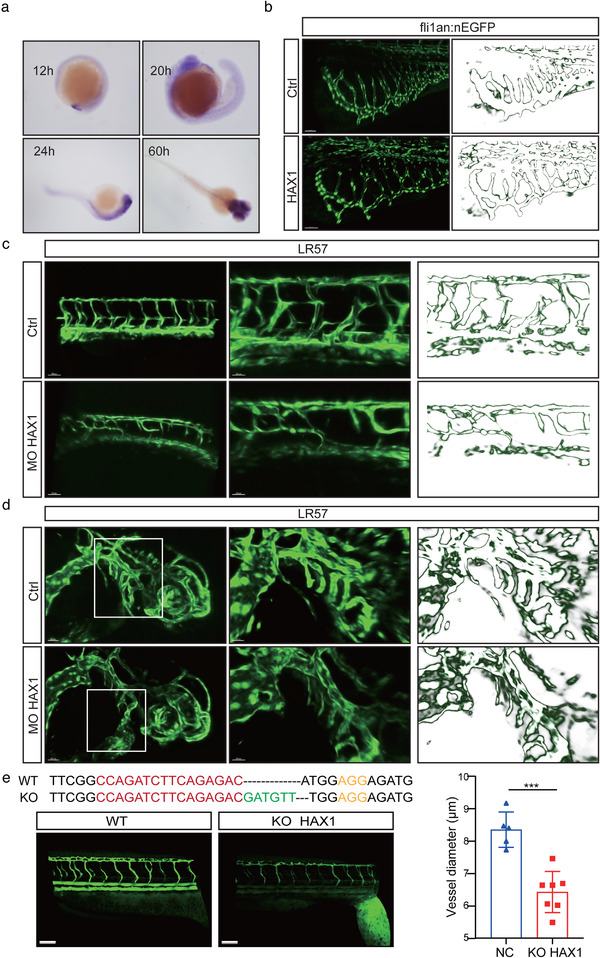
在HUVEC细胞中敲低HAX1后,能明显抑制其迁移和管形成能力,同时抑制HUVEC的体内血管生成能力。表明HAX1对血管生成起到关键作用。为分析其表达是否是血管特异性的,作者进行了HPA数据库分析,发现HAX1在一些具有很强再生能力的组织和细胞中高表达,如肝、直肠和精母细胞,且可能在未成熟血管中高表达。
 斑马鱼胚胎原位杂交结果显示,HAX1在24hpf之前主要表达与大脑、主静脉和发育中的血管中,但随着斑马鱼的成熟,其血管中HAX1的表达逐渐降低。为验证HAX1在体内血管发育中的作用,在斑马鱼胚胎中注射HAX1 mRNA或HAX1 ATG‐targeting morphants(抑制HAX1),与Ctrl组相比,HAX1 mRNA组肠下血管出现较多分支,而MO-HAX1组的节间和头部血管明显缺失。同样CRISPR/Cas9敲除斑马鱼中的HAX1后,血管发育延迟,节间血管支架明显小于Ctrl组,与MO-HAX1作用一致。
斑马鱼胚胎原位杂交结果显示,HAX1在24hpf之前主要表达与大脑、主静脉和发育中的血管中,但随着斑马鱼的成熟,其血管中HAX1的表达逐渐降低。为验证HAX1在体内血管发育中的作用,在斑马鱼胚胎中注射HAX1 mRNA或HAX1 ATG‐targeting morphants(抑制HAX1),与Ctrl组相比,HAX1 mRNA组肠下血管出现较多分支,而MO-HAX1组的节间和头部血管明显缺失。同样CRISPR/Cas9敲除斑马鱼中的HAX1后,血管发育延迟,节间血管支架明显小于Ctrl组,与MO-HAX1作用一致。
 4. HAX1促进HUVEC中的蛋白质翻译
4. HAX1促进HUVEC中的蛋白质翻译
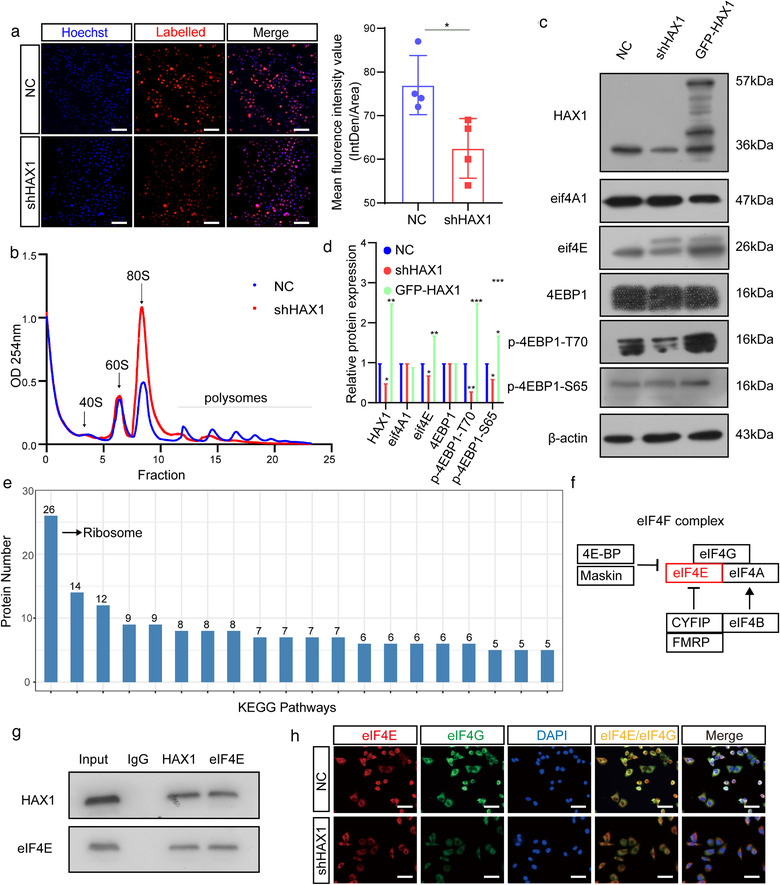
为探究其潜在机制,对野生型和HAX1-KO斑马鱼进行全转率组测序,结合通路富集分析和TCGA分析,发现HAX1与血管形成基因的表达无明显相关性。因此猜测可能通过调节蛋白质翻译参与血管生成。对新生蛋白质合成进行分析,发现shHAX1-HUVEC蛋白质合成水平明显降低,不利于多核糖体的形成,降低了eIF4E和磷酸化4EBP1的水平。经IP-MS和co-IP分析发现HAX1与eIF4E相互作用,且在4EGI的作用下,HAX1促进HUVEC迁移和管形成的能力被明显抑制。
5. HAX1调节HUVECs中ITGB6 mRNA的翻译
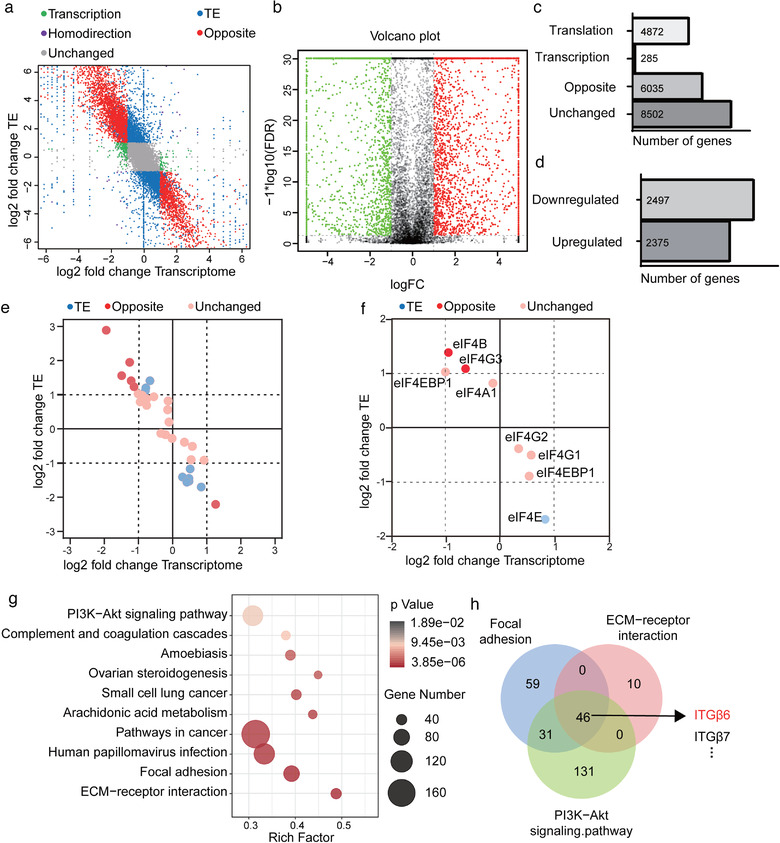
为了解HUVEC的血管生成依赖于HAX1的翻译调节作用,对shHAX1和Ctrl的HUVEC进行核糖体分析,发现在shHAX1组的核糖体中有2497个基因翻译受到下调,2375个基因的翻译受到上调,且观察到eIF4E的TE明显下降。
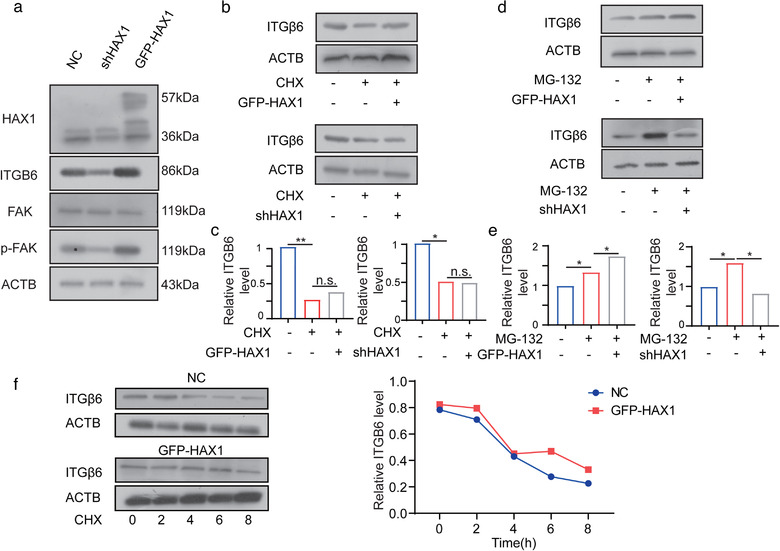
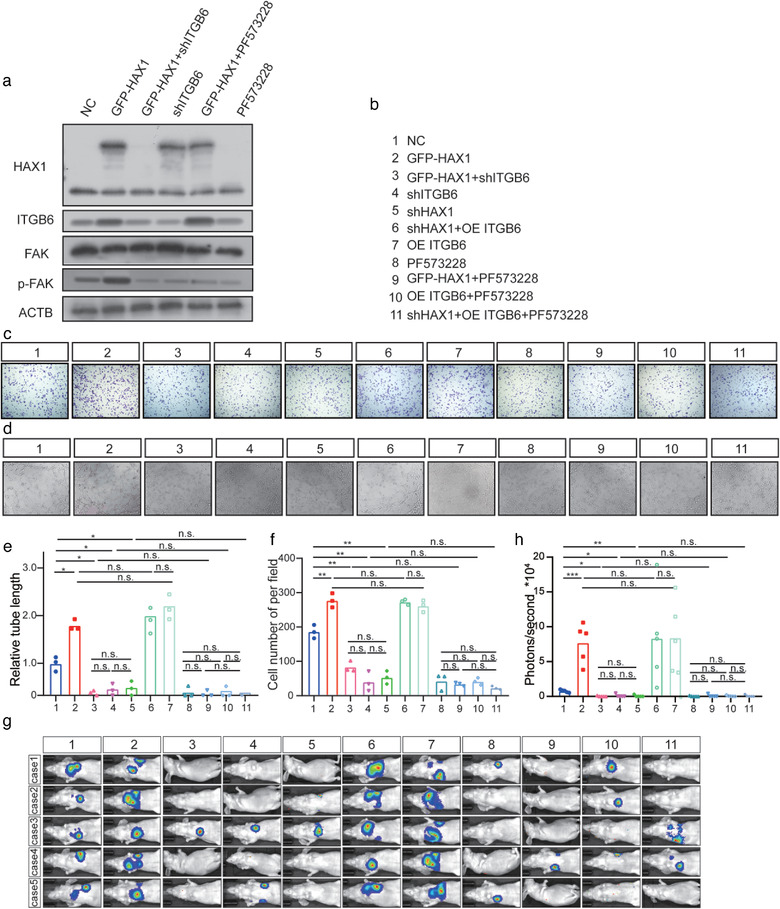
 对2497个上调的转录本进行通路富集分析,发现主要涉及PI3K信号通路、粘着斑和ECM-受体相互作用等,整合素家族在这些途经中均富集,其中ITGB6受到HAX1影响max。通过WB证实shHAX1抑制了ITGB6的表达及FAK的磷酸化。利用C15H23NO₄处理HUVEC,证明HAX1不影响ITGB6的半衰期;用MG132进一步证实HAX1影响了ITGB6的翻译效率。
对2497个上调的转录本进行通路富集分析,发现主要涉及PI3K信号通路、粘着斑和ECM-受体相互作用等,整合素家族在这些途经中均富集,其中ITGB6受到HAX1影响max。通过WB证实shHAX1抑制了ITGB6的表达及FAK的磷酸化。利用C15H23NO₄处理HUVEC,证明HAX1不影响ITGB6的半衰期;用MG132进一步证实HAX1影响了ITGB6的翻译效率。
6.HAX1通过FAK通路促进NPC的血管生成和转移
通过挽救实验发现,PF573228(FAK抑制剂)和ITGB6的敲低可抑制HAX1诱导的FAK磷酸化,过表达ITGB6挽救了细胞迁移和血管生成,但被shHAX1抑制。体内结果与体外一致,PF573228和ITGB6的敲低抑制了HAX1促进的NPC转移。
结论:
本研究阐明了HAX1在晚期NPC中高表达,与患者不良预后和MVD正相关,且在具有活跃增殖的组织中高表达。实验表明HAX1表达增加会促进NPC转移,且在血管发育过程中会有一个HAX1高表达阶段。来源于NPC的EV通过携带HAX1促进内皮细胞中ITGB6的翻译效率,唤醒FAK通路,从而影响血管生成,促进NPC转移。作者的成果表明,HAX1可用作NPC转移的重要生物标志物,为临床环境中的抗血管生成诊治提供新的基础。
越来越多的证据表明,EV通过多种机制参与各种人类疾病的进展,南通大学附属医院尤易文课题组前期研究发现富含HAX1的EV与NPC的转移有关,但其促进NPC血管生成的分子机制尚未阐明,今年5月他们通过动物和细胞模型深入探讨了其中的分子机制,并在J Extracell Vesicles(IF:17.338)上发表了该成果

技术路线:

实验结果:
1. HAX1上调促进NPC转移和血管生成
为验证HAX1在NPC进展中的作用,作者利用IHC、TCGA和CD31 IHC计算NPC中MVD,结果显示HAX1的高表达与晚期NPC、患者不良预后及高MVD正相关。从多种NPC细胞中筛选出高表达和中低表达HAX1的CNE2和6-10B细胞用于后续研究。两细胞中通过慢病毒转导shHAX1和GFP-HAX1,建立BALB/c小鼠模型,发现shHAX1明显抑制了CNE2和6-10B细胞的转移能力。将DiL-CNE2细胞注射到斑马鱼的主静脉中,3天后,shHAX1组斑马鱼尾部转移性tumour细胞数量低于NC组。表明NPC中HAX1表达影响NPC进展和血管生成。

2. 富含HAX1的EV促进NPC的血管生成
如下图所示,建立NPC和HUVEC共培养系统,来研究HAX1在血管生成中的作用,发现与NC组相比,CNE2-shHAX1组共培养的HUVEC血管生成和迁移能力明显降低。GW4869的处理,能明显抑制CNE2-NC促进血管生成。从转染GFP-HAX1的CNE2细胞中分离EV,与HUVEC共孵育,在HUVEC中可观察到绿色信号,说明HUVEC摄取了富含HAX1的EV。

提取CNE2-NC和CNE2-shHAX1细胞EV,注入斑马鱼胚胎或鸡胚绒毛尿囊膜(CAM)中,发现EV-shHAX1明显抑制了CAM和斑马鱼胚胎的血管生成。将带Luc信号的CNE2和6-10B细胞注入裸鼠尾静脉中,再给予EV-NC、EV-shHAX1和EV-GFP-HAX1,来探究EV-HAX1是否促进转移,结果显示,EV-shHAX1组的远端转移灶较少,EV-GFP-HAX1组的远端转移灶较多。经患者血清EV丰度的分析,发现EV的密度与疾病进展和患者预后没有明显统计学相关性,说明EV的功能并不取决于其数量或其中HAX1的含量。

3. HAX1在体内和体外均影响血管生成
在HUVEC细胞中敲低HAX1后,能明显抑制其迁移和管形成能力,同时抑制HUVEC的体内血管生成能力。表明HAX1对血管生成起到关键作用。为分析其表达是否是血管特异性的,作者进行了HPA数据库分析,发现HAX1在一些具有很强再生能力的组织和细胞中高表达,如肝、直肠和精母细胞,且可能在未成熟血管中高表达。


为探究其潜在机制,对野生型和HAX1-KO斑马鱼进行全转率组测序,结合通路富集分析和TCGA分析,发现HAX1与血管形成基因的表达无明显相关性。因此猜测可能通过调节蛋白质翻译参与血管生成。对新生蛋白质合成进行分析,发现shHAX1-HUVEC蛋白质合成水平明显降低,不利于多核糖体的形成,降低了eIF4E和磷酸化4EBP1的水平。经IP-MS和co-IP分析发现HAX1与eIF4E相互作用,且在4EGI的作用下,HAX1促进HUVEC迁移和管形成的能力被明显抑制。

5. HAX1调节HUVECs中ITGB6 mRNA的翻译
为了解HUVEC的血管生成依赖于HAX1的翻译调节作用,对shHAX1和Ctrl的HUVEC进行核糖体分析,发现在shHAX1组的核糖体中有2497个基因翻译受到下调,2375个基因的翻译受到上调,且观察到eIF4E的TE明显下降。


6.HAX1通过FAK通路促进NPC的血管生成和转移
通过挽救实验发现,PF573228(FAK抑制剂)和ITGB6的敲低可抑制HAX1诱导的FAK磷酸化,过表达ITGB6挽救了细胞迁移和血管生成,但被shHAX1抑制。体内结果与体外一致,PF573228和ITGB6的敲低抑制了HAX1促进的NPC转移。

结论:
本研究阐明了HAX1在晚期NPC中高表达,与患者不良预后和MVD正相关,且在具有活跃增殖的组织中高表达。实验表明HAX1表达增加会促进NPC转移,且在血管发育过程中会有一个HAX1高表达阶段。来源于NPC的EV通过携带HAX1促进内皮细胞中ITGB6的翻译效率,唤醒FAK通路,从而影响血管生成,促进NPC转移。作者的成果表明,HAX1可用作NPC转移的重要生物标志物,为临床环境中的抗血管生成诊治提供新的基础。






