研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
【Advance Science】15+,肿瘤外泌体ENPP1水解cGAMP抑制cGAS-STING信号传导
966 人阅读发布时间:2024-06-11 15:38
为了逃避免疫监视,肿瘤细胞在其膜表面表达外核苷酸热磷酸酶磷酸二酯酶1 (ENPP1),该酶降解细胞外环GMP-AMP (cGAMP),从而抑制干扰素基因(STING) DNA感应途径的环GMP-AMP合成酶(cGAS)刺激物。为了充分了解这种肿瘤隐身机制,有必要确定肿瘤微环境中是否存在具有水解cGAMP活性的其他形式的ENPP1来调节这种先天免疫途径。

湾湾今天分享的是发表在【Advance Science】上题为“Tumor Exosomal ENPP1 Hydrolyzes cGAMP to Inhibit cGAS‐STING Signaling”的研究,该研究报道多种肿瘤源性外泌体携带ENPP1,可水解合成2'3'-cGAMP和细胞产生的内源性2'3'-cGAMP,抑制免疫细胞中的cGAS‐STING通路。此外,肿瘤外泌体ENPP1还能水解与LL-37(2'3'-cGAMP的有效转运体)结合的2'3'-cGAMP,从而抑制STING信号传导。此外,从人乳腺癌和肺癌组织分离的外泌体中观察到ENPP1的高表达,肿瘤外泌体ENPP1抑制CD8+ T细胞和CD4+ T细胞的免疫浸润。这些结果阐明了肿瘤外泌体ENPP1在cGAS‐STING通路中的重要功能,进一步了解了肿瘤细胞与免疫系统之间的串扰。
研究结果
1.肿瘤源性外泌体表达ENPP1并水解2'3'-cGAMP/LL-37-2'3'-cGAMP
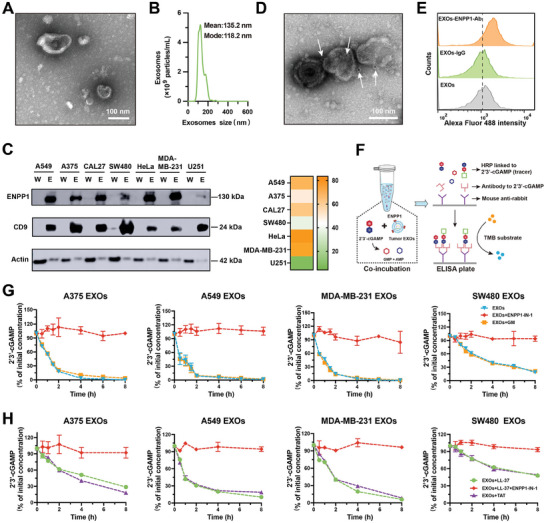
图1A:A375细胞来源外泌体(A375 EXOs)透射电镜图像。
图1B:A375 EXOs NTA粒径大小分布。
图1C:Western blot分析不同肿瘤细胞系全细胞裂解液(W)和外泌体(E)中总蛋白含量相同的ENPP1。使用Image J软件通过Western blot灰色值分析不同肿瘤源性外泌体中ENPP1的相对强度。
图1D:用抗ENPP1抗体免疫金标记的A375 EXOs代表性透射电镜图像。
图1E:流式细胞分析外泌体中ENPP1的表达。
图1F:肿瘤外泌体ENPP1水解2'3'-cGAMP后,ELISA测定残留2'3'-cGAMP浓度示意图。
图1G:来自经或未经ENPP1-IN-1/GM处理的A375、A549、MDA-MB-231和SW480细胞的外泌体和2'3'-cGAMP共孵育不同时间残留2'3'-cGAMP与初始2'3'-cGAMP的百分比。
图1H:外泌体LL-37和2'3'-cGAMP共孵育不同时间残留2'3'-cGAMP与初始2'3'-cGAMP的百分比。
这些结果表明了各种肿瘤来源的外泌体携带ENPP1蛋白,并且肿瘤外泌体ENPP1可以水解2'3'-cGAMP和LL-37-2'3'-cGAMP。
2.肿瘤外泌体ENPP1通过水解2'3'-cGAMP抑制cGAS-STING信号传导
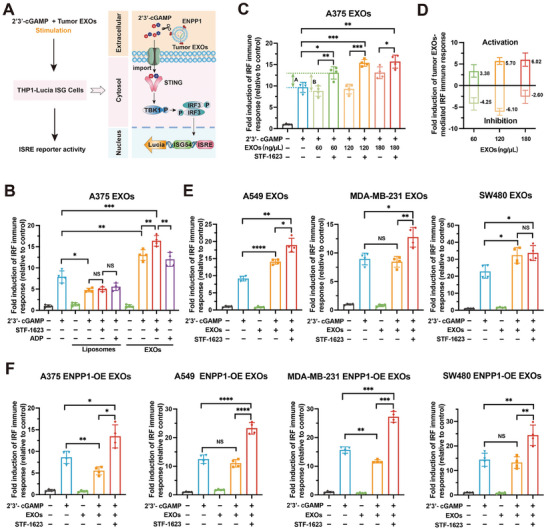
图2A:肿瘤源性外泌体介导的THP1 - Lucia ISG细胞免疫应答实验示意图。在STF-1623缺失或存在的情况下,用肿瘤来源的外泌体和2'3'-cGAMP处理THP1-Lucia ISG细胞24小时。收集培养基进行ISRE报告细胞活性分析。
图2B:用2'3'-cGAMP,A375 EXOs,2'3'-cGAMP和A375 EXOs,2'3'-cGAMP、A375 EXOs和STF-1623 ,或2'3'-cGAMP、A375 EXOs和ADP处理24小时后,对THP1-Lucia ISG细胞进行ISRE报告细胞活性分析。
图2C:2'3'-cGAMP 和不同浓度的A375 EXOs在STF-1623缺失或存在的情况下处理THP1-Lucia ISG细胞24小时的ISRE报告细胞活性分析。
图2D:不同浓度外泌体介导的STING信号的激活和抑制分析。
图2E:用2'3'-cGAMP,A549 EXOs ,2'3'-cGAMP和A549 EXOs,或2'3'-cGAMP、A549 EXOs和STF-1623 处理24小时的THP1-Lucia ISG细胞的ISRE报告细胞活性分析。并分别用MDA-MB-231 EXOs和SW480 EXOs进行实验。
图2F:用2'3'-cGAMP,A375 ENPP1-OE EXOs ,2'3'-cGAMPP和A375 ENPP1-OE EXOs,或2'3'-cGAMP、A375 ENPP1-OE EXOs和STF-1623处理24小时的THP1‐Lucia ISG细胞的ISRE报告细胞活性分析。并分别用A549 ENPP1-OE EXOs、MDA-MB-231 ENPP1-OE EXOs、SW480 ENPP1-OE EXOs进行实验。
这些数据表明了肿瘤外泌体ENPP1通过水解2'3'-cGAMP抑制cGAS- STING通路的强大功能。
3.肿瘤外泌体ENPP1通过水解LL-37-2'3'-cGAMP抑制cGAS'-STING信号传导
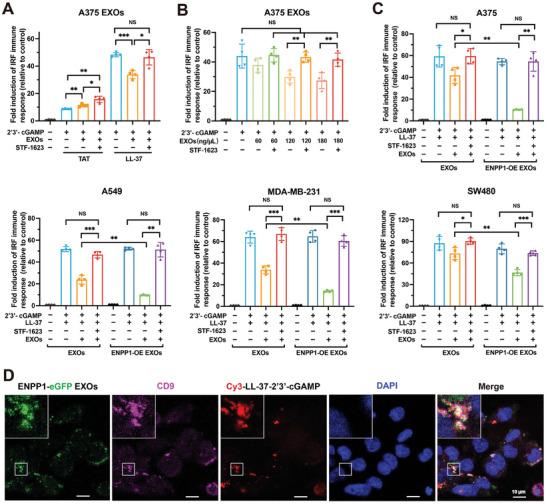
图3A:用LL-37-2'3'-cGAMP,A375 EXOs,LL-37-2'3'-cGAMP和A375 EXOs,或LL-37-2'3'-cGAMP复合物、A375 EXOs和STF-1623 处理24h后THP1-Lucia ISG细胞的ISRE报告细胞活性分析。同时,用TAT作为对照试验。
图3B:在STF-1623不存在或不存在的情况下,用LL-37-2'3'-cGAMP和不同浓度的A375 EXOs处理THP1-Lucia ISG细胞24h, ISRE报告细胞活性分析。
图3C:用LL-37-2'3'-cGAMP处理THP1-Lucia ISG细胞,用LL-37-2'3'-cGAMP复合物和A375 EXOs处理STF-1623 ,或者用LL-37-2'3'-cGAMP复合物和A375 ENPP1-OE EXOs 处理STF-1623 处理24小时,并分别用A549 ENPP1-OE EXOs、MDA-MB-231 ENPP1-OE EXOs、SW480 ENPP1-OE EXOs进行实验。
图3D:标记Cy3的LL-37-2'3'-cGAMP、标记ENPP1-eGFP的A375 EXOs和标记Alexa Flour 647的CD9在THP-1细胞中的共定位分析。
这些数据表明了肿瘤外泌体ENPP1在LL-37结合的2'3'-cGAMP水解抑制cGAS-STING信号通路中发挥重要作用。
4.肿瘤外泌体ENPP1水解细胞产生的内源性2'3'-cGAMP抑制旁邻细胞中的cGAS-STING信号
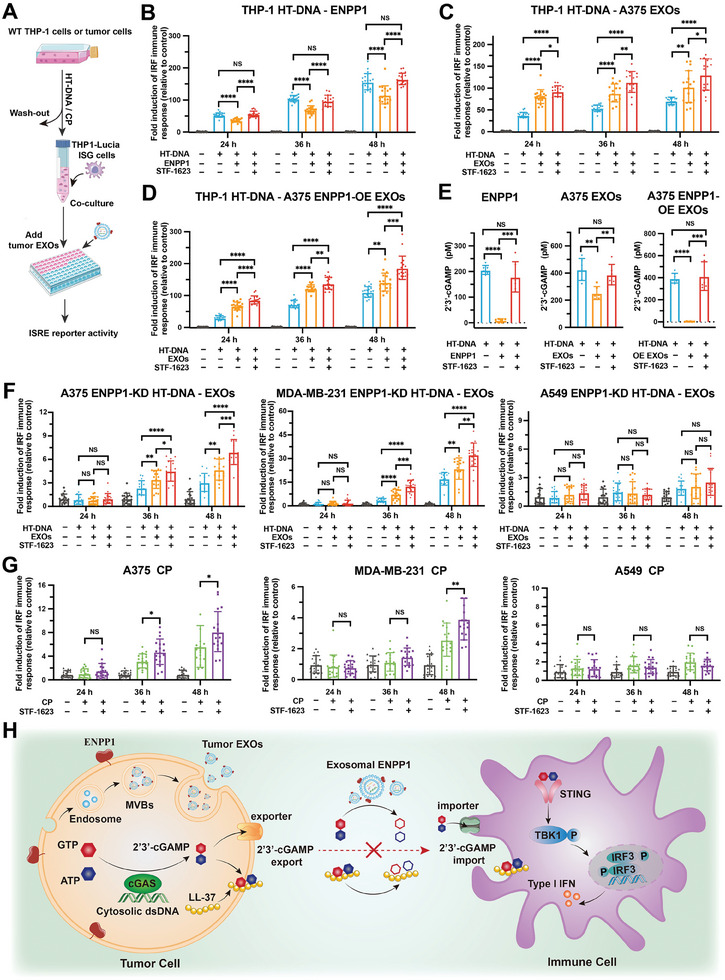
图4A:使用WT THP-1细胞产生2'3'-cGAMP和THP1-Lucia ISG细胞产生免疫应答的共培养系统示意图。WT THP-1细胞用HT-DNA 处理6小时,然后去除THP1-Lucia ISG细胞,在ENPP1蛋白或肿瘤来源的外泌体存在下,与加或不加STF-1623共培养48小时。收集不同时间的培养基进行ISRE报告活性分析。采用此方法将HT-DNA或CP-处理的人肿瘤细胞与THP1-Lucia ISG细胞共培养。
图4B-D:在ENPP1蛋白、A375 EXOs或A375 ENPP1-OE EXOs存在下,与HT-DNA处理过的WT THP-1细胞共培养48h的THP1-Lucia ISG细胞,ISRE报告细胞活性分析。
图4E:用2'3'-cGAMP ELISA试剂盒测定共培养24h细胞外2'3'-cGAMP的浓度。
图4F:THP1-Lucia ISG细胞与HT-DNA 共培养,在A375 EXOs、MDA-MB-231 EXOs 或A549 EXOs存在下,用加或不加STF-1623处理不同的ENPP1敲低肿瘤细胞48小时,ISRE报告细胞活性分析。
图4G:与CP共培养的THP1-Lucia ISG细胞,用加或不加STF-1623处理不同的人肿瘤细胞48小时,ISRE报告细胞活性分析。
图4H:肿瘤微环境中ENPP1介导的2'3'-cGAMP和LL-37-2'3'-cGAMP介导的cGAS-STING信号通路的机制模型。
这些结果表明了肿瘤外泌体ENPP1介导的细胞外2'3'-cGAMP水解抑制了旁邻细胞中的cGAS-STING信号。
5.肿瘤外泌体ENPP1与人类癌症免疫抑制相关
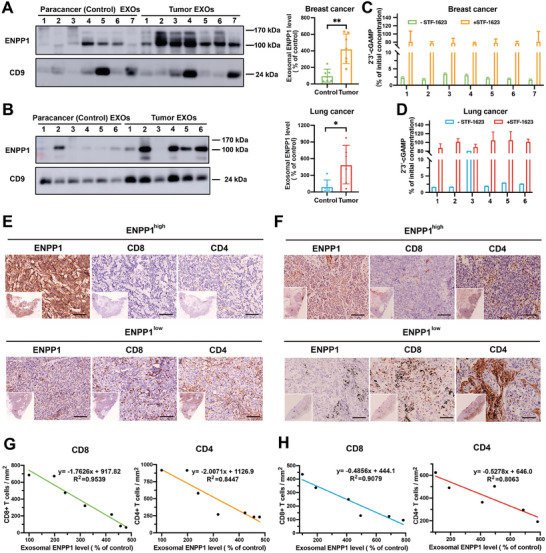
图5A:Western blot分析从7例乳腺癌患者的癌旁组织和肿瘤组织纯化的外泌体中ENPP1、CD9的表达水平。
图5B:Western blot分析从6例肺癌患者的癌旁组织和肿瘤组织纯化的外泌体中ENPP1、CD9的表达水平。
图5C-D:在STF-1623 存在或不存在的情况下,乳腺肿瘤组织或肺肿瘤组织外泌体24小时后残留2'3'-cGAMP与初始2'3'-cGAMP的百分比。
图5E-F:人类乳腺癌组织和肺癌组织使用抗ENPP1,抗CD8或抗CD4抗体染色的代表性图像。
图5G-H:人乳腺癌源性外泌体ENPP1表达水平或肺癌源性外泌体ENPP1表达水平与单位面积CD8+ T细胞和CD4+ T细胞浸润数量的相关性分析。
这些数据进一步表明了肿瘤外泌体ENPP1在癌症中的重要作用。
结论
在本研究中,作者揭示了肿瘤外泌体ENPP1有效水解2'3'- cGAMP以抑制免疫细胞中cGAS-STING通路激活的新机制。作为内源性第二信使,2'3'-cGAMP在先天免疫应答中发挥重要作用。虽然先前的研究表明肿瘤细胞膜上的ENPP1蛋白可以通过水解2'3 '-cGAMP而损害免疫应答,但对依赖于其他形式的ENPP1蛋白影响STING激活的机制仍然知之甚少。本研究不仅发现来自各种肿瘤细胞的外泌体表达ENPP1蛋白,还发现ENPP1在外泌体上丰富富集。事实上,在测试的所有细胞类型中,观察到各种肿瘤来源的外泌体多可以有效地水解2'3'- cGAMP,这表明肿瘤外泌体ENPP1对2'3'- cGAMP的水解不是癌症特异性现象;还表明所有携带ENPP1的肿瘤来源外泌体可能具有水解2'3'-cGAMP的功能。这些外泌体表现出双重调节功能,不仅由于ENPP1的清除机制抑制免疫细胞的cGAS-STING信号通路激活,而且还协助2'3'-cGAMP增强免疫细胞的cGAS-STING信号通路。作者假设外泌体可能含有新的2'3'-cGAMP转运体。然而,外泌体的ENPP1抑制增强了免疫细胞的2'3'-cGAMP介导的STING信号反应。这些发现强调了肿瘤源性外泌体在cGAS-STING信号通路中的关键功能。






