研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
植物来源“外泌体”爆7+大招!组装“外泌体”如何大显身手,彰显自身特长?一文带你走近外泌体创新!
657 人阅读发布时间:2025-05-16 10:20
乳腺癌是全球女性中第二大致命癌症,现有治疗手段存在诸多局限性,如手术可能导致肿瘤细胞扩散、化疗药物存在靶向性差和耐药性等问题。人参来源的外泌体样纳米颗粒(GENs)因具有高递送效率、高生物利用度和肿瘤靶向性等优势,在肿瘤治疗方面展现出潜力,但GENs在体内易被快速清除,稳定性和在肿瘤组织中的滞留性差。

湾湾今天分享的是一篇发表在【Int J Biol Macromol】(IF:7.7)上题为“Enhanced therapeutic effects of ginseng-derived exosome-like nanoparticles loaded hyaluronic acid injectable hydrogels for breast tumor treatment”的研究,该研究制备了基于改性透明质酸(HA)和羧甲基壳聚糖(CMCS)的水凝胶,并将人参来源的外泌体样纳米颗粒(GENs)负载其中,旨在提高GENs的稳定性和在肿瘤组织中的滞留性,进而增强其肿瘤治疗效果。
研究成果
1.GENs的提取、纯化和鉴定

图1A:从新鲜人参中分离GENs的过程示意图,包括高速剪切、多次离心和过滤等步骤。
图1B:超速离心后的蔗糖梯度中的变化。结果显示GENs在蔗糖梯度中的分布主要集中在30%-45%的界面处。
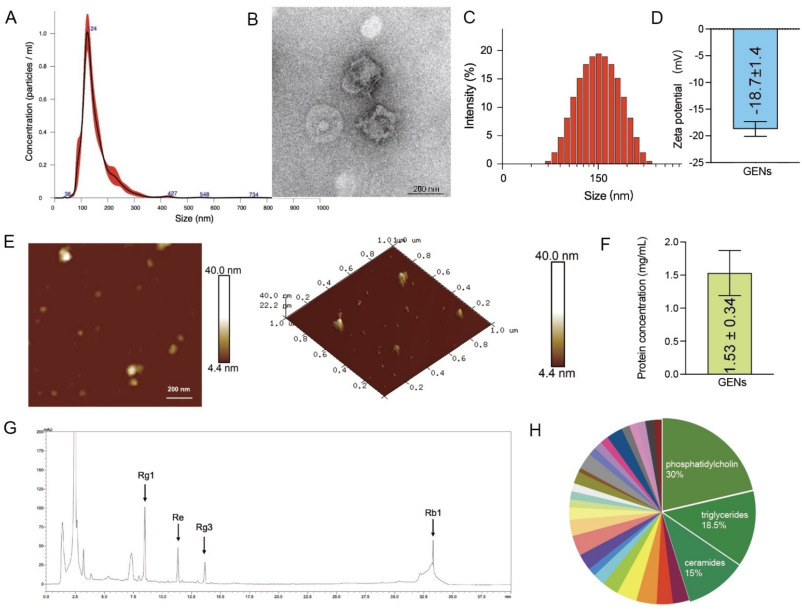
图2A:通过纳米颗粒跟踪分析(NTA)测定的GENs颗粒计数。结果显示其粒径均匀分布在150 nm左右,无杂峰。
图2B:透射电镜(TEM)成像。结果显示GENs呈碟状形态,形状均匀,无聚集或降解现象。
图2C:GENs的尺寸测定。结果显示平均粒径为146.2 nm。
图2D:GENs的zeta电位测定。结果显示为-18.7±1.4 mV。
图2E:原子力显微镜(AFM)成像。结果显示GENs表面纳米颗粒均匀分布,表面相对平坦。
图2F:通过BCA试剂盒测定GENs蛋白质浓度。结果显示蛋白质浓度为1.53±0.34 mg/mL。
图2G:通过HPLC分析GENs中人参皂苷的浓度。HPLC分析结果显示主要含磷脂酰胆碱、甘油三酯、神经酰胺等脂质以及多种人参皂苷。
图2H:GENs的脂质组学分析图表。结果显示其主要由磷脂酰胆碱(30.0%)、甘油三酯(18.5%)、神经酰胺(15.0%)组成。
这些结果表明,成功从人参中分离出GENs,其粒径均一、形态光滑,且含有多种生物活性成分,具备潜在的抗肿瘤物质基础。
2. GENs稳定性研究
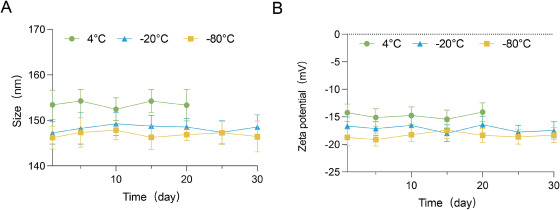
图3A:在30天内对GENs粒径稳定性进行测量。结果显示在-80℃和-20℃下,GENs粒径30天保持稳定(150nm),4℃下20天内稳定,20天后出现条纹沉淀。
图3B:在30天内对GENs电位稳定性进行测量。结果显示在-80℃和-20℃下,GENs电位30天保持稳定(-20mV),4℃下20天内稳定,之后电位随温度升高略有增加。
这些结果表明,GENs在-80℃和-20℃下稳定性良好,4℃下稳定性会随时间下降,温度对其稳定性有影响。
3. GENs@Hydrogels水凝胶的制备与表征
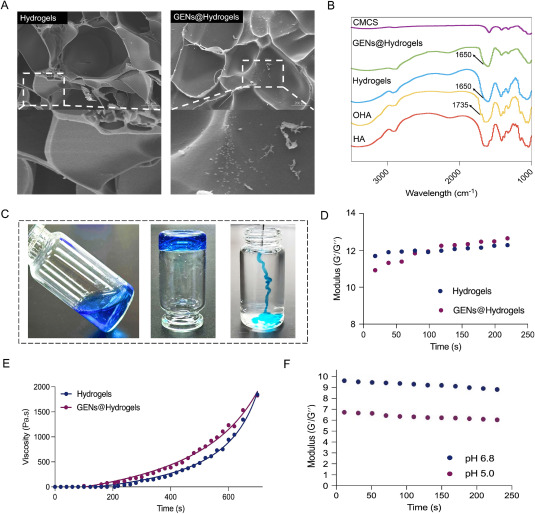
图4A:扫描电镜(SEM)观察水凝胶(Hydrogels)和GENs@Hydrogels的微观结构。结果显示二者均具有规则均匀的多孔网状结构,GENs@Hydrogels含有丰富的GENs包埋物。
图4B:通过傅里叶变换红外光谱(FTIR)对CMCS、HA、OHA、Hydrogels和GENs@Hydrogels的化学结构进行表征。结果显示GENs间存在氢键。
图4C:OHA和CMCS混合溶液的凝胶行为研究。结果显示二者混合后具有理想的原位凝胶形成性能。
图4D:测量凝胶前体溶液的粘度变化和凝胶化时间。结果显示GENs@Hydrogels的凝胶化时间与空白水凝胶相似,且凝胶化速率更快。
图4E-F:通过动态剪切振荡测量在小应变下Hydrogels和GENs@Hydrogels的储能模量。结果显示存储/损耗模量比略有下降。
这些结果表明,成功制备了具有特定结构和性能的GENs@Hydrogels,其具备良好的凝胶形成能力和稳定性,且对酸性环境有响应性。
4.体外生物相容性分析及GENs@Hydrogels中GENs的体外释放研究
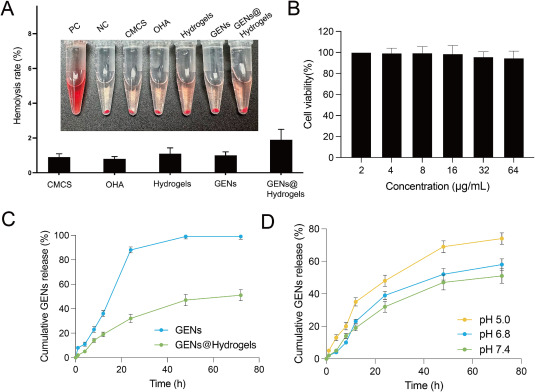
图5A:各实验组的溶血率评估。结果显示,CMCS、OHA、GENs、GENs@Hydrogels均具有良好的生物相容性。
图5B:用GENs@Hydrogels处理MCF-10A细胞后的细胞活力检测。结果显示当GENs@Hydrogels浓度在2-64 μg/mL时,细胞活力均高于90%。
图5C:GENs在有无水凝胶情况下的体外累积释放曲线。结果显示在PBS中,GENs在24h内释放超过90%,而GENs@Hydrogels具有持续释放性能,72h内释放约50%。
图5D:在不同pH条件下GENs从GENs@Hydrogels中的释放情况。结果显示在pH为5时,72h内释放显著增强,达到约74%;pH为6.8时,72h内释放约58%。
这些结果表明,Hydrogels和GENs具有良好的生物相容性和低细胞毒性,GENs@Hydrogels具有酸敏感释放和控释特性。
5.体外细胞摄取和溶酶体定位研究
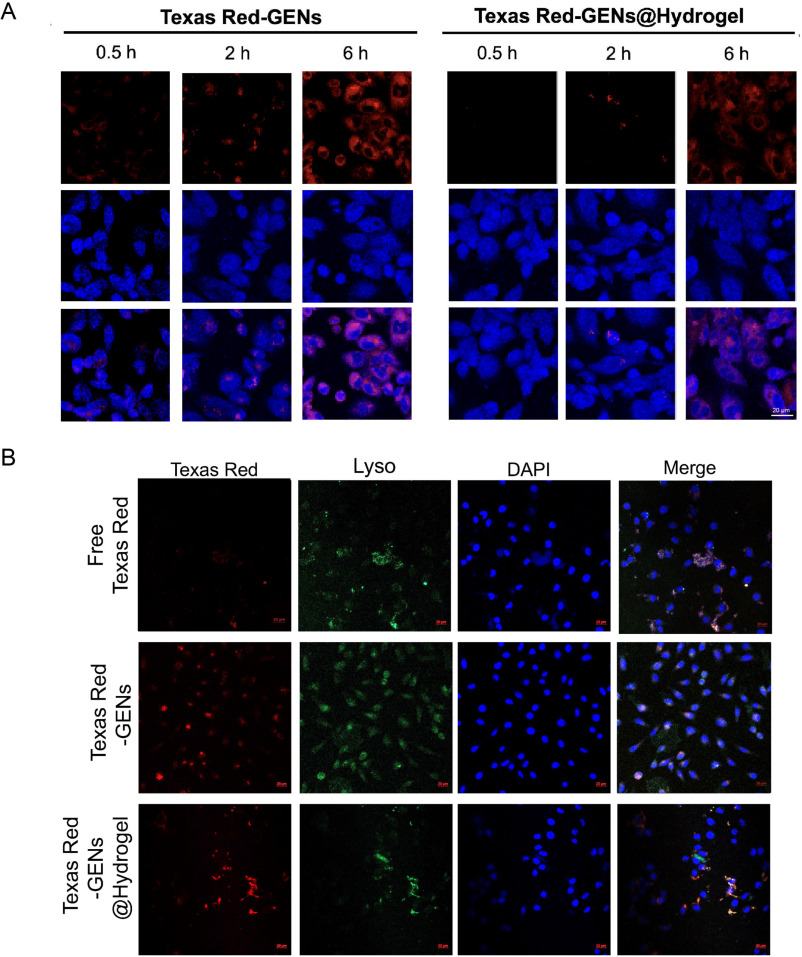
图6A:通过荧光显微镜观察4T1细胞对GENs和GENs@Hydrogels的摄取情况。结果显示随着时间推移,细胞对GENs的摄取呈时间依赖性增加,培养4h后,处理组细胞出现明显红色荧光,且游离GENs的细胞摄取高于GENs@Hydrogels。
图6B:处理6h后,4T1细胞中GENs和GENs@Hydrogels的溶酶体定位研究。结果显示细胞内药物(红色荧光)增加,表明GENs能成功从溶酶体逃逸。
这些结果表明,4T1细胞能够摄取GENs和GENs@Hydrogels,且GENs可从溶酶体逃逸,有利于发挥其抗肿瘤作用。
6. GENs和GENs@Hydrogels的体外抗肿瘤作用
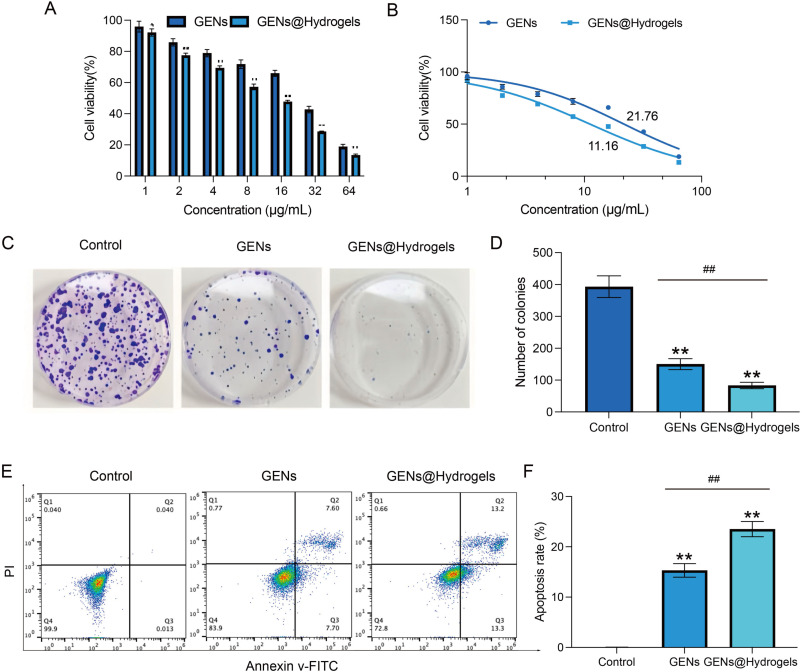
图7A:MTT法检测GENs和GENs@Hydrogels对4T1细胞的细胞毒性活性。结果显示在不同浓度下GENs组和GENs@Hydrogels组细胞活力随浓度变化,且GENs@Hydrogels组细胞活力下降更明显。
图7B:计算GENs和GENs@Hydrogels对4T1细胞的半数抑制浓度。结果显示GENs和GENs@Hydrogels对4T1细胞的半数抑制浓度分别为21.76 μg/mL和11.16 μg/mL。
图7C-D:克隆形成实验检测GENs和GENs@Hydrogels对4T1细胞增殖的抑制能力。结果显示二者均能抑制4T1细胞增殖,GENs@Hydrogels的抑制作用更强。
图7E-F:通过流式细胞术评估GENs和GENs@Hydrogels处理4T1细胞4h后的凋亡率。结果显示凋亡率增加。
这些结果表明,GENs和GENs@Hydrogels对4T1细胞具有明显抑制作用,GENs@Hydrogels能增强GENs的细胞毒性,促进肿瘤细胞凋亡,抑制细胞增殖。
7. GENs/GENs@Hydrogels的体外抗肿瘤机制研究
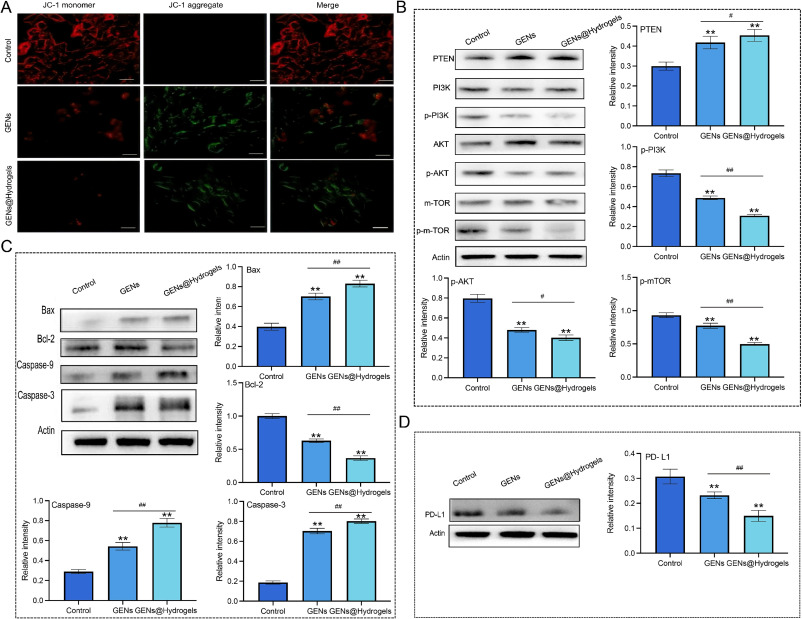
图8A:用JC-1染色检测4T1细胞线粒体膜电位变化。结果显示对照组JC-1无明显凋亡诱导作用,GENs和GENs@Hydrogels处理组线粒体膜电位下降。
图8B:检测4T1细胞中PTEN、PI3K、p-PI3K、AKT、p-AKT、m-TOR、p-m-TOR的表达。结果显示GENs和GENs@Hydrogels处理后,PTEN水平显著增加,p-PI3K、p-AKT和p-mTOR表达显著下降,p-PI3K/PI3K、p-Akt/AKT和p-mTOR/mTOR比值显著降低。
图8C:检测4T1细胞中Bax、Bcl-2、Caspase-3、Caspase-9的表达。结果显示GENs和GENs@Hydrogels处理后,Bax、Caspase-3、Caspase-9显著上调,Bcl-2显著下调。
图8D:检测4T1细胞中PD-L1的表达。结果显示GENs和GENs@Hydrogels处理后,PD-L1表达显著下调。
这些结果表明,PTEN/PI3K/AKT/mTOR通路和caspase依赖通路与GENs和GENs@Hydrogels诱导的4T1细胞死亡相关,且二者可能通过免疫调节发挥体内抗肿瘤作用。
8.体内抗肿瘤疗效研究
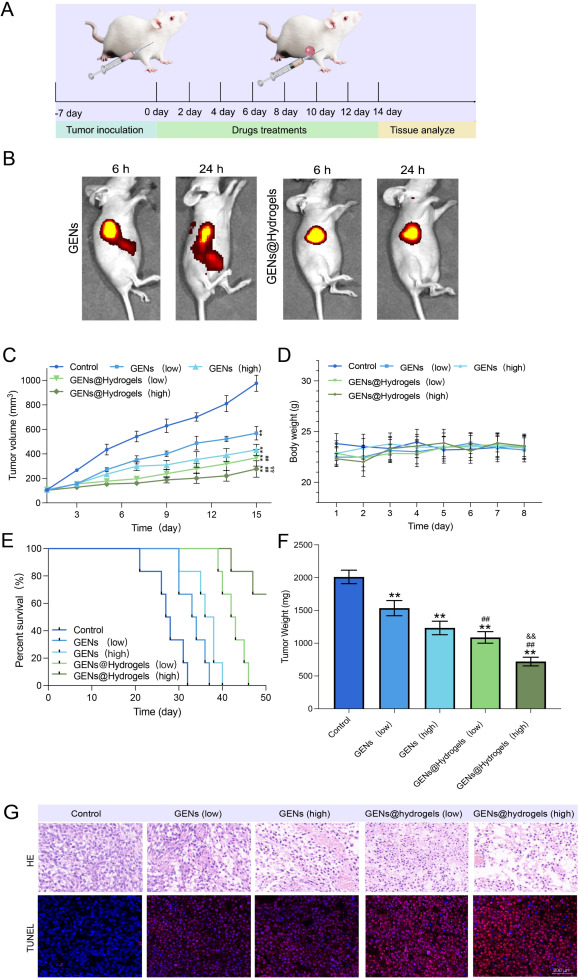
图9A:体内抗肿瘤实验设计,建立小鼠4T1皮下肿瘤模型,分组并进行不同处理。
图9B:体内荧光成像。结果显示水凝胶提高了GENs在肿瘤部位的滞留。
图9C:监测肿瘤体积变化。结果显示GENs组和GENs@Hydrogels组均能抑制肿瘤生长,高剂量组效果更显著,且GENs@Hydrogels组抑制效果优于GENs组。
图9D:记录4T1荷瘤小鼠体重。结果显示处理后小鼠体重稳定,表明GENs和GENs@Hydrogels无明显副作用。
图9E:统计4T1荷瘤小鼠生存时间。结果显示GENs组和GENs@Hydrogels组生存时间延长。
图9F:测量4T1荷瘤小鼠肿瘤重量变化。结果显示肿瘤重量变化与肿瘤体积变化趋势一致。
图9G:肿瘤组织的H&E和TUNEL染色结果。结果显示GENs和GENs@Hydrogels组肿瘤细胞显著减少,GENs@Hydrogels高剂量组肿瘤抑制最强,且该组肿瘤细胞凋亡率高于GENs组。
这些结果表明,GENs和GENs@Hydrogels在体内均具有抗肿瘤效果,GENs@Hydrogels通过增强GENs的滞留和稳定性,抗肿瘤效果更优,且无明显副作用。
9. GENs和GENs@Hydrogels的免疫调节作用研究
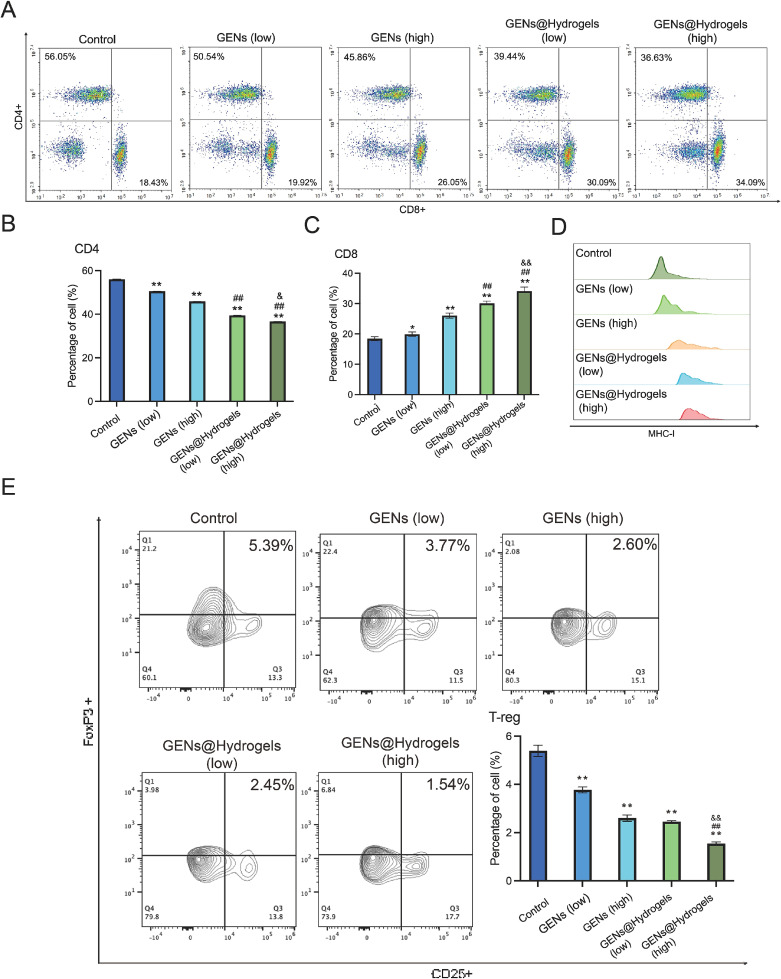
图10A-C:检测不同组肿瘤浸润的CD4⁺T细胞和CD8⁺T细胞百分比。结果显示GENs和GENs@Hydrogels处理后,CD8⁺T细胞(细胞毒性T细胞)显著增加,CD4⁺T细胞(辅助性T细胞)略有下降。
图10D:检测肿瘤中MHC-I水平。结果显示GENs和GENs@Hydrogels处理后,MHC-I水平显著上调。
图10E:检测不同组肿瘤浸润的调节性T细胞(Tregs,FoxP3⁺和CD25⁺)百分比。结果显示GENs和GENs@Hydrogels处理后,Tregs水平显著下降,且各处理组CD8⁺/Treg和CD8⁺/CD4⁺比值高于对照组。
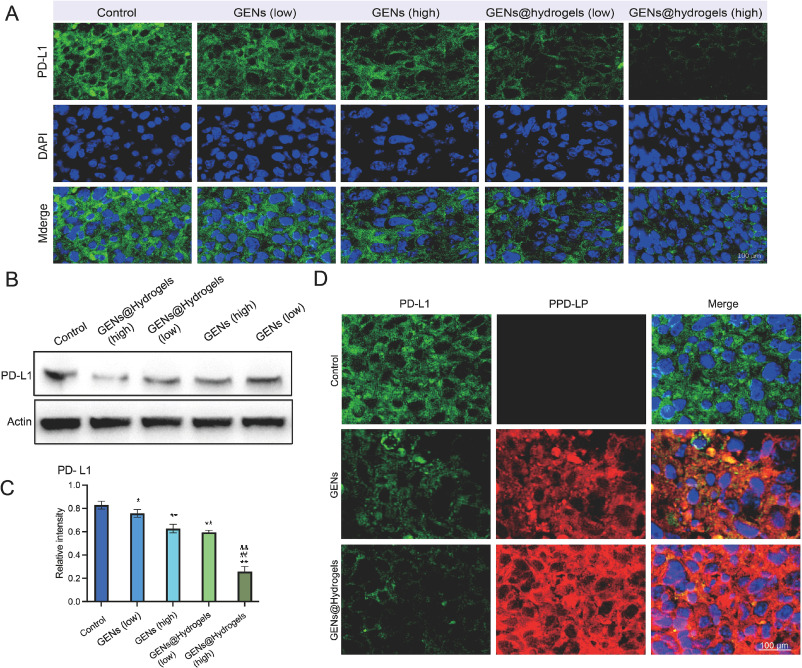
图11A:肿瘤组织的PD-L1抗体染色。结果显示GENs和GENs@Hydrogels处理后PD-L1表达下降。
图11B-C:定量分析肿瘤中PD-L1的表达。结果显示PD-L1的表达下降。
图11D:用Texas Red标记GENs后注射,观察荧光信号。结果进一步证实水凝胶可提高免疫调节能力和肿瘤抑制效果。
这些结果表明,GENs和GENs@Hydrogels通过调节T细胞、PD-L1和MHC-I发挥免疫调节作用,有利于增强全身抗肿瘤T细胞免疫,抑制肿瘤生长,且GENs@Hydrogels组治疗效果更好(图10);且GENs和GENs@Hydrogels可下调肿瘤中PD-L1表达,水凝胶通过增加GENs在肿瘤部位的滞留和肿瘤细胞对药物的摄取,提升免疫调节和肿瘤抑制效果(图11)。
10.器官的组织病理学结果
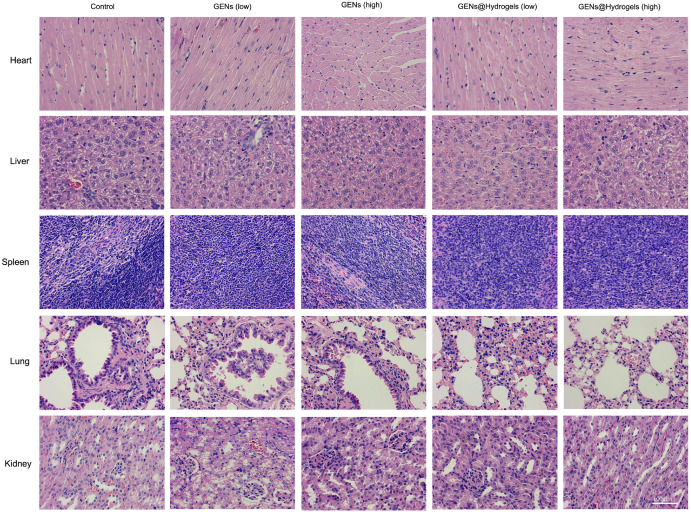
图12:主要脏器HE染色。结果未发现明显损伤。结果表明 GENs 和 GENs@Hydrogels 具有良好的生物相容性。
结论
该研究成功开发了负载GENs的可注射水凝胶,GENs@Hydrogels通过调节细胞增殖和肿瘤微环境,显著抑制肿瘤生长。水凝胶能将外泌体保留在肿瘤部位并持续释放GENs,维持其稳定性,增强治疗效果。该系统是一种有前景的治疗策略,未来可探索更多给药通路和联合治疗方案,以适应不同类型肿瘤的治疗需求。






