研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF40 +顶刊手把手教学:如何用外泌体 + 焦亡机制发高分?这篇文献堪称“教科书”!
973 人阅读发布时间:2025-05-21 17:19
阿霉素(DOX)是乳腺癌治疗的核心化疗药物,但其诱导的心脏毒性(DOXIC)严重限制临床应用。

湾湾今天分享的是发表在【Signal Transduct Target Ther】(IF:40.8)上题为“Exosomal transfer of pro-pyroptotic miR-216a-5p exacerbates anthracycline cardiotoxicity through breast cancer-heart pathological crosstalk”的研究。该研究聚焦于肿瘤与心脏的跨器官病理通信机制,发现乳腺癌细胞通过外泌体(EXOs)传递促焦亡的微小RNA(miR-216a-5p),激活心肌细胞焦亡通路,为缓解DOXIC提供了新靶点。研究通过体外共培养模型、外泌体功能验证及体内动物实验,系统揭示了“乳腺癌-心脏”病理串扰的分子机制。
研究结果
1、与乳腺癌细胞共培养加重DOX诱导的心肌细胞焦亡
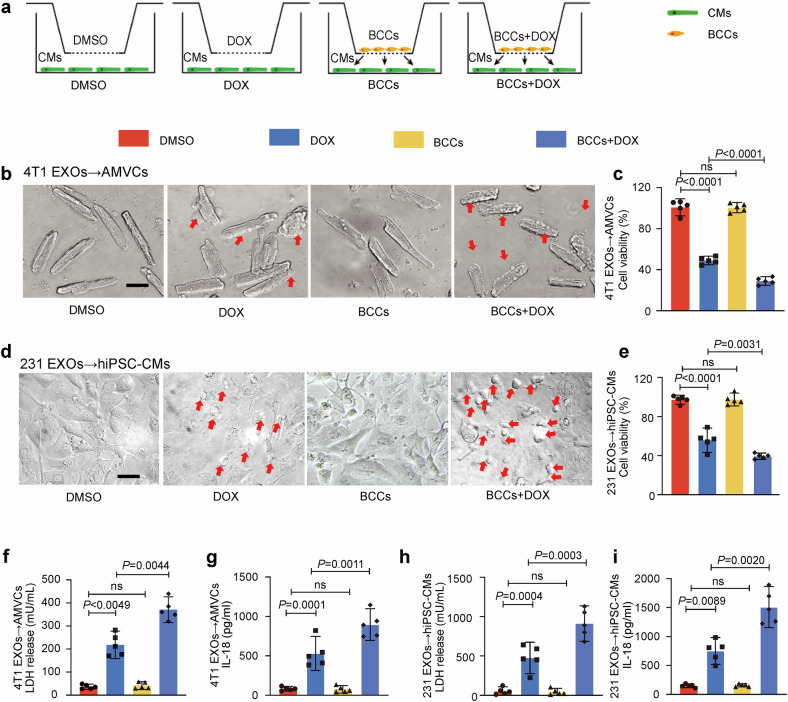
图1a:Transwell共培养系统示意图,显示乳腺癌细胞(BCCs)与心肌细胞(AMVCs/hiPSC-CMs)通过外泌体传递信号的上下层培养设计。
图1b-e:与BCCs共培养的心肌细胞在DOX处理后,细胞活力显著降低,乳酸脱氢酶(LDH)释放量和促炎因子IL-18水平显著升高,提示细胞损伤加重。
图1f-g:共培养的心肌细胞出现典型焦亡形态(气泡状突起、细胞肿胀),免疫荧光显示ASC斑点形成(焦亡标志物),证实焦亡通路激活。
图1h-i:抑制外泌体释放(GW4869)可显著减弱焦亡相关蛋白(GSDMD-N、CleavedCASP1、CleavedIL-1β)表达及IL-18分泌,而促进外泌体释放(Monensin)则加剧损伤。
这些结果表明,乳腺癌细胞通过外泌体传递信号,显著加剧DOX诱导的心肌细胞焦亡。
2、外泌体来自DOX诱导的乳腺癌细胞(D-BCC-EXOs)加重心肌细胞焦亡
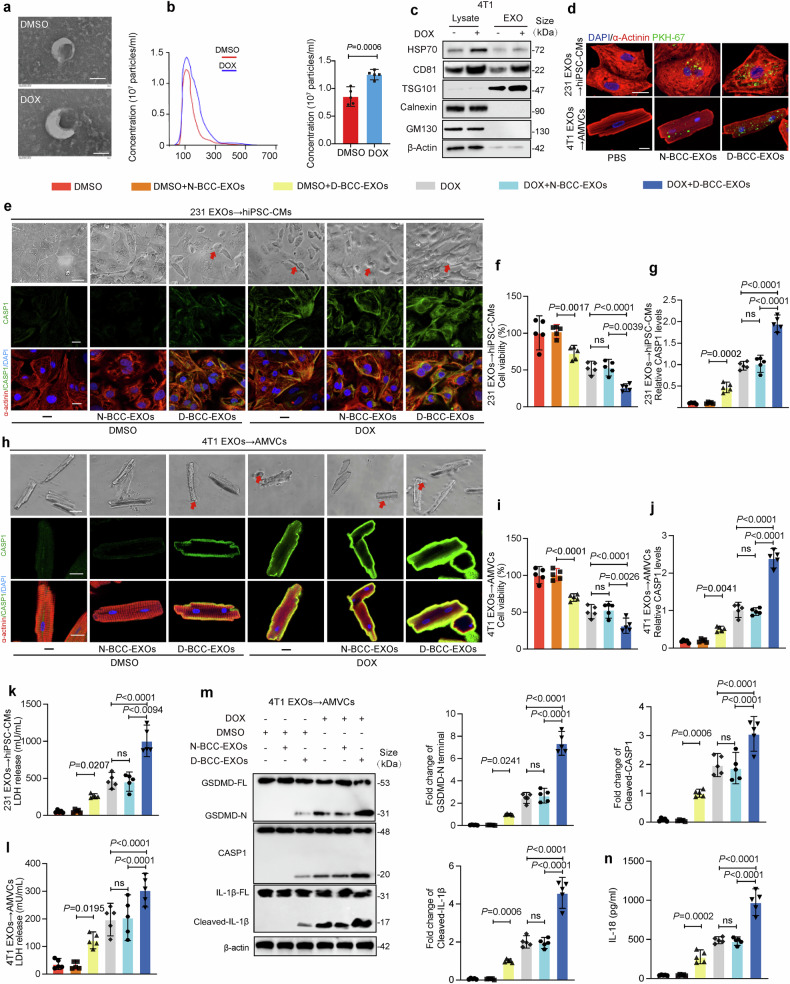
图2a:透射电镜显示D-BCC-EXOs呈典型杯状膜结构,粒径约100-200nm,符合外泌体形态特征。
图2b:纳米追踪分析(NTA)显示,DOX刺激后乳腺癌细胞释放的外泌体浓度显著增加,粒径分布集中在100-200nm。
图2c:Western blot证实D-BCC-EXOs表达外泌体特异性标志物(CD81、TSG101、HSP70),不表达细胞内蛋白(GM130、Calnexin),验证其纯度。
图2d:荧光标记实验显示,D-BCC-EXOs被心肌细胞高效摄取,且摄取效率显著高于正常乳腺癌细胞外泌体(N-BCC-EXOs)。
图2e-n:D-BCC-EXOs处理显著降低心肌细胞活力,增加LDH释放量,并上调焦亡相关蛋白(CleavedCASP1、GSDMD-N、IL-1β)及细胞因子(IL-18)表达,而N-BCC-EXOs无此效应。
这些结果表明,DOX诱导的乳腺癌细胞外泌体(D-BCC-EXOs)被心肌细胞摄取后,直接诱导焦亡并加重DOXIC。
3、D-BCC-EXOs在体内加重DOX诱导的心肌损伤和焦亡
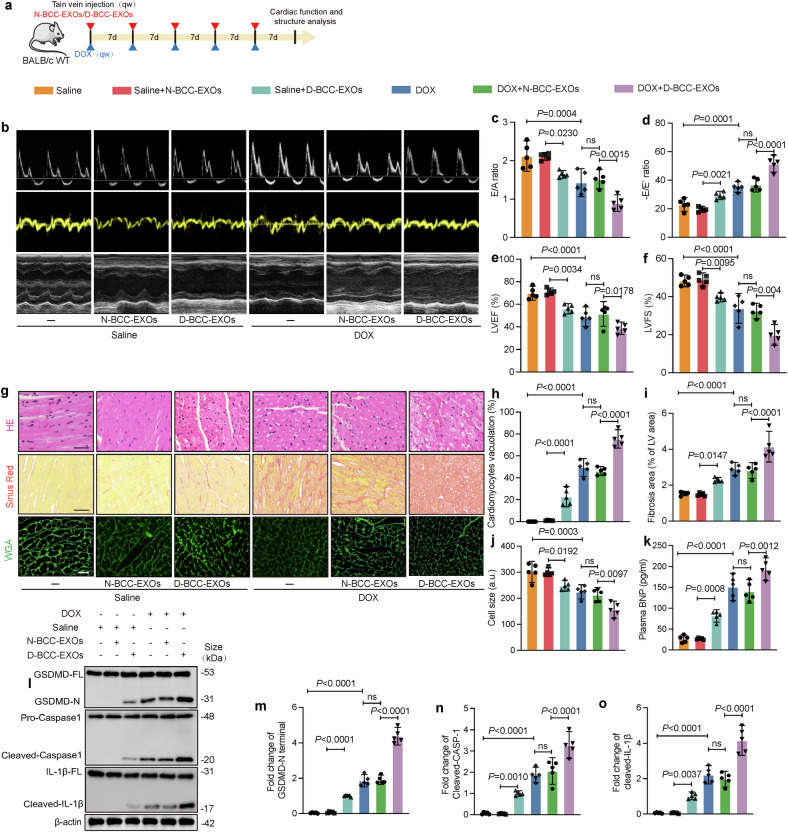
图3a:小鼠尾静脉注射D-BCC-EXOs的体内实验设计示意图,构建DOXIC小鼠模型。
图3b-f:超声心动图显示,D-BCC-EXOs加剧DOX诱导的左心室射血分数(LVEF)、左心室短轴缩短率(LVFS)下降,以及舒张功能异常(E/A和E/E’比值降低),提示心功能恶化。
图3g-j:组织染色显示,D-BCC-EXOs增强DOX诱导的心肌空泡化(HE染色)、纤维化(Sirius红染色)及心肌细胞萎缩(WGA染色)。
图3k-o:Western blot证实,D-BCC-EXOs显著上调心肌组织中焦亡相关蛋白(GSDMD-N、CleavedCASP1、CleavedIL-1β)表达。
这些体内实验证实,乳腺癌来源外泌体通过循环系统传递,加剧DOX诱导的心肌结构损伤和焦亡。
4、miR-216a-5p是D-BCC-EXOs加重DOXIC的关键效应分子
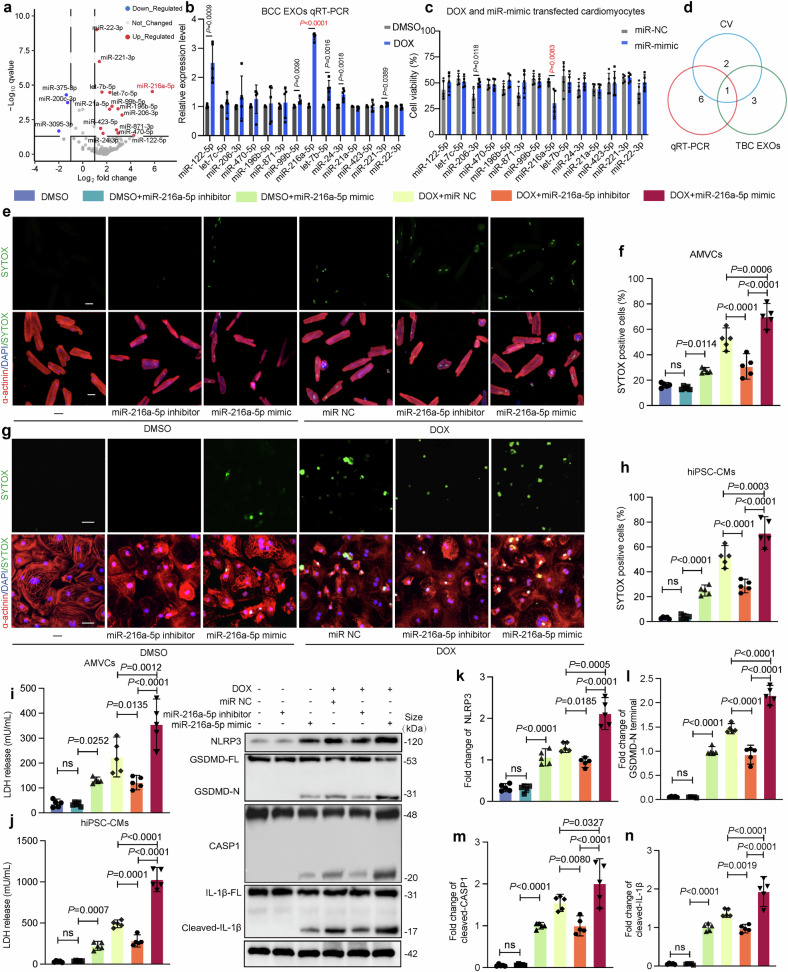
图4a:外泌体miRNA测序火山图显示,DOX处理后乳腺癌细胞外泌体中14个miRNA显著上调,其中miR-216a-5p上调最显著。
图4b-c:qRT-PCR验证,miR-216a-5p在D-BCC-EXOs中表达水平显著高于N-BCC-EXOs;其模拟物转染心肌细胞后,细胞活力显著降低,提示促损伤作用。
图4d:Venn分析显示,miR-216a-5p是唯yi同时满足“测序上调”和“功能验证损伤”的miRNA。
图4e-j:功能获得/缺失实验表明,miR-216a-5p mimic加重DOX诱导的心肌细胞死亡和LDH释放,而抑制剂则显著减轻损伤。
图4k-n:Western blot显示,miR-216a-5p上调焦亡相关蛋白(NLRP3、GSDMD-N、CleavedCASP1)表达,激活焦亡通路。
这些结果表明,miR-216a-5p是D-BCC-EXOs的核心致病因子,通过诱导心肌细胞焦亡加重DOXIC。
5、DOX通过ATF3上调miR-216a-5p转录
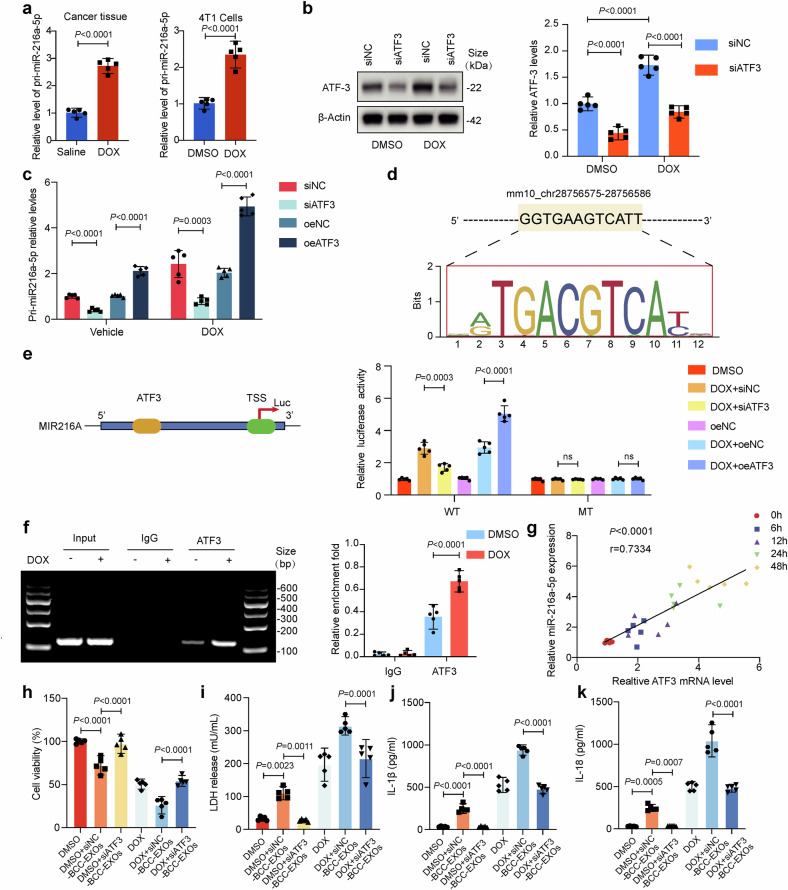
图5a:qRT-PCR显示,DOX处理的乳腺癌细胞和肿瘤组织中,miR-216a-5p前体(pri-miR-216a)表达显著增加,提示转录水平激活。
图5b-c:ATF3siRNA敲低后,pri-miR-216a表达显著下降;ATF3过表达则显著上调其表达,表明ATF3调控miR-216a-5p转录。
图5d-e:荧光素酶报告实验证实,ATF3直接结合miR-216a启动子区域,且DOX处理显著增强该结合作用。
图5f:染色质免疫沉淀(ChIP)实验验证,ATF3与miR-216a启动子存在直接结合,DOX处理后结合强度显著增加。
图5g:时间依赖性实验显示,ATF3与miR-216a-5p表达呈正相关(r=0.7334),证实DOX通过ATF3上调miR-216a-5p。
图5h:CCK-8实验显示,ATF3敲低的乳腺癌细胞来源外泌体(siATF3-BCC-EXOs)处理后,心肌细胞活力显著高于对照组(siNC-BCC-EXOs),表明ATF3缺失减弱外泌体的心肌损伤作用。
图5i-j:LDH释放实验和ELISA显示,siATF3-BCC-EXOs组心肌细胞LDH释放量、IL-1β和IL-18水平显著低于siNC-BCC-EXOs组,证实ATF3敲低抑制外泌体诱导的焦亡。
图5k:Westernblot显示,siATF3-BCC-EXOs处理的心肌细胞中焦亡相关蛋白(GSDMD-N、CleavedCASP1)表达显著下调。
这些结果表明,DOX通过激活ATF3转录因子,促进乳腺癌细胞中miR-216a-5p的转录和表达。ATF3通过调控miR-216a-5p的转录和外泌体传递,介导乳腺癌细胞与心肌细胞之间的病理串扰,敲低ATF3可减轻外泌体诱导的心肌焦亡。
6、SF3B4选择性包装miR-216a-5p进入外泌体
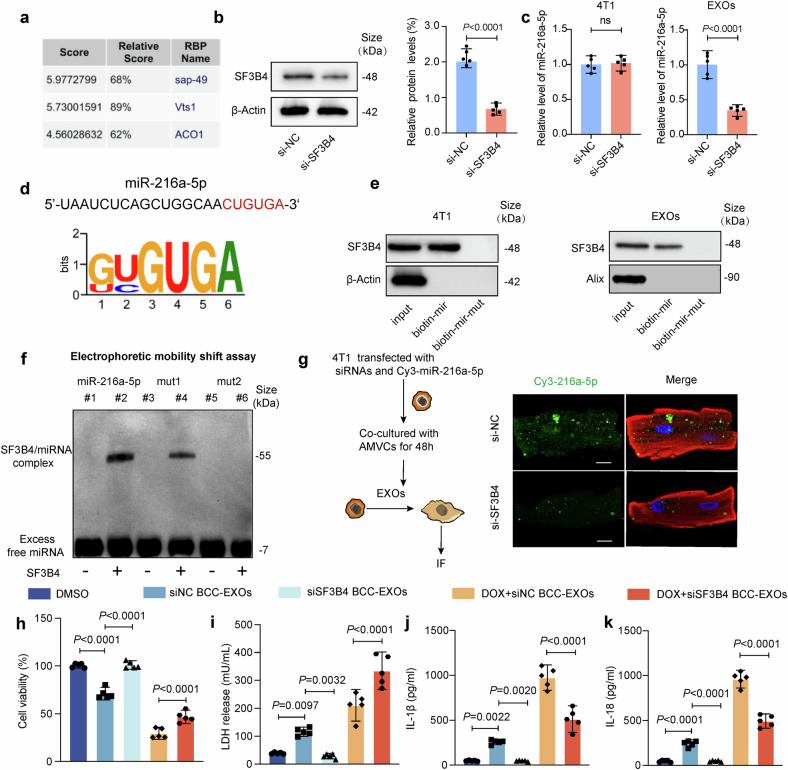
图6a:生物信息学预测显示,RNA结合蛋白SF3B4是miR-216a-5p的潜在结合蛋白,其结合基序为“CUGUGA”。
图6b-c:SF3B4siRNA敲低后,外泌体中miR-216a-5p水平显著下降,但乳腺癌细胞内miR-216a-5p水平不变,提示SF3B4调控外泌体包装过程。
图6d-e:RNA pulldown实验证实,SF3B4与miR-216a-5p直接结合,突变miR-216a-5p的“CUGUGA”基序后,结合作用消失。
图6f:电泳迁移率实验(EMSA)显示,野生型miR-216a-5p与SF3B4结合,突变型不结合,验证结合特异性。
图6g-k:SF3B4敲低减少外泌体传递至心肌细胞的Cy3-miR-216a-5p荧光信号,并显著减弱心肌细胞损伤和焦亡标志物表达。
这些结果表明,SF3B4通过特异性结合miR-216a-5p,将其选择性包装入乳腺癌细胞外泌体,促进心肌损伤信号传递。
7、miR-216a-5p通过靶向ITCH加重DOXIC
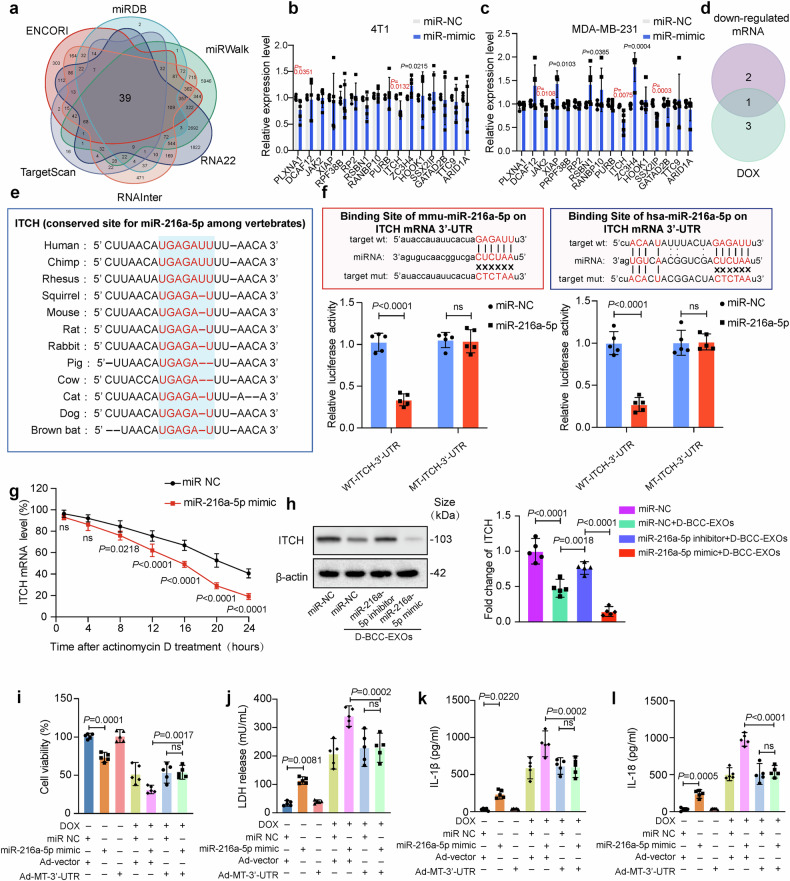
图7a:生物信息学预测显示,ITCH是miR-216a-5p的潜在靶基因,其3’UTR存在保守结合位点(CUUAACAUGAGA-UUU-AACA)。
图7b-d:共培养实验中,miR-216a-5p mimic显著下调ITCHmRNA表达,Venn分析确认ITCH为唯yi共同下调基因。
图7e:不同物种间ITCH3’UTR与miR-216a-5p的结合位点高度保守,提示功能保守性。
图7f:荧光素酶报告实验证实,miR-216a-5p与ITCH3’UTR直接结合,突变结合位点后抑制作用消失。
图7g:Dactinomycin实验显示,miR-216a-5p加速ITCHmRNA降解,降低其稳定性,导致ITCH蛋白水平下降。
图7h-l:ITCH过表达逆转miR-216a-5p诱导的心肌细胞损伤、LDH释放及焦亡标志物表达,而ITCH敲低则增强损伤。
这些结果表明,miR-216a-5p通过降解ITCHmRNA,抑制其泛素化功能,进而激活焦亡通路。
8、miR-216a-5p/ITCH轴通过减少TXNIP泛素化加重焦亡
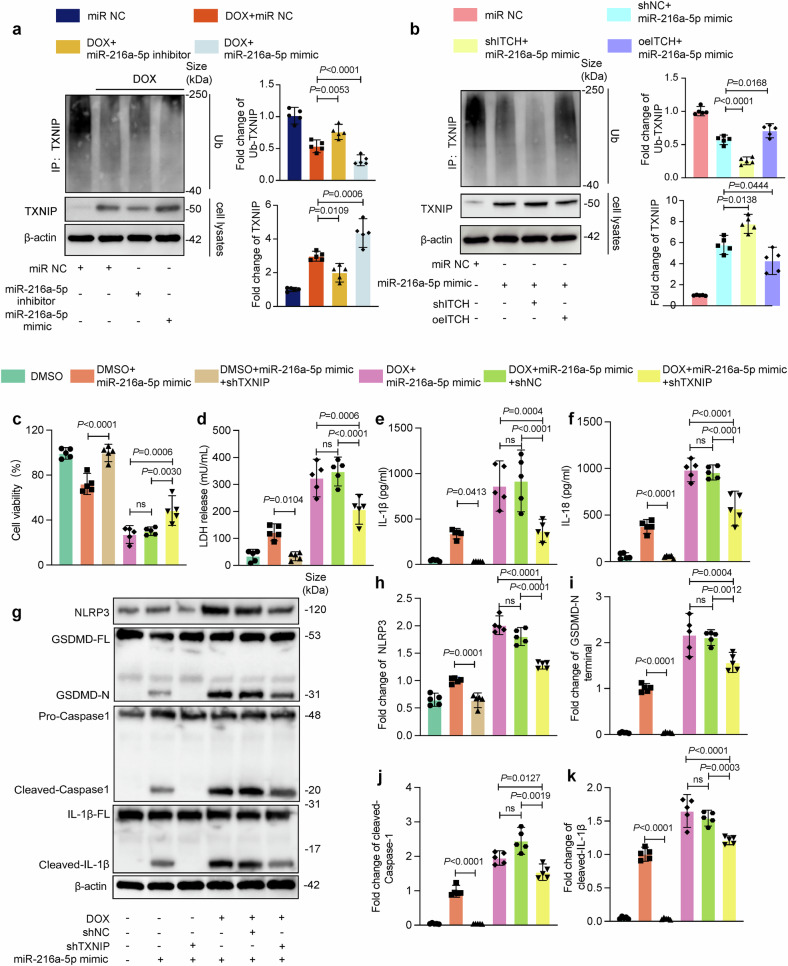
图8a:免疫共沉淀显示,miR-216a-5p抑制ITCH介导的TXNIP泛素化,导致TXNIP蛋白积累,激活焦亡通路。
图8b:ITCH敲低进一步减少TXNIP泛素化,而过表达ITCH则恢复泛素化水平,逆转miR-216a-5p的促焦亡作用。
图8c-f:TXNIP敲低显著减轻miR-216a-5p诱导的心肌细胞死亡、LDH释放及IL-1β/IL-18分泌,提示TXNIP是焦亡关键介质。
图8g-k:Western blot显示,TXNIP敲低下调焦亡相关蛋白(NLRP3、GSDMD-N、CleavedCASP1)表达,证实TXNIP在焦亡中的核心作用。
这些结果表明,miR-216a-5p通过抑制ITCH介导的TXNIP泛素化降解,激活NLRP3炎症小体通路,最终导致心肌细胞焦亡。
9、心肌特异性miR-216a-5p海绵减轻体内DOXIC
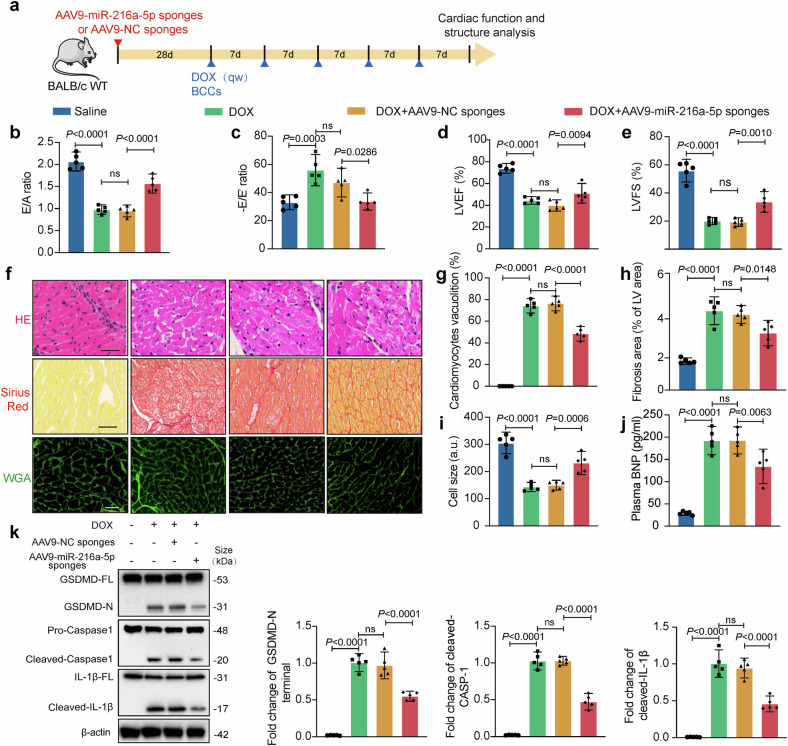
图9a:AAV9-miR-216a-5p海绵病毒的心肌特异性递送实验设计,通过启动子实现心肌细胞靶向。
图9b-e:超声心动图显示,miR-216a-5p海绵显著改善DOX诱导的LVEF、LVFS下降及舒张功能异常(E/A、E/E’比值恢复),提示心功能保护。
图9f-j:组织染色显示,miR-216a-5p海绵减少心肌空泡化(HE染色)、纤维化(Sirius红染色)及萎缩(WGA染色),降低血浆BNP水平(心力衰竭标志物)。
图9k:Westernblot证实,miR-216a-5p海绵下调心肌组织中焦亡相关蛋白(GSDMD-N、CleavedCASP1)表达,抑制焦亡通路。
这些结果表明,抑制心肌中的miR-216a-5p可有效减轻乳腺癌外泌体加剧的DOX诱导心肌损伤,验证其治疗潜力。
10、抑制TXNIP/NLRP3/Caspase-1通路减轻DOXIC
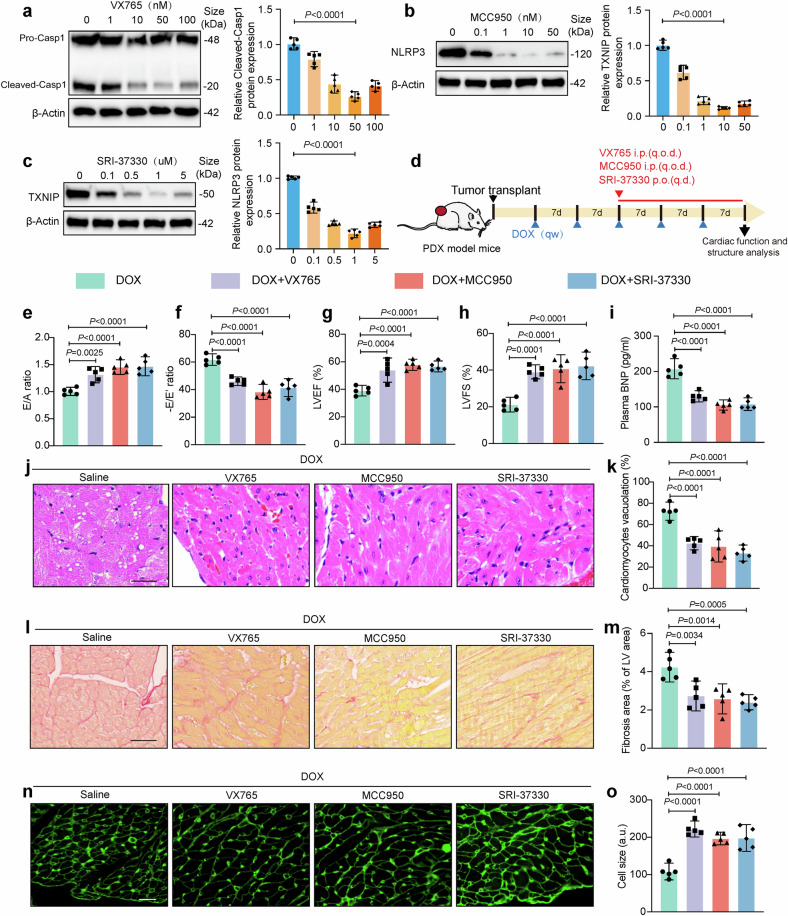
图10a-c:Western blot显示,VX765(Caspase-1抑制剂)、MCC950(NLRP3抑制剂)、SRI-37330(TXNIP抑制剂)均剂量依赖性抑制DOX处理心肌细胞中CleavedCASP1、TXNIP和NLRP3蛋白表达。
图10d:PDX模型实验设计示意图,显示抑制剂给药时间和剂量。
图10e-h:超声心动图显示,三种抑制剂均显著改善DOX诱导的左心室功能异常(LVEF、LVFS、E/A和E/E’比值恢复)。
图10i:ELISA显示,抑制剂组血浆BNP水平显著低于DOX组,提示心力衰竭程度减轻。
图10j-o:组织染色显示,抑制剂减少心肌空泡化(HE)、纤维化(Sirius红)和萎缩(WGA),改善心肌结构损伤。
这些结果表明,靶向TXNIP/NLRP3/Caspase-1通路可有效减轻DOX诱导的心肌损伤,验证焦亡通路在DOXIC中的核心作用。
11、人类乳腺癌患者外泌体加重心肌细胞焦亡及miR-216a-5p抑制剂的逆转作用
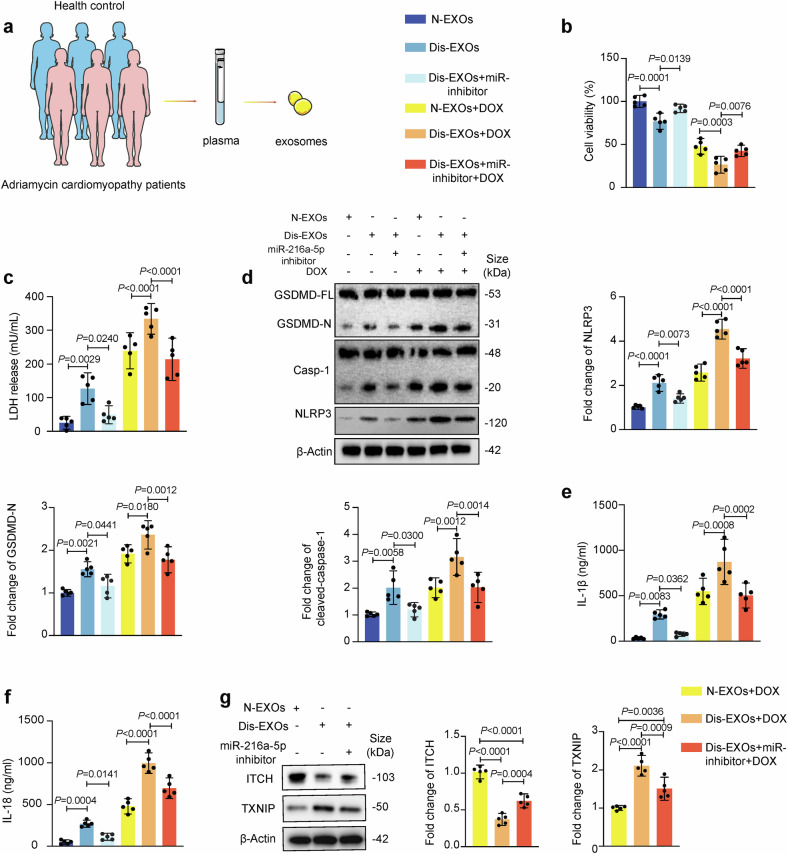
图11a:透射电镜和NTA显示,DOXIC患者血浆外泌体(Dis-EXOs)与健康人外泌体(N-EXOs)的形态和粒径分布相似,但Dis-EXOs中miR-216a-5p水平显著更高。
图11b-f:Dis-EXOs处理hiPSC-CMs后,细胞活力下降、LDH释放增加,焦亡相关蛋白(GSDMD-N、CleavedCASP1、NLRP3)和细胞因子(IL-1β、IL-18)表达上调,而miR-216a-5p抑制剂可逆转这些效应。
图11g:Western blot显示,Dis-EXOs下调心肌细胞ITCH蛋白表达,上调TXNIP表达,miR-216a-5p抑制剂恢复ITCH和TXNIP水平。
这些结果表明,人类乳腺癌患者外泌体通过miR-216a-5p/ITCH/TXNIP轴诱导心肌细胞焦亡,miR-216a-5p抑制剂具有临床转化潜力。
结论
本研究揭示了乳腺癌与心脏之间通过外泌体传递miR-216a-5p的病理串扰机制:DOX诱导乳腺癌细胞中ATF3转录因子激活,促进miR-216a-5p转录;miR-216a-5p通过SF3B4包装入外泌体并传递至心肌细胞,靶向ITCHmRNA使其降解,减少TXNIP泛素化并激活NLRP3炎症小体,最终导致心肌细胞焦亡和心脏毒性加重。抑制miR-216a-5p或阻断外泌体传递(如敲低Rab27a)可显著减轻DOXIC。该研究首次明确了“肿瘤-心脏”跨器官通信在化疗心脏毒性中的关键作用,为临床开发靶向miR-216a-5p或外泌体的心脏保护策略提供了理论依据。






