研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
14+热点发文!“外泌体”研究总有新技,吡啶离子转子战略如何一战?且看今日解析,国自然热点“外泌体”的精彩一招!
226 人阅读发布时间:2025-05-28 17:01
三阴性乳腺癌的免疫抑制性肿瘤微环境会阻碍其对彻底的免疫治疗的反应,降低其抗肿瘤疗效。STING通路有望成为修复缺陷的靶点,但药物递送的不确定性可能导致脱靶炎症反应。

湾湾今天分享的是一篇发表在【Journal of the American Chemical Society】(IF:14.5)上题为“Pyridinium Rotor Strategy toward a Robust Photothermal Agent for STING Activation and Multimodal Image-Guided Immunotherapy for Triple-Negative Breast Cancer”的研究,该研究设计了一种具有聚集诱导发光(AIE)特性的光热诊疗剂TBTP-Bz,将其与STING激动剂MSA-2共载入热响应外泌体-脂质体杂化纳米颗粒(AMFL)中,实现了近红外二区(NIR-II)荧光/光声/光热成像引导的光热免疫治疗。通过光热效应诱导免疫原性细胞死亡(ICD)并精准释放MSA-2,激活STING通路,重塑“冷肿瘤”为“热肿瘤”,有效抑制原发和远处肿瘤,并诱导免疫记忆效应。
研究成果
1、AMFL的设计与作用机制示意图
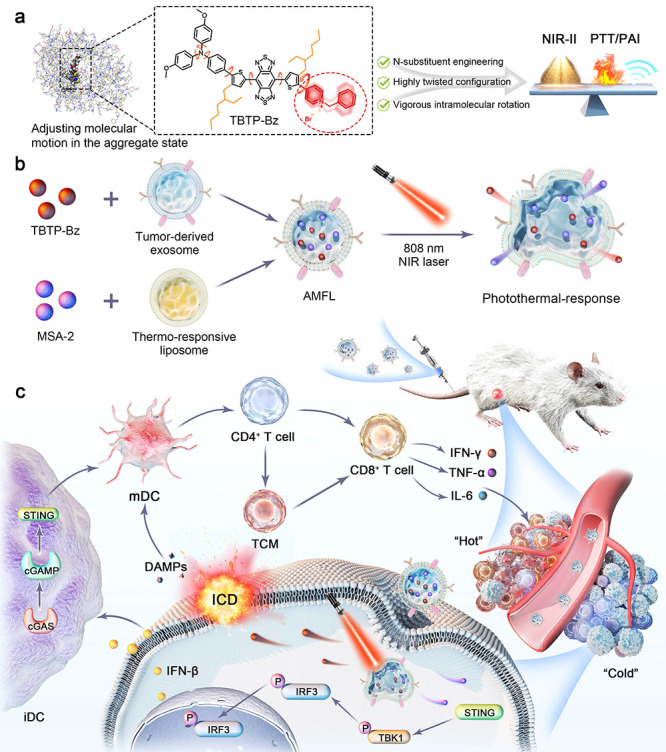
图1a:TBTP-Bz的分子设计示意图,通过吡啶转子策略优化分子旋转和电荷转移,实现聚集增强的NIR-II发光和光热效应。
图1b:AMFL的构建流程,通过外泌体-脂质体杂化结构共载TBTP-Bz和MSA-2,利用肿瘤靶向性和热响应特性实现精准给药。
图1c:作用机制示意图,光热效应诱导ICD释放损伤相关分子模式(DAMPs),结合MSA-2激活STING通路,促进DC成熟和T细胞免疫应答。
这些结果表明,AMFL通过光热效应和STING激活协同作用,可有效重塑肿瘤免疫微环境,增强抗肿瘤免疫响应。
2、AIE光热剂的优化与理论模拟
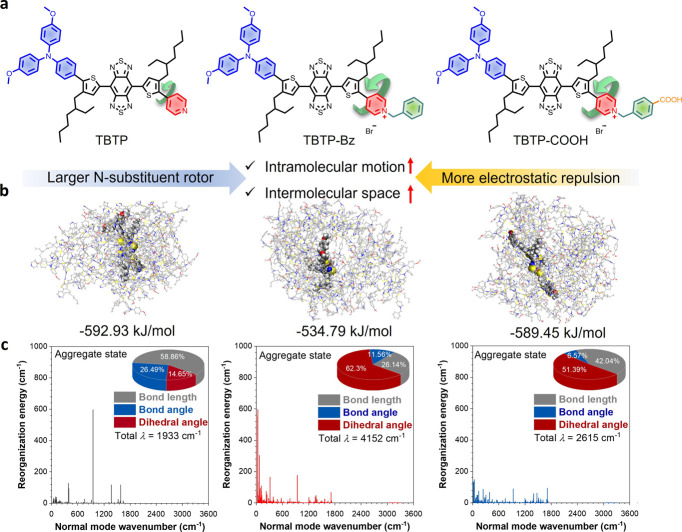
图2a:TBTP、TBTP-Bz和TBTP-COOH的分子结构,通过引入苄基(Bz)增强分子旋转和电荷排斥。
图2b:分子动力学模拟显示,TBTP-Bz因正电荷吡啶基团的静电排斥,分子堆积松散,分子间作用能最低(-534.79kJ/mol),利于非辐射能量耗散。
图2c:重组能分析表明,TBTP-Bz的二面角变化对非辐射衰变贡献最大(62.3%),解释其高光热转换效率(58.5%)。
这些结果表明,TBTP-Bz的分子结构优化通过增强分子运动和静电排斥,平衡了辐射与非辐射能量路径,实现高效光热转换和NIR-II发光。
3、AMFL的制备与表征
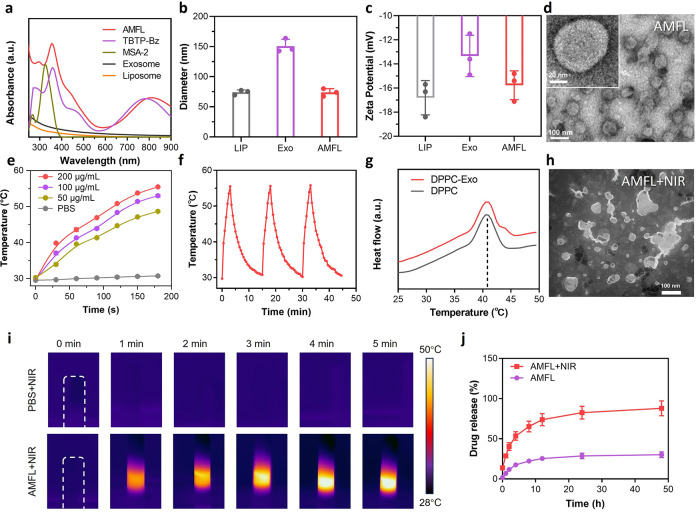
图3a:紫外-可见吸收光谱显示AMFL同时包含TBTP-Bz和MSA-2的特征峰,证实药物共载。
图3b-c:DLS显示AMFL粒径约80nm,zeta电位与外泌体相近,具备稳定性和肿瘤靶向性。
图3d:TEM显示AMFL呈球形,粒径均匀,外泌体膜包裹脂质体结构清晰。
图3e-f:光热实验显示AMFL在808nm激光下温度快速升至50℃以上,重复加热稳定性良好。
图3g-h:DSC证实AMFL的脂质体成分具有41℃相变温度,激光照射后结构崩解释放药物。
图3i-j:MSA-2在激光照射下释放效率显著提高,4小时累计释放率达60%。
这些结果表明,AMFL具有良好的物理稳定性、肿瘤靶向性和光热响应释药能力,适合体内精准治疗。
4、AMFL的体外抗肿瘤与免疫激活效应
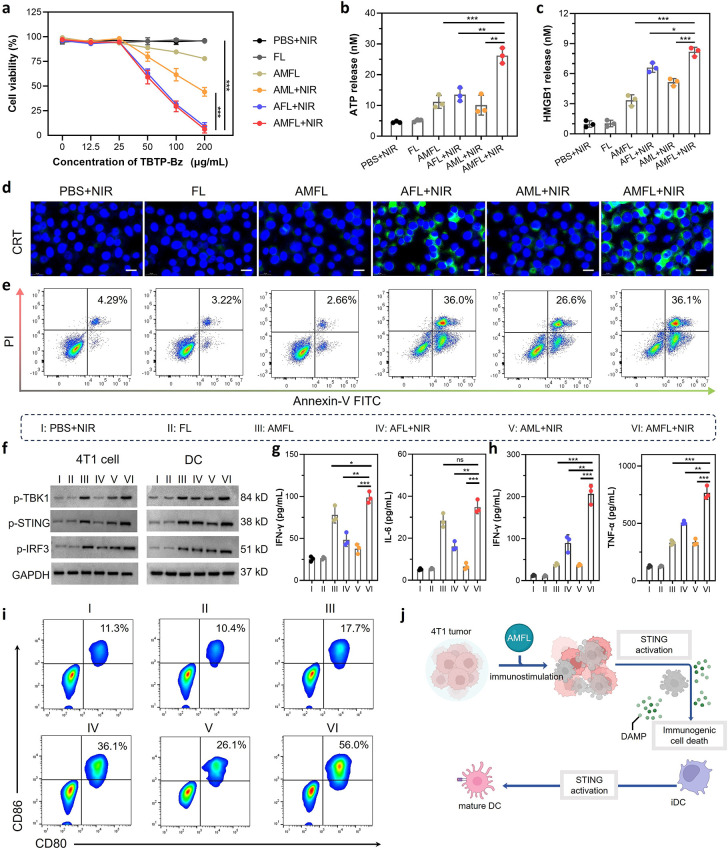
图4a:CCK-8细胞活力分析显示,AMFL在无激光照射时细胞毒性低,而在808nm激光照射下,随TBTP-Bz浓度升高,4T1细胞活力显著下降,表明光热效应主导细胞杀伤。
图4b-c:ELISA检测显示,AMFL+激光组细胞培养上清中ATP和HMGB1水平显著高于对照组,证实免疫原性细胞死亡(ICD)发生。
图4d:共聚焦激光扫描显微镜(CLSM)显示,AMFL+激光组细胞表面钙网蛋白(CRT)荧光强度显著增强,提示ICD特征性分子暴露。
图4e:AnnexinV/PI流式分析显示,AMFL+激光组凋亡率达36.1%,显著高于单纯光热组和单纯药物组,表明STING激动剂协同增强细胞死亡。
图4f:Western blot显示,AMFL+激光组4T1细胞和树突状细胞(DCs)中磷酸化STING(p-STING)、TBK1(p-TBK1)和IRF3(p-IRF3)表达显著上调,证实STING通路激活,且DCs中激活更显著。
图4g:ELISA检测显示,AMFL+激光组4T1细胞培养上清中IFN-γ和IL-6水平分别为对照组的4.2倍和3.8倍,提示促炎细胞因子分泌增加。
图4h:DCs与AMFL+激光处理的4T1细胞共培养后,IFN-β和TNF-α水平显著升高,表明DCs成熟和活化增强。
图4i:流式细胞术分析DC成熟标志物(CD80+/CD86+)显示,AMFL+激光组DC成熟率达56.0%,显著高于单纯光热组(36.1%)和未处理组(17.7%),证实STING激活促进DC成熟。
图4j:模式图总结AMFL作用机制:光热效应诱导ICD释放DAMPs,结合MSA-2激活STING通路,协同促进DC成熟和T细胞免疫应答。
这些结果表明,AMFL通过光热诱导ICD和STING通路激活的双重机制,显著增强免疫原性细胞死亡和抗肿瘤免疫响应,有效重塑肿瘤微环境。
5、AMFL的体内多模态成像能力
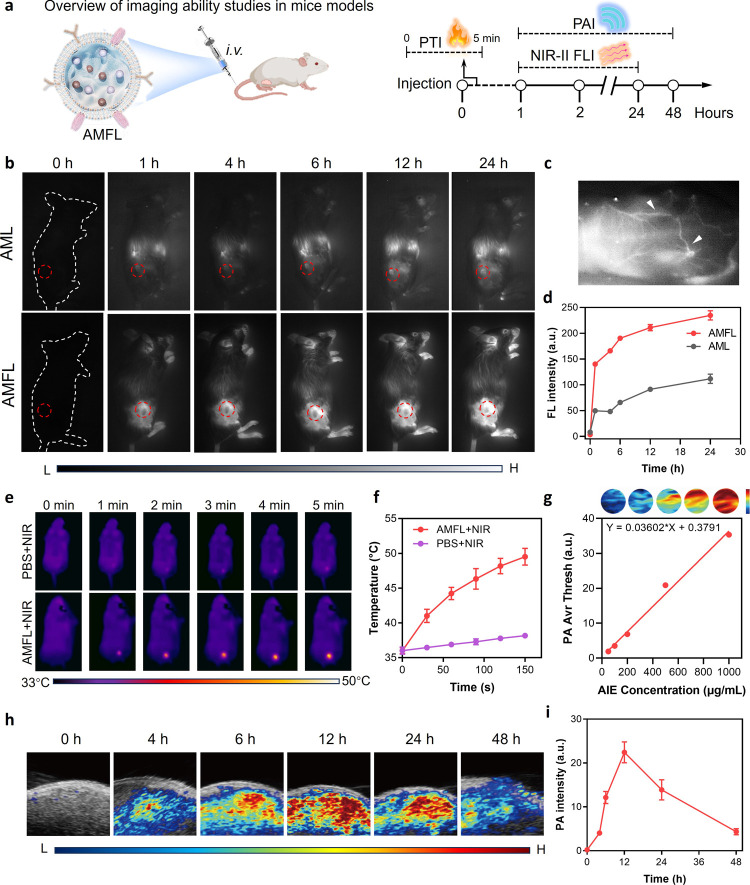
图5a:体内成像流程示意图,静脉注射AMFL后进行NIR-II荧光、光声(PA)和光热成像(PTI)。
图5b-d:NIR-II荧光成像显示AMFL在肿瘤部位持续富集,12小时信号达峰值,肿瘤/背景比显著高于单纯脂质体组(AML)。
图5e-f:光热成像显示AMFL组肿瘤温度在激光照射后升至50.6℃,显著高于PBS组。
图5g-i:光声信号强度与AMFL浓度正相关,体内PA成像清晰显示肿瘤边界,12小时信号最强。
这些结果表明,AMFL具备高效肿瘤靶向性和多模态成像能力,可实时监测肿瘤富集和光热效应。
图6:AMFL的体内抗肿瘤疗效
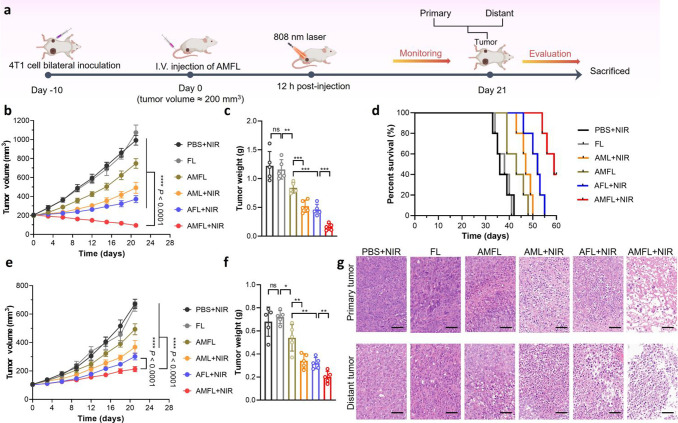
图6a:双侧肿瘤模型实验设计,左侧为原发瘤,右侧为远处瘤,治疗后观察抑瘤效果。
图6b-c:AMFL+激光组原发瘤体积和重量显著小于对照组,抑瘤率达85%以上。
图6d:生存曲线显示AMFL+激光组小鼠存活率达80%,显著高于其他组。
图6e-f:远处瘤生长受抑,体积和重量均显著小于对照组,表明系统性免疫响应。
图6g:HE染色显示AMFL+激光组肿瘤细胞坏死显著,炎症细胞浸润增多。
这些结果表明,AMFL单剂量光热免疫治疗可有效抑制原发和远处肿瘤,诱导强大的系统性抗肿瘤免疫。
7、AMFL诱导的免疫响应机制
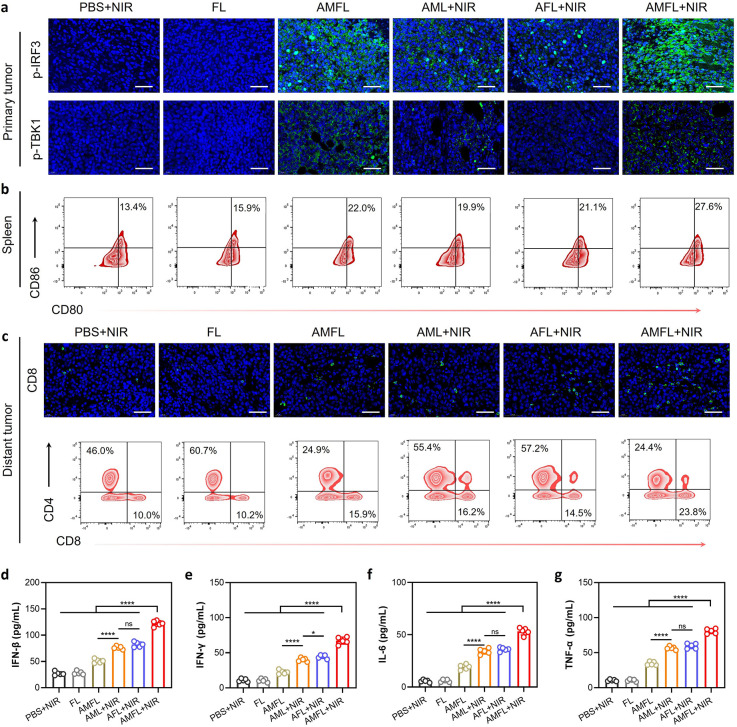
图7a:免疫荧光显示AMFL+激光组肿瘤组织中p-TBK1和p-IRF3表达显著升高,证实STING通路激活。
图7b:流式细胞术显示AMFL+激光组脾脏中成熟DC(CD80+/CD86+)比例达56%,显著高于对照组。
图7c:免疫荧光和流式显示远处瘤中CD8+T细胞浸润显著增加,激活抗肿瘤免疫。
图7d-g:ELISA检测显示AMFL+激光组肿瘤组织中IFN-β、IFN-γ、IL-6、TNF-α等细胞因子水平显著升高,营造促炎微环境。
这些结果表明,AMFL通过激活STING通路和促进DC成熟,诱导强效适应性免疫应答,清除远处肿瘤。
结论
本研究通过吡啶转子策略开发了AIE光热剂TBTP-Bz,构建了热响应外泌体-脂质体杂化纳米颗粒AMFL,实现了NIR-II成像引导的光热免疫治疗。AMFL通过光热效应诱导ICD,结合STING激动剂MSA-2激活固有免疫,有效重塑肿瘤微环境,抑制原发和远处肿瘤,并诱导免疫记忆效应。该策略为免疫“冷”肿瘤的治疗提供了新范式,展现了临床转化潜力。






