研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF:14+,外泌体circPRKD3“断联”IL6ST-STAT3,胶质瘤 TAMs 重编程+ CD8⁺T细胞招募双 buff 拉满!
1113 人阅读发布时间:2025-09-24 17:28
胶质母细胞瘤(GBM)是最常见的原发性恶性颅内肿瘤,具有高复发率和极差预后,其核心机制与肿瘤干细胞(GSCs)调控的免疫抑制微环境(TME)密切相关。GSCs通过分泌外泌体传递生物活性分子(如非编码RNA),影响肿瘤细胞增殖、干细胞特性维持及免疫细胞功能,但GSCs来源外泌体环状RNA(GDE-circRNAs)在TME重塑中的作用尚不明确。现有研究显示,外泌体circRNAs可作为肿瘤诊断标志物和治疗靶点,但针对GDE-circRNAs调控GBM免疫微环境的机制研究仍属空白。

今天分享的是发表在【Neuro Oncol】(IF:13.4)上题为“CircPRKD3-loaded exosomes concomitantly elicit tumor growth inhibition and glioblastoma microenvironment remodeling via inhibiting STAT3 signaling”的研究。该研究通过高通量测序筛选出GDE-circPRKD3,系统验证其在GBM中的表达特征、生物学功能及分子机制,探索其通过调控STAT3信号影响GSCs干性、肿瘤细胞恶性表型及TME中免疫细胞的作用,并开发脑靶向脂质纳米颗粒(LNP)递送系统,结合免疫检查点阻断(ICB)therapy,为GBM的RNA免疫治疗提供新策略。
研究结果
1.GSCs来源外泌体circPRKD3低表达且为潜在生物标志物,与TME调控相关
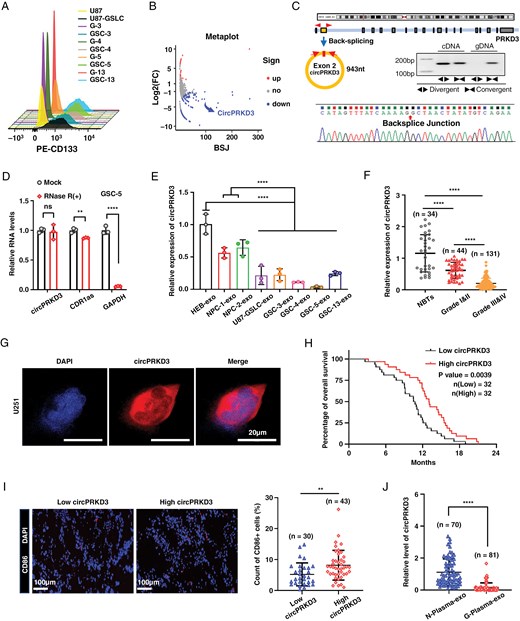
图1A:流式细胞术检测GSCs表面标志物CD133表达。U87-GSLC(U87来源胶质瘤干细胞样细胞)及原代GSC-3/4/5/13的CD133阳性率显著高于对应原代非干细胞胶质瘤细胞(G-3/4/5/13),证实GSCs成功分离。
图1B:RNA-seq差异circRNA分析热图。GSCs来源外泌体与正常外泌体(人星形胶质细胞/神经祖细胞来源)相比,共筛选出617个差异circRNAs,circPRKD3为下调最显著的circRNA之一。
图1C:circPRKD3基因结构与验证。circPRKD3由PRKD3基因第2外显子反向剪接形成,发散引物PCR可扩增出circPRKD3特异性条带,Sanger测序证实其反向剪接位点。
图1D:RNase R酶切实验。GSC-5细胞中,circPRKD3经RNase R处理后相对表达量无显著下降,证实其环状结构稳定性。
图1E:RT-qPCR检测circPRKD3在GSCs外泌体中的表达:GSCs来源外泌体中circPRKD3表达显著低于正常外泌体,与RNA-seq结果一致。
图1F:circPRKD3在临床样本中的表达。34例正常脑组织(NBTs)与175例胶质瘤组织中,circPRKD3表达随胶质瘤病理分级升高而降低,GBM组织中表达最低。
图1G:RNA原位杂交(FISH)。circPRKD3主要定位于胶质瘤细胞胞质,细胞核中几乎无信号,证实其胞质定位特征。
图1H:GBM患者生存分析。64例GBM患者中,circPRKD3高表达组中位生存期显著长于低表达组,提示circPRKD3高表达与良好预后相关。
图1I:免疫荧光检测CD86⁺巨噬细胞浸润。circPRKD3高表达的GBM组织中,CD86⁺促炎型巨噬细胞比例显著高于低表达组,证实circPRKD3与TME中促炎免疫细胞浸润正相关。
图1J:血浆外泌体circPRKD3表达:81例GBM患者血浆外泌体中circPRKD3表达显著低于70例健康对照,ROC曲线显示其区分GBM与健康人的AUC=0.9286,区分高/低级别胶质瘤的AUC=0.8977,证实其诊断价值。
这些结果表明,GSCs来源外泌体circPRKD3呈低表达特征,可作为GBM诊断与预后评估的潜在生物标志物,且其表达水平与TME中促炎巨噬细胞浸润相关,提示其可能参与GBM免疫微环境调控。
2.GDE-circPRKD3抑制GBM进展
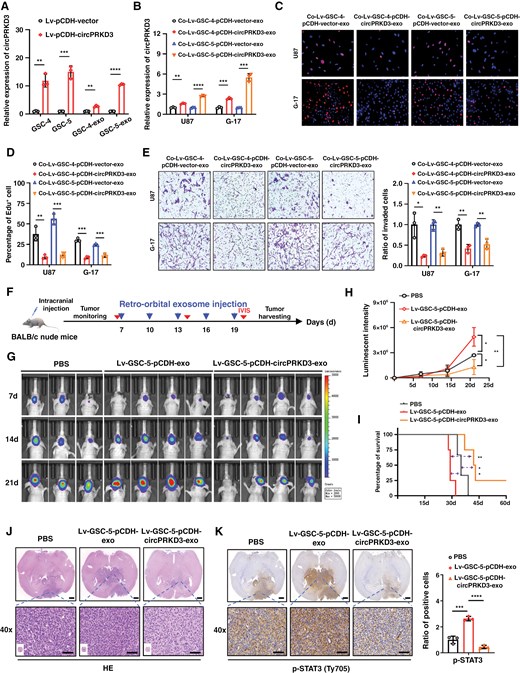
图2A:慢病毒过表达circPRKD3验证。在GSC-4、GSC-5中稳定过表达circPRKD3后,其来源外泌体中circPRKD3表达显著升高,证实外泌体可携带过表达的circPRKD3。
图2B:外泌体介导circPRKD3传递。U87、G-17细胞与GDE-OE-circPRKD3共孵育后,细胞内circPRKD3表达显著升高,而其亲本基因PRKD3表达无变化,证实外泌体可特异性传递circPRKD3。
图2C-D:EdU增殖实验。U87、G-17细胞经GDE-OE-circPRKD3处理后,EdU阳性细胞比例显著降低,证实GDE-circPRKD3抑制胶质瘤细胞增殖。
图2E:Transwell侵袭实验。GDE-OE-circPRKD3处理组U87、G-17细胞侵袭能力显著下降,证实其抑制肿瘤细胞侵袭。
图2F:体内实验设计。BALB/c裸鼠颅内接种G-17细胞,通过眶后注射给予PBS、对照外泌体或GDE-OE-circPRKD3,结合IVIS活体成像监测肿瘤生长。
图2G-H:活体成像定量。GDE-OE-circPRKD3组小鼠颅内肿瘤荧光强度显著低于对照外泌体组和PBS组,证实其抑制体内肿瘤生长。
图2I:生存分析。GDE-OE-circPRKD3组小鼠中位生存期显著长于对照外泌体组和PBS组,证实其改善荷瘤小鼠预后。
图2J:HE染色。GDE-OE-circPRKD3组肿瘤组织坏死区域更大,肿瘤边界更清晰,而对照组肿瘤组织致密、坏死少,证实其促进肿瘤细胞坏死。
图2K:免疫组化(IHC)检测p-STAT3。GDE-OE-circPRKD3组肿瘤组织中p-STAT3阳性细胞比例显著低于对照外泌体组,证实其抑制STAT3信号激活。
这些结果表明,GDE-circPRKD3可通过外泌体传递至胶质瘤细胞,抑制肿瘤细胞增殖与侵袭,减少体内肿瘤生长并延长荷瘤小鼠生存期,且其作用与抑制STAT3信号激活相关。
3.GDE-circPRKD3通过HNRNPC/IL6ST/STAT3轴调控IL6STmRNA稳定性,抑制GBM进展
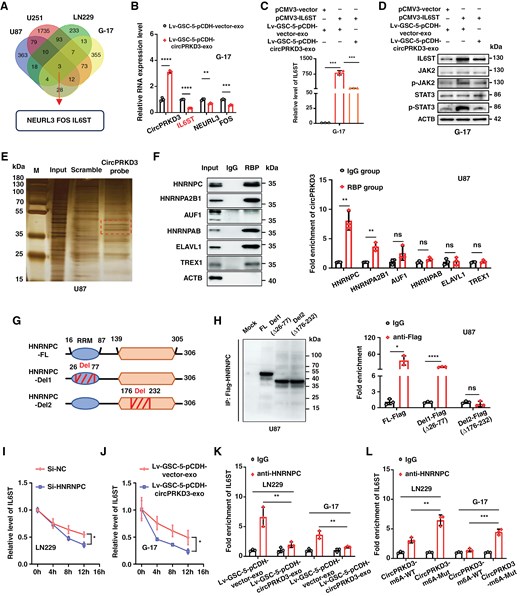
图3A:RNA-seq差异基因韦恩图。GDE-OE-circPRKD3与GDE-KD-circPRKD3处理胶质瘤细胞后,共筛选出3个共同差异基因,其中IL6ST表达变化最显著。
图3B:RT-qPCR验证IL6ST表达。G-17细胞经GDE-OE-circPRKD3处理后,IL6ST mRNA表达显著降低,而NEURL3、FOS等基因无显著变化,证实IL6ST为circPRKD3的关键靶基因。
图3C:rescue实验验证。G-17细胞过表达IL6ST后,GDE-OE-circPRKD3对IL6ST的抑制作用被逆转,证实circPRKD3直接调控IL6ST。
图3D:Western blot检测IL6ST/STAT3通路。GDE-OE-circPRKD3处理组IL6ST、p-JAK2、p-STAT3蛋白表达显著降低,而过表达IL6ST可恢复p-JAK2、p-STAT3水平,证实circPRKD3通过抑制IL6ST阻断JAK/STAT3通路。
图3E:RNA pulldown银染。用circPRKD3特异性探针捕获其结合蛋白,银染显示约55kDa处存在特异性条带,质谱鉴定为RNA结合蛋白HNRNPC。
图3F:RIP实验验证circPRKD3与HNRNPC结合。抗HNRNPC抗体免疫沉淀后,circPRKD3富集效率显著高于抗HNRNPA2B1、AUF1等抗体,GAPDH无富集,证实HNRNPC特异性结合circPRKD3。
图3G:HNRNPC截短体设计。构建全长HNRNPC(FL)、缺失26-77aa的截短体(Del1)、缺失176-232aa的截短体(Del2),其中176-232aa包含RNA识别基序(RRM)。
图3H:RIP验证HNRNPC结合结构域。Del2截短体与circPRKD3的结合效率显著低于FL和Del1,证实HNRNPC通过176-232aa结构域结合circPRKD3。
图3I:HNRNPC调控IL6ST mRNA稳定性。LN229细胞敲低HNRNPC后,经放线jun素D处理(抑制转录),IL6ST mRNA半衰期从约12h缩短至4h,证实HNRNPC维持IL6ST mRNA稳定。
图3J:GDE-circPRKD3抑制IL6ST mRNA稳定性:G-17细胞经GDE-OE-circPRKD3处理后,IL6ST mRNA半衰期从约10h缩短至6h,证实circPRKD3加速IL6ST mRNA降解。
图3K:GDE-circPRKD3竞争性结合HNRNPC:GDE-OE-circPRKD3处理组中,HNRNPC与IL6ST的结合效率显著低于对照组,证实circPRKD3竞争性抑制HNRNPC与IL6ST结合。
图3L:m⁶A修饰影响结合。circPRKD3的m⁶A突变体(m⁶A-Mut)与HNRNPC的结合效率显著低于野生型,且其对HNRNPC-IL6ST结合的抑制作用减弱,证实circPRKD3以m⁶A依赖方式结合HNRNPC。
这些结果表明,GDE-circPRKD3通过m⁶A依赖方式结合HNRNPC,竞争性抑制HNRNPC与IL6ST mRNA的结合,加速IL6ST mRNA降解,进而阻断JAK/STAT3通路,抑制GBM进展。
4.GDE-circPRKD3通过CXCL10促进CD8⁺T细胞浸润
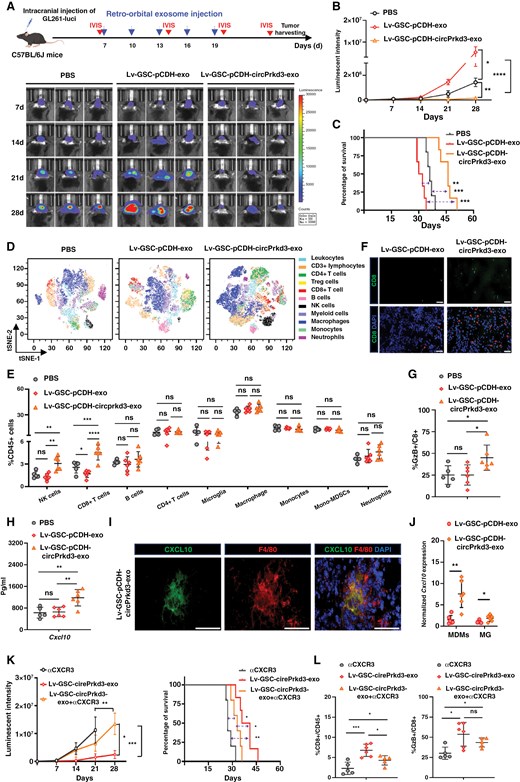
图4A:小鼠GBM模型实验设计。C57BL/6J小鼠颅内接种GL261-luci细胞,眶后注射PBS、对照外泌体或mGDE-OE-circPrkd3,每 3 天1次,IVIS监测肿瘤生长。
图4B:活体成像定量。mGDE-OE-circPrkd3组小鼠肿瘤荧光强度显著低于对照外泌体组和PBS组,证实小鼠源GDE-circPrkd3同样抑制肿瘤生长。
图4C:生存分析。mGDE-OE-circPrkd3组小鼠中位生存期显著长于对照外泌体组和PBS组,证实其体内治疗效果。
图4D:t-SNE分析肿瘤浸润免疫细胞。mGDE-OE-circPrkd3组CD45⁺免疫细胞中,CD8⁺T细胞、NK细胞聚类显著增多,而Treg细胞、M2型巨噬细胞聚类减少,证实其重塑TME免疫细胞组成。
图4E:流式细胞术定量。mGDE-OE-circPrkd3组CD8⁺T细胞、NK细胞占CD45⁺细胞比例显著高于对照组,CD4⁺T细胞、巨噬细胞比例无显著变化。
图4F:免疫荧光检测CD8⁺T细胞。mGDE-OE-circPrkd3组肿瘤组织中CD8⁺T细胞浸润密度显著高于对照组,证实其促进CD8⁺T细胞肿瘤内浸润。
图4G:流式检测CD8⁺T细胞功能。mGDE-OE-circPrkd3组GranzymeB⁺(GzB⁺)CD8⁺T细胞比例显著高于对照组,证实其增强CD8⁺T细胞细胞毒性。
图4H:ELISA检测CXCL10。mGDE-OE-circPrkd3组小鼠血清CXCL10浓度显著高于对照组,证实其促进CXCL10分泌。
图4I:免疫荧光共定位。mGDE-OE-circPrkd3组肿瘤组织中,CXCL10(绿色)与F4/80⁺巨噬细胞(红色)共定位信号显著增强,证实CXCL10主要由TAMs分泌。
图4J:RT-qPCR检测CXCL10来源。从小鼠肿瘤中分离的单核细胞衍生巨噬细胞(MDMs)中,CXCL10 mRNA表达显著升高,而小胶质细胞(MG)中无显著变化,证实MDMs是CXCL10的主要来源。
图4K:CXCR3阻断实验。抗CXCR3抗体处理后,mGDE-OE-circPrkd3组肿瘤荧光强度显著高于单独处理组,小鼠生存期从约60天缩短至40天,证实CXCL10-CXCR3轴对治疗效果至关重要。
图4L:CXCR3阻断对CD8⁺T细胞的影响。抗CXCR3抗体处理后,mGDE-OE-circPrkd3组CD8⁺T细胞浸润比例显著低于单独处理组,但剩余CD8⁺T细胞的GzB分泌能力无显著变化,证实CXCL10主要调控CD8⁺T细胞招募而非活化。
这些结果表明,GDE-circPRKD3通过促进TAMs分泌CXCL10,经CXCL10-CXCR3轴招募CD8⁺T细胞浸润至肿瘤微环境,增强CD8⁺T细胞细胞毒性,进而发挥antitumor免疫效应。
5.GDE-circPRKD3重编程肿瘤相关巨噬细胞(TAMs)向M1型极化
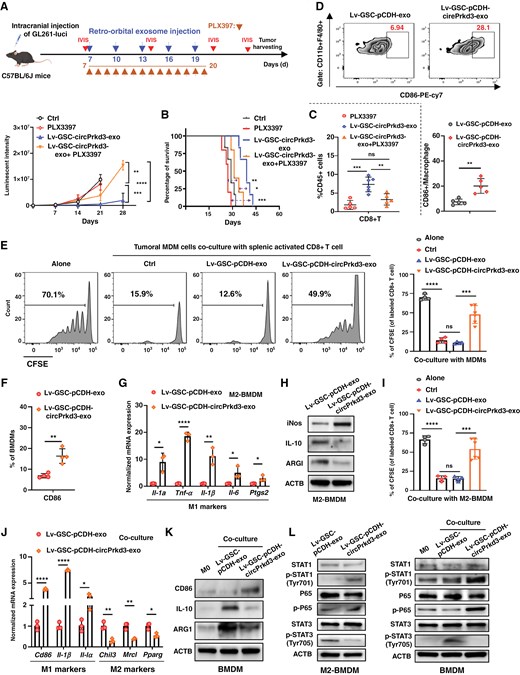
图5A:巨噬细胞耗竭实验设计。C57BL/6J小鼠颅内接种GL261-luci细胞,口服CSF1R抑制剂PLX3397耗竭巨噬细胞,同时眶后注射mGDE-OE-circPrkd3,IVIS监测肿瘤生长。
图5B:生存分析:PLX3397处理后,mGDE-OE-circPrkd3组小鼠中位生存期显著短于单独mGDE-OE-circPrkd3组,证实巨噬细胞是GDE-circPRKD3发挥作用的关键细胞。
图5C:流式检测CD8⁺T细胞。PLX3397联合mGDE-OE-circPrkd3组CD8⁺T细胞比例显著低于单独mGDE-OE-circPrkd3组,证实巨噬细胞耗竭削弱CD8⁺T细胞浸润。
图5D:流式检测TAMs表型。mGDE-OE-circPrkd3组CD86⁺M1型巨噬细胞比例显著高于对照外泌体组,证实其促进TAMs向M1型极化。
图5E:TAMs与CD8⁺T细胞共培养。mGDE-OE-circPrkd3组TAMs(MDMs)与CFSE标记的活化CD8⁺T细胞共培养后,CD8⁺T细胞增殖比例显著高于对照组,证实重编程后的TAMs促进T细胞增殖。
图5F:M2型BMDMs极化检测。mGDE-OE-circPrkd3处理IL-4/IL-13诱导的M2型骨髓来源巨噬细胞(BMDMs)后,CD86⁺细胞比例显著高于对照组,证实其诱导M2型巨噬细胞向M1型转化。
图5G:RT-qPCR检测M1标志物。mGDE-OE-circPrkd3组M2型BMDMs中Il-1α、Tnf-α、Il-1β等M1型基因表达显著上调,M2型基因表达显著下调。
图5H:Western blot检测M1/M2标志物。mGDE-OE-circPrkd3组M2型BMDMs中iNOS蛋白表达升高,IL-10、ARG1蛋白表达降低,证实其调控巨噬细胞极化相关蛋白。
图5I:M2型BMDMs与CD8⁺T细胞共培养。mGDE-OE-circPrkd3处理的M2型BMDMs与CD8⁺T细胞共培养后,CD8⁺T细胞增殖比例显著高于对照组,证实其逆转M2型巨噬细胞对T细胞的抑制作用。
图5J:RT-qPCR检测共培养体系中巨噬细胞表型。GL261细胞诱导的M2型BMDMs经mGDE-OE-circPrkd3处理后,Cd86、Il-1β等M1基因表达上调,Chil3、Mrc1等M2基因表达下调,证实其在肿瘤细胞诱导的巨噬细胞极化中仍发挥作用。
图5K:Western blot验证。上述共培养体系中,mGDE-OE-circPrkd3组CD86蛋白表达升高,IL-10、ARG1蛋白表达降低,与RT-qPCR结果一致。
图5L:Western blot检测信号通路。mGDE-OE-circPrkd3组M2型BMDMs中p-STAT1、p-P65(NF-κB)蛋白表达显著升高,p-STAT3蛋白表达显著降低,证实其通过激活STAT1/NF-κB、抑制STAT3通路调控巨噬细胞极化。
这些结果表明,GDE-circPRKD3通过激活STAT1/NF-κB通路、抑制STAT3通路,重编程TAMs从M2型免疫抑制表型向M1型促炎表型转化,进而促进CD8⁺T细胞增殖与功能,增强antitumor免疫。
6.LNP递送circPRKD3联合PD-1阻断治疗延长GBM小鼠生存期
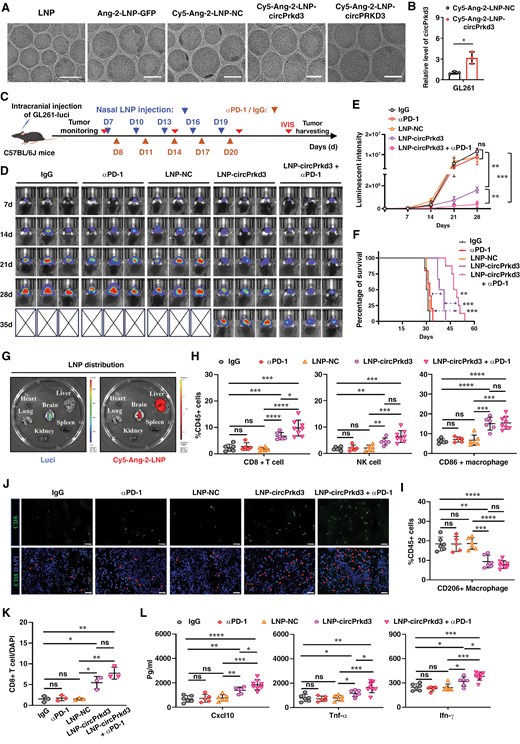
图6A:脑靶向LNP表征。冷冻电镜显示Ang-2修饰的LNP呈球形,粒径均一,可有效包裹circPRKD3。
图6B:LNP转染效率。GL261细胞与Cy5标记的Ang-2-LNP-circPrkd3共孵育后,circPrkd3表达显著升高(约3倍),证实LNP可高效递送circPRKD3至肿瘤细胞。
图6C:体内治疗方案。C57BL/6J小鼠颅内接种GL261-luci细胞,鼻腔滴注Ang-2-LNP-circPrkd3,同时腹腔注射抗PD-1抗体,监测肿瘤生长与生存。
图6D:活体成像。LNP-circPrkd3+抗PD-1组小鼠肿瘤荧光强度显著低于LNP-NC组、单独抗PD-1组和单独LNP-circPrkd3组,证实联合治疗抑制肿瘤生长效果最优。
图6E:荧光强度定量。联合治疗组肿瘤荧光强度随时间增长最慢,第35天较其他组降低约70%-80%,证实其持续抑制肿瘤进展。
图6F:生存分析。LNP-circPrkd3+抗PD-1组小鼠中位生存期显著长于单独LNP-circPrkd3组、单独抗PD-1组和LNP-NC组,证实联合治疗协同延长生存期。
图6G:LNP体内分布。Cy5标记的Ang-2-LNP主要富集于小鼠脑肿瘤组织和肝脏,脑内荧光强度显著高于非靶向LNP,证实其脑靶向递送能力。
图6H-I:流式检测免疫细胞。联合治疗组CD8⁺T细胞、NK细胞、CD86⁺M1型巨噬细胞比例显著高于其他组,CD206⁺M2型巨噬细胞比例显著降低,证实其最优重塑TME免疫组成。
图6J-K:免疫荧光检测CD8⁺T细胞。联合治疗组肿瘤组织中CD8⁺T细胞浸润密度显著高于其他组,证实其最强促进CD8⁺T细胞浸润。
图6L:ELISA检测细胞因子。联合治疗组小鼠血清CXCL10、TNF-α、IFN-γ浓度显著高于其他组,证实其最强激活炎症免疫应答。
这些结果表明,脑靶向Ang-2-LNP可高效递送circPRKD3至GBM组织,联合抗PD-1免疫检查点阻断治疗可协同重塑免疫微环境、增强CD8⁺T细胞浸润与功能,显著延长荷瘤小鼠生存期,为GBM的RNA免疫治疗提供可行方案。
结论
本研究首次揭示胶质瘤干细胞来源外泌体circPRKD3在GBM中的关键作用:circPRKD3在GSCs外泌体中低表达,可作为GBM诊断与预后的潜在生物标志物;其通过m⁶A依赖方式结合HNRNPC,竞争性抑制HNRNPC与IL6ST mRNA的结合并加速其降解,进而阻断JAK/STAT3通路,抑制GSCs干性维持、肿瘤细胞增殖与侵袭;同时,circPRKD3可重编程TAMs向M1型极化,促进TAMs分泌CXCL10,经CXCL10-CXCR3轴招募CD8⁺T细胞浸润并增强其细胞毒性;此外,脑靶向Ang-2-LNP递送circPRKD3联合抗PD-1治疗可协同抑制GBM生长、延长荷瘤小鼠生存期。该研究不仅阐明了GDE-circPRKD3调控GBM进展与免疫微环境的分子机制,还为GBM的RNA免疫治疗提供了新的靶点与策略,具有重要的临床转化价值。






