研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
国自然热点“外泌体”持续发力!14+高分来袭,科研小白进阶的秘籍!
349 人阅读发布时间:2025-10-10 13:33
心肌梗死(MI)对人类健康构成严重威胁,其发病率和死亡率逐年上升。心肌梗死发生时,局部缺血缺氧导致大量功能性心肌细胞坏死、凋亡及其他类型的死亡,血管阻塞阻碍了修复受损心肌所需营养物质的运输。跳动的心肌细胞的缺失被纤维瘢痕组织所取代,进而导致心室重构、心功能下降,并最终发展为心力衰竭。近来,介入、手术和药物治疗已被证明在一定程度上能改善心功能,但它们无法补充梗死期间丢失的心肌细胞。因此,寻找促进心脏再生的治疗策略具有重要意义。

今天分享的是发表在【Nature Communications】(IF:14.7)上题为“Cardiac repair using regenerating neonatal heart tissue-derived extracellular vesicles”的研究,该研究揭示了来自新生小鼠心脏组织的细胞外囊泡(Neo-EVs)表现出促增殖、抗凋亡和促血管生成的活性,而成年小鼠心脏来源的细胞外囊泡(Adu-EVs)则没有这些活性。令人惊讶的是,与Neo-EVs相比,通过心尖切除手术(AR手术)从再生的新生心脏组织中获得的细胞外囊泡(AR-Neo-EVs)在成年梗死心脏中显示出更强的促进心脏生成和血管生成的能力。此外,细胞外囊泡在体内的低保留率是治疗效果有限的主要原因之一。为了克服直接注射细胞外囊泡导致的组织保留率低的问题,作者进一步制备了用海藻酸钠水凝胶微球(MS)包裹的AR-Neo-EVs,发现以微球形式递送的细胞外囊泡在治疗心肌梗死方面更有效。该研究结果表明,这种基于生物材料的方法可以有效地从心脏组织中制备高产量的具有生物活性的细胞外囊泡,用于治疗缺血性心脏组织,在未来心脏损伤的治疗中具有潜在的临床价值。
研究结果
1.Neo-EVs、AR-Neo-EVs和Adu-EVs的提取及对体外心肌细胞增殖和凋亡的影响
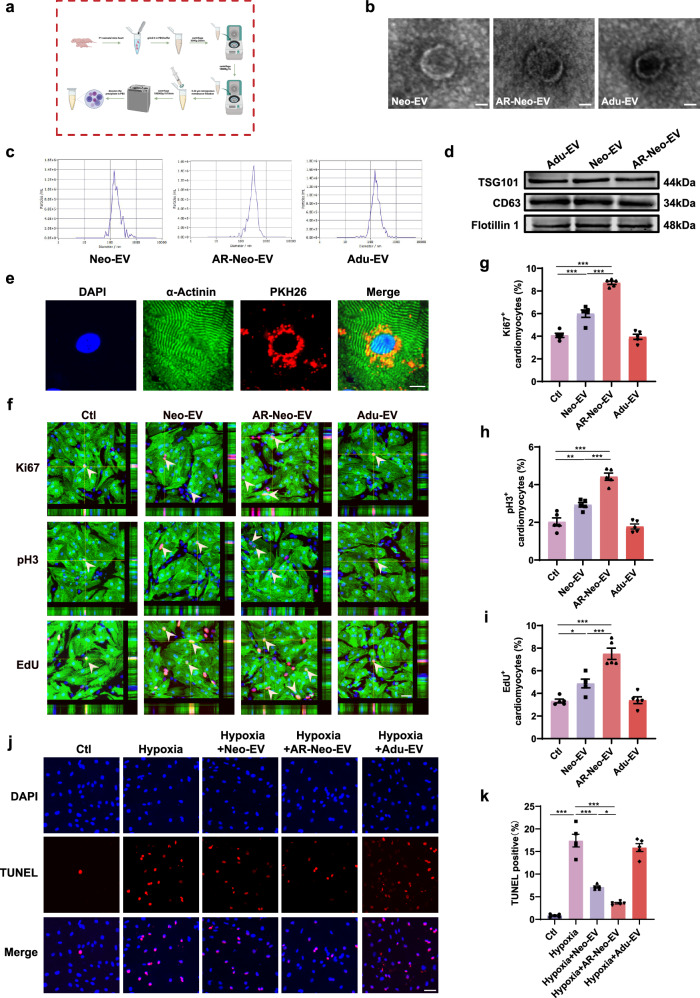
图1a:基于差速超速离心的细胞外囊泡(EVs)纯化流程的流程图。
图1b:Neo-EVs、AR-Neo-EVs和Adu-EVs的透射电子显微镜(TEM)图像。
图1c:通过纳米颗粒跟踪分析(NTA)测定的Neo-EVs、AR-Neo-EVs和Adu-EVs的尺寸分布和颗粒大小。
图1d:通过Western blot检测典型的EVs标志物TSG101、CD63和Flotillin1的表达。
图1e:PKH26标记的EVs与心肌细胞共培养6小时。在心肌细胞(α-Actinin,绿色)的细胞质内可以看到内吞的EVs(PKH26,红色)。
图1f:通过检测Ki67、pH3和EdU分析Neo-EVs、AR-Neo-EVs和Adu-EVs对心肌细胞增殖的影响。Ki67、pH3和EdU标记增殖细胞(红色),α-Actinin标记心肌细胞(绿色),DAPI标记细胞核(蓝色)。
图1g-i:Ki67、pH3和EdU增殖测定的定量分析
图1j:通过TUNEL染色分析Neo-EVs、AR-Neo-EVs和Adu-EVs对心肌细胞凋亡的影响。TUNEL标记凋亡细胞(红色),DAPI标记细胞核(蓝色)。
图1k:TUNEL测定的定量分析。
这些结果表明,AR-Neo-EVs在诱导心肌细胞细胞周期再进入和抗凋亡方面具有更高的生物活性。
2.Neo-EVs、AR-Neo-EVs和Adu-EVs对体外HUVECs血管生成的影响
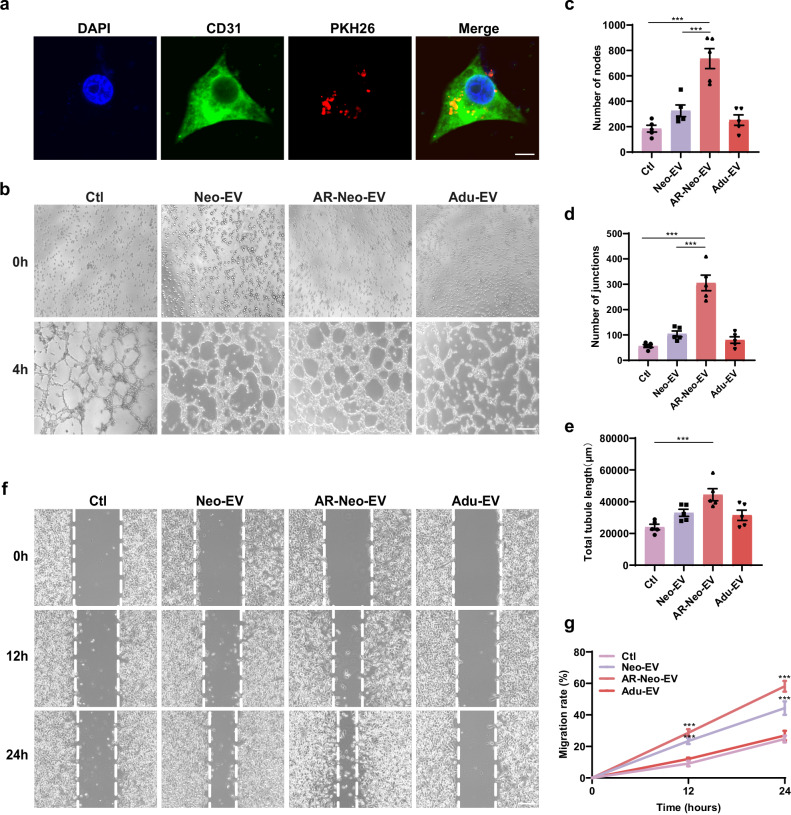
图2a:PKH26标记的EVs与HUVECs共培养6小时后,在HUVECs中观察到强烈的红色荧光信号,表明心脏组织来源的EVs能被HUVECs有效内化。
图2b-e:与Neo-EVs相比,AR-Neo-EVs处理的HUVECs能形成更多的管状网络,而Adu-EVs未显示出增强血管生成的能力。
图2f-g:伤口愈合实验表明,Neo-EVs和AR-Neo-EVs增强了内皮细胞的迁移能力,且AR-Neo-EVs的促迁移活性更强。
这些结果表明,AR-Neo-EVs具有更高的血管生成活性。
3.AR-Neo-EVs促进成年小鼠心肌梗死后的心脏修复
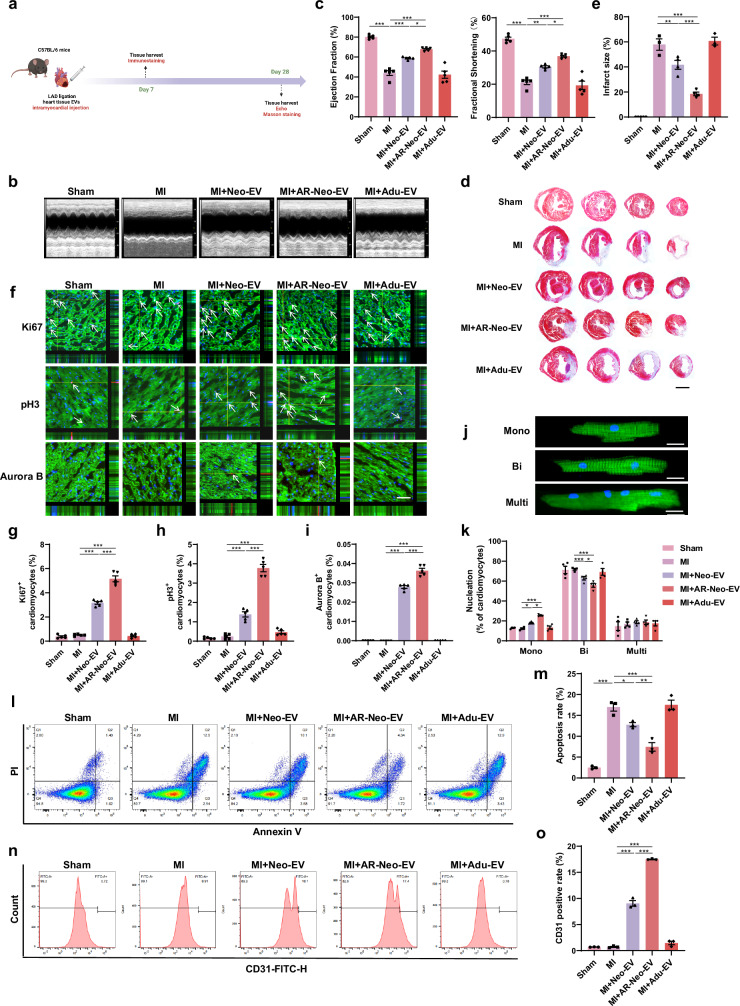
图3a:实验设计示意图,展示建立心肌梗死(MI)模型及注射不同EVs的流程。
图3b-c:超声心动图测量结果显示,MI组左心室射血分数(EF)和缩短分数(FS)显著降低,Neo-EVs和AR-Neo-EVs治疗后明显升高,且AR-Neo-EVs对保护小鼠心脏功能的作用更显著,Adu-EVs治疗组与MI组心脏功能无明显差异。
图3d-e:Masson染色和天狼星红染色显示,Neo-EVs和AR-Neo-EVs治疗的小鼠心脏纤维化面积显著小于Adu-EVs组。
图3f-i:心脏组织免疫荧光显示,AR-Neo-EVs治疗可明显增加MI小鼠心脏梗死边缘区域Ki67、pH3和AuroraB阳性心肌细胞的数量。
图3j-k:分离成年小鼠心肌细胞后发现,Neo-EVs和AR-Neo-EVs组单核成年心肌细胞数量显著增加。
图3l-m:流式细胞术分析显示,AR-Neo-EVs治疗的MI小鼠心脏梗死边缘区域凋亡心肌细胞数量显著减少。
图3n-o:通过流式细胞术分析和免疫荧光染色检测CD31,发现AR-Neo-EVs组刺激新血管形成的能力更强。
这些结果表明,AR-Neo-EVs能显著改善MI后体内心脏功能,促进心肌细胞增殖、减少凋亡和促进血管生成。
4.可注射海藻酸钠水凝胶微球(MS)的制备与表征
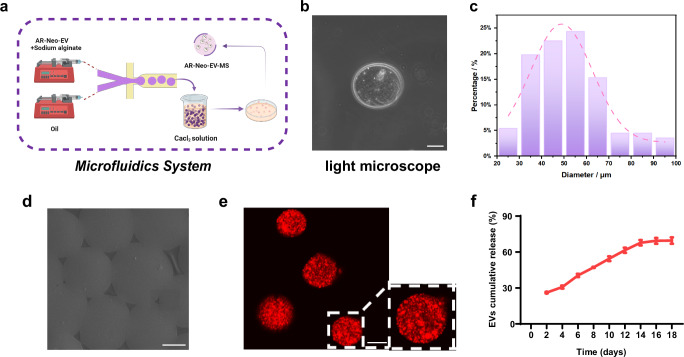
图4a:展示利用微流控技术制备海藻酸钠水凝胶MS的示意图。
图4b:光学显微镜下,MS在溶液中分布均匀,平均粒径约50μm。
图4c:MS的粒径分析结果。
图4d:扫描电子显微镜(SEM)显示MS表面光滑完整。
图4e:荧光图像显示PKH26标记的EVs均匀分散在MS内。
图4f:海藻酸钠水凝胶MS可连续释放EVs至少14天。
这些结果表明,制备的海藻酸钠水凝胶MS能有效包封EVs并实现其持续释放。
5.通过MS递送AR-Neo-EVs可进一步促进心肌梗死后心脏功能的恢复
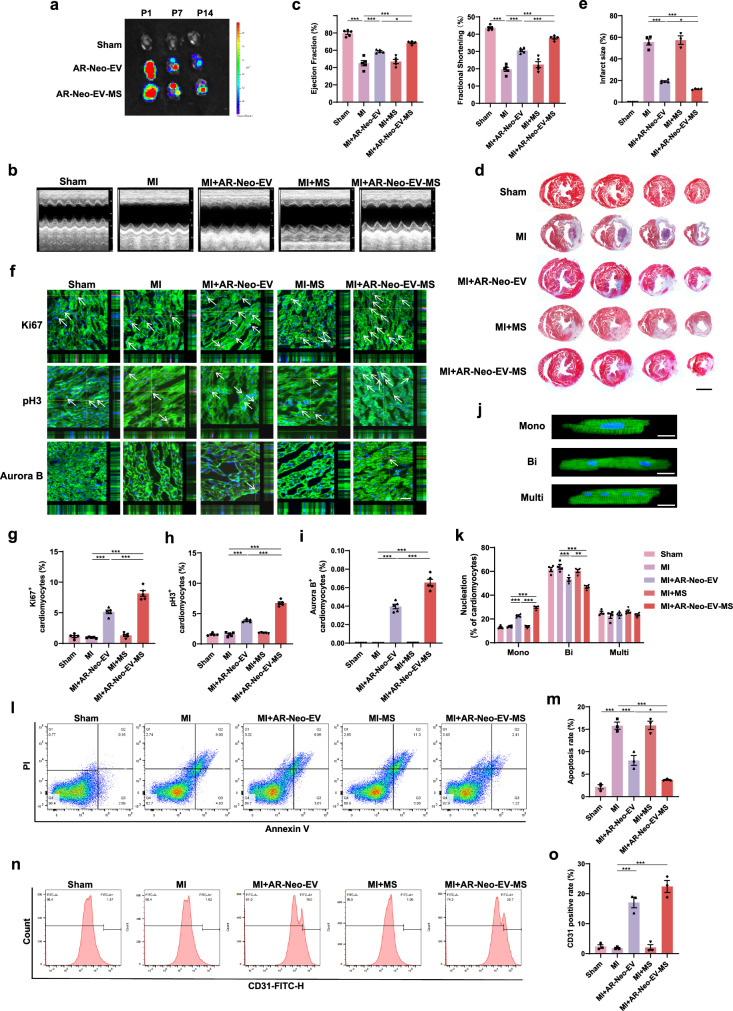
图5a:生物发光成像显示,注射AR-Neo-EVs-MS组在第14天心脏中的红色荧光信号仍较明显,而AR-Neo-EVs组荧光信号很弱,表明MS能持续有效地将EVs释放到梗死心肌中。
图5b-c:超声心动图测量结果显示,AR-Neo-EVs-MS组的EF%和FS%高于AR-Neo-EVs组,表明其改善心脏功能的效果更显著。
图5d-e:Masson三色染色和梗死面积定量分析显示,AR-Neo-EVs-MS组纤维化面积明显小于MS和直接注射AR-Neo-EVs组。
图5f-o:免疫荧光染色、流式细胞术和蛋白质免疫印迹实验表明,与直接注射AR-Neo-EVs相比,AR-Neo-EVs-MS在促进心肌细胞周期重新进入、抑制凋亡和增加血管生成方面更有效。
这些结果表明,通过MS将AR-Neo-EVs递送至梗死心肌可延长EVs在心脏中的停留时间,更充分地发挥其促进心脏再生和修复的作用。
6.Neo-EVs、AR-Neo-EVs和Adu-EVs的差异蛋白质表达谱
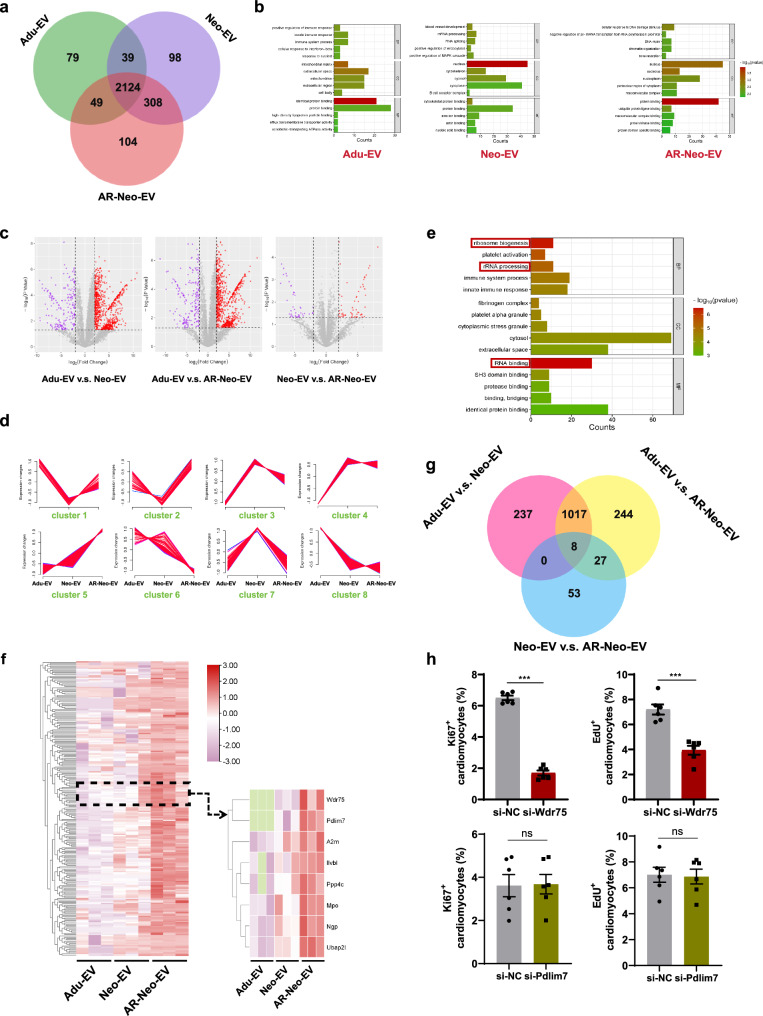
图6a:Venn图显示Adu-EVs组有2291种蛋白质,Neo-EVs组有2569种蛋白质,AR-Neo-EVs组有2585种蛋白质。
图6b:基因本体(GO)分析表明,Adu-EVs组主要富集在免疫反应,Neo-EVs组参与血管发育、mRNA加工和RNA剪接过程,AR-Neo-EVs组在DNA损伤和修复中起重要作用。
图6c:火山图展示不同组织EVs蛋白质表达谱的差异,表明Adu-EVs与Neo-EVs/AR-Neo-EVs的蛋白质组成差异较大,而Neo-EVs与AR-Neo-EVs相似。
图6d:聚类分析显示,蛋白质簇5从Adu-EVs、Neo-EVs到AR-Neo-EVs呈逐渐增加的趋势,与小鼠心肌再生规律一致。
图6e:对蛋白质簇5进行GO分析,发现逐渐上调的蛋白质倾向于参与核糖体生物发生、rRNA加工和RNA结合。
图6f-g:通过热图和Venn图进一步筛选出8种候选蛋白质,包括Wdr75、Pdlim7等。
图6h:免疫荧光结果显示,敲低Wdr75增加了Ki67和EdU阳性心肌细胞的数量,而敲低Pdlim7无明显变化,表明Wdr75可能是候选靶蛋白。
这些结果表明,不同来源的EVs具有不同的蛋白质表达谱,Wdr75可能在AR-Neo-EVs介导的心脏修复中起关键作用。
7.WD重复结构域75(Wdr75)蛋白在AR-Neo-EVs介导的体外心肌细胞增殖和血管生成中的关键作用
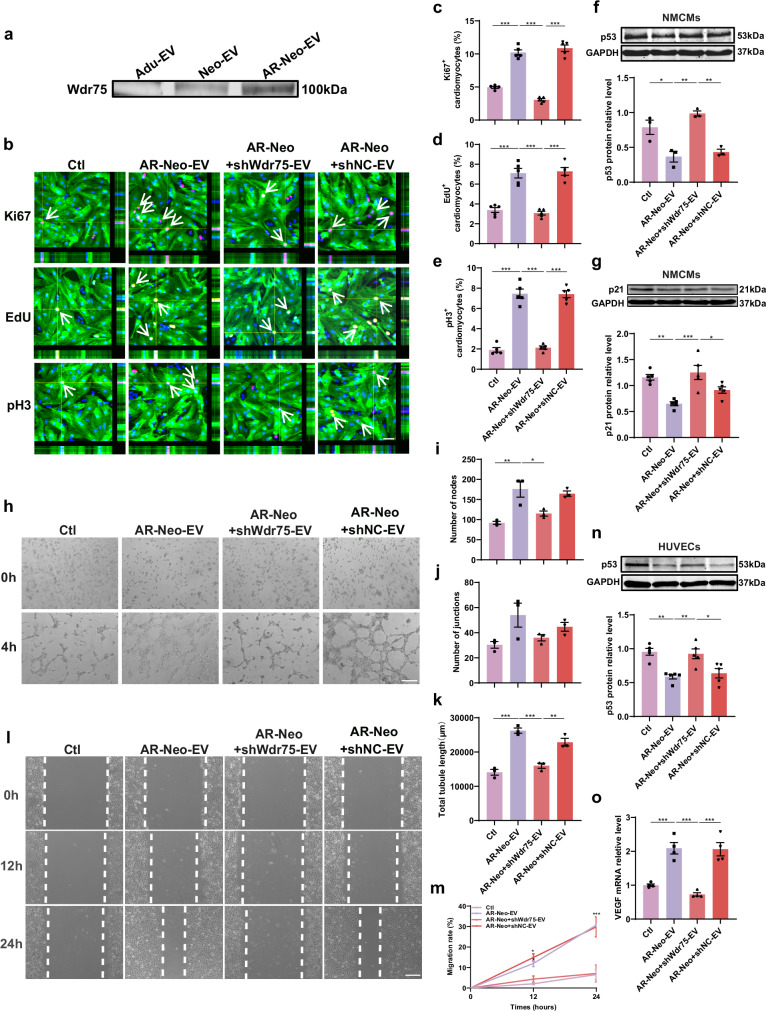
图7a:蛋白质免疫印迹分析显示,AR-Neo-EVs中Wdr75的表达显著高于Neo-EVs组,Adu-EVs中几乎检测不到Wdr75表达。
图7b-e:免疫荧光结果表明,敲低Wdr75消除了AR-Neo-EVs促进心肌细胞周期进入的作用,抑制了Ki67、EdU和pH3阳性率。
图7f-g:AR-Neo-EVs显著下调心肌细胞中p53和p21蛋白的表达,但敲低Wdr75可逆转这种抑制作用。
图7h-m:抑制Wdr75表达消除了AR-Neo-EVs促进HUVECs迁移和血管生成的作用,且AR-Neo+shWdr75-EVs处理的HUVECs中p53蛋白水平显著升高,血管内皮生长因子(VEGF)mRNA表达降低。
这些结果表明,AR-Neo-EVs通过递送Wdr75蛋白,调节心肌细胞和内皮细胞中p53的表达,参与调节细胞周期重新进入、凋亡和血管生成。
8.Wdr75对心肌细胞增殖和血管生成的影响
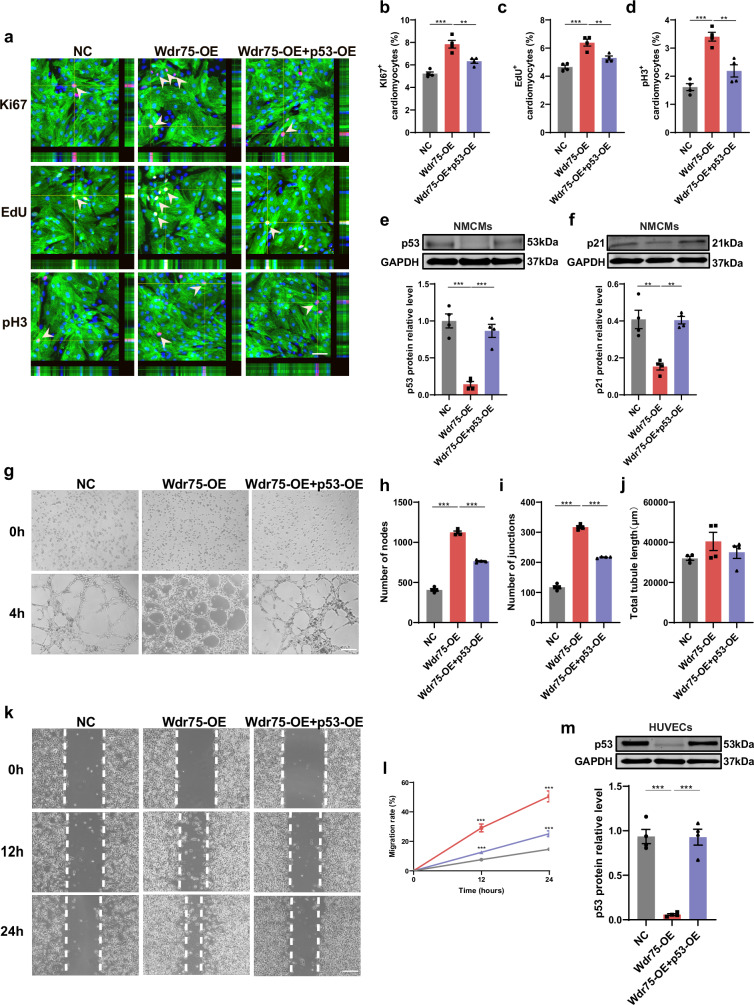
图8A-D:共转染Wdr75和p53质粒后,免疫荧光染色显示同时过表达p53明显阻断了Wdr75促进心肌细胞周期重新进入的作用。
图8E-F:蛋白质免疫印迹分析表明,过表达p53逆转了Wdr75对p21蛋白表达的抑制作用。
图8G-M:在内皮细胞中,过表达p53逆转了Wdr75的促血管生成作用,且敲低Wdr75显著抑制了体外细胞周期重新进入和血管生成。
这些结果表明,Wdr75通过影响心肌细胞和内皮细胞中p53蛋白水平发挥其多种功能。
结论
本研究揭示了AR-Neo-EVs具有心脏再生活性,通过向成年心脏递送Wdr75蛋白抑制p53信号通路,从而激活心肌细胞周期重新进入、抑制心肌细胞凋亡并促进新血管生成。此外,通过海藻酸钠水凝胶MS将这种促再生的EVs递送至梗死心脏,可有效促进心肌梗死后心脏功能的恢复。该研究为工程化EVs在缺血性心脏病中的应用提供了实验和理论基础。






