研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
脓毒症伤肺又“造疤”难破?IF 12+研究实锤:PGC-1α“拿捏”迁移体,破解思路藏在这里!
323 人阅读发布时间:2025-10-16 11:41
该研究聚焦脓毒症相关肺纤维化(SAPF)中巨噬细胞-肌成纤维细胞转化(MMT)的机制缺口,以“迁移体介导的细胞间通讯”为核心切入点,采用“体内模型+体外验证+分子调控”的研究思路突破:首先构建脂多糖(LPS)诱导的SAPF小鼠模型,结合单细胞RNA测序(scRNA-seq)确认MMT在SAPF中的存在;随后通过成纤维细胞-巨噬细胞共培养体系,探究LPS对成纤维细胞迁移体分泌的影响及迁移体中线粒体DNA(mtDNA)的作用;再深入解析PGC-1α(过氧化物酶体增殖物激活受体γ辅激活因子1α)对线粒体功能、迁移体释放及MMT的调控机制;最后通过PGC-1α过表达AAV载体干预,在体内验证其对SAPF的缓解效果,最终明确“LPS抑制PGC-1α→线粒体功能障碍→mtDNA迁移体释放→MMT→SAPF”的调控轴,为SAPF治疗提供新机制与靶点。

研究背景
脓毒症引发的急性呼吸窘迫综合征(ARDS)进展中,脓毒症相关肺纤维化(SAPF)是关键病理阶段,肺成纤维细胞聚集活化形成纤维灶是SAPF发生发展的核心。近年研究发现,巨噬细胞-肌成纤维细胞转化(MMT)是SAPF中肌成纤维细胞的新型来源,但其驱动机制尚未明确。
迁移体作为新型细胞外囊泡,直径0.5-3μm,通过细胞迁移时的回缩纤维释放,可携带线粒体、蛋白质等物质介导细胞间通讯,已在胚胎发育、组织再生中发挥重要作用,但其在SAPF中的分泌机制及下游效应尚未探索。此外,PGC-1α作为调控线粒体生物合成的关键转录辅激活因子,与肺损伤修复密切相关,且线粒体DNA(mtDNA)释放可引发炎症反应,与ARDS发展相关,但PGC-1α是否通过调控成纤维细胞迁移体释放影响MMT,仍缺乏相关研究,需深入探究。
研究结果
1、LPS诱导的肺纤维化中存在巨噬细胞-肌成纤维细胞转化(MMT)
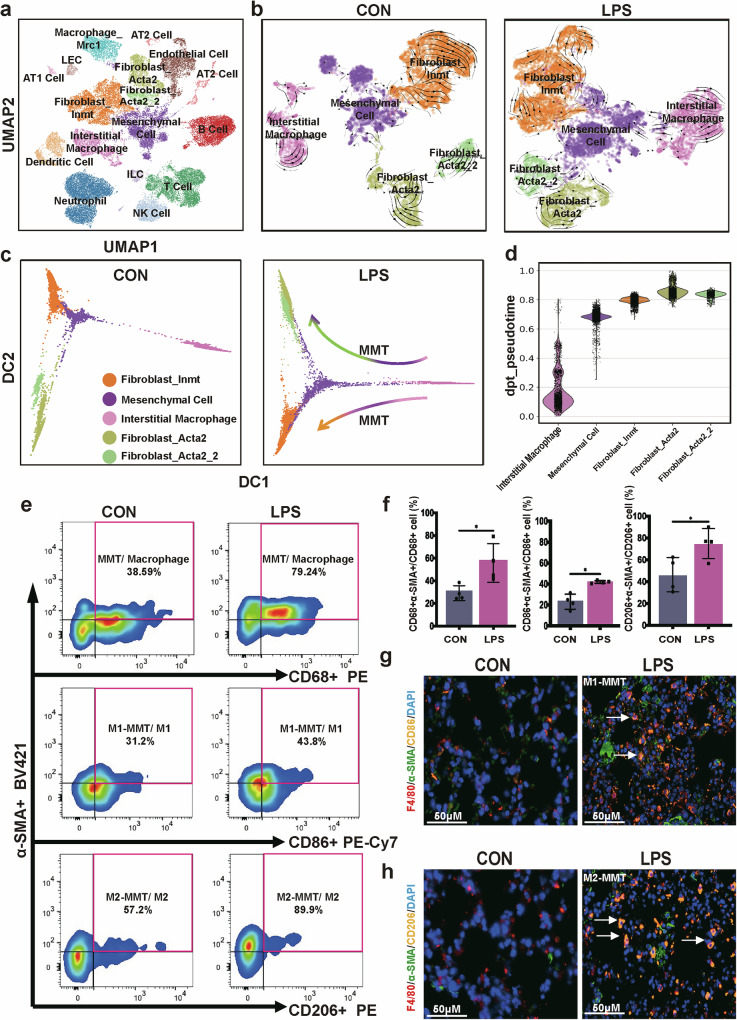
通过scRNA-seq对LPS诱导的SAPF小鼠肺组织进行分析,UMAP聚类识别出包括成纤维细胞、巨噬细胞在内的多种细胞类型;RNAvelocity分析显示,LPS组中巨噬细胞向间充质细胞、成纤维细胞转化的轨迹明显,对照组无此现象;伪时间分析进一步证实,LPS组巨噬细胞可从CD68⁺α-SMA⁻状态逐步过渡到α-SMA⁺CD68⁻的成纤维细胞状态;流式细胞术检测发现,LPS组肺组织中α-SMA⁺CD68⁺的MMT细胞、α-SMA⁺CD86⁺的M1-MMT细胞及α-SMA⁺CD206⁺的M2-MMT细胞比例均显著高于对照组;多重免疫荧光成像证实,LPS组肺组织中存在F4/80⁺CD86⁺α-SMA⁺和F4/80⁺CD206⁺α-SMA⁺的MMT细胞,对照组无明显阳性信号。这些结果表明,LPS诱导的SAPF模型中存在MMT过程,且M1、M2型巨噬细胞均可通过MMT转化为肌成纤维细胞,为SAPF中肌成纤维细胞的来源提供了新解释。
2、LPS刺激促进成纤维细胞迁移及迁移体释放
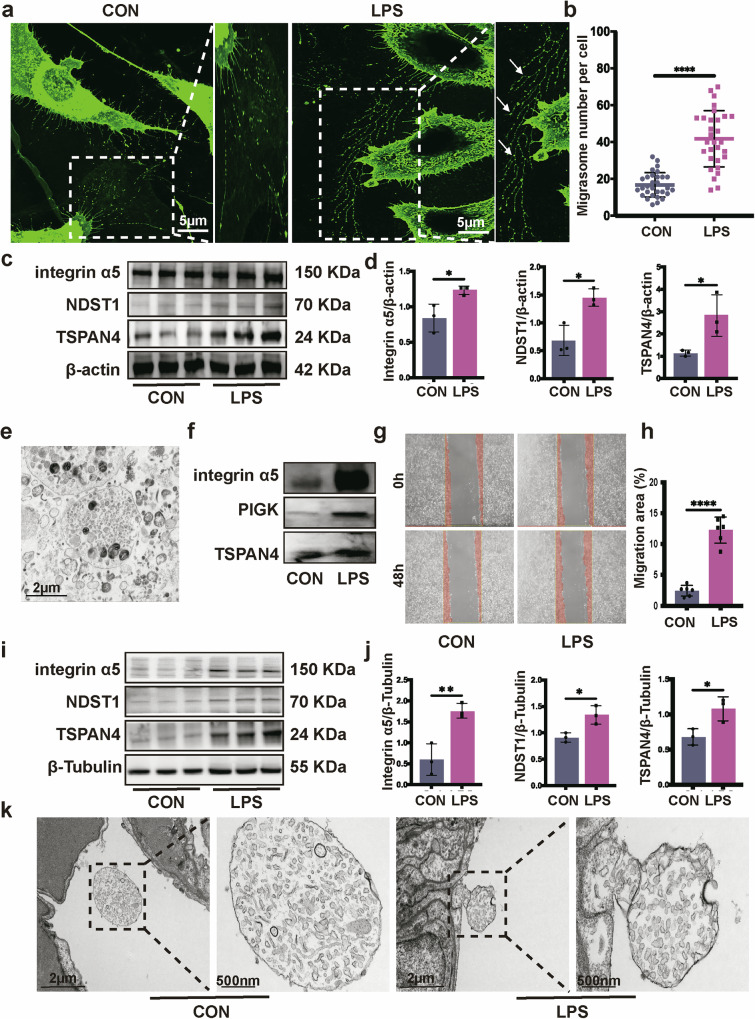
通过体外实验观察LPS对L929成纤维细胞的影响,WGA染色显示,LPS处理48h后,成纤维细胞表面迁移体数量显著增加,且迁移体形态典型;Western blot检测发现,LPS组迁移体特异性标志物(整合素α5、NDST1、TSPAN4)的蛋白表达显著上调;透射电镜(TEM)观察到纯化的迁移体中含有线粒体结构,且Western blot进一步验证了迁移体标志物的存在(图2E、F);划痕实验显示,LPS组成纤维细胞迁移面积显著大于对照组;体内实验中,LPS处理小鼠肺组织的迁移体标志物表达显著升高,TEM也观察到肺组织中存在迁移体样结构。这些结果表明,LPS刺激可在体内外显著促进成纤维细胞迁移,并诱导其释放迁移体,提示迁移体可能参与成纤维细胞与巨噬细胞的互作及SAPF进展。
3、成纤维细胞释放的mtDNA迁移体促进LPS诱导肺纤维化中的MMT

通过Transwell共培养系统探究迁移体的作用,使用3μm孔径Transwell(允许迁移体通过)时,LPS处理的成纤维细胞可显著上调巨噬细胞中α-SMA的表达,而单独LPS刺激巨噬细胞无此效应;使用0.4μm孔径Transwell(阻断迁移体通过)时,LPS对巨噬细胞α-SMA表达无显著影响;加入迁移体抑制剂SAR407899后,巨噬细胞α-SMA表达随抑制剂浓度升高而降低;共聚焦成像显示,LPS处理使成纤维细胞线粒体碎片化,胞质中dsDNA(mtDNA)增多,且部分dsDNA与迁移体共定位;纯化的LPS组成纤维细胞迁移体(0.1μg)可显著上调巨噬细胞α-SMA表达,且LPS组成纤维细胞来源的mtDNA转染巨噬细胞后,也能促进α-SMA表达;此外,LPS组TSPAN4-mCherry标记的迁移体被巨噬细胞吞噬的效率显著高于对照组。这些结果表明,LPS诱导成纤维细胞释放含mtDNA的迁移体,这些迁移体被巨噬细胞摄取后可促进其向肌成纤维细胞转化,是MMT过程的关键驱动因素。
4、激活PGC-1α可缓解LPS诱导的线粒体功能障碍并抑制成纤维细胞mtDNA迁移体形成
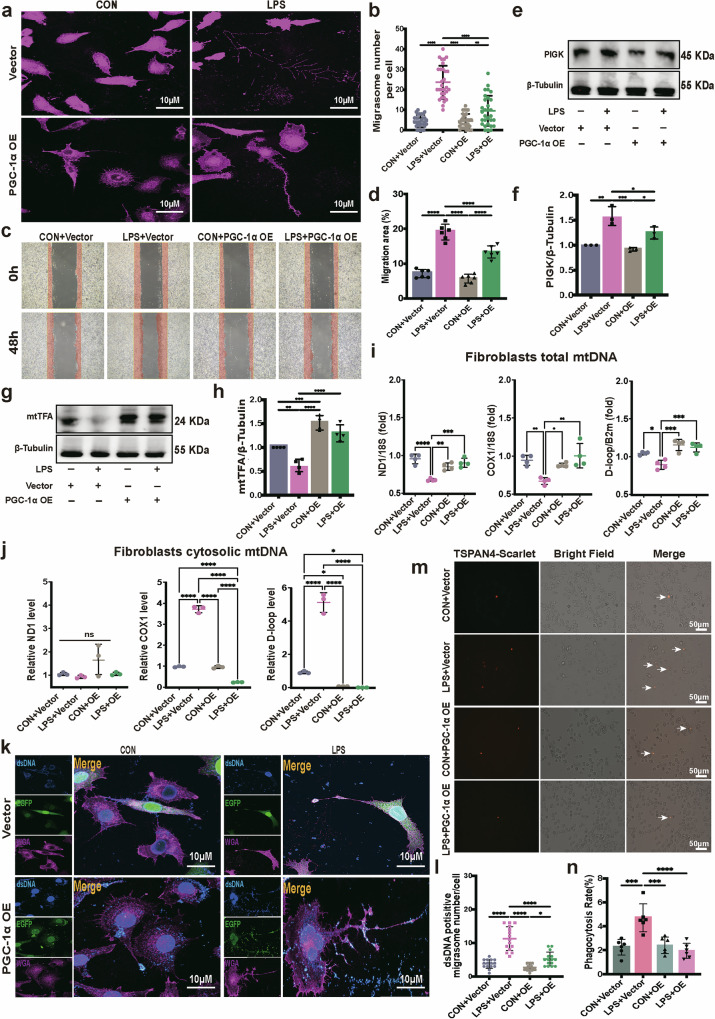
探究PGC-1α对迁移体形成的调控,CCK-8实验确定25μMPGC-1α激活剂ZLN005无明显细胞毒性,且ZLN005可上调LPS处理成纤维细胞中PGC-1α的表达,降低α-SMA水平;构建PGC-1α过表达L929细胞系,WGA染色显示,即使在LPS刺激下,PGC-1α过表达组成纤维细胞的迁移体数量仍显著少于空载体组;划痕实验显示,PGC-1α过表达组成纤维细胞迁移面积显著小于空载体组;Western blot检测发现,LPS诱导的迁移体标志物PIGK表达上调被PGC-1α过表达逆转;此外,PGC-1α过表达可上调线粒体转录因子A(mtTFA)的表达,增加成纤维细胞总mtDNA含量,减少胞质中mtDNA泄漏,且降低迁移体中dsDNA的阳性比例;TSPAN4-mScarlet标记实验显示,PGC-1α过表达组成纤维细胞的迁移体被巨噬细胞吞噬的效率显著降低。这些结果表明,激活PGC-1α可改善LPS诱导的成纤维细胞线粒体功能障碍,减少mtDNA泄漏及迁移体形成,进而降低迁移体被巨噬细胞摄取的效率。
5、成纤维细胞中PGC-1α介导的mtDNA迁移体释放是MMT所必需的
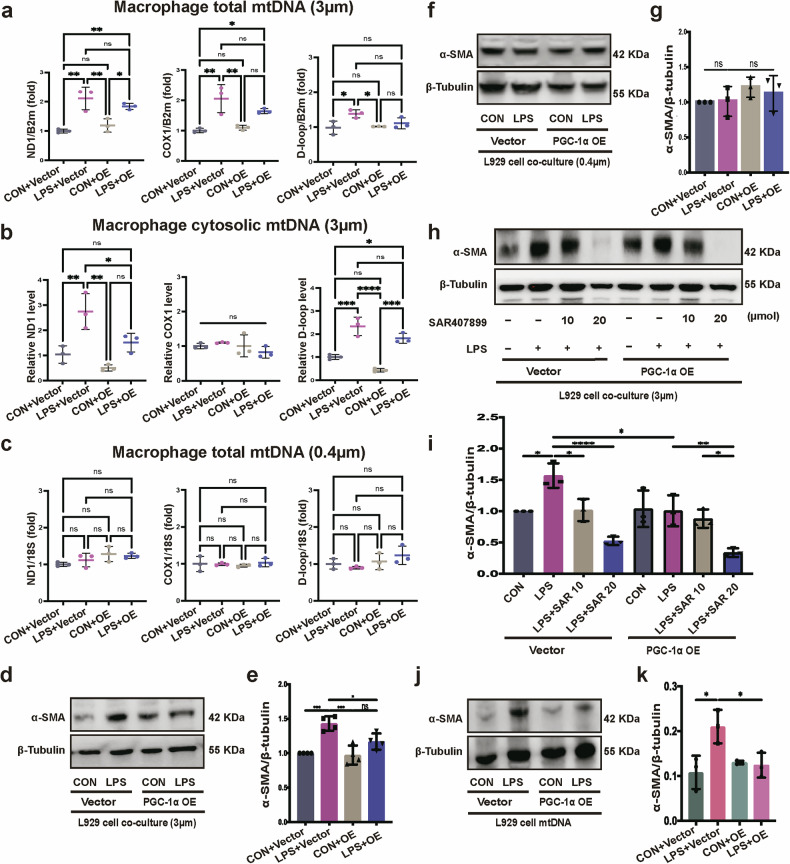
通过共培养实验分析PGC-1α的作用,使用3μm孔径Transwell时,LPS处理的PGC-1α过表达成纤维细胞共培养组,巨噬细胞总mtDNA及胞质mtDNA含量显著低于LPS处理的空载体组;使用0.4μm孔径Transwell时,各组巨噬细胞mtDNA含量无显著差异;Western blot显示,3μm孔径Transwell条件下,PGC-1α过表达组成纤维细胞可显著降低巨噬细胞α-SMA的表达;而在0.4μm孔径Transwell或加入迁移体抑制剂时,PGC-1α过表达对巨噬细胞α-SMA表达的影响消失;将不同处理组成纤维细胞的mtDNA转染巨噬细胞,发现LPS组mtDNA可上调α-SMA表达,而PGC-1α过表达+LPS组mtDNA的该效应显著减弱。这些结果表明,成纤维细胞中PGC-1α通过抑制mtDNA迁移体释放,减少巨噬细胞对mtDNA的摄取,进而抑制MMT过程,且该作用依赖于迁移体的介导。
6、激活PGC-1α通过抑制MMT过程缓解LPS相关肺纤维化
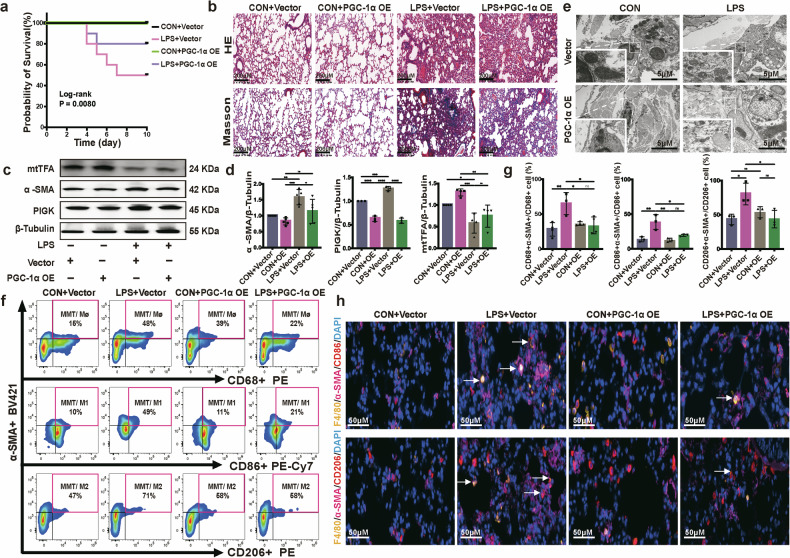
通过体内干预实验验证PGC-1α的作用,小鼠气管内注射PGC-1α过表达AAV后,LPS处理的PGC-1α过表达组(LPS+OE)生存率显著高于LPS+空载体组,且体重下降幅度更小;HE和Masson染色显示,LPS+OE组肺组织炎症浸润和胶原沉积显著少于LPS+空载体组;Western blot检测发现,LPS+OE组肺组织中mtTFA表达上调,α-SMA和迁移体标志物PIGK表达下调,总mtDNA含量增加;TEM显示,LPS+OE组成纤维细胞线粒体损伤(肿胀、嵴缺失)较LPS+空载体组显著缓解;流式细胞术和免疫荧光显示,LPS+OE组肺组织中α-SMA⁺CD68⁺的MMT细胞、α-SMA⁺CD86⁺的M1-MMT细胞及α-SMA⁺CD206⁺的M2-MMT细胞比例均显著低于LPS+空载体组。这些结果表明,体内激活PGC-1α可通过抑制MMT过程,减轻LPS诱导的肺组织炎症和纤维化,证实了PGC-1α作为SAPF治疗靶点的潜力。
结论
本研究系统揭示了PGC-1α调控迁移体分泌影响脓毒症相关肺纤维化(SAPF)的机制:LPS刺激抑制肺成纤维细胞中PGC-1α的表达,导致线粒体功能障碍、mtDNA在胞质积累,进而促进含mtDNA的迁移体释放;这些迁移体被巨噬细胞摄取后,可诱导巨噬细胞向肌成纤维细胞转化(MMT),最终加剧肺纤维化;而激活或过表达PGC-1α可改善线粒体功能,减少mtDNA迁移体释放,抑制MMT过程,从而缓解SAPF。研究不仅首次建立了“PGC-1α-线粒体-mtDNA迁移体-MMT”的SAPF调控轴,还为SAPF的治疗提供了新的潜在靶点(如PGC-1α激活剂、迁移体抑制剂),为后续临床转化研究奠定了理论基础。






