研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
“双功能工程外泌体”体内修复效能!“转录组PCA+GSEA分析”深挖分子机制
260 人阅读发布时间:2025-10-17 09:54
WNT信号通路是调节组织形态发生和再生的重要途径。然而,由于缺乏识别和向目标组织递送特定WNT配体的方法,将其用于再生医学一直颇具挑战性。以下研究提出的“双功能工程外泌体(exoWNT3A/RSPO1)”,为这一难题提供了突破性解决方案——其通过WLS蛋白介导,实现WNT3A与RSPO1双配体高效共载,在急性肝损伤、慢性肝纤维化及衰老肝脏模型中均展现出优异修复效能,并通过“转录组PCA+GSEA分析”解锁外泌体调控肝再生的分子密码。

今天分享的是一篇发表在【Nat Commun.】(IF:15.7)上题为“Dual-ligand engineered exosome regulates WNT signaling activation to promote liver repair and regeneration”的研究,该研究开发了一组携带19种WNT和4种RSPO配体的工程化外泌体,这些外泌体即使在存在WNT拮抗剂的情况下也表现出与重组蛋白相当的活性。且将携带WNT和RSPO1的外泌体组合使用时,WNT信号通路会协同激活。研究通过人类肝祖细胞培养,发现WNT3-RSPO1或WNT3A-RSPO1组合能够调节肝祖细胞的命运,部分是通过PPARα信号通路介导的。重要的是,研究结果证明了单个外泌体携带的双WNT3A/RSPO1配体(exoWNT3A/RSPO1)在Axin2-mGFP小鼠模型中能有效诱导WNT活性,能从急性及慢性肝损伤中拯救小鼠,并逆转与衰老相关的肝脏表型。这种激活WNT信号通路的外泌体平台为评估各种生物系统中的WNT配体活性提供了机会,并为受损、患病和衰老组织的再生提供了一种有前景的策略。
研究成果
1. WNT和R-spondin家族配体可被工程化到外泌体上
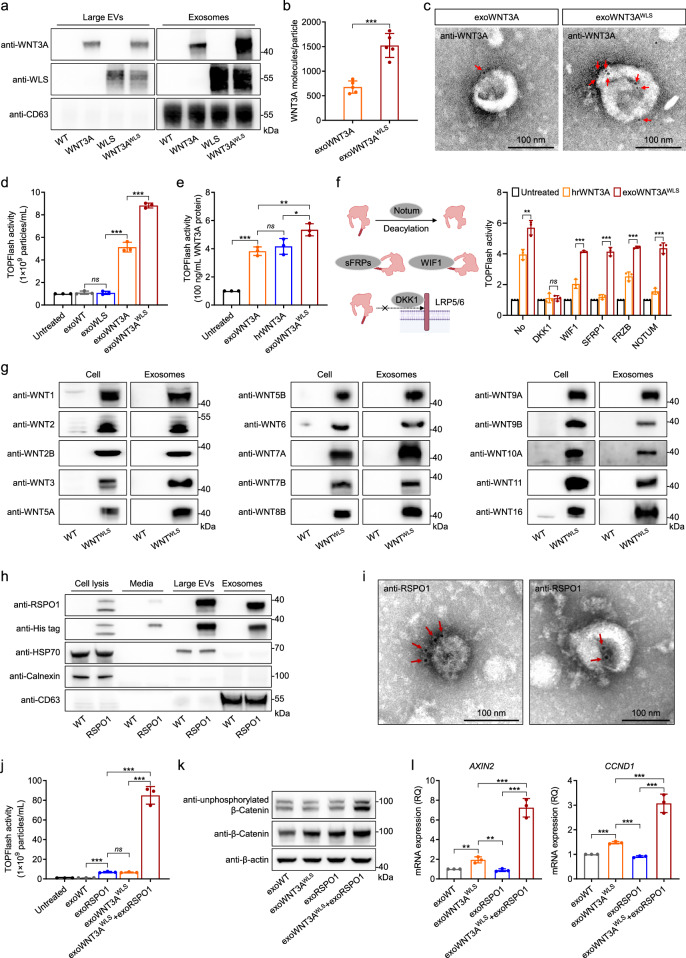
图1A:检测工程细胞系来源的大细胞外囊泡(EV)和外泌体中WLS(Wnt转运蛋白)与WNT3A的蛋白水平。结果显示外泌体中WLS和WNT3A的富集程度高于大EV。
图1B:定量分析每个外泌体颗粒中WNT3A分子的数量,明确WNT3A在外泌体上的负载效率。
图1C:通过透射电镜(TEM)观察,抗WNT3A抗体标记的金颗粒定位于外泌体表面。结果证实WNT3A可加载到外泌体表面。
图1D:用相同颗粒数的exoWNT3A(无WLS工程化)、exoWLS(仅WLS工程化)和exoWNT3Aᴵᵂᴸˢ(WLS+WNT3A工程化)处理HEK293FT细胞。TOPFlash报告基因检测显示exoWNT3Aᴵᵂᴸˢ诱导的WNT信号活性显著高于前两者。
图1E:用相同蛋白量的人重组WNT3A(hrWNT3A)和exoWNT3Aᴵᵂᴸˢ处理细胞。TOPFlash检测显示两者诱导的WNT信号活性相当,证明外泌体负载的WNT3A功能完整。
图1F:左侧为WNT信号拮抗剂(DKK1、WIF1等)与通路组件相互作用的示意图;右侧为TOPFlash检测。结果证实外泌体可保护WNT配体免受多数拮抗剂干扰。
图1G:通过Western blot检测15种WNT配体在工程外泌体上的表达。结果证实WLS可介导多种WNT配体加载到外泌体。
图1H:检测His标签RSPO1表达细胞的细胞裂解液、条件培养基、大EV和外泌体中RSPO1的水平。结果显示RSPO1可自然富集到外泌体和大EV中,且外泌体中含量显著。
图1I:通过TEM检测。结果显示,抗RSPO1抗体标记的金颗粒定位于外泌体表面,证实RSPO1可加载到外泌体表面。
图1J:相同颗粒数的exoWNT3Aᴵᵂᴸˢ、exoRSPO1单独或联合处理细胞。TOPFlash检测显示联合处理组信号活性显著高于单独处理组,证明两者协同激活WNT信号。
图1K:Western blot检测。结果显示,exoWNT3Aᴵᵂᴸˢ+exoRSPO1联合处理组的活性β-连环蛋白(Ser45去磷酸化)和总β-连环蛋白水平高于单独处理组,进一步证实协同激活效应。
图1L:qPCR检测。结果显示,联合处理组的WNT下游靶基因AXIN2和CCND1表达水平显著高于单独处理组,从基因层面验证协同效应。
这些结果表明,WLS可作为通用载体将所有19种WNT配体高效加载到外泌体,且外泌体可保护WNT配体免受多数拮抗剂干扰;RSPO1可自然富集到外泌体,且exoWNT3Aᴵᵂᴸˢ与exoRSPO1协同激活WNT信号通路。
2. exoWNTWLS和exoRSPO1在体外协同调节肝祖细胞命运
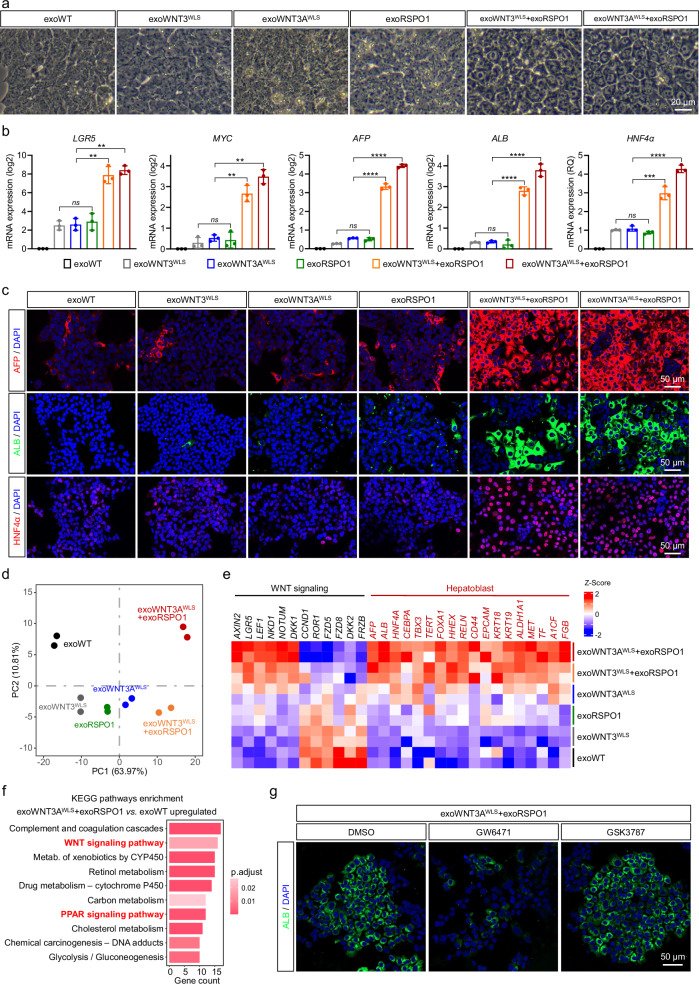
图2A:明场图像。结果显示,iPSC来源的肝内胚层(HE)细胞经exoWNT3ᴵᵂᴸˢ+exoRSPO1或exoWNT3Aᴵᵂᴸˢ+exoRSPO1处理6天后,细胞形态显著变大,呈现肝祖细胞(LPC)特征;而exoWT、exoWNT3ᴵᵂᴸˢ、exoWNT3Aᴵᵂᴸˢ或exoRSPO1单独处理组无此变化。
图2B:qPCR检测。结果证实联合处理可诱导HE细胞向肝祖细胞分化。
图2C:免疫荧光染色。结果显示,联合处理组的AFP、ALB、HNF4α阳性细胞比例显著高于单独处理组。
图2D:转录组主成分分析(PCA)。结果显示,联合处理组细胞与其他组细胞的转录组差异显著。
图2E:热图显示。结果表明联合处理组中WNT信号相关基因(AXIN2、LGR5等)和肝母细胞标记基因(AFP、ALB等)的表达水平显著上调。
图2F:KEGG通路分析。结果显示,exoWNT3Aᴵᵂᴸˢ+exoRSPO1处理组上调基因显著富集于WNT信号通路、PPAR信号通路、补体凝血级联等通路。
图2G:免疫荧光染色。结果显示,用PPARα抑制剂GW6471处理后,联合处理组的ALB阳性细胞比例显著降低;而PPARβ/δ抑制剂GSK3787无显著影响。
这些结果表明,exoWNT(WNT3或WNT3A)与exoRSPO1在体外协同调控肝内胚层细胞向肝祖细胞分化,且该过程依赖PPARα信号通路,为体外肝祖细胞诱导提供了高效方法。
3.携带WNT3A和RSPO1的双外泌体,有效诱导WNT信号活性,调控肝细胞命运
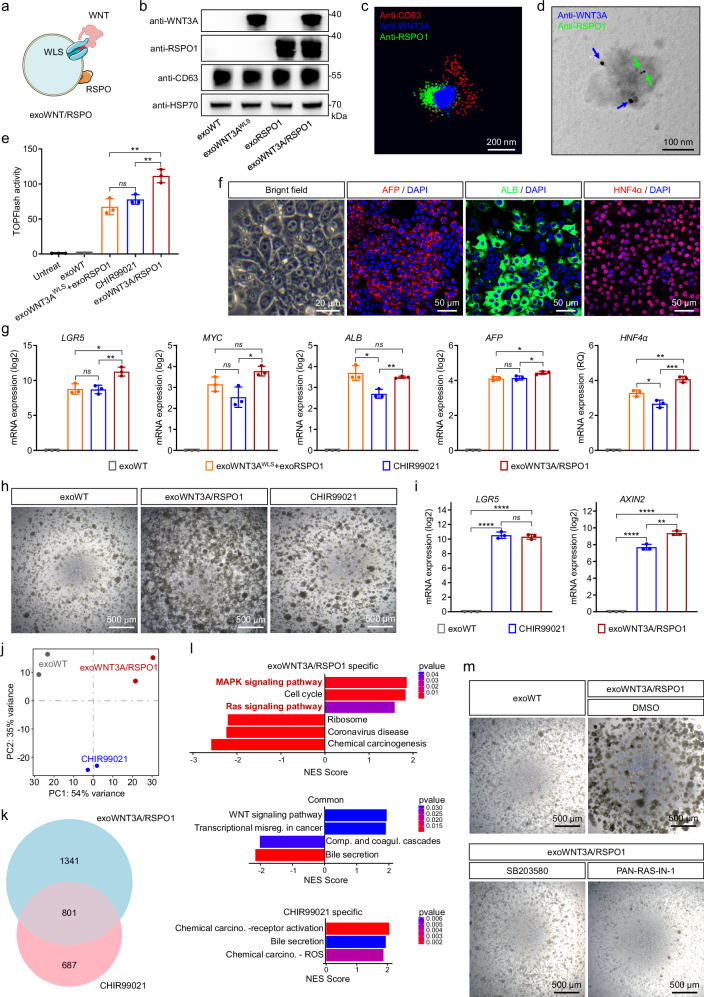
图3A:示意图展示双配体外泌体(exoWNT3A/RSPO1)的构建原理,即通过工程细胞共表达WLS、WNT3A和RSPO1,使外泌体同时负载两种配体。
图3B:Western blot检测。结果显示,exoWNT3A/RSPO1中WNT3A和RSPO1的蛋白水平分别与exoWNT3Aᴵᵂᴸˢ、exoRSPO1相当。
图3C:STORM超分辨成像。结果显示,exoWNT3A/RSPO1表面同时存在WNT3A、RSPO1和外泌体标志物CD31。
图3D:免疫金标记TEM。结果显示,抗WNT3A金颗粒和抗RSPO1金颗粒共定位于同一外泌体表面。
图3E:TOPFlash检测,结果显示,相同颗粒数的exoWNT3A/RSPO1诱导的WNT信号活性显著高于exoWNT3Aᴵᵂᴸˢ+exoRSPO1联合处理组,且与3μMCHIR99021(常用WNT激活剂)相当。
图3F:明场图像和免疫荧光染色。结果显示,exoWNT3A/RSPO1处理6天后,HE细胞呈现肝祖细胞形态,且AFP、ALB、HNF4α阳性细胞比例与联合处理组、CHIR99021处理组相当。
图3G:qPCR检测。结果显示,exoWNT3A/RSPO1处理组的LGR5、MYC、AFP、ALB、HNF4α表达水平与联合处理组、CHIR99021处理组无显著差异。
图3H:明场图像。结果显示,用exoWNT3A/RSPO1培养10天的肝类器官体积显著大于exoWT处理组,且略大于CHIR99021处理组。
图3I:qPCR检测。结果显示,exoWNT3A/RSPO1和CHIR99021处理组的LGR5、AXIN2表达水平相当,且均显著高于exoWT组。
图3J:转录组PCA检测。结果显示,exoWNT3A/RSPO1和CHIR99021处理组的肝类器官转录组差异显著。
图3K:韦恩图显示。结果表明exoWNT3A/RSPO1vsexoWT的差异表达基因(DEGs)与CHIR99021 vs exoWT的DEGs存在部分重叠,但也有大量特异性DEGs。
图3L:GSEA分析。结果显示,exoWNT3A/RSPO1特异性DEGs显著富集于RAS-MAPK信号通路和细胞周期通路,而CHIR99021特异性DEGs富集于化学致癌、胆汁分泌等通路。
图3M:明场图像。结果显示,加入RAS-MAPK抑制剂(SB203580或PAN-RAS-IN-1)后,exoWNT3A/RSPO1促进肝类器官生长的效应显著减弱。
这些结果表明,双配体外泌体exoWNT3A/RSPO1可同时高效负载WNT3A和RSPO1,其激活WNT信号的效率高于单配体外泌体联合处理,且通过RAS-MAPK信号通路促进肝类器官生长,功能与小分子抑制剂CHIR99021相当但机制不同。
4. exoWNT3A/RSPO1处理小鼠肝脏中WNT信号通路的高效递送和激活
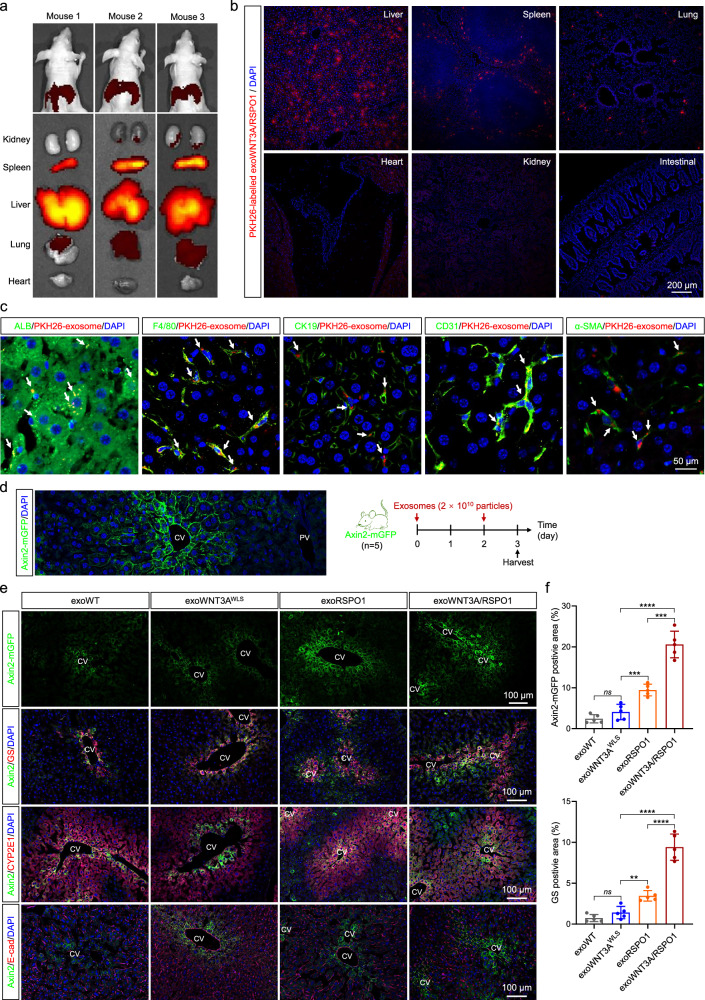
图4A:DiR荧光标记图像。结果显示,静脉注射exoWNT3A/RSPO124小时后,荧光信号主要集中在肝脏,其他器官(脾、肺、心、肾)信号微弱。
图4B:PKH26荧光标记的组织切片,结果显示,外泌体在肝脏中分布广泛,而在脾、肺、心、肾中仅少量分布。
图4C:免疫荧光共定位。结果显示,PKH26标记的外泌体可被肝脏多种细胞摄取。
图4D:左侧为Axin2-mGFP报告小鼠肝脏中央静脉(CV)处的荧光图像,右侧为实验设计示意图。
图4E:免疫荧光图像。结果显示,exoWNT3A/RSPO1处理组的Axin2-mGFP信号(WNT活性标志物)在中央静脉周围显著增强,且与区3标记GS(谷氨酰胺合成酶)共定位;exoWT、exoWNT3Aᴵᵂᴸˢ、exoRSPO1处理组信号较弱。
图4F:定量分析。结果显示,exoWNT3A/RSPO1处理组的mGFP阳性区域和GS阳性区域百分比显著高于其他组。
这些结果表明,exoWNT3A/RSPO1静脉注射后可快速靶向积累于小鼠肝脏,并被多种肝细胞摄取,特异性激活中央静脉周围细胞的WNT信号;长期给药(1-3个月)无显著器官毒性,仅6个月时小肠出现轻微变化,安全性良好。
5. exoWNT3A/RSPO1加速急性损伤后小鼠肝脏修复和再生
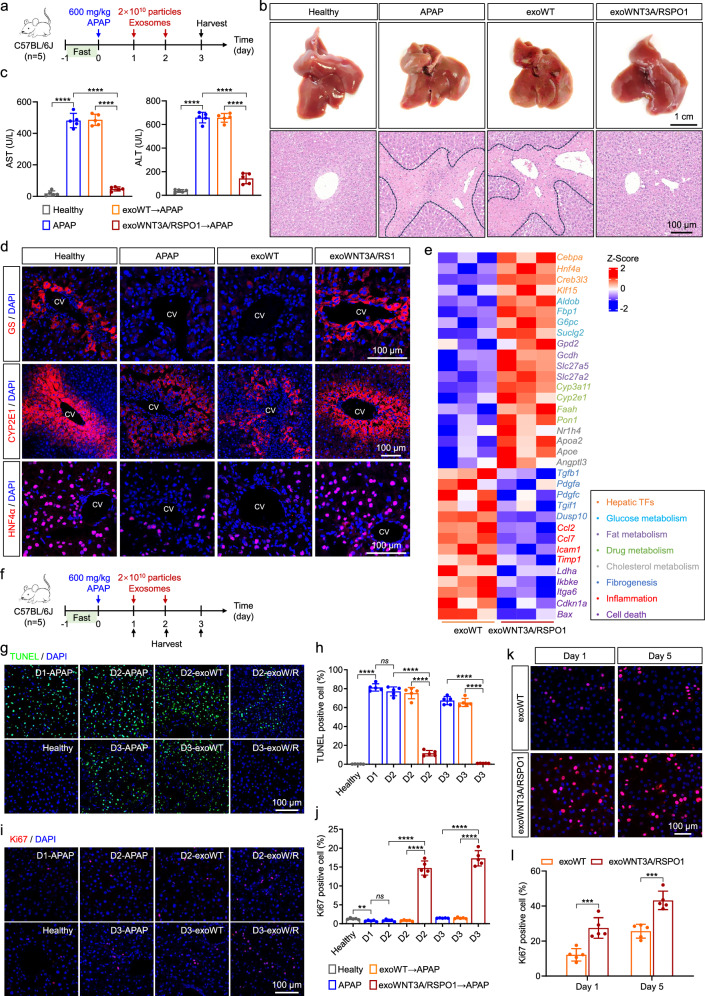
图5A:实验设计示意图。
图5B:明场图像。结果显示,APAP损伤组肝脏表面出现坏死灶,exoWNT3A/RSPO1处理组坏死灶显著减少;HE染色显示,APAP损伤组存在大片肝细胞坏死,exoWNT3A/RSPO1处理组坏死区域显著缩小,exoWT处理组无明显改善。
图5C:血清生化检测。结果显示,exoWNT3A/RSPO1处理组的ALT(谷丙转氨酶)和AST(谷草转氨酶)水平显著低于APAP损伤组和exoWT处理组。
图5D:免疫荧光检测图像。结果显示,APAP损伤组的GS(区3)、CYP2E1(区2/3)和HNF4α(肝细胞标志物)阳性细胞显著减少,exoWNT3A/RSPO1处理组上述标志物阳性细胞恢复至接近健康组水平。
图5E:热图显示。结果表明exoWNT3A/RSPO1处理组的肝功能相关基因(如Gcdh、Faah)表达上调,炎症和细胞死亡相关基因表达下调。
图5F:实验设计示意图。
图5G:TUNEL染色图像。结果显示,APAP损伤组1-3天均存在大量凋亡细胞,exoWNT3A/RSPO1处理组24小时和48小时后凋亡细胞显著减少。
图5H:定量检测结果。结果显示,exoWNT3A/RSPO1处理组的TUNEL+细胞比例显著低于APAP损伤组。
图5I:Ki67免疫荧光检测图像。结果显示,exoWNT3A/RSPO1处理组2-3天的Ki67+细胞(增殖标志物)显著多于APAP损伤组和exoWT处理组。
图5J:exoWNT3A/RSPO1处理组的Ki67+细胞比例定量结果。结果显示,exoWNT3A/RSPO1处理组Ki67+细胞比例显著高于其他组。
图5K:免疫荧光图像。结果显示,exoWNT3A/RSPO1处理的原代人肝细胞(PHH)中Ki67+细胞比例显著高于exoWT处理组。
图5L:exoWNT3A/RSPO1处理组1天和5天的Ki67+细胞比例定量。结果显示,exoWNT3A/RSPO1处理组约为exoWT组的2倍。
这些结果表明,exoWNT3A/RSPO1可通过促进肝细胞增殖、抑制凋亡,显著修复APAP或CCl₄诱导的急性肝损伤,降低血清肝酶水平,恢复肝脏分区,且对原代人肝细胞具有同样的促增殖效应,为急性肝损伤治疗提供依据。
6. exoWNT3A/RSPO1在慢性肝损伤后和衰老的小鼠肝脏中修复和恢复肝功能和生理机能
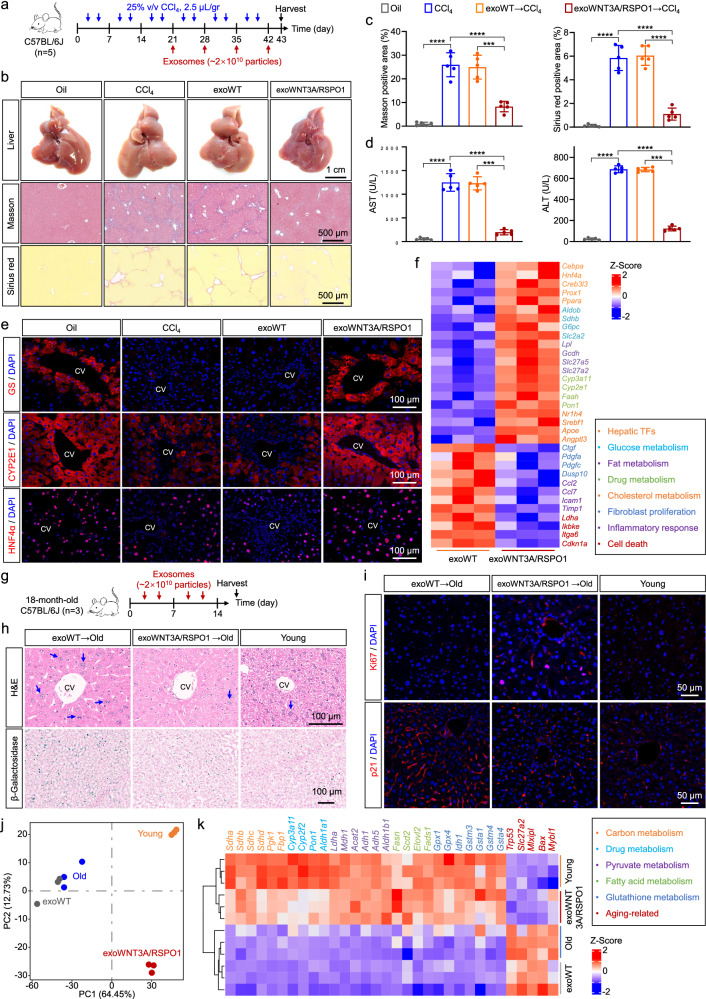
图6A:实验设计示意图。
图6B:整体肝脏图像。结果显示,CCl₄损伤组肝脏表面粗糙、呈颗粒状,exoWNT3A/RSPO1处理组表面光滑度显著改善;Masson和天狼星红染色显示,CCl₄损伤组存在大量胶原沉积,exoWNT3A/RSPO1处理组胶原沉积显著减少。
图6C:exoWNT3A/RSPO1处理组的Masson和天狼星红阳性纤维化区域百分比定量。结果显示,exoWNT3A/RSPO1处理组纤维化区域显著低于CCl₄损伤组和exoWT处理组。
图6D:血清生化检测。结果显示,exoWNT3A/RSPO1处理组的ALT和AST水平显著低于CCl₄损伤组。
图6E:免疫荧光检测图像。结果显示,CCl₄损伤组的GS、CYP2E1和HNF4α阳性细胞显著减少,exoWNT3A/RSPO1处理组上述标志物阳性细胞恢复。
图6F:exoWNT3A/RSPO1处理组热图。结果显示,肝功能基因(如A1AT)上调,纤维化、炎症和细胞死亡相关基因下调。
图6G:衰老逆转效果实验设计示意图。
图6H:HE染色图像。结果显示,衰老小鼠肝脏肝细胞大小不均,exoWNT3A/RSPO1处理组细胞形态更接近年轻小鼠;β-半乳糖苷酶染色显示,衰老小鼠肝脏存在大量阳性细胞(衰老标志物),exoWNT3A/RSPO1处理组阳性细胞显著减少。
图6I:免疫荧光检测图像。结果显示,exoWNT3A/RSPO1处理组的Ki67+细胞比例显著高于衰老对照组,p21+细胞(衰老相关基因)比例显著低于对照组。
图6J:转录组PCA图像。结果显示,exoWNT3A/RSPO1处理的衰老肝脏转录组与年轻肝脏的距离显著拉近,与衰老对照组差异显著。
图6K:exoWNT3A/RSPO1处理组热图。结果显示,肝功能相关基因(如碳代谢、药物代谢基因)上调,衰老相关基因下调。
这些结果表明,exoWNT3A/RSPO1可减少CCl₄诱导的慢性肝损伤小鼠的胶原沉积和纤维化,恢复肝功能;同时可逆转衰老小鼠肝脏的多倍体肝细胞增加、衰老标志物阳性等表型,使衰老肝脏的转录组和生理功能更接近年轻肝脏,为慢性肝损伤和肝脏衰老的治疗提供新策略。
结论
从WLS蛋白介导19种WNT配体高效加载,到exoWNT3A/RSPO1双功能外泌体在急性肝损伤、慢性纤维化与衰老肝脏中展现的“全场景”修复效能,这项研究不仅破解了WNT信号靶向递送的经典难题,更用“转录组PCA+GSEA”等生信工具清晰勾勒出其调控肝再生的分子通路。






