研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
护肤“天然新赛道”!植物PENs外泌体火了,抗老、防脱、促愈合,天生自带buff!
551 人阅读发布时间:2025-10-23 09:43
皮肤作为人体最大的器官,其多层屏障结构(表皮、真皮、皮下组织)虽能维持稳态、抵御外界刺激,但也为药物递送带来巨大挑战。当前皮肤病(如皮肤老化、脱发、色素异常、伤口愈合障碍)的治疗手段(外用制剂、激光、手术等)存在药物渗透性差、副作用明显、患者依从性低等局限。

哺乳动物来源外泌体(MDEs)虽在疾病治疗中展现潜力,但存在免疫毒性、产量低、成本高的问题。而植物来源外泌体样纳米颗粒(PENs)作为新型生物活性纳米载体,具有来源广泛、生物相容性高、成本低、可大规模提取等优势,且能携带脂质、蛋白质、核酸(尤其是miRNAs)及植物次生代谢物,通过抗氧化、抗炎、调控细胞代谢等多靶点作用干预皮肤病。
今天分享的是发表在【J Nanobiotechnology】(IF:12.6)上题为“Plant-derived exosome-like nanovesicles: a novel therapeutic perspective for skin diseases”的综述。该述系统梳理了PENs的生物发生、分离鉴定方法、递送途径及在皮肤病治疗中的应用,同时分析临床转化挑战,为PENs在皮肤健康领域的应用提供理论支撑。
研究内容
(一)PENs的基础特性:与动物外泌体的差异及生物发生
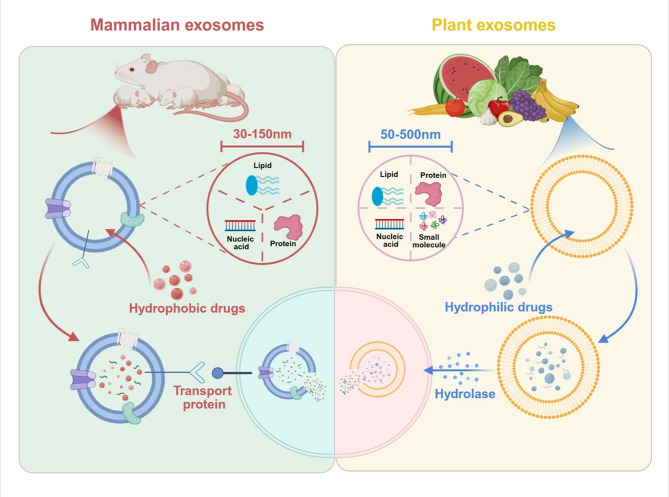
1、PENs与动物外泌体的区别:动物外泌体直径30-150nm,富含胆固醇和膜融合相关蛋白,存在免疫原性风险;PENs直径50-500nm,含植物特异性成分(如磷脂、phytosterols、植物miRNAs),免疫原性低、胃肠道稳定性好,更适合口服或透皮递送。
2、PENs的生物发生途径:主要通过3种途径生成——多泡体(MVB)途径(主流途径,内体成熟为MVBs,释放腔内囊泡形成PENs)、外囊复合体阳性细胞器(EXPO)途径(植物特有,双膜结构与细胞膜融合释放囊泡)、液泡途径(与植物抗病相关,液泡释放水解酶等成分时可能伴随PENs生成)。
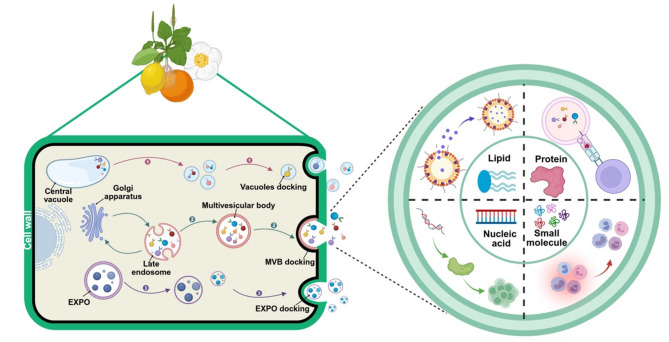
PENs的结构特性(无胆固醇、含植物活性成分)和生物发生途径(多途径生成)使其在安全性、稳定性上优于动物外泌体,为后续皮肤病治疗应用奠定基础。
(二)PENs的分离鉴定与递送途径
1、分离纯化方法:常用方法包括超速离心法(“金标准”,但耗时、易破坏PENs完整性)、蔗糖密度梯度离心法(纯度高但产量低)、聚合物沉淀法(操作简单、适合大规模生产但易含蛋白杂质)、尺寸排阻色谱法(保留PENs活性但设备要求高)、微流控技术(自动化程度高但样本处理量有限),不同方法的优缺点及适用场景已通过对比总结。
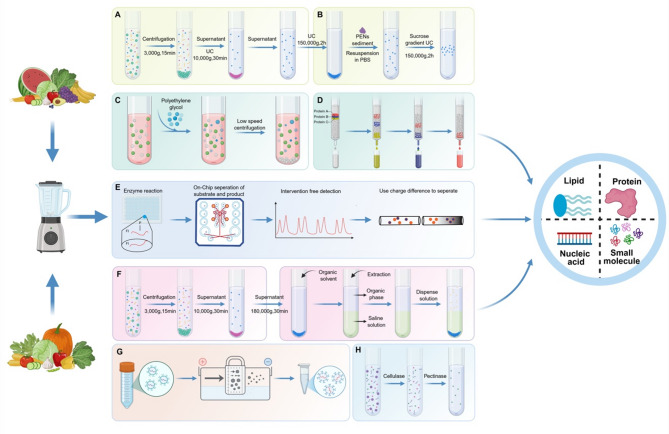
2、鉴定技术:通过动态光散射(DLS)、纳米颗粒追踪分析(NTA)检测粒径和zeta电位;透射电镜(TEM)、冷冻电镜(cryo-EM)观察形态(多为球形、杯状);蛋白质组学(Westernblot、LC-MS/MS)、核酸组学(小RNA测序)、脂质组学(薄层色谱)分析成分;代谢组学(FTIR光谱)验证次生代谢物活性。
3、递送途径:包括口服(主要分布于胃肠道,通过肠道-皮肤轴调节皮肤稳态)、透皮(利用毛囊-皮脂腺通道穿透角质层,直接作用于病变部位,减少全身副作用)、注射(静脉注射可规避肝脏首过效应,但需严格控制粒径和杂质以保证生物相容性)。
PENs的分离鉴定方法需根据研究需求选择(如小规模功能研究选蔗糖密度梯度离心,大规模生产选聚合物沉淀);透皮递送因“直接靶向皮肤病变、副作用小”的优势,成为PENs干预皮肤病的第一途径。
(三)PENs在皮肤病治疗中的应用
1.皮肤老化干预
皮肤老化分为内源性(自然衰老)和外源性(UV辐射、污染等,主要诱因),核心机制为氧化应激(ROS积累)和慢性炎症(NF-κB通路激活)。PENs通过以下途径抗老化:
1.1激活抗氧化通路:如柠檬PENs激活AhR/Nrf2通路,减少ROS生成、提升超氧化物歧化酶(SOD)活性;
1.2抑制炎症与胶原降解:蓝莓PENs下调TNF-α诱导的炎症基因,海带PENs抑制基质金属蛋白酶(MMPs),减少胶原降解;
1.3促进胶原合成:羽衣甘蓝PENs通过miRNA抑制Smad7,上调胶原合成相关基因。
2.脱发防治
雄激素性脱发是最常见类型,与毛囊干细胞功能异常、炎症(NLRP3 inflammasome激活)、氧化应激相关。PENs的作用机制包括:
2.1调节毛囊细胞代谢:木瓜PENs抑制NLRP3炎症小体,下调IL-6、IL-1β,保护毛囊真皮乳头细胞;
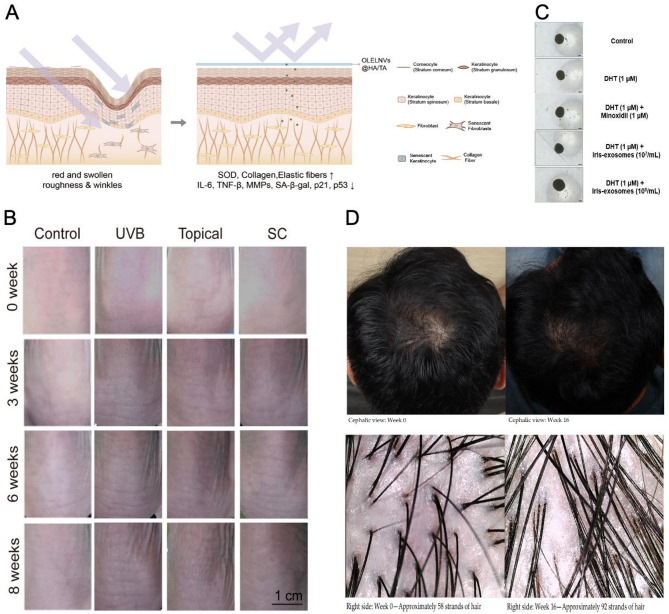
2.2激活毛发生成通路:玫瑰PENs激活Wnt/β-连环蛋白通路,促进毛囊干细胞增殖;鸢尾PENs缓解双氢睾酮(DHT)诱导的毛囊损伤,提升毛囊存活率。
3.皮肤美白(色素异常调节)
黑色素过度合成(如黄褐斑、雀斑)与酪氨酸酶活性升高、小眼畸形相关转录因子(MITF)激活有关。PENs通过以下途径抑制色素生成:
3.1抑制酪氨酸酶活性:苍术PENs下调MITF,减少B16-F10黑素瘤细胞的酪氨酸酶表达;
3.2调节黑素细胞周期:葡萄柚PENs在体外(B16-F10细胞)和体内(斑马鱼幼体)均能显著降低黑色素含量,且无细胞毒性;
3.3增强美白成分递送:黄瓜PENs作为脂质载体,能提升亲脂性美白成分的透皮效率(是空白对照组的2倍)。
4.伤口愈合促进
伤口愈合是复杂过程(止血、炎症、增殖、重塑),慢性炎症和氧化应激是愈合障碍的主要原因。PENs的作用包括:
4.1抗炎与抗氧化:香菜PENs激活Nrf2通路,提升抗氧化酶活性,减少ROS积累;红洋葱PENs促进巨噬细胞从促炎M1型向抗炎M2型极化,缓解伤口炎症;
4.2促进细胞增殖与血管生成:人参PENs激活TGF-β通路,加速皮肤细胞增殖;柠檬PENs调控血管内皮细胞和成纤维细胞迁移,促进肉芽组织形成;
4.3改善糖尿病伤口:生姜PENs通过重编程糖酵解通路,恢复高糖环境下内皮细胞的增殖和管形成能力,加速糖尿病溃疡愈合。
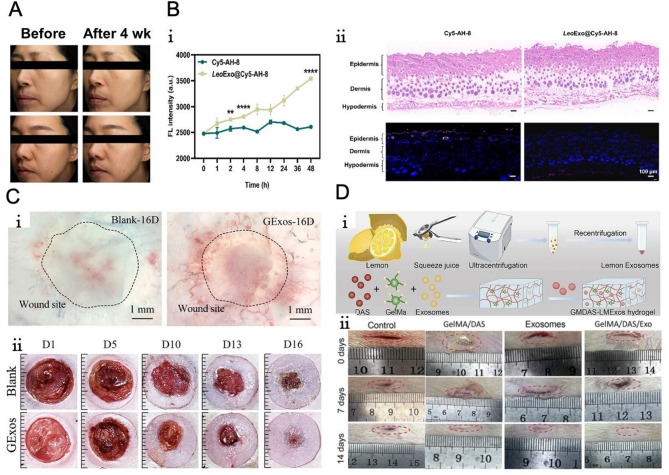
PENs通过“调节炎症微环境+促进组织再生”,尤其对糖尿病等难愈合伤口具有显著干预效果,且水凝胶等载体能进一步提升其作用持续性。
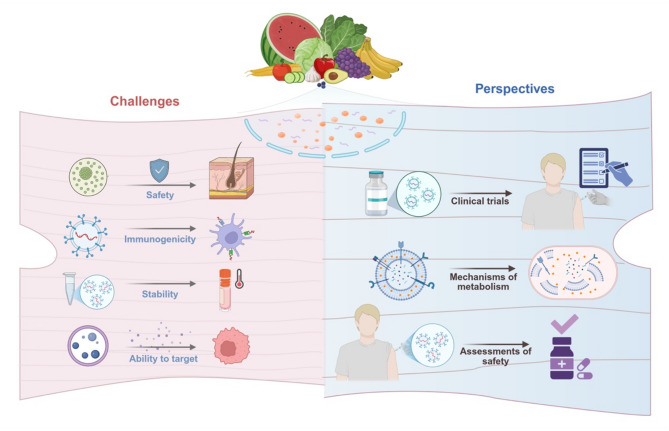
(四)PENs临床转化的挑战
1、安全性与稳定性:PENs虽生物相容性高,但长期透皮使用的皮肤蓄积风险、不同植物来源的致敏性差异尚未明确;且PENs对温度敏感,需-80℃储存,冻融循环易破坏其脂质双分子层,影响活性。
2、标准化问题:植物品种、收获季节、提取方法均会导致PENs产量和成分异质性(如人参PENs的蛋白含量可相差3倍),缺乏统一的质量控制标准。
3、靶向效率与临床数据:PENs的皮肤组织靶向性依赖被动渗透(如毛囊通道),主动靶向配体(如皮肤特异性抗体)的研究较少;目前仅4项PENs相关临床实验,且多聚焦肠道疾病,皮肤病领域的人体临床试验数据匮乏。
结论
本综述证实,PENs凭借“天然来源+多活性成分+多靶点作用”的优势,在皮肤老化、脱发、色素异常、伤口愈合障碍等皮肤病治疗中展现巨大潜力:其可通过透皮、口服等途径递送,通过抗氧化、抗炎、调控细胞信号通路(如Nrf2、Wnt、TGF-β)干预疾病,且安全性优于动物外泌体和化学药物。然而,PENs的临床转化仍需突破:一是建立PENs分离、鉴定、储存的标准化protocol,减少批次差异;二是通过表面修饰(如适配体、多肽)提升皮肤靶向效率;三是开展更多皮肤病领域的临床实验,验证长期安全性和有效性。






