研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
谁懂胰腺病变的痛?TSPAN4 +成纤维细胞“联动”迁移体搞破坏,靶定这俩信号轴就是新出路!
466 人阅读发布时间:2025-10-23 10:03
该研究聚焦胰腺癌复杂肿瘤微环境(TME)中转移微环境形成的机制缺口,以“迁移体介导的细胞间通讯”为核心,采用“多组学解析+功能验证”的研究思路突破:首先整合单细胞RNA测序(scRNA-seq)、空间转录组数据及TCGA/GEO数据库,结合Seurat、Monocle等工具解析胰腺癌组织中TSPAN4⁺成纤维细胞的分布与功能特征;其次通过CellCall/CellChat分析细胞间通讯网络,明确TSPAN4⁺成纤维细胞与免疫细胞、内皮细胞的互作通路;再借助空间代谢组学揭示其对TME代谢重编程的调控作用;最后通过siRNA干扰TSPAN4表达,在胰腺癌细胞系(SW1990、PANC-1)中验证其对细胞增殖、迁移、侵袭及凋亡的影响,最终明确TSPAN4⁺成纤维细胞通过迁移体驱动代谢重编程与基质-免疫互作,成为胰腺癌转移微环境组装的关键协调者,为胰腺癌治疗提供新靶点。

研究背景
胰腺癌(PC)是恶性程度极高的胰腺恶性肿瘤,其复杂的肿瘤微环境(TME)与强转移能力导致预后极差。成纤维细胞作为TME的核心组分,通过重塑细胞外基质(ECM)、调控免疫反应参与肿瘤进展与转移,但具体调控机制尚未完全阐明。
迁移体作为新型细胞外囊泡,直径0.5-3μm,通过细胞迁移时的回缩纤维释放,可携带信号分子介导细胞间通讯,已在肿瘤转移中发挥作用。TSPAN4作为迁移体形成的关键调控因子,可调节细胞黏附与信号传导,ITGA5则参与ECM锚定与迁移编程,二者在胰腺癌成纤维细胞中的作用及对转移微环境的影响尚未明确。此外,胰腺癌免疫治疗疗效受TME免疫抑制微环境限制,探索成纤维细胞对免疫抑制的调控机制,对改善免疫治疗效果具有重要意义。
研究结果
1、研究技术路线图

呈现研究的整体技术流程,包括数据获取(GEO单细胞转录组、空间转录组及TCGA胰腺癌数据)、数据处理(批次校正、质量控制)、分析环节(单细胞聚类、拟时序分析、细胞通讯分析、空间转录组解析)及实验验证(qPCR、CCK-8、克隆形成、划痕实验、Transwell侵袭实验、流式细胞术),清晰展示了从多组学解析到功能验证的完整研究框架。这些结果表明,该研究通过系统的多组学分析与实验验证相结合的策略,为解析TSPAN4⁺成纤维细胞在胰腺癌中的作用提供了严谨的技术支撑。
2、胰腺癌单细胞水平细胞分型与TSPAN4/ITGA5表达特征

通过t-SNE聚类将胰腺癌组织分为11种主要细胞类型;热图与小提琴图显示,成纤维细胞中转移相关基因模块激活评分最高,且TSPAN4、ITGA5在成纤维细胞中特异性高表达;t-SNE与UMAP投影显示,MC/PC组成纤维细胞与血管内皮细胞功能活性显著高于CT组,且TSPAN4在成纤维细胞区与导管界面特异性分布,ITGA5呈泛基质/内皮分布。这些结果表明,胰腺癌中TSPAN4⁺成纤维细胞富集于转移相关表型,且TSPAN4与ITGA5的差异化表达提示二者在TME中发挥互补作用,可能共同调控肿瘤转移。
3、成纤维细胞拟时序轨迹与细胞通讯网络分析

通过拟时序分析显示,TSPAN4、ITGA5在成纤维细胞恶性转化早期高表达,且随拟时序进展成纤维细胞表型逐渐多样化;UMAP分析发现,从CT到MC/PC组,成纤维细胞亚型从17种扩展至19种;chord图与热图显示,高迁移体成纤维细胞(MigrasomeHigh-Fibro)与肿瘤相关巨噬细胞、血管内皮细胞通讯频繁,且PERIOSTIN、ncWNT、FGF等促转移通路显著激活;机制分析表明,MigrasomeHigh-Fibro是PERIOSTIN信号网络的核心枢纽,可激活PI3K/Akt通路,同时调控多个促转移通路;Sankey图揭示了成纤维细胞主导的信号网络层级结构。这些结果表明,TSPAN4⁺成纤维细胞通过丰富的细胞间通讯网络,尤其是激活多个促转移信号通路,成为胰腺癌TME中转移信号的关键传递者。
4、空间转录组与代谢通路分析
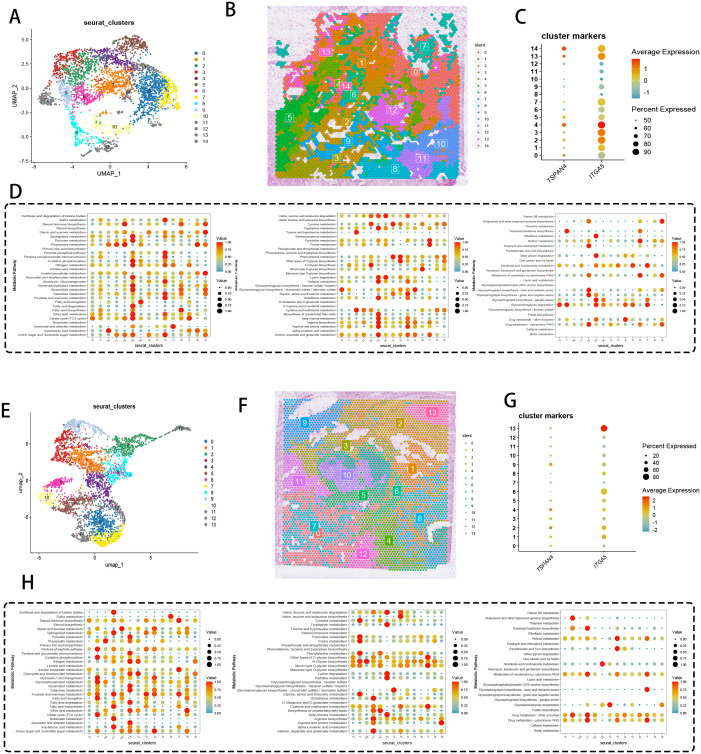
通过UMAP聚类将胰腺癌组织分为14个转录组学不同的细胞模块,空间定位显示各模块呈区域化分布;DotPlot显示,TSPAN4与ITGA5在聚类4、13、14中高共表达,检测频率超80%;热图显示,高迁移体富集模块中氧化磷酸化、脂质代谢等能量代谢通路显著激活;跨队列验证识别出13种保守细胞生态型,空间分布显示微环境niche特征保守,聚类13为主要迁移体信号枢纽,且存在谷氨酰胺分解与核苷酸合成相关代谢重编程。这些结果表明,TSPAN4⁺成纤维细胞通过空间特异性调控代谢通路,驱动胰腺癌TME的代谢重编程,为肿瘤细胞提供能量支持与营养分配,促进转移微环境形成。
5、空间发育轨迹与特征基因富集分析

对不同细胞聚类的发育轨迹分析显示,聚类5→0轨迹中30个共调控模块主要富集于ECM分解通路,与间质重塑、侵袭微环境形成及PD-L1介导的免疫逃逸相关,反调控模块则与MAPK增殖通路负相关;聚类5→1轨迹中,整合素信号体为主要共调控网络,反调控模块涉及内体运输与受体回收;聚类8→5轨迹中,干扰素响应凋亡调控因子同步激活,反调控模块抑制ECM支架形成与氧化应激缓冲;聚类6→10、7→10轨迹分别激活ECM蛋白水解、FAK信号及avb3整合素机械感知通路,同时抑制白细胞募集与抗原呈递。这些结果表明,TSPAN4⁺成纤维细胞通过调控ECM重塑、免疫抑制及增殖信号通路,在胰腺癌空间发育轨迹中主导转移微环境的动态组装。
6、TSPAN4⁺成纤维细胞的空间分布与免疫调控分析
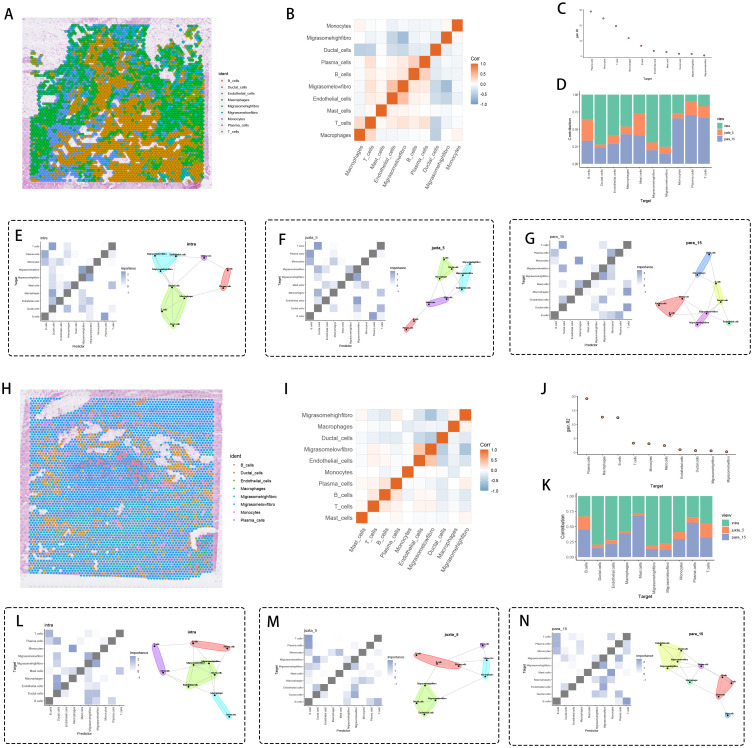
空间定位显示,高迁移体成纤维细胞呈同心圆分布于肿瘤-基质交界区;调控网络分析表明,高迁移体成纤维细胞与细胞毒性免疫细胞呈负相关,且与T细胞、巨噬细胞的界面倾向评分高;定量分析显示,高迁移体成纤维细胞在肿瘤侵袭边缘(para-15mm)富集;区域特异性细胞互作分析显示,肿瘤实质区存在T细胞-上皮细胞通讯,juxta-5mm区低迁移体成纤维细胞-内皮细胞互作促进血管生成,para-15mm区高迁移体成纤维细胞诱导免疫沉默;多区域验证证实,高迁移体成纤维细胞通过STAT3依赖的检查点激活抑制免疫反应,且在不同区域通过IL-10/TGFb、MMP9/VEGF-A、L1CAM-整合素等通路调控免疫抑制与肿瘤增殖。这些结果表明,TSPAN4⁺成纤维细胞在胰腺癌不同空间区域通过差异化通路,协调免疫抑制微环境形成,为肿瘤转移创造免疫豁免区。
7、TSPAN4⁺成纤维细胞的细胞网络中心性分析
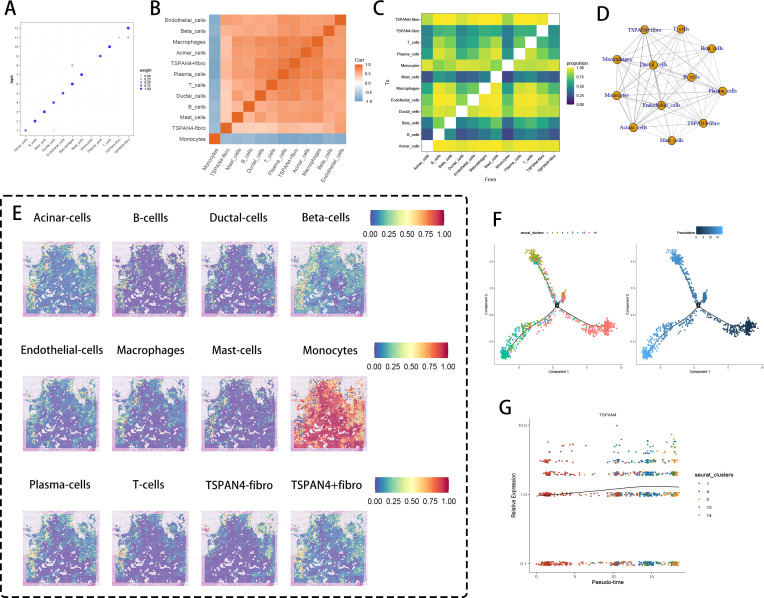
图论中心性分析显示,TSPAN4⁺成纤维细胞是细胞间通讯的核心枢纽;边界信号分析表明,其作为基质-免疫中介,与内皮细胞、上皮细胞选择性互作;热图显示,其与Th2型T细胞、浆细胞互作增强,可能通过IgE调控抗肿瘤免疫;网络拓扑图显示,TSPAN4⁺成纤维细胞形成“中心-辐射”连接框架,连接CD14⁺髓系祖细胞、M2型巨噬细胞与血管单元;空间共定位分析发现,TSPAN4⁺成纤维细胞与CX3CR1⁺单核细胞在肿瘤侵袭区共定位;拟时序分析显示,成纤维细胞从静息态(聚类1)向激活态(聚类4-5)分化,TSPAN4表达逐步上调,且与ECM重塑、SOX9介导的恶性重编程同步。这些结果表明,TSPAN4⁺成纤维细胞作为胰腺癌TME的网络核心,通过整合基质、免疫与血管信号,主导转移微环境的网络组装。
8、TSPAN4⁺成纤维细胞的配体-受体互作网络
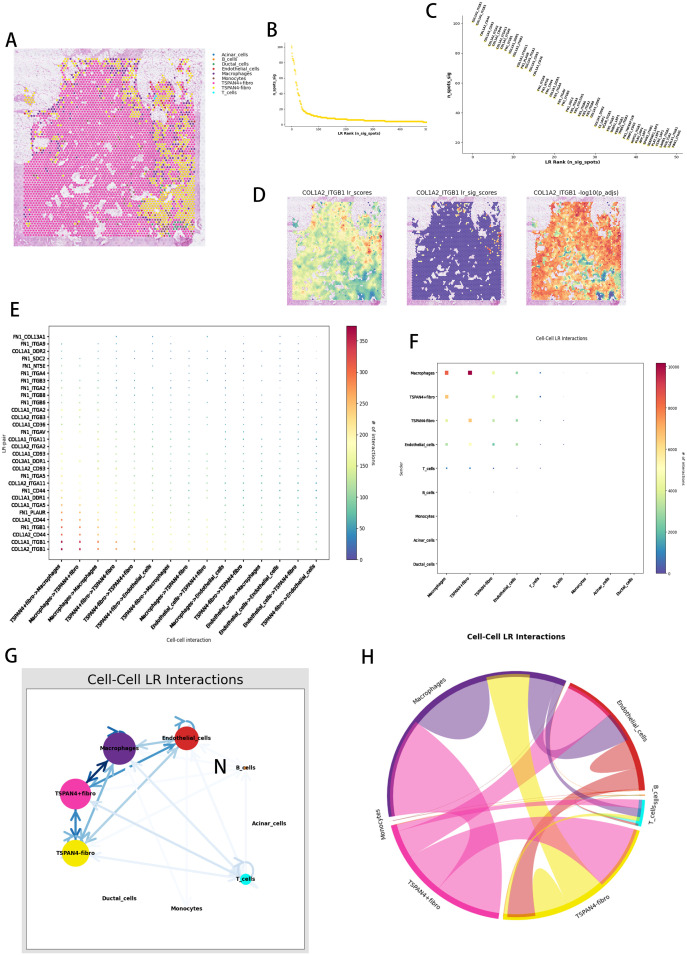
空间共定位分析显示,TSPAN4⁺成纤维细胞与巨噬细胞、内皮细胞在胰腺癌TME中呈区域特异性共定位;配体-受体(LR)网络分析显示,COL1A2-ITGB1复合物为关键biomechanical信号单元,且富集于基质-血管交界区;定向通讯分析表明,TSPAN4⁺成纤维细胞通过CXCL12-CXCR4通路调控巨噬细胞,通过VEGFC-VEGFR3通路调控内皮细胞;网络架构分析显示,TSPAN4⁺成纤维细胞整合TGFb1-LTBP1(纤维化)与ANGPT2-TIE1(血管生成)信号;LR通路整合显示,其通过MMP2/MMP9调控巨噬细胞吞噬(CD47-SIRPa)与血管屏障(JAM3-ITGAV),同时通过IL10-IL10R(免疫抑制)与LOXL2-EGFR(基质浓缩)协调微环境。这些结果表明,TSPAN4⁺成纤维细胞通过多维度LR网络,协调纤维化、血管生成与免疫抑制,为胰腺癌转移构建功能性微环境。
9、TSPAN4⁺成纤维细胞与免疫治疗响应的关联

TIDE算法分析显示,TSPAN4⁺成纤维细胞丰度与免疫治疗疗效呈负相关;多维度协方差分析表明,TSPAN4⁺成纤维细胞与CD8⁺T细胞功能障碍显著相关(p=7.51×10⁻⁶),且明确其基质起源(p=1.96×10⁻³⁷);相关性网络显示,TSPAN4与CD27、CTLA4、PDCD1等免疫逃逸分子呈正相关,且同时关联激活型(CD28)与抑制型(TIM3)免疫受体;调控网络显示,TSPAN4与基质调控因子(TYRBP9、TSPAN9)、间质适应性标志物(VIM、VASN)存在转录互作;免疫组分分析显示,TSPAN4⁺成纤维细胞与FOXP3⁺调节性T细胞、未成熟B细胞招募正相关,与抗原呈递细胞互作减少;转录协方差网络显示,其与蛋白稳态(UBTQ1)、间质转化(WTIP)通路相关,且与基因组不稳定性负相关。这些结果表明,TSPAN4⁺成纤维细胞通过塑造免疫抑制微环境,降低胰腺癌免疫治疗响应,是免疫治疗耐药的重要调控因素。
10、TSPAN4干扰对胰腺癌细胞增殖与迁移的影响
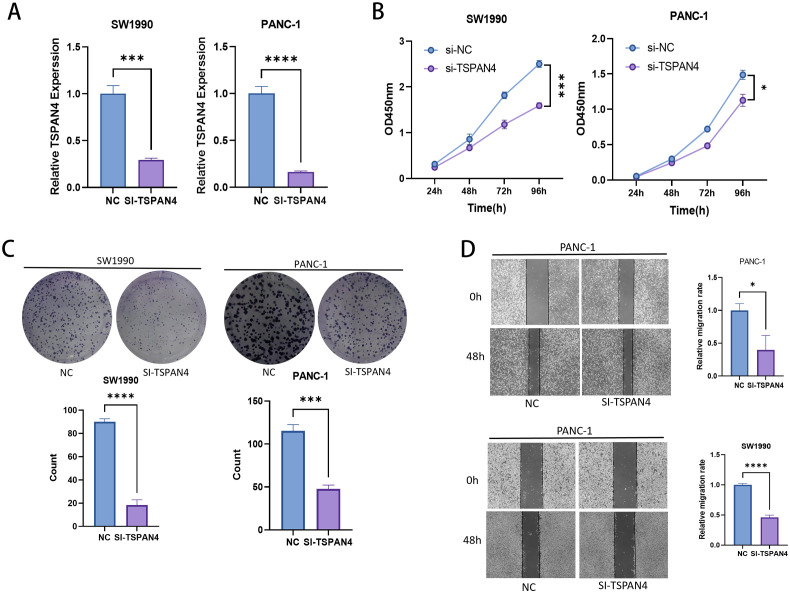
qPCR验证显示,siRNA干扰TSPAN4后,SW1990与PANC-1细胞中TSPAN4 mRNA显著下调;CCK-8实验显示,干扰TSPAN4后,两细胞系在24-96h内增殖活性显著降低;克隆形成实验显示,干扰组克隆形成能力几乎完全丧失;划痕实验显示,48h时干扰组细胞迁移能力显著下降,SW1990侵袭率降低82%,PANC-1降低63%。这些结果表明,TSPAN4对胰腺癌细胞的增殖、克隆形成及迁移能力至关重要,干扰其表达可显著抑制胰腺癌细胞的恶性表型。
11、TSPAN4干扰对胰腺癌细胞侵袭与凋亡的影响
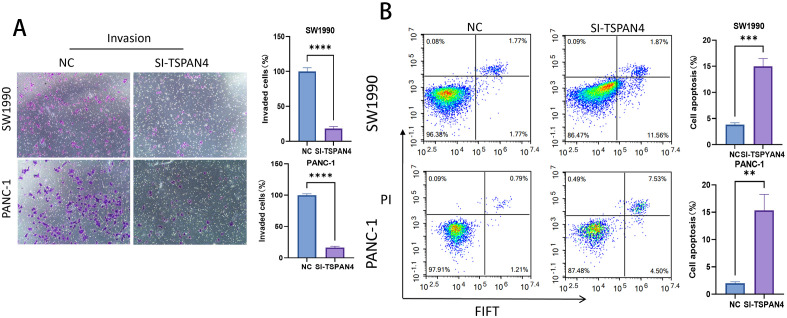
Transwell侵袭实验显示,干扰TSPAN4后,SW1990细胞侵袭能力降低4.7倍,PANC-1降低3.9倍;流式细胞术显示,干扰组细胞凋亡率显著升高,SW1990从0.08%升至11.6%,PANC-1从2.09%升至12.87%。这些结果表明,TSPAN4不仅促进胰腺癌细胞侵袭,还可抑制其凋亡,干扰TSPAN4表达可同时削弱癌细胞侵袭能力并激活凋亡通路。
结论
本研究通过多组学分析与功能验证,明确TSPAN4⁺成纤维细胞是胰腺癌转移微环境组装的关键协调者:其通过迁移体驱动TME代谢重编程,为肿瘤细胞提供能量支持;通过丰富的细胞间通讯网络与基质-免疫互作,塑造免疫抑制微环境,促进ECM重塑与血管生成;同时,TSPAN4对胰腺癌细胞的增殖、迁移、侵袭至关重要,且其高表达与胰腺癌免疫治疗耐药相关。研究不仅揭示了TSPAN4⁺成纤维细胞在胰腺癌转移中的核心作用,还为胰腺癌治疗提供了新的潜在靶点,为改善胰腺癌预后与免疫治疗疗效提供了理论依据。






