研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
外泌体的“超能力”:机械拉伸改造后,脂肪源性干细胞外泌体加速糖尿病骨折骨再生!
225 人阅读发布时间:2025-10-31 15:10
糖尿病患者骨折后出现骨不连或延迟愈合是一种严重的并发症,迫切需要新的治疗策略,而来自基质细胞的外泌体是天然存在的纳米颗粒,携带生物活性分子,介导细胞间通讯,在糖尿病骨折修复中发挥着关键作用。重要的是,机械刺激可以调节外泌体的货物组成,从而影响骨愈合结果。基于此,以下文章首次研究机械拉伸的脂肪源性基质细胞(MS-ADSC-Exos)衍生的外泌体是否能促进2型糖尿病(T2DM)骨不连模型中的骨折愈合,并阐明其潜在机制。

今天分享的是一篇发表在【Stem Cell Res Ther】(IF:7.3)上题为“MiR-877, an exosomal miRNA from mechanical stretch induced adipose derived stromal cells, enhances fracture healing in nonunion rats with type 2 diabetes mellitus”的研究,该研究将不同机械拉伸幅度的脂肪源性干细胞(ADSCs)分泌的外泌体应用于体外培养的大鼠骨髓间充质基质细胞(BMSCs)和人脐静脉内皮细胞(HUVECs)。通过茜素红S和碱性磷酸酶(ALP)染色、管形成、划痕和迁移实验分别评估成骨分化、增殖、迁移和血管生成情况;通过蛋白质印迹法和免疫荧光法评估成骨标志物的表达。在体内实验中,术后连续3天将MS-ADSC-Exos或磷酸盐缓冲液(PBS)局部注射到糖尿病大鼠股骨骨不连模型的骨折部位;在术后4周通过微计算机断层扫描(micro-CT)和组织学分析评估骨再生情况,通过RNA测序、生物信息学和实时定量逆转录聚合酶链反应(qRT-PCR)表征MS-ADSC-Exos的miRNA图谱,模拟物和抑制剂转染实验进一步验证miR-877的功能作用。结果表明,miR-877在LMS-ADSC-Exos中显著上调,并可转移到BMSCs和HUVECs中,从而促进糖尿病患者的成骨和血管生成。
研究成果
1. ADSC-exos的表征和鉴定
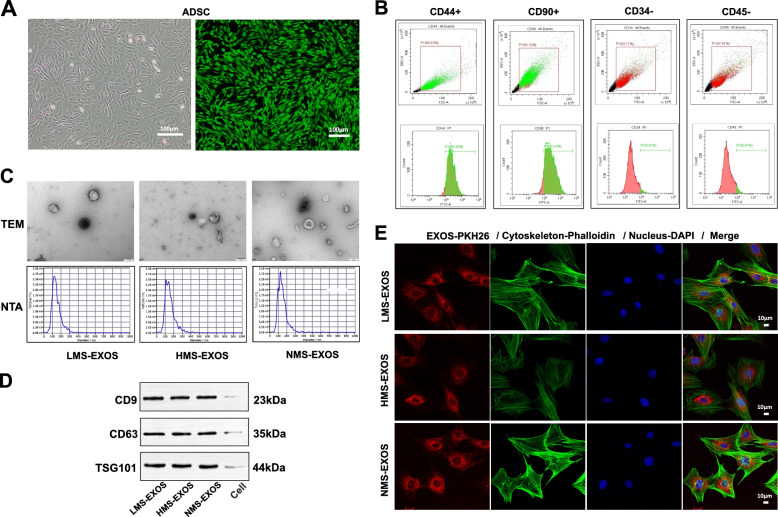
图1A:ADSCs的形态观察。结果显示,从大鼠腹股沟皮下脂肪分离培养的ADSCs在体外呈贴壁生长,形态为典型的梭形。
图1B:ADSCs表面标志物的流式细胞术鉴定。结果显示,ADSCs高表达间充质干细胞阳性标志物CD44和CD90,低表达或不表达造血干细胞阴性标志物CD34和CD45。
图1C:ADSC-Exos的形态与粒径分析。结果显示,透射电镜(TEM)下ADSC-Exos呈典型的“杯状”结构;纳米颗粒追踪分析(NTA)显示其粒径分布在30-200nm之间,平均直径约120nm。
图1D:ADSC-Exos特异性标志物的Western blot检测。结果显示,ADSC-Exos表达外泌体核心标志物CD9(23kDa)、CD63(35kDa)及TSG101(44kDa)。
图1E:BMSCs对ADSC-Exos的摄取实验。结果显示,用红色荧光染料PKH26标记的ADSC-Exos与BMSCs共培养12h后,共聚焦激光扫描显微镜(CLSM)下可见红色荧光(外泌体)与BMSCs的细胞骨架(鬼笔环肽染色)、细胞核(DAPI染色,蓝色)共定位。
这些结果表明实验成功从大鼠皮下脂肪分离并鉴定了ADSCs,且从ADSCs中提取的外泌体符合典型特征,可被骨愈合关键细胞BMSCs有效摄取。
2.循环机械拉伸诱导的ADSCs-外泌体在体外促进BMSCs的成骨分化
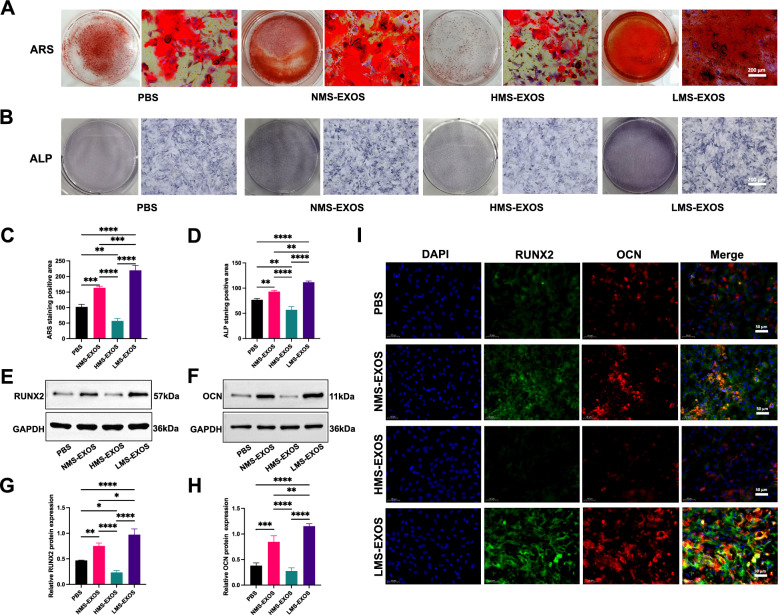
图2A:BMSCs成骨分化的茜素红染色(ARS)结果。结果显示,成骨诱导14天后,LMS-Exos组的红色矿化结节数量显著多于PBS组、NMS-Exos组,而HMS-Exos组矿化结节数量显著少于其他三组。
图2B:BMSCs成骨分化的碱性磷酸酶(ALP)染色结果。结果显示,LMS-Exos组的ALP阳性染色(深色区域)强度显著高于其他三组,HMS-Exos组染色强度最弱。
图2C-D:ARS和ALP染色的半定量分析。结果显示,LMS-Exos组的矿化程度(ARS定量)和ALP活性(ALP定量)显著高于PBS组、NMS-Exos组,HMS-Exos组显著低于其他三组。
图2E-F:BMSCs中成骨标志物RUNX2、OCN的Western blot检测。结果显示,LMS-Exos上调成骨标志物蛋白表达。
图2G-H:Western blot结果的定量分析。结果显示,LMS-Exos组RUNX2、OCN的蛋白相对表达量显著高于PBS组、NMS-Exos组,HMS-Exos组显著低于其他三组。
图2I:BMSCs中RUNX2、OCN的免疫荧光染色。结果显示,细胞核经DAPI染色(蓝色),RUNX2、OCN为特异性荧光(绿色);LMS-Exos组的绿色荧光强度显著强于其他三组,HMS-Exos组荧光最弱。
这些结果表明低机械拉伸诱导的ADSC-Exos(LMS-Exos)在体外可显著促进BMSCs的成骨分化(表现为矿化增强、ALP活性升高、成骨标志物RUNX2/OCN表达上调),而高机械拉伸的ADSC-Exos(HMS-Exos)则抑制BMSCs成骨分化,且该效应具有“机械拉伸强度依赖性”。
3.循环机械拉伸诱导的ADSCs-外泌体在体外促进血管生成
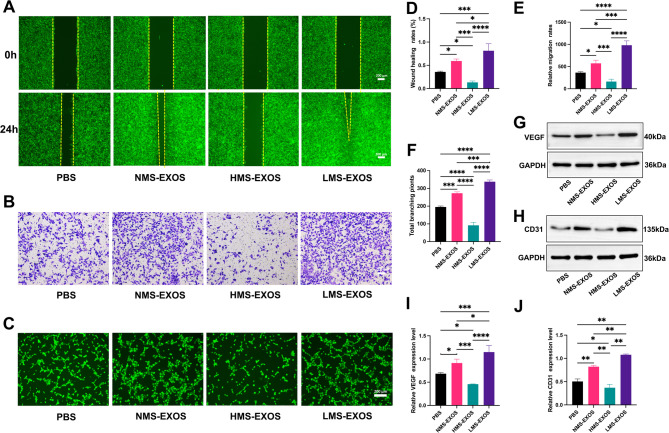
图3A、D:HUVECs迁移能力的划痕愈合实验及定量。结果表明LMS-Exos促进HUVECs迁移,HMS-Exos抑制迁移。
图3B、E:HUVECs迁移能力的Transwell实验及定量。结果显示,结晶紫染色后,LMS-Exos组穿过Transwell小室的HUVECs数量显著多于其他三组,HMS-Exos组迁移细胞数最少;定量分析证实LMS-Exos组迁移细胞数显著高于PBS组、NMS-Exos组,HMS-Exos组显著降低。
图3C、F:HUVECs血管生成能力的管形成实验及定量。结果显示,荧光显微镜下,LMS-Exos组HUVECs形成的“管结构”(长度、分支数)显著多于其他三组,HMS-Exos组管结构最少;定量分析显示LMS-Exos组平均管长度显著高于其他三组,HMS-Exos组显著降低。
图3G、H:HUVECs中血管生成标志物VEGF、CD31的Western blot检测及定量。结果显示,以GAPDH为内参,LMS-Exos组VEGF、CD31的蛋白表达量显著高于PBS组、NMS-Exos组,HMS-Exos组显著低于其他三组。
这些结果表明低机械拉伸诱导的ADSC-Exos(LMS-Exos)在体外可显著促进HUVECs的血管生成相关功能(迁移能力增强、管结构形成增多、血管标志物VEGF/CD31表达上调),而高机械拉伸的HMS-Exos则抑制血管生成,与成骨分化的“强度依赖性”规律一致。
4.循环机械拉伸诱导的ADSCs- Exos促进非愈合大鼠骨折模型中BMSCs的成骨分化和骨愈合
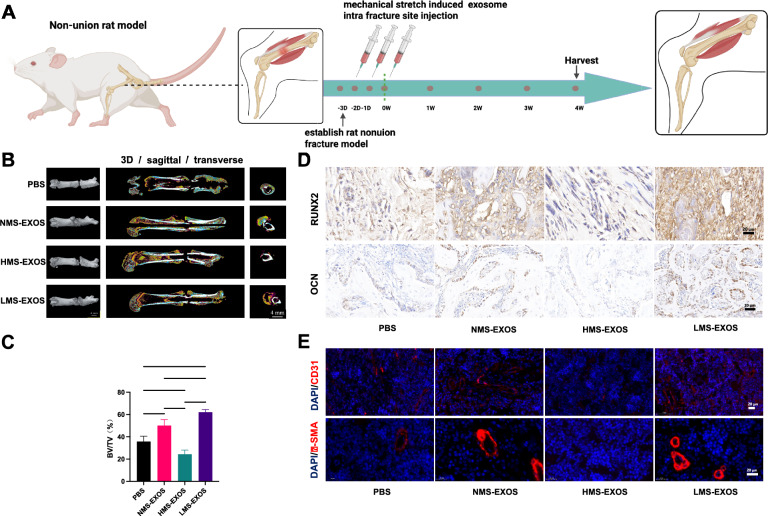
图4A:实验设计示意图。
图4B:大鼠股骨的Micro-CT扫描结果。结果显示,3D重建、矢状面及横断面图像中,LMS-Exos组骨折间隙显著缩小,骨痂体积显著大于PBS组、NMS-Exos组;HMS-Exos组骨折间隙最大,骨痂量最少。
图4C:骨体积/总体积(BV/TV)的定量分析。结果显示,LMS-Exos组的BV/TV(骨再生关键指标)显著高于PBS组、NMS-Exos组。
图4D:骨折区域成骨标志物的免疫组化染色。结果显示,RUNX2、OCN的阳性染色细胞数(棕色)在LMS-Exos组显著多于其他三组。
图4E:骨折区域血管标志物的免疫荧光染色。结果显示,α-SMA(血管平滑肌标志物)、CD31(血管内皮标志物)的荧光强度在LMS-Exos组显著强于其他三组。
这些结果表明,在T2DM骨不连大鼠体内,局部注射低机械拉伸诱导的ADSC-Exos(LMS-Exos)可显著促进骨折部位的骨再生(BV/TV升高、骨痂增多、成骨标志物上调)及血管生成(血管标志物上调),从而加速骨折愈合;而HMS-Exos则抑制骨愈合,验证了LMS-Exos的体内治疗效果。
5. MiR-877在循环机械拉伸诱导的ADSCs- Exos中表达上调
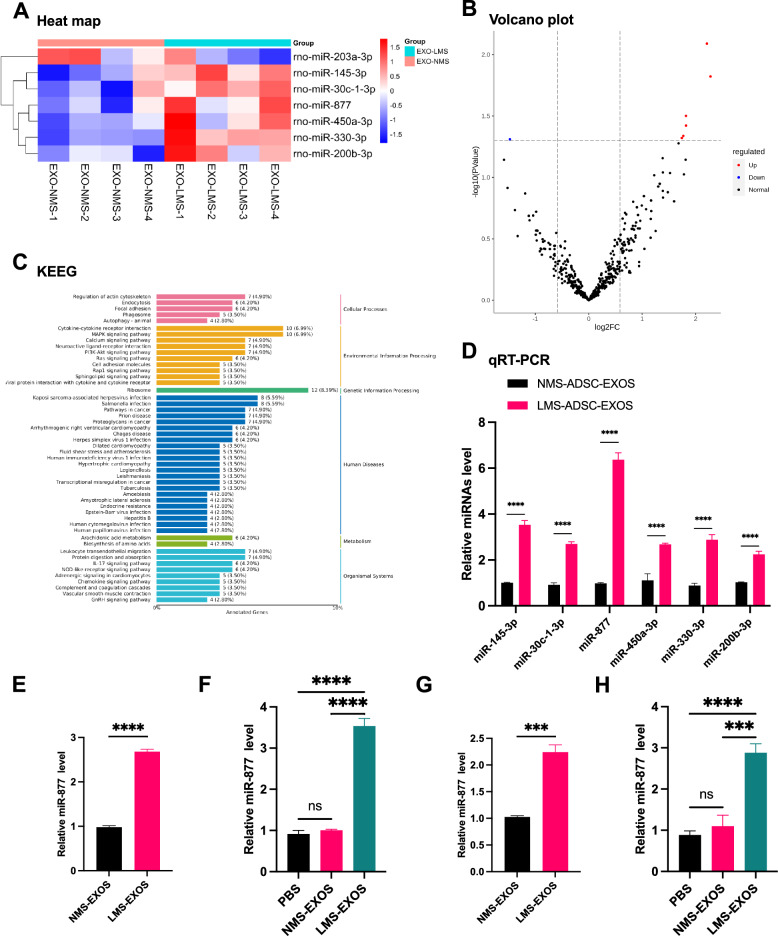
图5A:差异miRNA的热图分析。结果显示,与NMS-Exos相比,LMS-Exos中存在多个显著差异表达的miRNA,其中miR-877的上调幅度最为明显。
图5B:差异miRNA的火山图分析。结果进一步证实LMS-Exos中miR-877表达显著升高。
图5C:差异miRNA的KEGG通路分析。结果显示,差异miRNA富集于与“骨再生”“血管生成”相关的信号通路(如PI3K-Akt通路)。
图5D:6个上调miRNA的qRT-PCR验证。结果显示,与NMS-Exos相比,LMS-Exos中miR-145-3p、miR-30c-1-3p、miR-877等6个miRNA均上调,其中miR-877的上调幅度显著高于其他5个miRNA,为核心差异miRNA。
图5E-F:BMSCs中miR-877的表达检测。结果显示,与PBS组、NMS-Exos组相比,LMS-Exos处理的BMSCs中miR-877表达量显著升高。
图5G-H:HUVECs中miR-877的表达检测。结果显示,与PBS组、NMS-Exos组相比,LMS-Exos处理的HUVECs中miR-877表达量显著升高。
这些结果表明低机械拉伸诱导的ADSC-Exos(LMS-Exos)中miR-877表达显著上调,且LMS-Exos可作为“载体”将miR-877转移至骨愈合关键受体细胞(BMSCs、HUVECs),使受体细胞内miR-877水平升高。
6.循环机械拉伸诱导的ADSCs- Exos通过体外上调miR-877表达促进成骨分化和血管生成,从而增强骨愈合
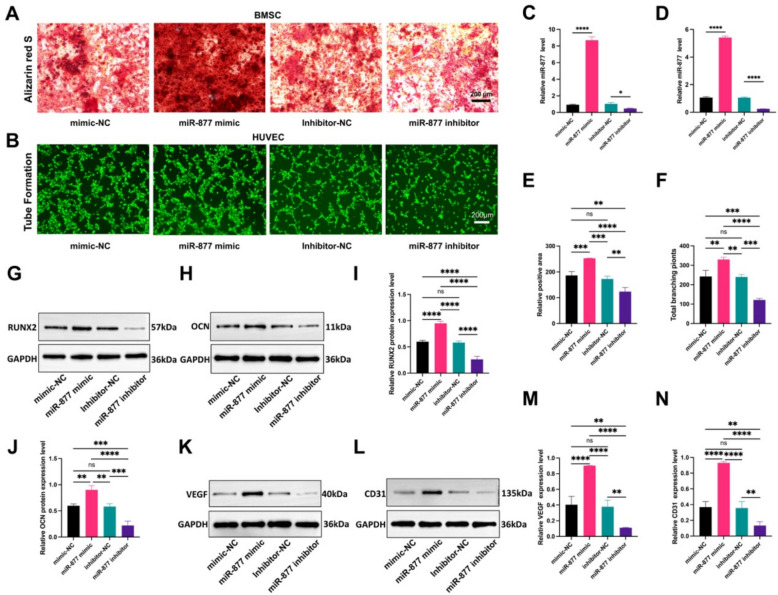
图6A:转染后BMSCs的成骨分化检测(ARS、ALP染色)。结果显示,与模拟物阴性对照(mimic-NC)相比,转染miR-877模拟物(miR-877 mimic)的BMSCs矿化结节(ARS)和ALP阳性染色显著增多;与抑制剂阴性对照(inhibitor-NC)相比,转染miR-877抑制剂(miR-877 inhibitor)的BMSCs染色显著减少。
图6B:转染后HUVECs的血管生成检测(管形成实验)。结果显示,miR-877 mimic组HUVECs形成的管结构显著多于mimic-NC组,miR-877 inhibitor组管结构显著少于inhibitor-NC组。
图6C-D:转染后细胞中miR-877的qRT-PCR验证。结果显示,miR-877 mimic组BMSCs、HUVECs中miR-877表达量显著高于对应阴性对照,miR-877 inhibitor组显著低于对应阴性对照。
图6E-F:成骨与血管生成的定量分析。结果显示,miR-877 mimic组BMSCs的矿化程度、ALP活性及HUVECs的管长度显著高于阴性对照,miR-877 inhibitor组显著降低。
图6G-J:转染后BMSCs中成骨标志物的Western blot检测及定量。结果显示,miR-877 mimic组RUNX2、OCN蛋白表达显著高于mimic-NC组,miR-877inhibitor组显著低于inhibitor-NC组。
图6K-N:转染后HUVECs中血管标志物的Western blot检测及定量。结果显示,miR-877 mimic组VEGF、CD31蛋白表达显著高于mimic-NC组,miR-877 inhibitor组显著低于inhibitor-NC组。
这些结果表明miR-877是LMS-Exos促进成骨分化和血管生成的“关键效应分子”——外源性过表达miR-877可模拟LMS-Exos的功能(促进BMSCs成骨、HUVECs血管生成),而抑制miR-877则会阻断该功能,明确了LMS-Exos→miR-877→成骨/血管生成的调控轴。
结论
本研究揭示了一种新型“机械生物学机制”——机械刺激可通过调节ADSCs外泌体的miRNA负载物(如上调miR-877),进而调控骨愈合关键细胞的功能,为“机械信号→细胞应答→骨再生”的调控网络提供了新视角。






