研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
实验闭环咋搭不迷茫?细胞→体内模型→类器官,这篇外泌体研究证据链超扎实!IF:9+发文逻辑轻松学
195 人阅读发布时间:2025-11-11 09:51
肺癌是全球范围内极具危害性的恶性肿瘤,其中肺腺癌(LUAD)作为非小细胞肺癌(NSCLC)的主要亚型,约占肺癌病例的40%,晚期患者预后极差,5年总生存率不足20%。自2002年发现驱动癌基因以来,靶向治疗成为晚期LUAD治疗的重要方向,但耐药问题常导致治疗效果受限。表皮生长因子受体(EGFR)突变在LUAD中较为常见,奥希替尼作为第三代EGFR酪氨酸激酶抑制剂(TKI),虽能有效靶向敏感EGFR突变及耐药T790M突变,却仍无法避免耐药现象的发生。研究表明,c-MET扩增是奥希替尼一线和二线治疗中常见的耐药机制之一,然而其具体作用机制尚不明确,且缺乏有效延长耐药患者生存期的治疗策略。
外泌体作为细胞间通讯的关键介质,可通过传递信号分子影响受体细胞行为,在肿瘤进展、免疫抑制及放化疗耐药中发挥重要作用。长链非编码RNA(lncRNA)LUCAT1已被证实与多种癌症的化疗耐药相关,但外泌体LUCAT1在肿瘤靶向药物耐药中的作用尚未明确。

今天分享的是发表在【Cell Death Dis】(IF:9.6)上题为“Hypoxia-induced exosomal LUCAT1 promotes osimertinib resistance in lung adenocarcinoma by stabilizing c-MET”的研究,该研究旨在阐明缺氧诱导外泌体(HExo)在促进LUAD对奥希替尼耐药中的功能与机制,明确外泌体LUCAT1的作用,为寻找诊断生物标志物和治疗靶点提供依据。
研究结果
1、缺氧来源外泌体在体内外诱导EGFR突变型LUAD对奥希替尼耐药
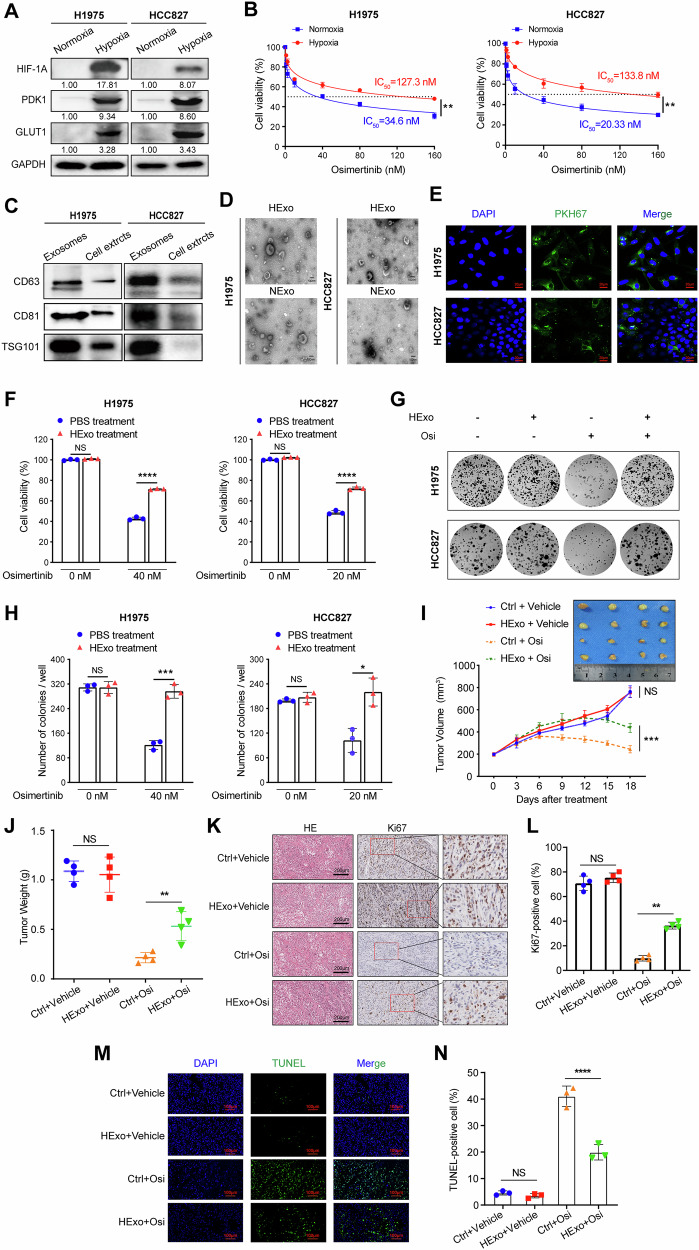
图1A:通过Western blot检测H1975和HCC827细胞在缺氧与常氧条件下缺氧标志物HIF-1α、PDK1、GLUT1及内参GAPDH的蛋白表达,结果显示缺氧条件下HIF-1α、PDK1、GLUT1表达显著升高,成功构建缺氧细胞模型。
图1B:绘制缺氧和常氧条件下H1975、HCC827细胞经不同浓度奥希替尼处理48小时的剂量反应曲线,缺氧组细胞对奥希替尼的半数抑制浓度显著高于常氧组,表明缺氧降低细胞对奥希替尼的敏感性。
图1C:Western blot检测H1975和HCC827细胞来源外泌体中特异性蛋白CD63、CD81、TSG101的表达,证实成功分离出外泌体。
图1D:奥希替尼耐药细胞与亲本H1975、HCC827细胞来源外泌体的透射电镜(TEM)图像,外泌体呈典型囊泡状结构。
图1E:H1975和HCC827细胞与PKH67标记(绿色)的HExo共培养后的免疫荧光图像,在细胞内观察到绿色荧光,证实HExo可被LUAD细胞内化。
图1F:H1975和HCC827细胞经HExo(或PBS对照)预处理24小时后,再用不同浓度奥希替尼处理48小时的细胞活力检测结果,HExo组细胞活力显著高于对照组,表明HExo降低细胞对奥希替尼的敏感性。
图1G-H:H1975(上图)和HCC827(下图)细胞与HExo共培养并经不同浓度奥希替尼处理2周的集落形成实验结果,包括代表性图像和集落平均数量统计,HExo组集落数量显著多于对照组,进一步证实HExo促进细胞对奥希替尼耐药。
图1I-J:H1975细胞(3×10⁶个)在NCG小鼠皮下移植,经溶剂或奥希替尼(5mg/kg)处理的异种移植实验结果,包括肿瘤体积和重量统计,HExo处理组在奥希替尼治疗下肿瘤体积和重量显著大于对照组,且无奥希替尼处理时HExo对肿瘤大小无显著影响。
图1K-L:经溶剂或奥希替尼(5mg/kg)处理的异种移植肿瘤组织的HE染色和Ki67免疫组化(IHC)染色结果及Ki67阳性率定量分析,HExo处理组Ki67阳性率显著高于对照组,表明HExo促进肿瘤细胞增殖。
图1M-N:经溶剂或奥希替尼(5mg/kg)处理的异种移植肿瘤组织中凋亡细胞比例的TUNEL染色分析结果及TUNEL阳性细胞定量,HExo处理组TUNEL阳性细胞比例显著低于对照组,表明HExo抑制奥希替尼诱导的细胞凋亡。
这些结果表明,缺氧来源的外泌体(HExo)可在体内外显著降低EGFR突变型LUAD细胞对奥希替尼的敏感性,通过促进肿瘤细胞增殖、抑制凋亡来诱导耐药。
2、外泌体中LUCAT1的鉴定
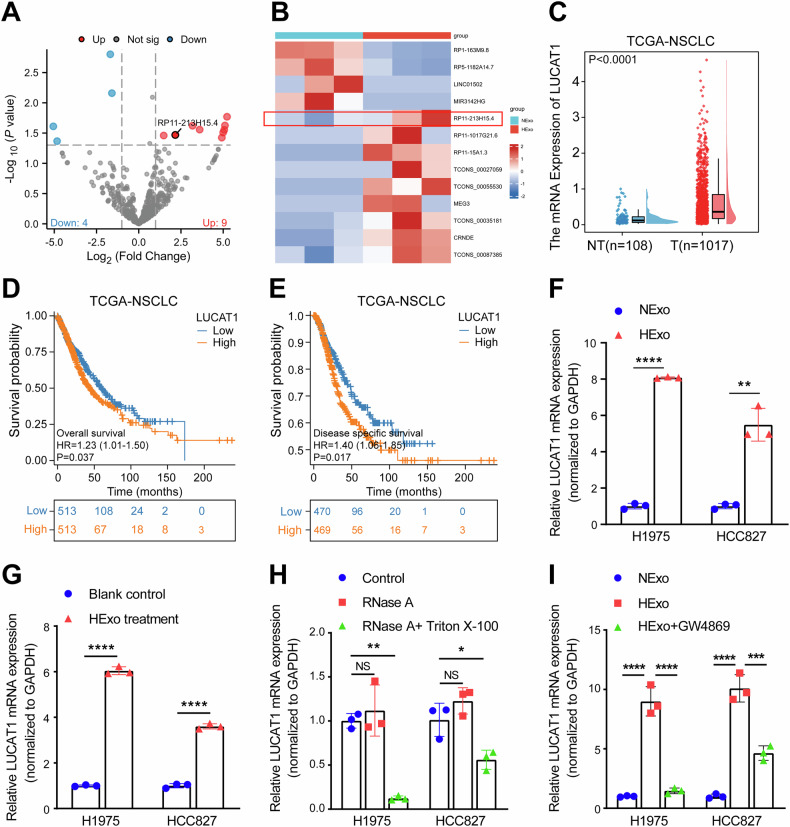
图2A-B:H1975细胞来源HExo和常氧诱导外泌体(NExo)的lncRNA测序数据,分别以火山图和热图呈现,筛选出13个差异表达lncRNA,其中9个在HExo中高表达。
图2C:TCGA队列中LUCAT1在癌旁组织和肿瘤组织中的相对表达水平,肿瘤组织中LUCAT1表达显著高于癌旁组织。
图2D-E:根据TCGA队列中NSCLC患者LUCAT1表达中位数分组,绘制高、低LUCAT1表达组的总生存期(OS,D)和疾病特异性生存期(DSS,E)Kaplan-Meier曲线,高LUCAT1表达组患者OS和DSS显著缩短(D中P=0.037)。
图2F:qRT-PCR检测H1975和HCC827细胞来源HExo和NExo中LUCAT1的表达,HExo中LUCAT1表达显著高于NExo。
图2G:H1975和HCC827细胞与HExo(或PBS对照)共培养48小时后,qRT-PCR检测LUCAT1的表达,共培养组LUCAT1表达显著高于对照组。
图2H:H1975和HCC827细胞条件培养基经RNaseA(2mg/ml)单独处理或联合Triton X-100(0.1%)处理后,qRT-PCR检测LUCAT1表达,单独RNaseA处理对LUCAT1表达无显著影响,联合处理则显著降低其表达。
图2I:qRT-PCR检测NExo、HExo及HExo+GW4869(外泌体合成释放抑制剂)组中LUCAT1的表达,HExo+GW4869组LUCAT1表达显著低于HExo组。
这些结果表明,LUCAT1可被缺氧诱导的外泌体包裹并传递至受体细胞,且外泌体的脂质双分子层能保护LUCAT1免受降解,同时LUCAT1高表达与NSCLC患者不良预后相关。
3、LUCAT1上调促进LUAD在体内外对奥希替尼耐药
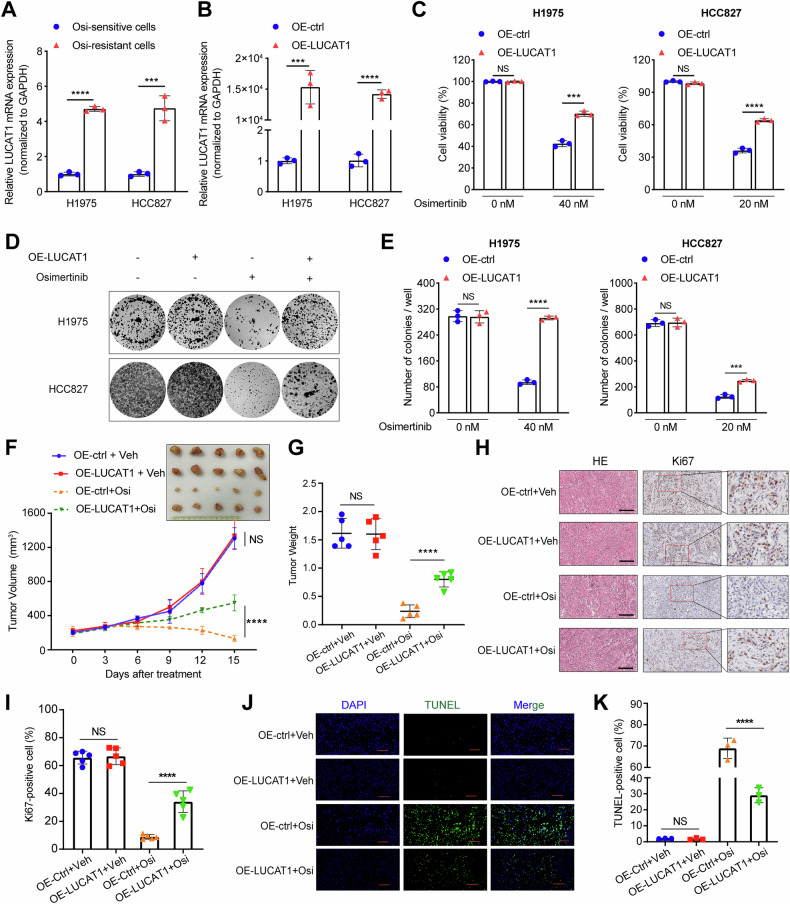
图3A:qRT-PCR检测奥希替尼耐药H1975/OR、HCC827/OR细胞与亲本细胞中LUCAT1的表达,耐药细胞中LUCAT1表达显著高于亲本细胞。
图3B:qRT-PCR检测LUCAT1过表达(OE-LUCAT1)和对照(OE-ctrl)LUAD细胞中LUCAT1的表达,过表达组LUCAT1表达显著升高。
图3C:OE-LUCAT1和对照LUAD细胞经不同浓度奥希替尼处理48小时的细胞活力检测,过表达组细胞活力显著高于对照组。
图3D-E:OE-LUCAT1和对照LUAD细胞经不同浓度奥希替尼处理2周的集落形成实验,包括代表性图像和集落平均数量统计,过表达组集落数量显著多于对照组。
图3F-G:OE-LUCAT1和对照H1975细胞(3×10⁶个)在NCG小鼠皮下移植,经溶剂或奥希替尼(5mg/kg)处理的异种移植实验,包括肿瘤体积和重量统计,过表达组在奥希替尼治疗下肿瘤体积和重量显著大于对照组,且无奥希替尼时两组无显著差异。
图3H-I:经溶剂或奥希替尼(5mg/kg)处理的异种移植肿瘤组织的HE染色和Ki67 IHC染色及Ki67阳性率定量,过表达组Ki67阳性率显著高于对照组。
图3J-K:经溶剂或奥希替尼(5mg/kg)处理的异种移植肿瘤组织中凋亡细胞比例的TUNEL染色及TUNEL阳性细胞定量,过表达组TUNEL阳性细胞比例显著低于对照组。
这些结果表明,LUCAT1上调可在体内外显著降低EGFR突变型LUAD细胞对奥希替尼的敏感性,通过促进细胞增殖、抑制凋亡诱导耐药。
4、LUCAT1敲低恢复LUAD在体内外对奥希替尼的敏感性
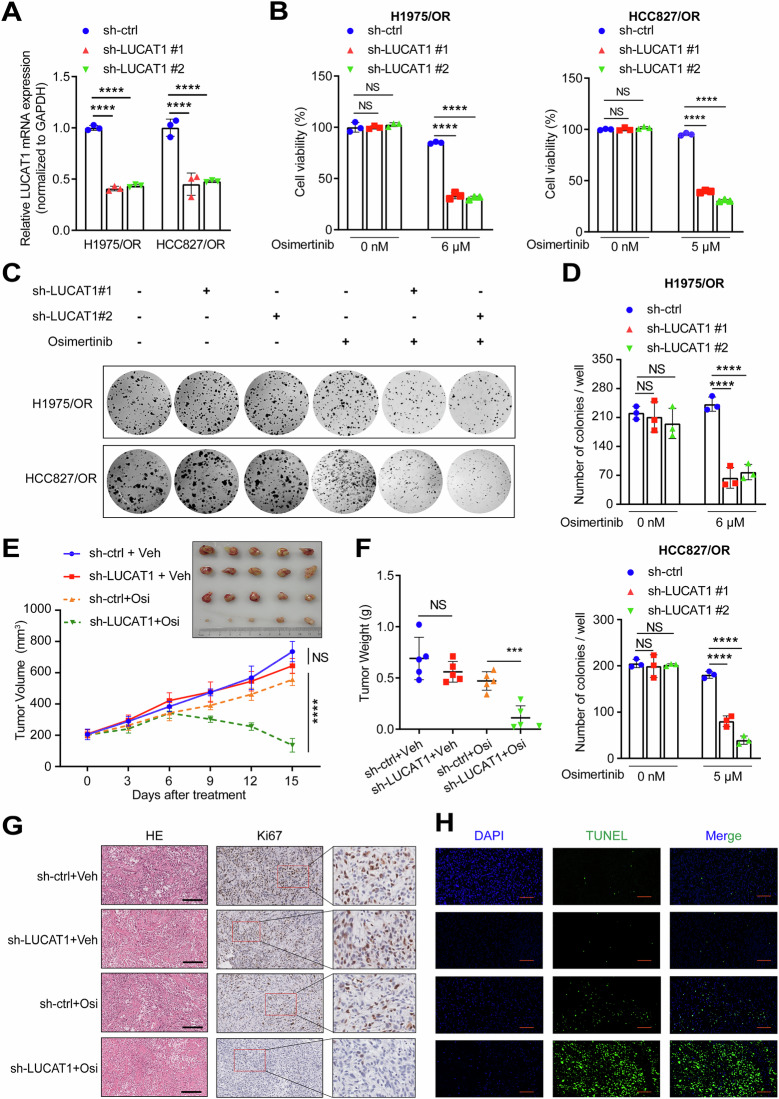
图4A:qRT-PCR检测H1975/OR和HCC827/OR细胞转染LUCAT1 shRNA 72小时后LUCAT1的表达,敲低组LUCAT1表达显著低于对照(sh-ctrl)组。
图4B:LUCAT1敲低和对照H1975/OR(左)、HCC827/OR(右)细胞经不同浓度奥希替尼处理48小时的细胞活力检测,敲低组细胞活力显著低于对照组。
图4C-D:LUCAT1敲低和对照H1975/OR(上)、HCC827/OR(下)细胞经不同浓度奥希替尼处理2周的集落形成实验,包括代表性图像和集落平均数量统计,敲低组集落数量显著少于对照组。
图4E-F:LUCAT1敲低和对照H1975/OR细胞(3×10⁶个)在NCG小鼠皮下移植,经溶剂或奥希替尼(5mg/kg)处理的异种移植实验,包括肿瘤体积和重量统计,敲低组在奥希替尼治疗下肿瘤体积和重量显著小于对照组。
图4G:经溶剂或奥希替尼(5mg/kg)处理的异种移植肿瘤组织的HE染色和Ki67 IHC染色,敲低组Ki67阳性细胞比例低于对照组。
图4H:经溶剂或奥希替尼(5mg/kg)处理的异种移植肿瘤组织中凋亡细胞比例的TUNEL染色,敲低组TUNEL阳性细胞比例高于对照组。
这些结果表明,LUCAT1敲低可在体内外恢复EGFR突变型LUAD耐药细胞对奥希替尼的敏感性,通过抑制细胞增殖、促进凋亡逆转耐药。
5、耐药细胞来源外泌体通过细胞间传递LUCAT1扩散奥希替尼耐药性
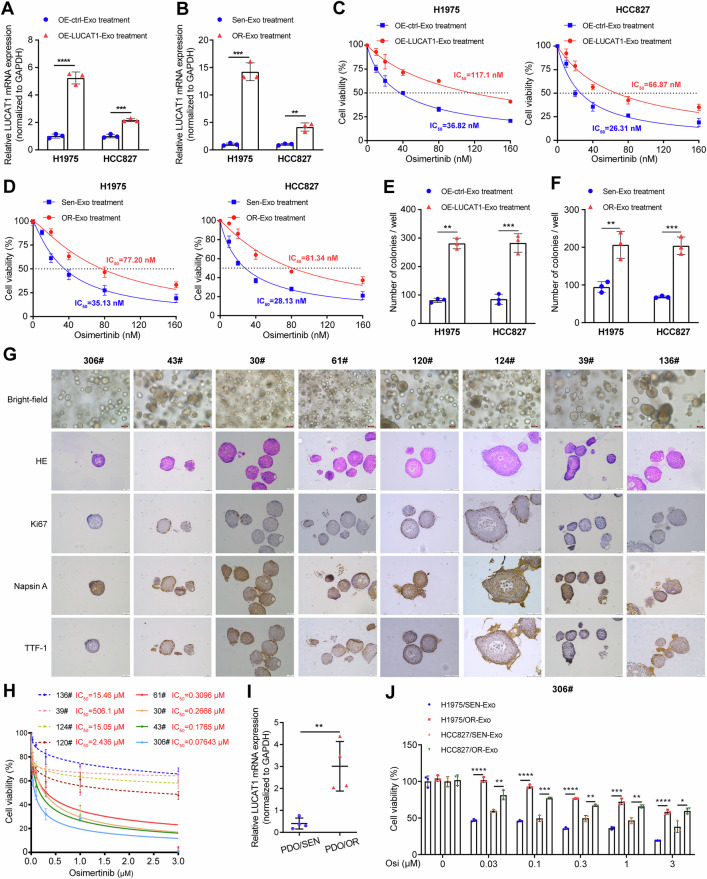
图5A:H1975和HCC827细胞与LUCAT1过表达(OE)LUAD细胞来源外泌体共培养48小时后,qRT-PCR检测LUCAT1的表达,共培养组LUCAT1表达显著升高。
图5B:H1975和HCC827细胞与奥希替尼耐药(OR)LUAD细胞来源外泌体共培养48小时后,qRT-PCR检测LUCAT1的表达,共培养组LUCAT1表达显著升高。
图5C-D:H1975和HCC827细胞与指定外泌体共培养后,经不同浓度奥希替尼处理48小时的细胞活力检测,与OE-LUCAT1或OR细胞来源外泌体共培养的细胞活力显著高于对照。
图5E-F:H1975和HCC827细胞与指定外泌体共培养后,经不同浓度奥希替尼处理3周的集落形成实验,与OE-LUCAT1或OR细胞来源外泌体共培养的细胞集落数量显著多于对照。
图5G:8例EGFR突变型LUAD患者来源肿瘤类器官的代表性明场图像、HE染色及Ki67、NapsinA、TTF-1的IHC染色结果。
图5H:EGFR突变型LUAD类器官经不同浓度奥希替尼处理3天的ATP活力检测,4个类器官(136#、19#、124#、120#)对奥希替尼耐药,4个(61#、30#、43#、306#)敏感。
图5I:qRT-PCR检测EGFR突变型LUAD类器官中LUCAT1的表达,耐药类器官中LUCAT1表达显著高于敏感类器官。
图5J:306#类器官与指定外泌体(40μg/ml)共培养后,经不同浓度奥希替尼处理3天的ATP活力检测,与OR细胞来源外泌体共培养的类器官活力显著高于对照。
这些结果表明,耐药细胞来源的外泌体可通过细胞间传递LUCAT1,将奥希替尼耐药性扩散至敏感的EGFR突变型LUAD细胞及类器官。
6、LUCAT1通过阻止c-MET降解上调其蛋白表达
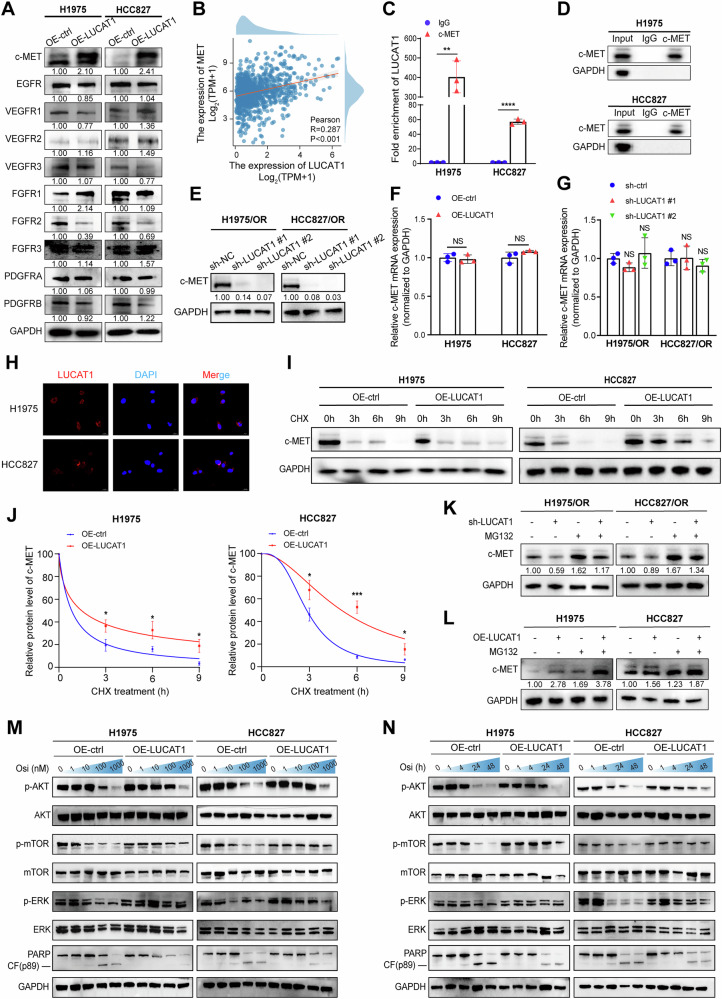
图6A:Western blot检测OE-LUCAT1和对照H1975、HCC827细胞中10种受体酪氨酸激酶(RTKs)的表达,仅c-MET蛋白水平在过表达组显著上调,其他RTKs无显著变化。
图6B:TCGA队列中NSCLC组织LUCAT1与c-MET表达的Pearson相关性分析,二者呈显著正相关。
图6C-D:RIP实验检测H1975和HCC827细胞中c-MET与LUCAT1的相互作用,c-MET抗体组富集的LUCAT1显著多于IgG对照组。
图6E:Western blot检测LUCAT1敲低和对照H1975/OR、HCC827/OR细胞中c-MET的表达,敲低组c-MET蛋白水平显著降低。
图6F-G:qRT-PCR检测OE-LUCAT1和对照H1975、HCC827细胞及LUCAT1敲低和对照H1975/OR、HCC827/OR细胞中c-MET的mRNA表达,各组间无显著差异。
图6H:H1975和HCC827细胞中LUCAT1的荧光原位杂交(FISH)分析,LUCAT1主要定位于细胞质。
图6I-J:OE-LUCAT1和对照H1975、HCC827细胞经50μg/ml CHX处理不同时间后,Western blot检测c-MET蛋白稳定性,过表达组c-MET降解速率显著慢于对照组。
图6K-L:OE-LUCAT1和对照H1975、HCC827细胞(上)及LUCAT1敲低和对照H1975/OR、HCC827/OR细胞(下)经MG132(30μM,3小时)处理后,Western blot检测c-MET蛋白表达,MG132处理减弱了LUCAT1对c-MET蛋白水平的调控作用。
图6M:OE-LUCAT1和对照H1975、HCC827细胞经不同浓度奥希替尼处理24小时后,Western blot检测相关蛋白表达,过表达组AKT、mTOR、ERK磷酸化水平显著高于对照组,cleaved-PARP表达显著低于对照组。
图6N:OE-LUCAT1和对照H1975、HCC827细胞经100nM奥希替尼处理不同时间后,Western blot检测相关蛋白表达,过表达组AKT、mTOR、ERK磷酸化水平显著高于对照组。
这些结果表明,LUCAT1通过在转录后水平与c-MET相互作用,阻止其蛋白酶体依赖性降解,上调c-MET蛋白水平,并激活下游AKT/mTOR和ERK信号通路,进而诱导LUAD对奥希替尼耐药。
7、c-MET介导LUCAT1诱导的LUAD对奥希替尼耐药
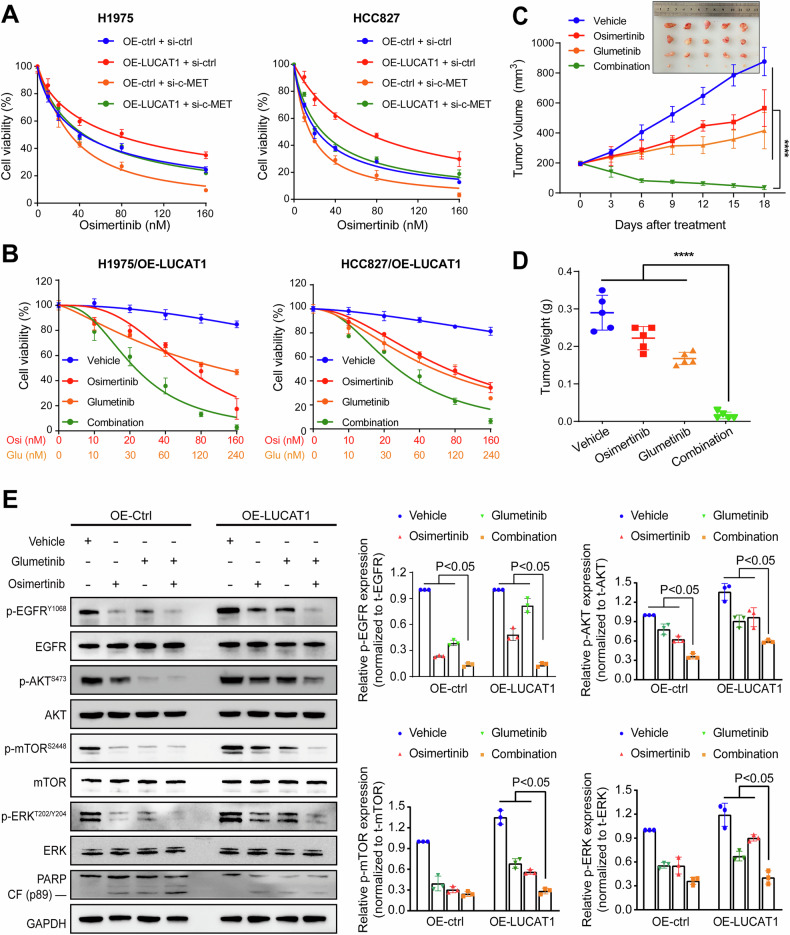
图7A:转染指定载体的H1975和HCC827细胞经不同浓度奥希替尼处理48小时的剂量反应曲线,OE-LUCAT1+si-c-MET组细胞对奥希替尼的敏感性显著高于OE-LUCAT1+si-ctrl组。
图7B:OE-LUCAT1的H1975和HCC827细胞经奥希替尼和谷美替尼(c-MET特异性抑制剂)单独或联合处理48小时的剂量反应曲线,联合处理组细胞活力显著低于单独处理组。
图7C-D:OE-LUCAT1和对照H1975细胞(3×10⁶个)在NCG小鼠皮下移植,经溶剂、奥希替尼(5mg/kg)或联合谷美替尼(5mg/kg)处理的异种移植实验,包括肿瘤体积和重量统计,联合处理组肿瘤体积和重量显著小于其他组。
图7E:OE-LUCAT1和对照H1975细胞经溶剂、奥希替尼或联合谷美替尼处理24小时后,Western blot检测相关蛋白表达及定量分析,联合处理组AKT、mTOR、ERK磷酸化水平显著降低,cleaved-PARP表达显著升高。
这些结果表明,c-MET是LUCAT1介导LUAD对奥希替尼耐药的关键介质,靶向c-MET(如使用谷美替尼)可有效恢复耐药细胞对奥希替尼的敏感性。
8、外泌体LUCAT1作为EGFR突变型LUAD对奥希替尼耐药的诊断生物标志物
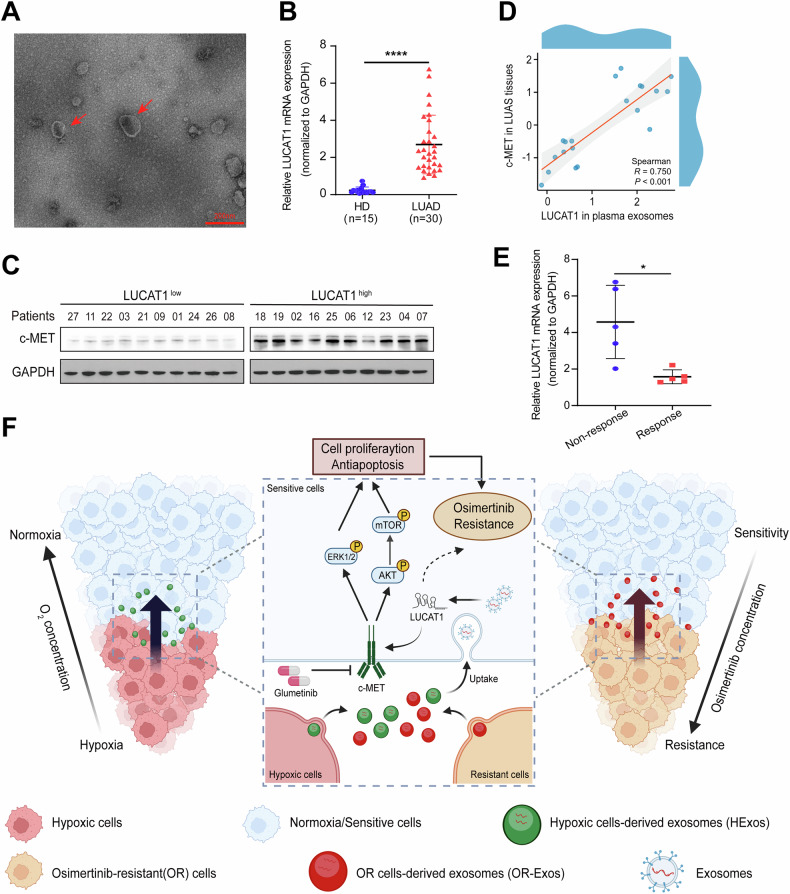
图8A:LUAD患者血浆来源外泌体的代表性TEM图像。
图8B:qRT-PCR检测LUAD患者和健康供体血浆来源外泌体中LUCAT1的表达,患者组LUCAT1表达显著高于健康组。
图8C:Western blot检测LUAD组织中c-MET和GAPDH的表达,LUCAT1高表达患者组织中c-MET蛋白水平显著高于低表达患者。
图8D:LUAD患者血浆来源外泌体中LUCAT1水平与组织中c-MET水平的Spearman相关性分析,二者呈显著正相关。
图8E:qRT-PCR检测对奥希替尼治疗有反应或无反应的EGFR突变型LUAD患者治疗前血浆来源外泌体中LUCAT1的表达,无反应组LUCAT1表达显著高于有反应组。
图8F:外泌体LUCAT1在LUAD对奥希替尼耐药中作用的示意图,缺氧细胞或耐药细胞分泌的外泌体携带LUCAT1传递至敏感细胞,通过稳定c-MET激活AKT/mTOR和ERK通路,诱导耐药。
这些结果表明,血浆外泌体LUCAT1水平与EGFR突变型LUAD患者对奥希替尼的耐药性密切相关,可作为评估奥希替尼治疗反应的潜在液体活检生物标志物。
结论
本研究发现,缺氧诱导的外泌体(HExo)可通过传递LUCAT1降低EGFR突变型肺腺癌(LUAD)细胞对奥希替尼的敏感性,其机制为LUCAT1在转录后水平与c-MET相互作用,阻止c-MET的蛋白酶体依赖性降解,进而激活下游AKT/mTOR和ERK信号通路,最终诱导耐药;同时,耐药细胞来源的外泌体可通过传递LUCAT1扩散耐药性,且血浆外泌体LUCAT1水平与患者对奥希替尼的治疗反应显著相关,可作为潜在诊断生物标志物,而靶向c-MET能有效逆转LUCAT1介导的耐药,为克服奥希替尼耐药提供了新的治疗策略和诊断靶点。






