研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF:12+,双肽修饰+药物负载+铁死亡,这篇脊髓损伤研究的外泌体设计,手把手教你做创新!
256 人阅读发布时间:2025-11-12 16:49
脊髓损伤(SCI)是一种严重的中枢神经系统创伤,以神经元丢失、轴突断裂和再生能力有限为特征,常导致神经功能缺损。铁死亡在SCI后的神经细胞死亡中发挥关键作用,激活谷胱甘肽过氧化物酶4(GPX4)以抑制铁死亡,是修复损伤脊髓的潜在策略。然而,现有治疗因难以穿透血-脊髓屏障(BSCB),疗效受限。外泌体具有生物相容性高、免疫原性低、可携带多种生物分子的天然优势,人脐带间充质干细胞(HUCMSC)来源的外泌体(MSCEXOs)在调节微环境和药物递送方面潜力显著,但针对脊髓损伤部位的靶向效率仍需提升。

今天分享的是发表在【J Nanobiotechnology】(IF:12.6)上题为“Targeted delivery of the GPX4 activator via HUCMSC-derived exosomes inhibits ferroptosis in spinal cord injury”的研究。该研究构建了多功能靶向外泌体递送系统,通过TAT肽(增强BSCB穿透性)和RVG肽(提高神经元靶向特异性)修饰MSCEXOs,并负载GPX4激活剂(GA),旨在精准抑制脊髓损伤部位的铁死亡,为SCI治疗提供新方案。
研究结果
1、MSC-EXOR&T-GA的表征及靶向能力评估
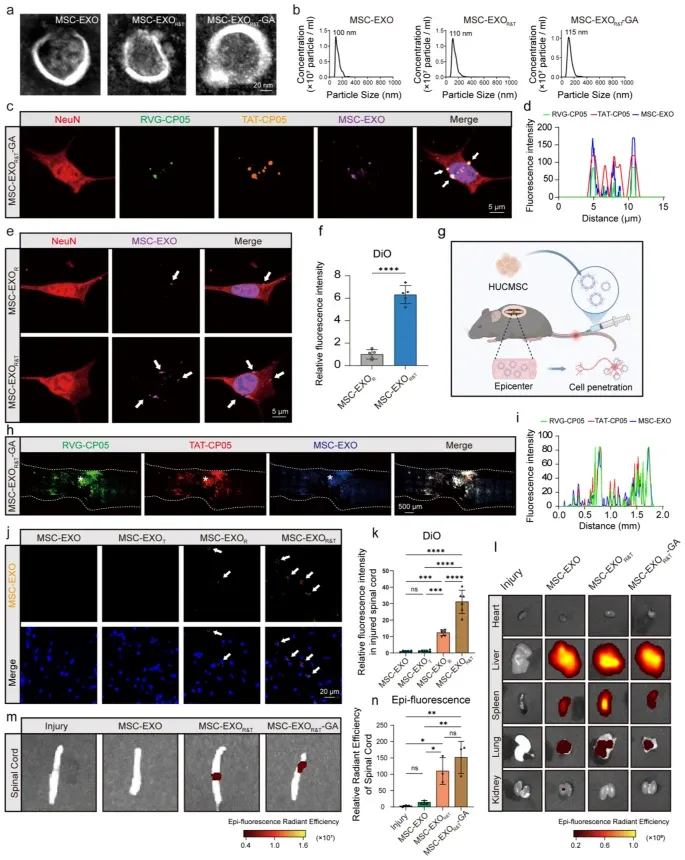
图1a:透射电镜(TEM)观察显示,MSC-EXOs、MSC-EXOR&T及MSC-EXOR&T-GA均呈现典型的双层膜囊泡结构。
图1b:纳米颗粒追踪分析(NTA)结果表明,三种外泌体的粒径分布具有一致性。
图1c:免疫荧光染色显示,NeuN(红色)、RVG-CP05(绿色)、TAT-CP05(橙色)与MSC-EXO(紫色)荧光信号重叠,证实TAT和RVG肽成功修饰外泌体且可进入HT22细胞。
图1d:HT22细胞中荧光强度分布曲线显示,RVG-CP05、TAT-CP05与MSC-EXO荧光信号存在多重重叠峰,进一步验证修饰成功。
图1e-f:共聚焦显微镜观察及荧光强度定量分析显示,MSC-EXOR&T处理组的相对荧光强度显著高于MSC-EXOR组,表明TAT肽增强了外泌体的细胞摄取效率。
图1g:小鼠尾静脉注射外泌体的靶向示意图,显示外泌体可到达脊髓损伤部位并穿透细胞发挥作用。
图1h:注射2小时后脊髓组织的体外荧光分析显示,损伤部位可见RVG-CP05(绿色)、TAT-CP05(红色)与DAPI(蓝色)的荧光信号,证实修饰后外泌体成功靶向SCI部位。
图1i:脊髓损伤部位的荧光强度分布曲线显示,三种信号存在重叠峰,验证外泌体表面肽修饰及在损伤部位的富集。
图1j-k:免疫荧光染色及定量分析显示,MSC-EXOR&T组在SCI部位的荧光信号显著高于MSC-EXOR组,表明TAT肽提升了外泌体的组织靶向性和穿透效率。
图1l-m:全身组织荧光分布结果显示,修饰后的外泌体在脊髓损伤部位富集更显著。
图1n:脊髓组织荧光强度定量分析证实,MSC-EXOR&T和MSC-EXOR&T-GA组的靶向效率显著优于对照组。
这些结果表明,经TAT和RVG肽修饰的外泌体(MSC-EXOR&T)具有良好的结构稳定性,且显著提升了对神经元细胞和脊髓损伤部位的靶向性与穿透能力。
2、MSC-EXOR&T-GA在体外抑制RSL3诱导的铁死亡
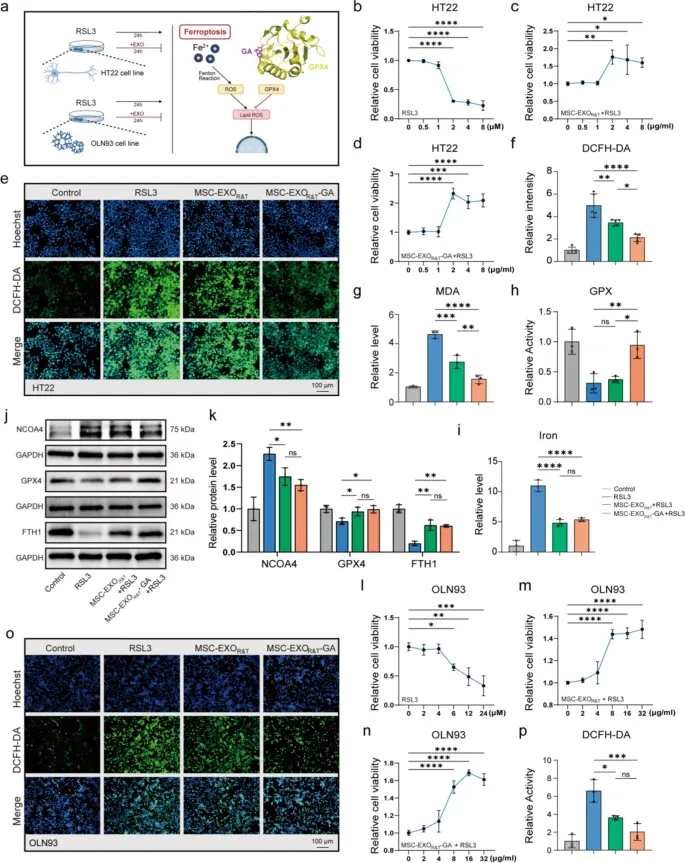
图2a:通过RSL3处理构建HT22神经元和OLN93少突胶质细胞铁死亡模型。
图2b:细胞活力分析显示,随RSL3浓度升高,HT22细胞活力显著下降。
图2c-d:2μg/mL浓度下,MSC-EXOR&T和MSC-EXOR&T-GA处理均显著提高HT22细胞活力,且MSC-EXOR&T-GA的保护效果更优。
图2e-f:DCFH-DA分析检测显示,MSC-EXOR&T和MSC-EXOR&T-GA组的ROS水平显著降低,其中MSC-EXOR&T-GA组降低最明显。
图2g:MDA水平检测显示,RSL3处理后损伤组MDA升高,而MSC-EXOR&T和MSC-EXOR&T-GA组显著降低,MSC-EXOR&T-GA组效果最佳。
图2h:GPX活性检测显示,MSC-EXOR&T-GA组的GPX活性显著高于其他组。
图2i:细胞内铁含量检测显示,损伤组铁含量显著升高,MSC-EXOR&T-GA处理后显著降低。
图2j-k:Western blot结果显示,RSL3处理后NCOA4表达升高,GPX4和FTH1表达降低;MSC-EXOR&T和MSC-EXOR&T-GA处理可逆转该变化,且MSC-EXOR&T-GA的修复效果更显著。
图2l:随RSL3浓度升高,OLN93细胞活力显著下降。
图2m-n:MSC-EXOR&T和MSC-EXOR&T-GA处理显著提高OLN93细胞活力。
图2o-p:OLN93细胞中ROS水平检测显示,MSC-EXOR&T和MSC-EXOR&T-GA处理显著降低ROS,其中MSC-EXOR&T-GA组效果最显著。
这些结果表明,MSC-EXOR&T-GA可通过激活GPX4、调节氧化应激和铁稳态,在体外有效保护神经元和少突胶质细胞免受RSL3诱导的铁死亡损伤。
3、MSC-EXOR&T-GA促进脊髓损伤后的功能恢复
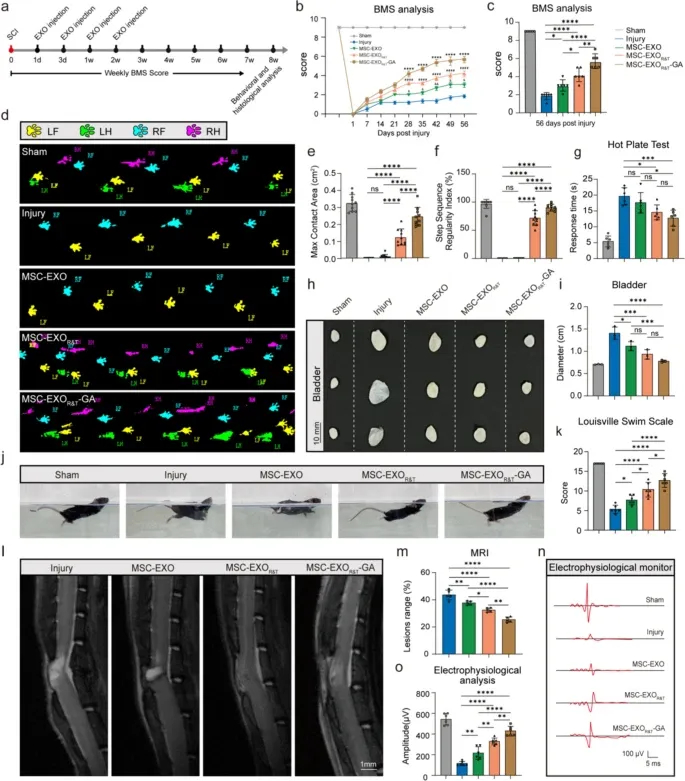
图3a:SCI模型建立及治疗评估的实验时间线示意图。
图3b-c:Basso小鼠量表(BMS)评分显示,MSC-EXOR&T和MSC-EXOR&T-GA组的后肢运动功能显著优于损伤组,且MSC-EXOR&T-GA组改善最明显。
图3d-f:CatWalk步态分析显示,MSC-EXOR&T和MSC-EXOR&T-GA组的步序规律性指数和最大接触面积显著高于损伤组,MSC-EXOR&T-GA组步行表现最佳。
图3g:热板试验显示,MSC-EXOR&T-GA组的痛觉反应时间显著短于损伤组,表明感觉功能恢复更佳。
图3h-i:膀胱直径测量显示,MSC-EXOR&T-GA组显著减小膀胱体积,自主神经调节功能恢复更优。
图3j-k:游泳试验显示,MSC-EXOR&T-GA组的游泳评分显著高于损伤组和MSC-EXO组。
图3l-m:MRI结果显示,MSC-EXOR&T和MSC-EXOR&T-GA组的脊髓损伤体积减小,其中MSC-EXOR&T-GA组损伤体积最小。
图3n-o:运动诱发电位(MEPs)检测显示,MSC-EXOR&T和MSC-EXOR&T-GA组的神经元传导性显著恢复,MSC-EXOR&T-GA组的波幅更高。
这些结果表明,MSC-EXOR&T-GA治疗可显著改善脊髓损伤小鼠的运动协调能力、感觉功能和自主神经功能,减小损伤体积并保护组织完整性,促进神经传导功能恢复。
4、MSC-EXOR&T-GA促进神经元存活并减少星形胶质细胞活化
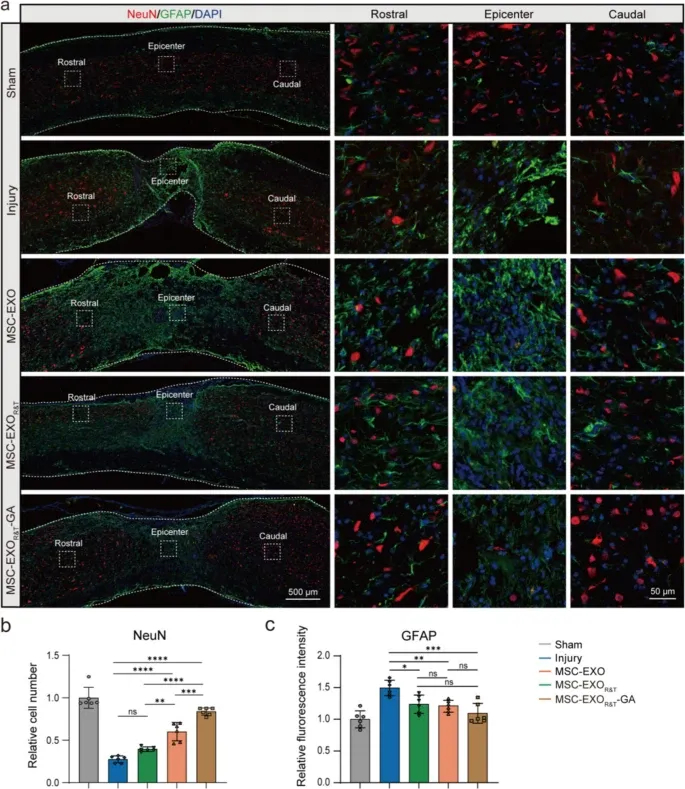
图4a:免疫荧光染色显示,8周时损伤组NeuN+神经元(红色)数量减少,GFAP+星形胶质细胞(绿色)活性升高;MSC-EXOR&T和MSC-EXOR&T-GA组神经元存活增加,星形胶质细胞活性降低,MSC-EXOR&T-GA组效果更显著。
图4b:NeuN+细胞计数定量显示,MSC-EXOR&T-GA组的神经元数量显著多于损伤组和MSC-EXO组。
图4c:GFAP荧光强度定量显示,MSC-EXOR&T-GA组的星形胶质细胞活化水平显著低于损伤组。
这些结果表明,MSC-EXOR&T-GA具有显著的神经保护作用,可促进脊髓损伤后神经元存活,抑制星形胶质细胞活化和胶质瘢痕形成。
5、MSC-EXOR&T-GA促进少突胶质细胞存活和髓鞘再生
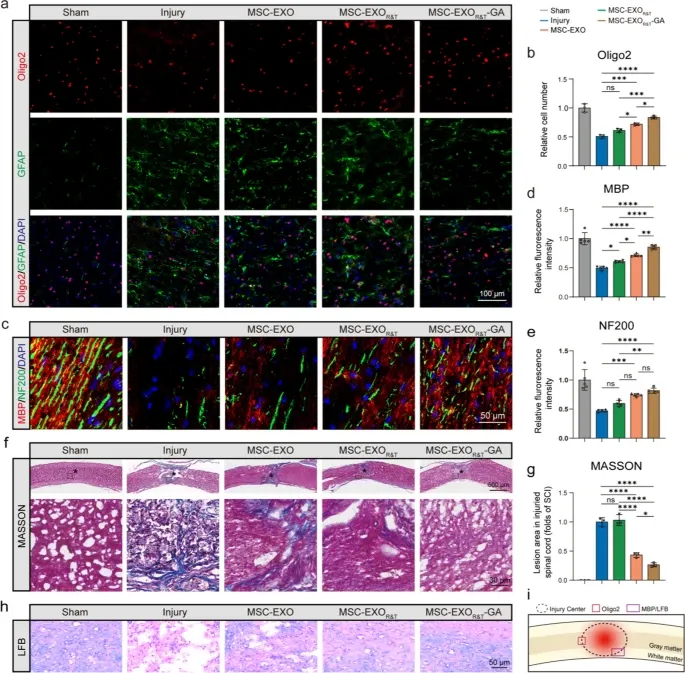
图5a-b:免疫荧光染色及定量显示,损伤组Oligo2+少突胶质细胞数量显著低于假手术组;MSC-EXOR&T和MSC-EXOR&T-GA组显著增加,MSC-EXOR&T-GA组接近假手术组水平。
图5c-e:MBP(髓鞘碱性蛋白)和NF200免疫荧光染色及定量显示,损伤组MBP荧光强度降低,MSC-EXOR&T和MSC-EXOR&T-GA组显著升高,且MSC-EXOR&T-GA组的髓鞘再生和轴突完整性保护效果最佳。
图5f-g:Masson三色染色显示,MSC-EXOR&T-GA组的瘢痕组织减少,脊髓组织保存更完整。
图5h:LFB染色显示,MSC-EXOR&T-GA组的髓鞘保护和修复效果最显著,损伤面积减小,髓鞘完整性改善。
图5i:脊髓矢状切片中不同染色方法的检测区域示意图。
这些结果表明,MSC-EXOR&T-GA可显著促进脊髓损伤后少突胶质细胞存活,增强髓鞘再生,减少瘢痕组织形成,为神经修复提供结构支持。
6、MSC-EXOR&T-GA通过调控铁蛋白自噬和GPX4激活抑制铁死亡
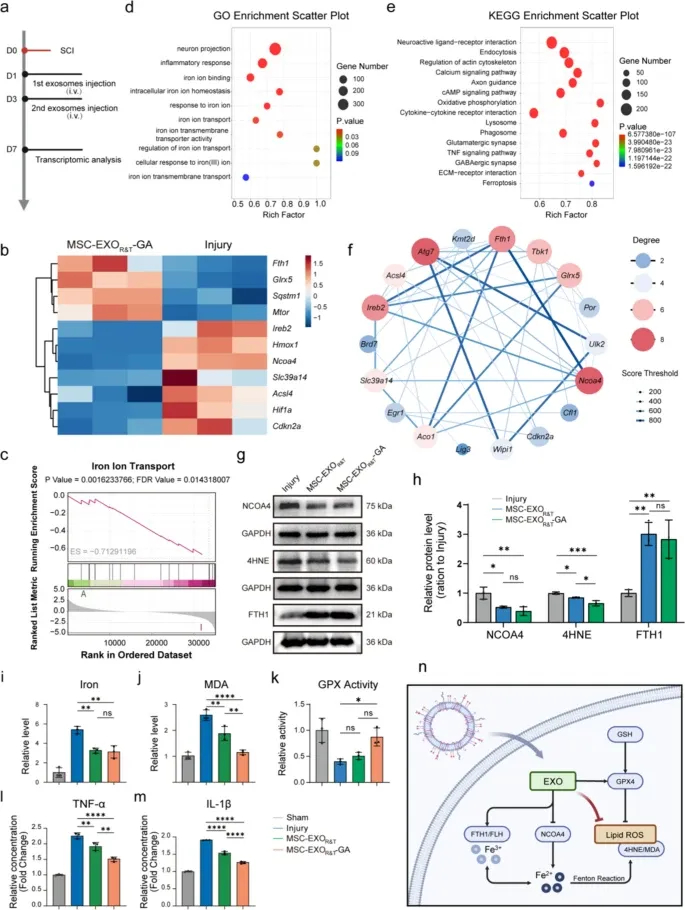
图6a:实验设计示意图,SCI后1、3天静脉注射外泌体,7天收集组织进行转录组测序。
图6b:热图显示,与损伤组相比,MSC-EXOR&T-GA组上调铁稳态和抗氧化相关基因(如FTH1、Sqstm1),下调铁死亡促进基因(如ACSL4)。
图6c:GSEA分析显示,MSC-EXOR&T-GA组显著富集“铁离子转运”通路。
图6d:GO富集分析显示,差异基因集中在“铁离子结合”“细胞对铁离子的反应”等铁死亡调控相关术语。
图6e:KEGG富集分析显示,差异基因富集于轴突导向、TNF信号通路和铁死亡通路。
图6f:PPI网络分析显示,FTH1和NCOA4是铁死亡调控的核心枢纽基因。
图6g-h:Western blot及定量显示,MSC-EXOR&T-GA组恢复GPX4表达,降低4HNE水平,上调FTH1和NCOA4表达。
图6i-k:定量检测显示,MSC-EXOR&T-GA组的细胞内铁积累、MDA水平显著降低,GPX活性显著升高。
图6l-m:ELISA检测显示,MSC-EXOR&T-GA组的促炎因子TNF-α和IL-1β水平显著低于损伤组。
图6n:机制示意图显示,MSC-EXOR&T-GA通过调控NCOA4介导的铁蛋白降解、铁释放、脂质ROS积累及GPX4抑制,抑制铁死亡。
这些结果表明,MSC-EXOR&T-GA通过双重调控铁蛋白自噬抑制和GPX4激活,调节铁稳态、减轻脂质过氧化和炎症反应,从而抑制脊髓损伤后的铁死亡。
结论
本研究成功构建了经TAT和RVG肽修饰、负载GPX4激活剂(GA)的多功能靶向外泌体(MSC-EXOR&T-GA),该外泌体具有良好的结构稳定性和生物安全性,可高效穿透血-脊髓屏障并靶向富集于脊髓损伤部位;通过激活GPX4、调控铁稳态(上调FTH1和NCOA4表达)、抑制脂质过氧化和炎症反应,在体外有效保护神经元和少突胶质细胞免受铁死亡损伤,在体内显著促进脊髓损伤小鼠的神经元存活、轴突再生、髓鞘修复,减少胶质瘢痕形成,并改善运动、感觉及自主神经功能恢复;其核心机制为通过双重调控铁蛋白自噬和GPX4激活抑制铁死亡,为脊髓损伤提供了兼具靶向性、有效性和临床转化潜力的新型治疗策略,也为神经再生领域的外泌体工程化应用提供了重要参考。






