研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF:10+思路直接抄!从 PMENs 到动物验证,何首乌外泌体miRNA跨界调控雄激素通路,科研人速戳!
92 人阅读发布时间:2025-11-20 15:40
雄激素性脱发(AGA)是最常见的脱发类型,影响全球约80%的男性和50%的女性,其核心病理机制与雄激素受体(AR)介导的信号通路异常相关。AR与二氢睾酮(DHT)结合后,会抑制Wnt/β-连环蛋白(β-catenin)通路,阻碍毛囊干细胞分化,导致毛发生长受阻。何首乌作为传统中药,长期用于治疗脱发和早白,但传统研究多聚焦于二苯乙xi类、蒽醌类等次级代谢产物,其潜在的生物活性成分及作用机制仍需深入探索。植物来源外泌体样纳米颗粒(PENs)具有低毒性、高生物相容性和跨界递送生物分子的特性,可携带核酸、蛋白质等发挥调控作用。

今天分享的是发表在【Pharmacol Res】(IF:10.5)上题为“Cross-Kingdom Delivery and Putative Gene Modulation of Androgen Pathways by Plant-Derived Exosome-like Nanoparticles from Polygoni Multiflori Radix Promotes Hair Growth via miRNA Cargo”的研究,该研究旨在分离鉴定何首乌来源外泌体样纳米颗粒(PMENs),探究其通过跨界递送miRNA调控雄激素通路、促进毛发生长的分子机制,为AGA治疗提供新型天然纳米疗法。
研究结果
1、PMENs的分离与表征
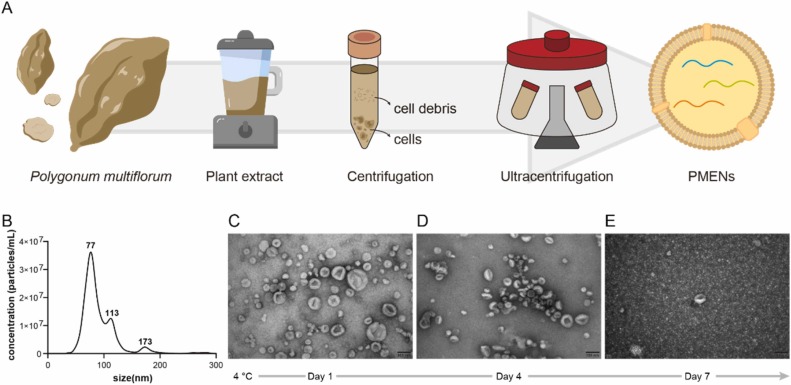
图1A:PMENs提取流程图,通过对新鲜何首乌进行破碎、过滤、梯度离心去除细胞和碎片,再经超速离心富集PMENs。
图1B:纳米颗粒追踪分析(NTA)显示,PMENs粒径呈单分散分布,峰值水动力直径为77nm。
图1C:透射电镜(TEM)显示,新鲜制备的PMENs呈典型圆形或杯状囊泡结构,无细胞碎片和蛋白聚集,纯度较高。
图1D:4℃储存4天后,PMENs仍保持基本结构完整性,但出现明显颗粒聚集。
图1E:4℃储存7天后,PMENs发生显著降解,囊泡破裂并产生碎片。
这些结果表明,通过超速离心法可成功分离高纯度何首乌来源外泌体样纳米颗粒,其粒径符合PENs标准,4℃储存稳定性有限,需在4天内使用以维持结构和功能完整。
2、PMENs的细胞摄取及内化机制
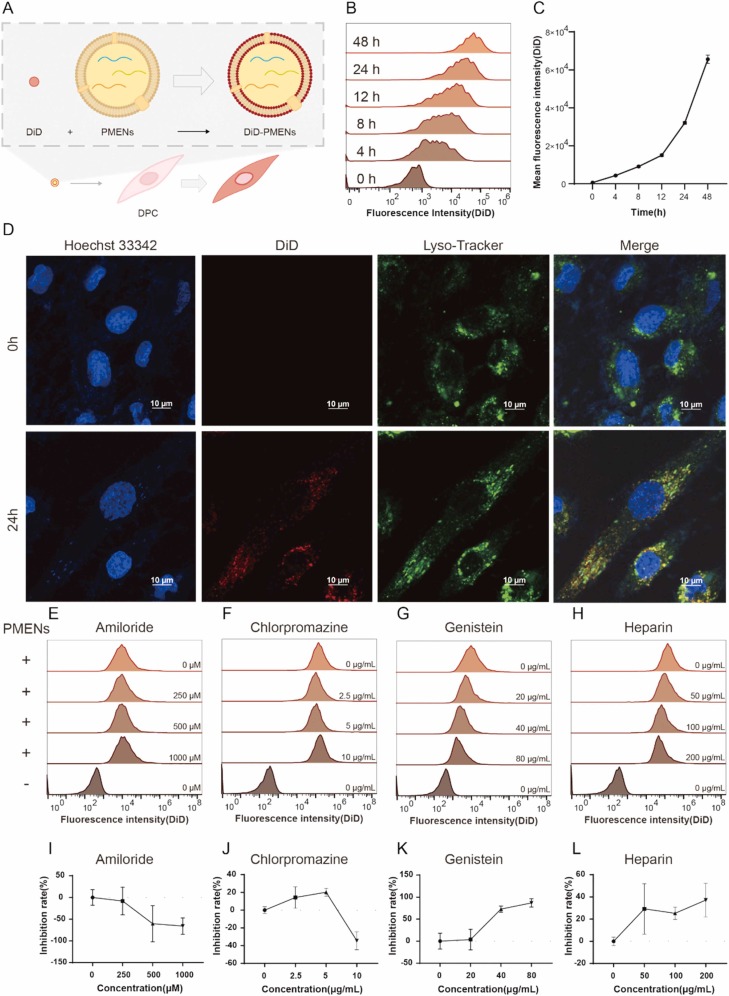
图2A:实验流程示意图,PMENs经DiD染料标记后,与永生化人毛囊真皮乳头细胞(IHFDPC-SV40)共孵育,通过流式细胞术和激光共聚焦显微镜分析摄取情况。
图2B:流式细胞术结果显示,随孵育时间延长(0-48小时),细胞荧光强度分布逐渐右移,呈现时间依赖性摄取特征。
图2C:定量分析显示,细胞平均荧光强度随孵育时间显著升高,证实PMENs被细胞持续内化。
图2D:激光共聚焦成像显示,24小时后DiD标记的PMENs(红色)定位于细胞质,与溶酶体(绿色)部分共定位形成黄橙色信号,细胞核经Hoechst 33342染色(蓝色)。
图2E-I:阿米洛利(巨胞饮抑制剂)处理后,PMENs摄取量反而增加,提示巨胞饮受抑时其他内吞途径代偿增强。
图2F-J:氯丙嗪(网格蛋白介导内吞抑制剂)对PMENs摄取无显著抑制作用。
图2G-K:金雀异黄素(小窝蛋白介导内吞抑制剂)呈剂量依赖性抑制PMENs摄取,80μM时抑制率达86.85%。
图2H-L:硫酸肝素(硫酸乙酰肝素蛋白聚糖抑制剂)同样剂量依赖性抑制摄取,200μg/mL时抑制率为37.17%。
这些结果表明,PMENs可被IHFDPC-SV40细胞高效内化,且主要通过小窝蛋白介导的内吞和硫酸乙酰肝素蛋白聚糖依赖途径实现细胞摄取。
3、PMENs在体内外调控雄激素通路并促进毛发生长
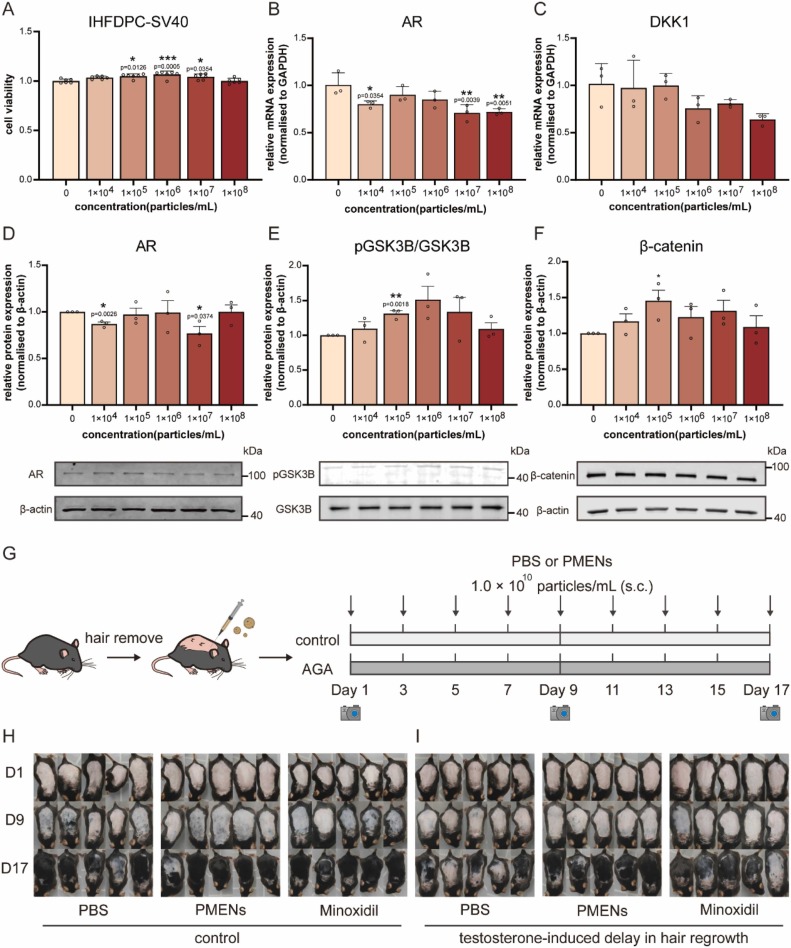
图3A:细胞活力检测显示,PMENs在1×10⁴—1×10⁶颗粒/mL浓度范围内呈剂量依赖性促进IHFDPC-SV40细胞增殖,1×10⁶颗粒/mL时增殖率提升6.58%±3.9%,且最高浓度1×10⁸颗粒/mL无细胞毒性。
图3B:qRT-PCR显示,PMENs处理后AR mRNA水平降低28.6%±19.8%。
图3C:qRT-PCR显示,AR下游靶基因DKK1(Wnt通路抑制剂)mRNA水平降低37.7%±40.1%。
图3D:Western blot显示,PMENs剂量依赖性下调AR蛋白表达,1×10⁷颗粒/mL时降低23.2%±7.6%,对应蛋白条带显示AR(100kDa)和内参β-actin(40kDa)表达。
图3E:Western blot显示,PMENs促进GSK3β磷酸化,1×10⁵颗粒/mL时pGSK3β/GSK3β比值升高31.0%±4.2%,对应蛋白条带显示pGSK3β(40kDa)、GSK3β(40kDa)。
图3F:Western blot显示,PMENs上调β-catenin蛋白表达,1×10⁵颗粒/mL时升高45.6%±14.7%,对应蛋白条带显示β-catenin(100kDa)。
图3G:体内实验流程示意图,C57BL/6小鼠背部脱毛后,分为对照组(PBS)、PMENs组(1.0×10¹⁰颗粒/mL,皮下注射,隔天一次)和米诺地尔组(阳性对照),分别在正常小鼠和睾酮诱导脱发小鼠中评估毛发生长。
图3H:正常小鼠毛发生长代表性图像,第9天PMENs组和米诺地尔组均出现皮肤变黑,第17天均实现完全色素沉着的毛发再生。
图3I:睾酮诱导脱发小鼠毛发生长代表性图像,第17天PMENs组毛发再生密度显著高于米诺地尔组,而PBS组毛发生长受阻。
这些结果表明,PMENs在体外可通过下调AR表达、促进GSK3β磷酸化和β-catenin稳定激活Wnt通路,促进真皮乳头细胞增殖;在体内可有效促进正常小鼠毛发生长,且在睾酮诱导脱发模型中疗效优于米诺地尔。
4、PMENs的miRNA测序分析
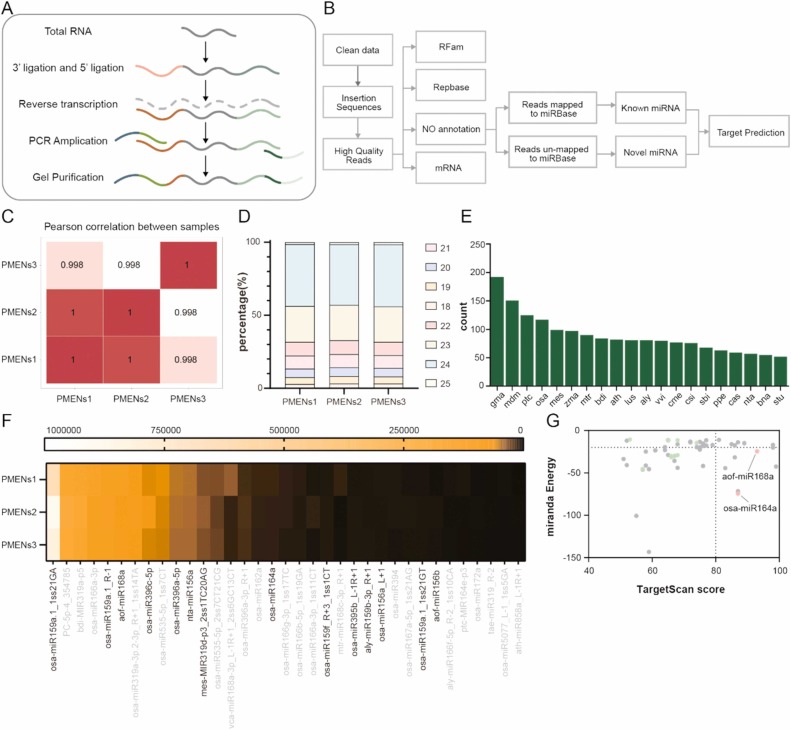
图4A:miRNA测序流程图,提取PMENs总RNA,经接头连接、逆转录、PCR扩增构建文库,通过Illumina HiSeq 2000/2500平台进行单端50bp测序。
图4B:生物信息学分析流程,原始数据经过滤去接头后,排除rRNA、tRNA等非miRNA序列,比对至miRBase数据库鉴定已知miRNA并预测新miRNA,通过TargetScan和miRanda进行靶基因预测。
图4C:三个生物学重复样本的Pearson相关系数均>0.99,表明测序数据重复性良好。
图4D:miRNA长度分布显示,23nt和24nt长度的miRNA占比最高,符合植物Dicer酶切割特征。
图4E:进化保守性分析显示,何首乌miRNA前体在大豆、苹果中匹配度最高,提示存在进化保守性。
图4F:热图显示高表达miRNA在样本间表达一致,其中70%的预测miRNA具有AR靶向潜力,前12个高表达miRNA中58.3%可结合AR mRNA。
图4G:散点图显示,aof-miR168a和osa-miR164a具有高TargetScan评分(≥80)和热力学稳定性(ΔG≤-20kcal/mol),为核心调控miRNA。
这些结果表明,PMENs富含植物特异性miRNA,其中aof-miR168a和osa-miR164a为靶向AR的核心效应分子,具备调控雄激素通路的潜力。
5、miRNA mimic调控雄激素受体通路的功能验证
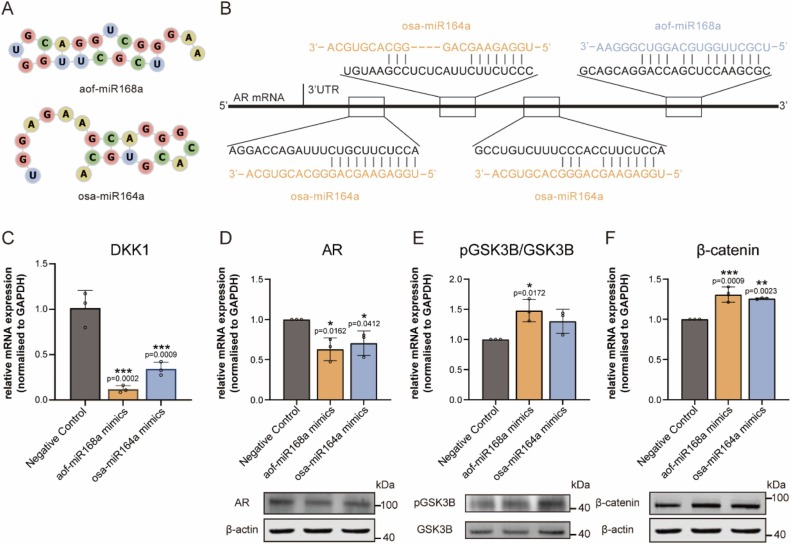
图5A:aof-miR168a和osa-miR164a的预测二级结构。
图5B:序列比对显示,aof-miR168a的种子区(5′-CGCUUC-3′)与AR mRNA 3′UTR的6469-6475位完全互补;osa-miR164a的种子区(5′-GCGAAC-3′)与AR mRNA 3′UTR的636-642、792-798、999-1005位形成8-mer种子匹配。
图5C:qRT-PCR显示,转染aof-miR168a和osa-miR164a mimic后,DKK1 mRNA水平显著降低。
图5D:Western blot显示,两种miRNA mimic均显著下调AR蛋白表达,对应蛋白条带显示AR(100kDa)和内参β-actin(40kDa)。
图5E:Western blot显示,两种miRNA mimic均显著升高pGSK3β/GSK3β比值,对应蛋白条带显示pGSK3β(40kDa)、GSK3β(40kDa)。
图5F:Western blot显示,两种miRNA mimic均显著上调β-catenin蛋白表达,对应蛋白条带显示β-catenin(100kDa)和内参β-actin(40kDa)。
这些结果表明,aof-miR168a和osa-miR164a可通过直接结合AR mRNA 3′UTR,下调AR表达,进而抑制DKK1,激活Wnt/β-catenin通路,与PMENs的生物学效应一致。
结论
本研究成功从何首乌中分离鉴定出外泌体样纳米颗粒(PMENs),其通过小窝蛋白和硫酸乙酰肝素蛋白聚糖介导的内吞途径被毛囊真皮乳头细胞内化;PMENs携带的核心miRNA(aof-miR168a和osa-miR164a)可跨界调控人类AR基因,通过结合AR mRNA 3′UTR下调其表达,进而抑制下游DKK1,促进GSK3β磷酸化和β-catenin稳定,激活Wnt/β-catenin通路,最终促进毛囊细胞增殖和毛发生长;在体内实验中,PMENs不仅能促进正常小鼠毛发生长,还能有效改善睾酮诱导的脱发,疗效优于传统药物米诺地尔。这些发现揭示了何首乌促进毛发生长的新型分子机制,证实PMENs是天然的miRNA递送载体,为雄激素性脱发提供了安全有效的跨界纳米治疗策略,也为传统中药的活性成分研究提供了新视角。






