研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
外泌体藏“纤”机:miR-122-5p靶向HIF-1α,为肾间质纤维化研究破局!
61 人阅读发布时间:2025-11-21 16:54
肾间质纤维化(RIF)是慢性肾脏病进展的共同病理特征和最终表现,受损肾小管上皮细胞(TECs)与成纤维细胞的相互作用是RIF发生发展的核心,但外泌体介导的细胞间通讯在该过程中的具体机制尚未完全明确。外泌体作为脂质双层包裹的纳米级囊泡,可携带microRNA(miRNA)等信号分子调控受体细胞功能。
今天分享的是一篇发表在【Cell Death Discov】(IF:7.0)上题为“Exosomal miR-122-5p from tubular cells ameliorates renal interstitial fibrosis by regulating fibroblasts via HIF-1α”的研究,该研究探究了源自受损的肾小管上皮细胞(TECs)的外泌体miR-122-5p在调节成纤维细胞活化和肾纤维化中的作用。研究从单侧输尿管梗阻(UUO)小鼠的肾脏以及TGF-β1诱导的HK-2细胞中分离出外泌体,与成纤维细胞(NRK-49F细胞)共培养或通过尾静脉注射到UUO小鼠体内;之后采用高通量miRNA分析来鉴定来自HK-2细胞的外泌体中差异表达的miRNA,并基于表达水平和生物信息学预测选择miR-122-5p进行进一步研究,使用miRNA mimic、抑制剂和靶标验证实验进行功能分析。结果表明,在TECs衍生的外泌体中miR-122-5p的表达降低会通过HIF-1α/TGF-β1/Smad轴促进肾纤维化,而重新引入miR-122-5p能够有效地逆转这些效应。综合来看,该研究为通过外泌体miRNA介导的TECs与成纤维细胞之间的细胞间通讯提供了新的见解,并将miR-122-5p确定为治疗肾间质纤维化的潜在治疗靶点。
研究成果
1. HK-2细胞中外泌体的miRNA表达谱
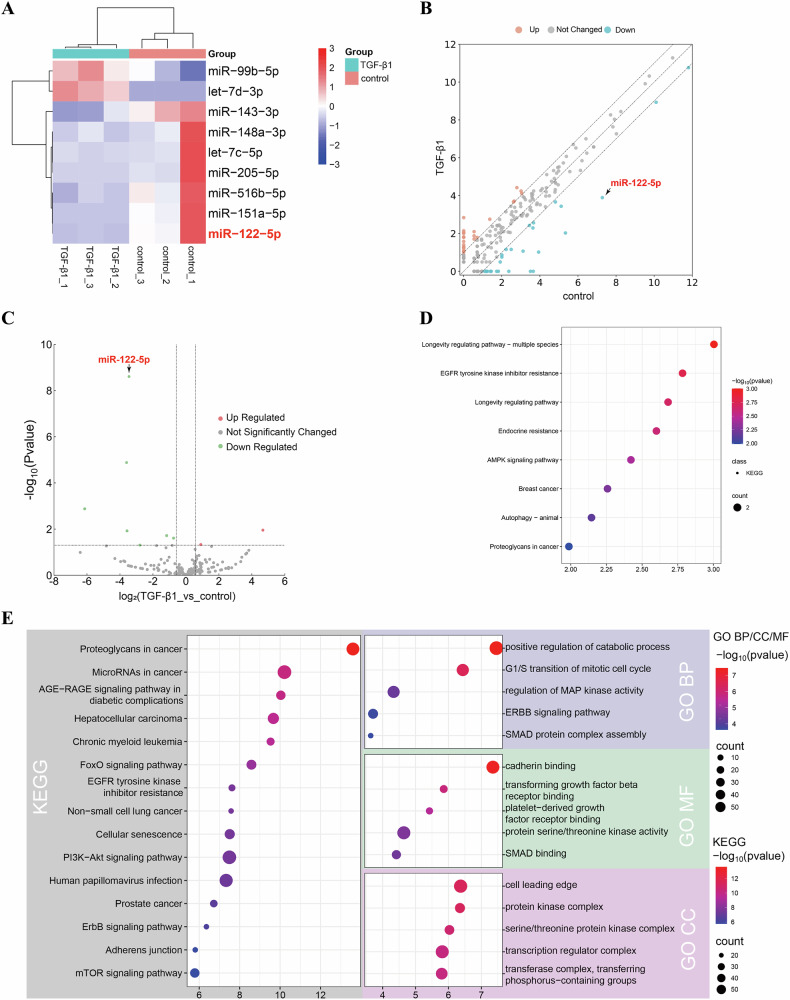
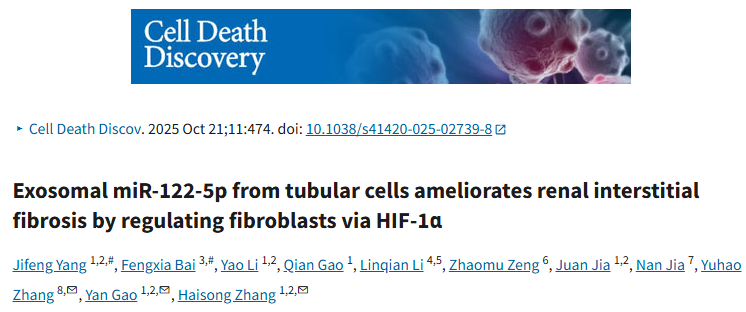
图1 HK-2细胞外泌体的miRNA表达谱
图1A:HK-2细胞外泌体miRNA表达聚类图。结果显示TGF-β1处理组与对照组的miRNA表达模式存在显著差异。
图1B:miRNA表达散点图,直观呈现出两组间miRNA表达的分布差异。
图1C:miRNA表达火山图。结果筛选出9个差异表达miRNA,其中miR-122-5p差异表达最为显著。
图1D:KEGG通路分析结果。结果显示上调miRNA靶基因富集于癌症、耐药性及信号通路相关通路,下调miRNA靶基因涉及癌症、代谢调控及细胞结构相关通路。
图1E:GO功能富集分析结果。结果显示差异miRNA靶基因在生物学过程、细胞组分及分子功能中均有广泛富集,尤其与信号转导相关。
这些结果表明,TGF-β1刺激可显著改变HK-2细胞外泌体的miRNA表达谱,miR-122-5p作为核心差异miRNA,为后续功能验证提供了关键候选分子。
2. HK-2细胞过度表达miR-122-5p分泌的外泌体能够改善由TGF-β1诱导的NRK-49F细胞的纤维化
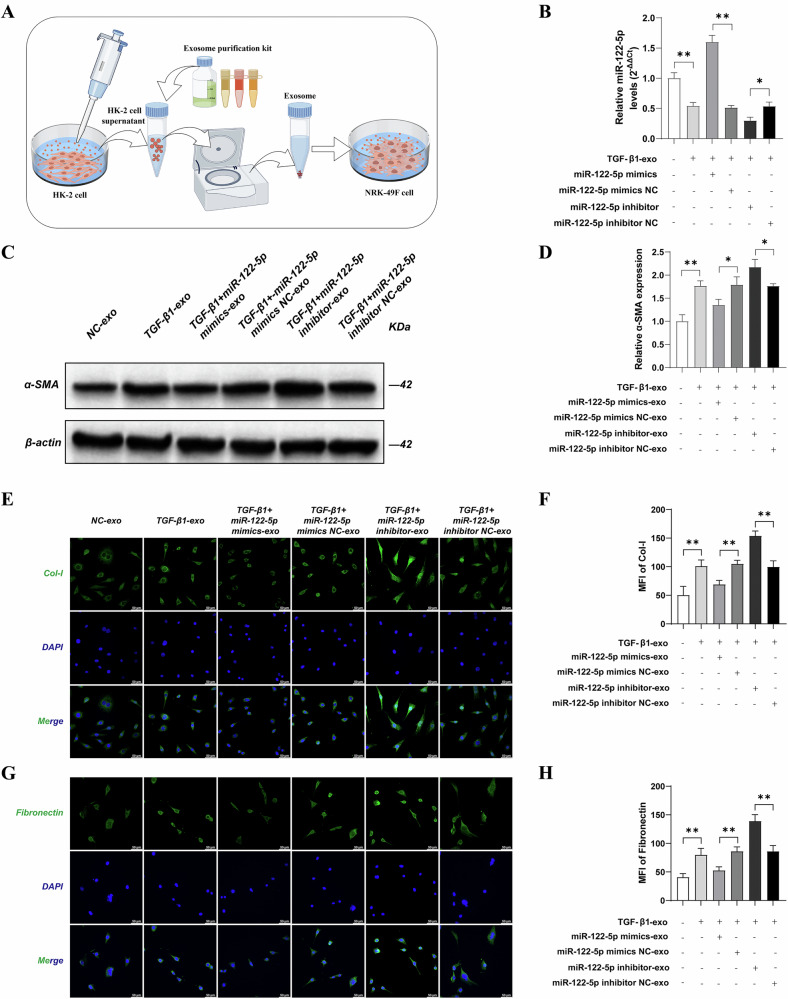
图2 过表达miR-122-5p的HK-2细胞外泌体改善TGF-β1诱导的NRK-49F细胞纤维化
图2A:外泌体与TGF-β1刺激的NRK-49F细胞共培养实验流程图。
图2B:qPCR检测。结果显示,TGF-β1组HK-2细胞外泌体中miR-122-5p表达显著降低,转染miR-122-5p mimic后其表达显著升高,抑制剂处理后进一步降低。
图2C-D:Western blot结果显示,与对照组相比,TGF-β1组NRK-49F细胞α-SMA表达显著升高,miR-122-5p mimic组α-SMA表达显著降低,抑制剂组则显著升高。
图2E-H:免疫荧光检测。结果显示,TGF-β1组NRK-49F细胞中Col-I和Fibronectin表达显著升高,miR-122-5p mimic可逆转该效应,抑制剂则加剧纤维化标志物表达。
这些结果表明,肾小管细胞外泌体miR-122-5p在体外可显著抑制TGF-β1诱导的成纤维细胞活化,减轻纤维化反应。
3.外泌体中miR-122-5p过度表达或抑制对UUO小鼠肾功能和EMT标志物的影响
图3 外泌体中miR-122-5p对UUO小鼠肾功能及EMT标志物的影响
图3A:外泌体尾静脉注射UUO小鼠实验流程图。
图3B:qPCR检测。结果显示,TGF-β1组小鼠肾组织中miR-122-5p表达显著降低,miR-122-5p mimic组其表达显著升高,抑制剂组显著降低。
图3C-D:生化分析。结果显示,TGF-β1组小鼠血清肌酐和尿素氮水平显著升高,miR-122-5p mimic可显著降低二者水平,抑制剂组则进一步升高。
图3E-G:Western blot检测。结果显示,TGF-β1组肾组织α-SMA表达显著升高、E-cadherin表达显著降低,miR-122-5p mimic可逆转该表型,抑制剂组则加剧EMT进程。
这些结果表明,外泌体miR-122-5p可改善UUO小鼠的肾功能,抑制肾小管上皮细胞间充质转化(EMT),缓解肾脏损伤。
4.外泌体中过度表达或抑制miR-122-5p对UUO小鼠肾纤维化和胶原蛋白沉积的影响
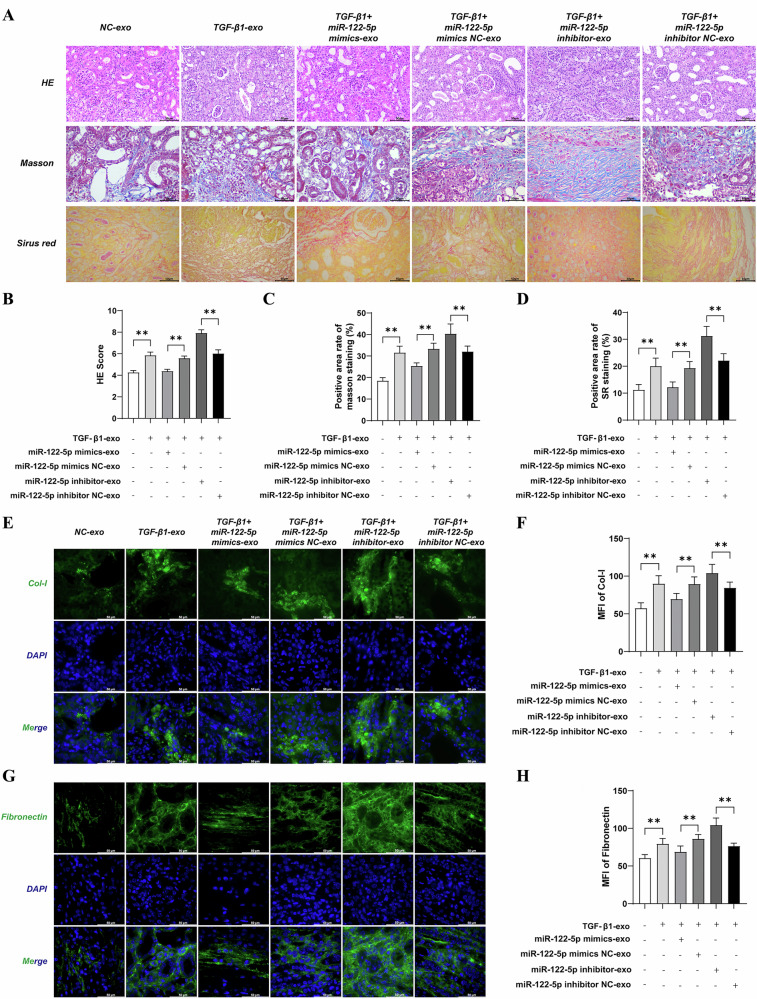
图4 外泌体中miR-122-5p对UUO小鼠肾纤维化及胶原沉积的影响
图4A:HE、Masson及SiriusRed(SR)染色结果。结果显示,TGF-β1组小鼠肾间质损伤严重、胶原沉积显著,miR-122-5p mimic组间质损伤和纤维化程度明显减轻,抑制剂组则加重。
图4B-D:染色定量分析结果。结果显示,TGF-β1组HE染色损伤评分、Masson及SR染色胶原沉积面积显著升高,miR-122-5p mimic组显著降低,抑制剂组显著升高。
图4E-H:免疫荧光检测,结果显示,TGF-β1组肾组织Col-I和Fibronectin表达显著升高,miR-122-5p mimic可显著抑制其表达,抑制剂组则促进其表达。
这些结果表明,外泌体miR-122-5p在体内可有效减轻UUO小鼠的肾间质纤维化和胶原沉积,发挥抗纤维化作用。
5. HIF-1α为miR-122-5p的潜在靶点
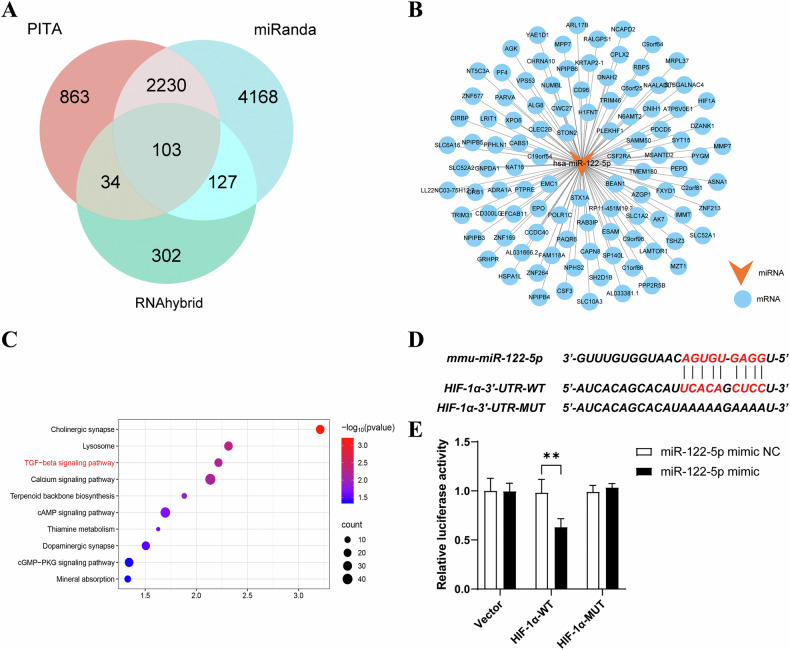
图5 HIF-1α被鉴定为miR-122-5p的潜在靶基因
图5A:Venn图展示。结果显示通过PITA、miRanda和RNAhybrid三种工具预测的miR-122-5p靶基因交集有103个。
图5B:miRNA-mRNA靶基因网络图展示miR-122-5p与潜在靶基因的相互作用关系。
图5C:靶基因功能富集分析。结果显示,其显著富集于多个信号转导和代谢相关通路,尤其涉及TGF-β信号通路。
图5D:生物信息学预测。结果显示,miR-122-5p在HIF-1α的3'非编码区(3'-UTR)存在特异性结合位点。
图5E:荧光素酶报告基因实验。结果显示,miR-122-5p mimic可显著降低HIF-1α-WT质粒的荧光素酶活性,对突变体质粒无显著影响。
这些结果表明,HIF-1α是miR-122-5p的直接靶基因,二者可通过特异性结合位点相互作用。
6. TECs来源的外泌体miR-122-5p通过HIF-1α通过TGF-β1/Smad在体外调控成纤维细胞
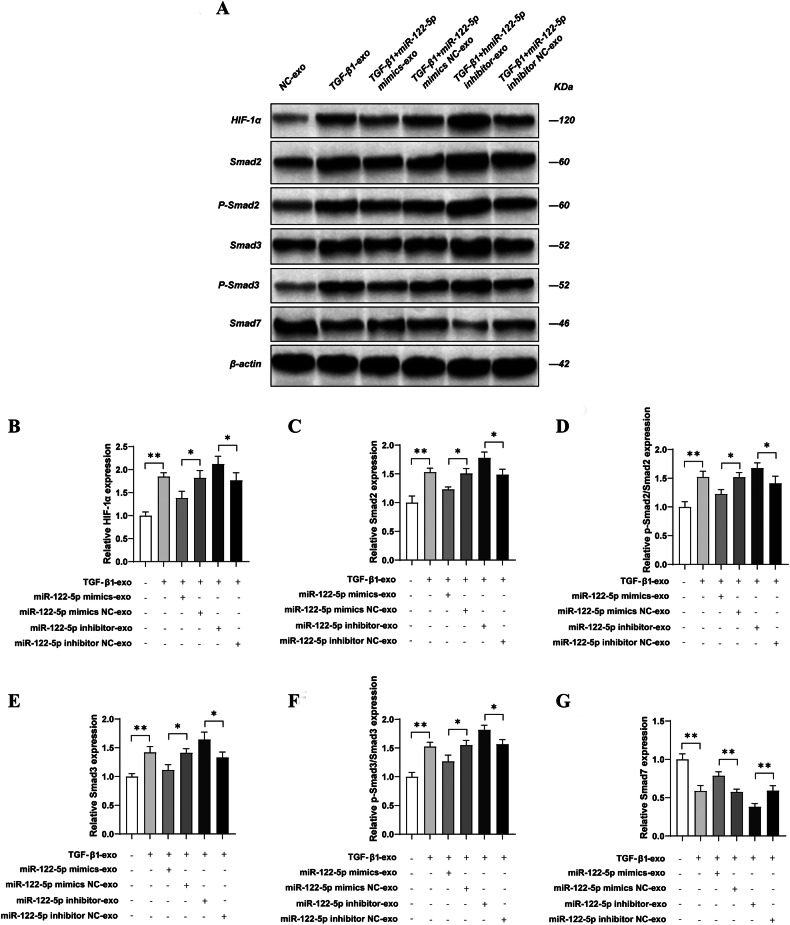
图6 TECs来源外泌体miR-122-5p在体外通过HIF-1α调控TGF-β1/Smad通路
图6A:Western blot检测。结果显示,TGF-β1组NRK-49F细胞中HIF-1α、Smad2、p-Smad2、Smad3、p-Smad3表达显著升高,Smad7表达显著降低。
图6B-G:定量分析。结果显示,miR-122-5p mimic组HIF-1α、Smad2、p-Smad2、Smad3、p-Smad3表达显著降低,Smad7表达显著升高;抑制剂组则呈现相反趋势。
这些结果表明,体外实验中肾小管细胞外泌体miR-122-5p可通过靶向HIF-1α抑制TGF-β1/Smad通路活化,调控成纤维细胞功能。
7. TECs来源的外泌体miR-122-5p通过HIF-1α通过TGF-β1/SMAD在体内调控成纤维细胞
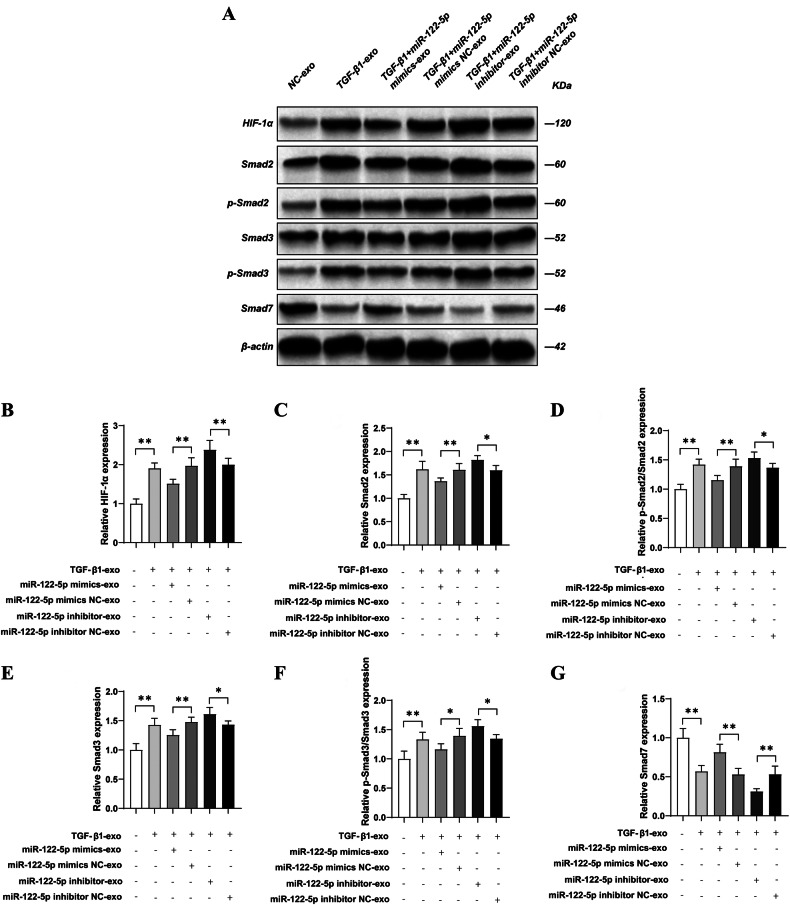
图7 TECs来源的外泌体miR-122-5p在体内通过HIF-1α调控TGF-β1/Smad通路
图7A:Western blot检测。结果显示,TGF-β1组UUO小鼠肾组织中HIF-1α、Smad2、p-Smad2、Smad3、p-Smad3表达显著升高,Smad7表达显著降低。
图7B-G:定量分析。结果显示,miR-122-5p mimic组上述促纤维化通路分子表达显著降低,Smad7表达显著升高;抑制剂组则加剧通路活化。
这些结果表明,体内实验中肾小管细胞外泌体miR-122-5p可通过靶向HIF-1α调控TGF-β1/Smad通路,缓解肾间质纤维化。
8. HIF-1α的过度表达逆转了MiR-122-5p拟态株对TGF-β1外泌体诱导的NRK-49F纤维化细胞模型的改善作用
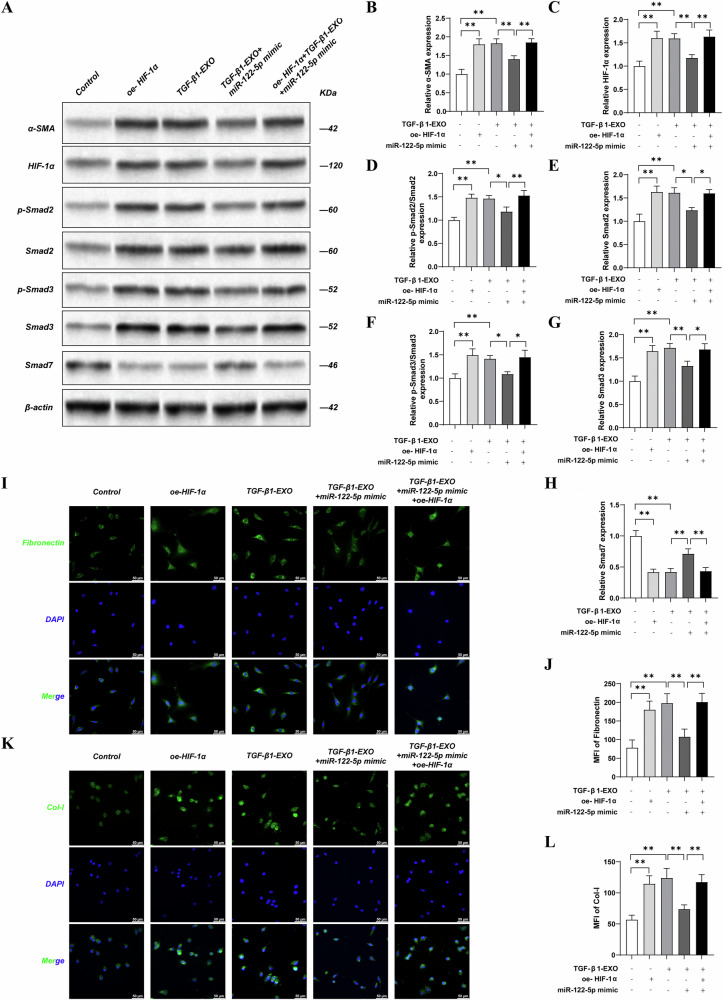
图8 过表达HIF-1α可逆转miR-122-5p mimic对TGF-β1外泌体诱导的NRK-49F细胞纤维化的改善作用
图8A-H:Western blot检测及定量分析。结果显示,与TGF-β1-exo组相比,miR-122-5p mimic组α-SMA、HIF-1α、Smad2、p-Smad2、Smad3、p-Smad3表达显著降低,E-cadherin、Smad7表达显著升高;而过表达HIF-1α后,上述指标均逆转,纤维化表型加重。
图8I-L:免疫荧光及定量分析。结果显示,miR-122-5p mimic可降低Col-I和Fibronectin表达,过表达HIF-1α则恢复二者高表达,证实HIF-1α在纤维化中的关键作用。
这些结果表明,miR-122-5p通过靶向抑制HIF-1α表达发挥抗纤维化作用,HIF-1α过表达可逆转其治疗效应,明确了miR-122-5p-HIF-1α轴的调控关系。
结论
该研究结果证实,TECs来源的外泌体miR-122-5p在肾间质纤维化模型中表达显著下调,揭示了外泌体介导的肾小管细胞与成纤维细胞间通讯在肾间质纤维化中的关键作用,明确miR-122-5p为肾间质纤维化治疗的潜在靶点,为慢性肾脏病的临床干预提供了新的思路和实验依据。






