研载生物科技(上海)有限公司
8 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
公司新闻/正文
IF:14+植物外泌体发文!从姜GELNs鉴定到免疫重编程,这篇RCC研究闭环绝了
424 人阅读发布时间:2025-11-28 14:07
肾细胞癌(RCC)是一种复发转移能力强的恶性肿瘤,现有治疗受限于耐药性和毒副作用。酪氨酸激酶抑制剂(如舒尼替尼)是临床常用药物,但存在多靶点抑制相关的血液学、肝毒性等不良反应,且耐药性不可避免。植物来源外泌体样纳米颗粒(PELNs)具有低毒、生物相容性好、易大规模制备等优势,是理想的药物递送载体。姜来源外泌体样纳米颗粒(GELNs)富含生物活性成分,但其抗RCC机制尚未明确。

今天分享的是发表在【Advanced Science】(IF:14.1)上题为“Folic Acid-Modified Ginger-Derived Exosome-Like Nanoparticles Co-Delivering Sunitinib Suppress Renal Cell Carcinoma via PI3K-Akt Pathway Inhibition, P-gp Downregulation, and Macrophage Reprogramming”的研究,该研究构建叶酸-聚乙二醇修饰的GELNs共递送舒尼替尼(FPD-GELNs/Su),通过主动-被动靶向策略,探究其通过PI3K-Akt通路抑制、P-糖蛋白(P-gp)下调及巨噬细胞重编程的多机制协同抗RCC效应,为RCC精准低毒纳米治疗提供新方案。
研究结果
1、GELNs的提取、表征及代谢组学分析
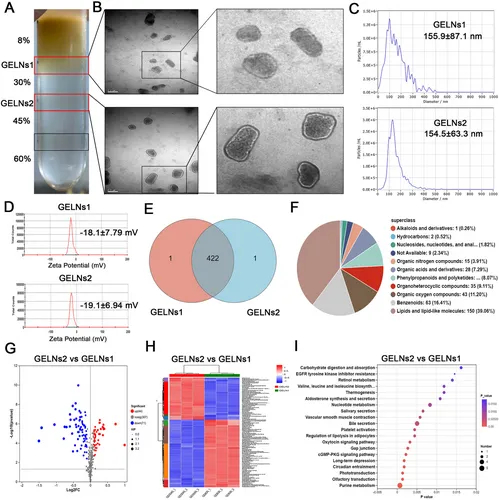
图1A:蔗糖梯度离心纯化流程,8/30%层为GELNs1,30/45%层为GELNs2(n=3)。
图1B:TEM显示GELNs1和GELNs2均为球形双层膜囊泡,粒径100-200nm。
图1C:NTA检测显示,GELNs1平均粒径155.9±87.1nm,GELNs2为154.5±63.3nm。
图1D:zeta电位检测显示,GELNs1为-18.1±7.79mV,GELNs2为-19.1±6.94mV。
图1E:韦恩图显示GELNs1和GELNs2存在共同代谢物。
图1F:HMDB分类显示,GELNs主要成分包括脂质及类脂质分子(39.06%)、苯类化合物(16.41%)等。
图1G:火山图显示GELNs2相对于GELNs1的差异代谢物分布。
图1H:热图显示GELNs2与GELNs1的差异代谢物表达模式。
图1I:KEGG富集分析显示,差异代谢物富集于EGFR酪氨酸激酶抑制剂耐药等通路。
这些结果表明,通过蔗糖梯度离心可获得高纯度GELNs,其粒径、电位符合PELNs特征,且富含多种潜在生物活性代谢物,为后续功能研究奠定基础。
2、GELNs影响RCC进展的靶点预测及调控网络
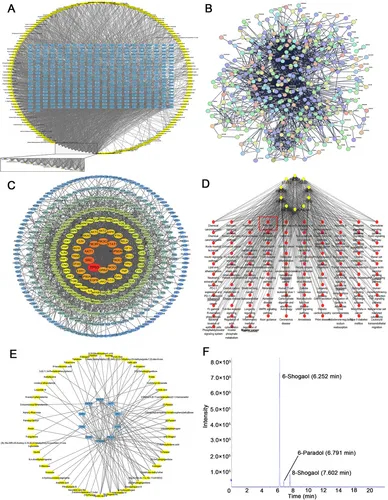
图2A:GELNs对人RCC的药物调控网络可视化。
图2B:STRING数据库构建的GELNs相关靶点PPI网络。
图2C:Cytoscape生成的按度中心性排序的基因-基因相互网络。
图2D:ClueGO+CluePedia插件构建的基因-通路关联图,PI3K-Akt通路富集显著。
图2E:靶向人核心枢纽基因(CHGs)的化合物调控网络。
图2F:正离子模式HPLC检测显示,GELNs中6-姜烯酚、8-姜烯酚、6-姜酚均有表达。
这些结果表明,GELNs通过多成分、多靶点调控RCC进展,PI3K-Akt通路是核心调控通路,6-姜烯酚等成分可能发挥关键作用。
3、核心枢纽基因的分子对接分析
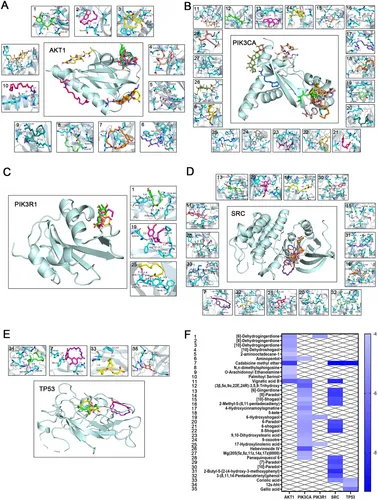
图3A:化合物与AKT1的分子对接结果,蓝色线为氢键,灰色虚线为疏水作用等。
图3B:化合物与PI3KCA的分子对接模式。
图3C:化合物与PI3KR1的分子对接模式。
图3D:化合物与SRC的分子对接模式。
图3E:化合物与TP53的分子对接模式。
图3F:结合能热图显示,多数化合物-受体对结合能低于-5kcal/mol,部分低于-6kcal/mol。
这些结果表明,GELNs中的生物活性化合物与RCC核心靶点具有稳定结合能力,为后续功能验证提供分子基础。
4、分子动力学(MD)模拟分析
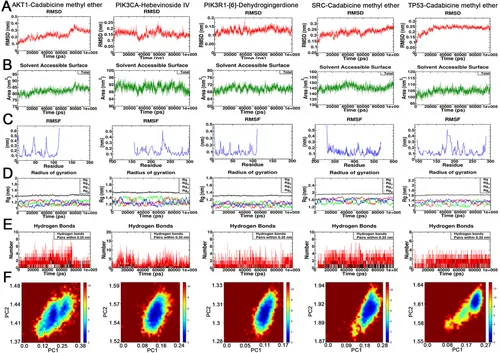
图4A:五种配体-受体复合物的RMSD值波动范围窄,结构稳定。
图4B:SASA值全程稳定,结合对蛋白质表面性质影响小。
图4C:RMSF分析显示蛋白质局部残基灵活性存在差异,功能位点波动明显。
图4D:Rg分析显示蛋白质整体构象平衡,无松散或折叠现象。
图4E:氢键数量稳定在2-5个,结合特异性中等。
图4F:自由能景观显示,所有结合系统均呈现稳定单一构象。
这些结果表明,化合物与核心靶点的结合具有动力学稳定性,进一步验证了靶向作用的可靠性。
5、GELNs的体外抗癌效能及机制
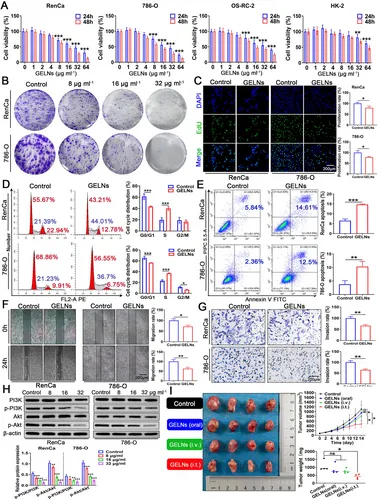
图5A:MTT分析显示,GELNs对RenCa、786-O、OS-RC-2细胞呈剂量和时间依赖性抑制,对HK-2细胞毒性低。
图5B:克隆形成实验显示,GELNs剂量依赖性抑制RCC细胞集落形成。
图5C:EdU实验显示,8μg/mLGELNs显著抑制RCC细胞增殖。
图5D:流式细胞术显示,GELNs将RCC细胞阻滞在S期,抑制G2/M期转换。
图5E:流式细胞术显示,GELNs处理后RenCa细胞凋亡率从5.84%升至14.61%,786-O细胞从2.36%升至12.5%。
图5F:划痕实验显示,GELNs显著降低RCC细胞迁移率。
图5G:Transwell实验显示,GELNs显著减少RCC细胞侵袭数量。
图5H:Western blot显示,GELNs剂量依赖性抑制PI3K和Akt磷酸化。
图5I:体内实验显示,GELNs腹腔注射组抑瘤效果弱于瘤内注射组,口服组无显著效果。
这些结果表明,GELNs通过抑制PI3K-Akt通路,诱导RCC细胞周期阻滞、凋亡,抑制迁移侵袭,且体内给药方式影响疗效。
6、纳米制剂的制备与表征
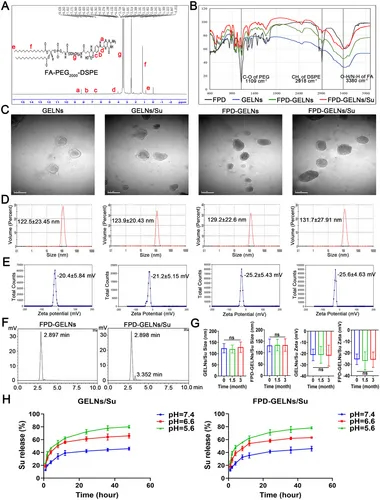
图6A:¹H-NMR验证FA-PEG2000-DSPE(FPD)结构成功合成。
图6B:FTIR光谱显示,FPD-GELNs和FPD-GELNs/Su出现FPD特征振动峰。
图6C:TEM显示,GELNs、GELNs/Su、FPD-GELNs、FPD-GELNs/Su均为球形。
图6D:DLS检测显示,四者粒径分别为122.5±23.45nm、123.9±20.43nm、129.2±22.6nm、131.7±27.91nm。
图6E:zeta电位检测显示,四者电位分别为-20.4±5.84mV、-21.2±5.15mV、-25.2±5.43mV、-25.6±4.63mV。
图6F:HPLC显示,FPD与GELNs、GELNs/Su的结合效率分别为58.19%和58.93%。
图6G:3个月稳定性检测显示,GELNs/Su和FPD-GELNs/Su的粒径、电位无显著变化。
图6H:体外释放实验显示,pH5.6时Su释放率最高,GELNs/Su和FPD-GELNs/Su48h释放率分别为80.08±2.12%和78.25±1.62%。
这些结果表明,纳米制剂制备成功,具有均一粒径分布、良好稳定性,且在酸性肿瘤微环境中可高效释放药物。
7、FOLR1和FOLR2的生物信息学及RT-qPCR分析
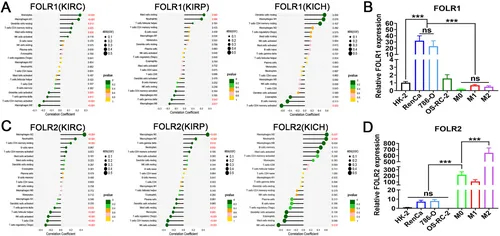
图7A:TCGA队列分析显示,ccRCC、chRCC、pRCC中FOLR1与M0、M2巨噬细胞无显著相关性。
图7B:RT-qPCR显示,RenCa和786-O细胞的FOLR1mRNA水平显著高于HK-2细胞和巨噬细胞。
图7C:TCGA队列分析显示,FOLR2与M2巨噬细胞在各RCC亚型中呈正相关。
图7D:RT-qPCR显示,M0和M2巨噬细胞的FOLR2mRNA水平显著高于肿瘤细胞和正常组织细胞。
这些结果表明,FOLR1主要表达于RCC细胞,FOLR2主要表达于巨噬细胞,为靶向递送提供分子基础。
8、FPD的体内肿瘤靶向评价
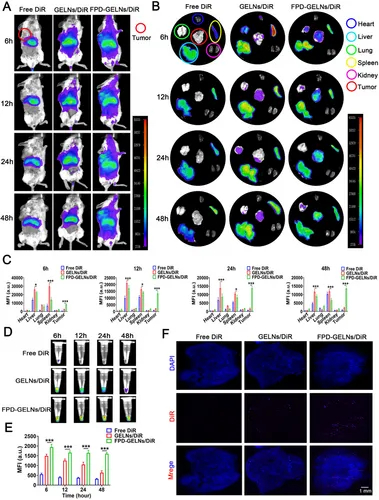
图8A:活体荧光成像显示,FPD-GELNs/DiR在肿瘤部位的荧光信号持续高于GELNs/DiR。
图8B-C:主要器官荧光成像显示,FPD-GELNs/DiR在肿瘤中富集,肝脾摄取减少。
图8D-E:血清荧光检测显示,FPD修饰延长GELNs循环时间。
图8F:肿瘤冰冻切片显示,FPD-GELNs/DiR的荧光信号显著强于GELNs/DiR。
这些结果表明,FPD修饰可增强GELNs的肿瘤靶向性,减少系统清除,提升肿瘤部位富集。
9、FPD增强GELNs对RCC细胞的摄取及舒尼替尼敏感性
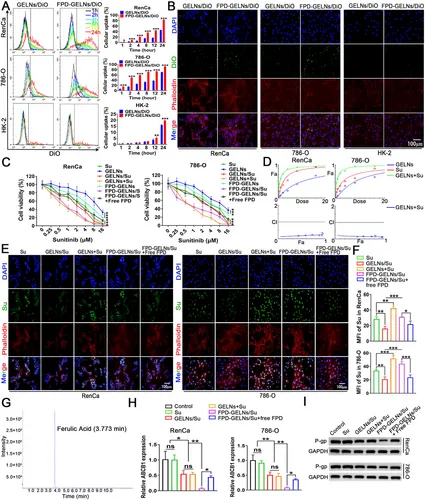
图9A:流式细胞术显示,FPD-GELNs/DiO被RenCa、786-O细胞的摄取率显著高于GELNs/DiO,24h时分别达82.85±0.65%和91.45±0.61%。
图9B:荧光显微镜显示,24h时FPD-GELNs/DiO在RCC细胞内的荧光强度更强。
图9C:MTT显示,FPD-GELNs/Su对RCC细胞的细胞毒性显著高于其他组,过量游离FPD可逆转该效应。
图9D:联合效应曲线显示,GELNs+Su呈强协同效应。
图9E-F:荧光成像及定量显示,FPD-GELNs/Su组细胞内舒尼替尼积累量最高。
图9G:负离子模式HPLC检测到GELNs中阿魏酸表达。
图9H-I:RT-qPCR和Western blot显示,FPD-GELNs显著下调ABCB1/P-gp的mRNA和蛋白水平。
这些结果表明,FPD修饰通过FA/FOLR1相互作用增强RCC细胞对GELNs的摄取,下调P-gp表达以减少药物外排,提升舒尼替尼敏感性。
10、FPD对巨噬细胞的靶向及极化调控
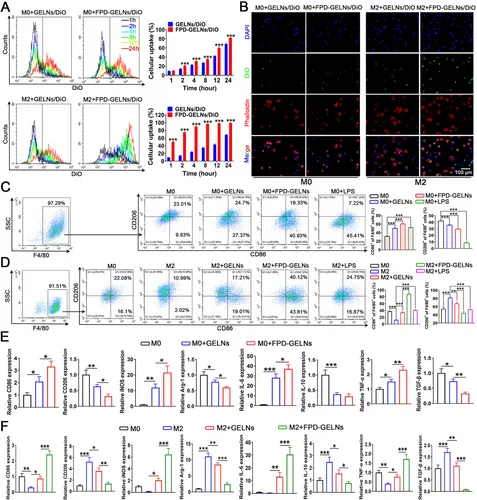
图10A:流式细胞术显示,FPD-GELNs/DiO被M0和M2巨噬细胞的摄取率显著高于GELNs/DiO,24h时分别达82.06±0.68%和99.33±0.17%。
图10B:荧光显微镜验证FPD增强GELNs对巨噬细胞的摄取。
图10C:流式细胞术显示,FPD-GELNs显著诱导M0巨噬细胞向M1(F4/80⁺CD86⁺)极化。
图10D:流式细胞术显示,FPD-GELNs显著诱导M2巨噬细胞向M1极化。
图10E-F:RT-qPCR显示,FPD-GELNs上调M1相关标志物(CD86、iNOS等),下调M2相关标志物(CD206、Arg-1等)。
这些结果表明,FPD修饰增强GELNs对巨噬细胞的靶向性,促进M1极化,重编程肿瘤免疫微环境。
11、巨噬细胞极化的免疫机制探究
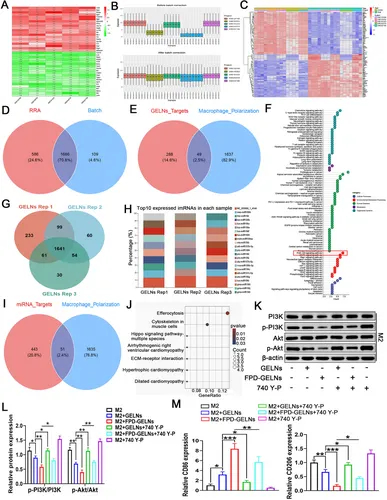
图11A:RRA分析热图显示巨噬细胞极化相关差异基因。
图11B:SVA批量校正后的数据分布。
图11C:批量校正后的差异表达热图。
图11D:韦恩图显示RRA和批量校正共同鉴定的1686个极化特征基因。
图11E:韦恩图显示GELNs靶点与巨噬细胞极化基因的49个交集靶点。
图11F:KEGG显示,交集靶点富集于PI3K-Akt通路。
图11G:韦恩图显示GELNs中1641个共同表达的miRNA。
图11H:热图显示第10高表达miRNA。
图11I:韦恩图显示miRNA靶点与极化基因的51个交集。
图11J:KEGG显示,miRNA靶点富集于胞葬作用通路。
图11K-L:Western blot显示,FPD-GELNs显著抑制M2巨噬细胞中PI3K-Akt磷酸化,740Y-P可逆转。
图11M:RT-qPCR显示,740Y-P减弱GELNs和FPD-GELNs对CD86和CD206的调控。
这些结果表明,GELNs通过抑制PI3K-Akt通路促进巨噬细胞M1极化,FPD修饰增强该效应。
12、纳米制剂的体内抗癌效能及免疫重编程
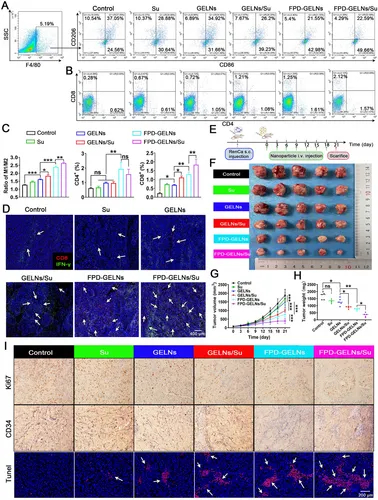
图12A-C:流式细胞术显示,FPD-GELNs/Su组M1/M2比值及CD4⁺、CD8⁺T细胞浸润显著高于其他组。
图12D:免疫荧光显示,FPD-GELNs/Su组CD8⁺T细胞和IFN-γ表达最高。
图12E:体内干预时间线示意图,每3天静脉注射一次,共7次。
图12F-H:肿瘤图像、重量及生长曲线显示,FPD-GELNs/Su组抑瘤效果最显著。
图12I:IHC和TUNEL显示,FPD-GELNs/Su组Ki67阳性率最低、CD34阳性血管密度最低、凋亡细胞最多。
这些结果表明,FPD-GELNs/Su在体内显著抑制肿瘤生长,重塑免疫微环境,促进抗肿瘤免疫应答。
13、药代动力学及生物安全性评价
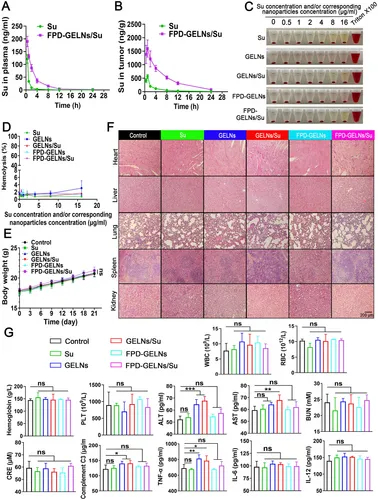
图13A:血浆药代动力学显示,FPD-GELNs/Su的AUC₀₋₂₄是游离Su的4.66倍。
图13B:肿瘤组织药代动力学显示,FPD-GELNs/Su的AUC₀₋₂₄是游离Su的5.36倍。
图13C-D:溶血实验显示,所有纳米制剂溶血率均<4%。
图13E:体重曲线显示,各治疗组小鼠无显著体重下降。
图13F:HE染色显示,主要器官无明显组织损伤。
图13G:血常规和生化指标显示,FPD修饰逆转GELNs和GELNs/Su的肝毒性,无显著肾毒性和炎症异常。
这些结果表明,FPD-GELNs/Su改善舒尼替尼药代动力学,提升肿瘤部位富集,且生物安全性良好。
14、纳米制剂对RCC肺转移的抑制作用
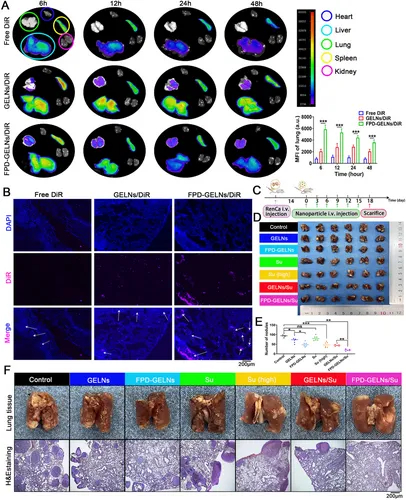
图14A:器官荧光成像显示,FPD-GELNs/DiR在肺转移灶的富集显著高于GELNs/DiR。
图14B:肺组织切片显示,FPD-GELNs/DiR在转移灶的荧光信号更强。
图14C:肺转移模型干预时间线示意图,每3天静脉注射一次,共6次。
图14D-F:肺组织图像、转移结节计数及HE染色显示,FPD-GELNs/Su组肺转移结节最少。
这些结果表明,FPD-GELNs/Su可特异性靶向RCC肺转移灶,显著抑制转移进展。
结论
本研究构建的叶酸修饰姜来源外泌体样纳米颗粒共递送舒尼替尼(FPD-GELNs/Su)通过多机制协同抑制肾细胞癌:GELNs自身通过抑制PI3K-Akt通路磷酸化发挥抗癌作用;FPD修饰增强肿瘤细胞和巨噬细胞靶向性,下调ABCB1/P-gp表达以提升舒尼替尼敏感性;同时重编程肿瘤免疫微环境,促进M1巨噬细胞极化并增加T细胞浸润,显著抑制肿瘤生长和肺转移。该纳米制剂改善了舒尼替尼的药代动力学特征,降低系统毒性,为肾细胞癌的精准治疗提供了安全有效的新型策略,具有重要临床转化潜力。






